Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Une cellule à cellule essai de transport macromoléculaire In planta Utilisant bombardement biolistique
Dans cet article
Résumé
Le trafic entre les cellules végétales macromoléculaire peut être évaluée par transitoirement exprimant une protéine fluorescente-marqués d'intérêt et d'analyser sa distribution intra-et intercellulaires par microscopie confocale.
Résumé
Ici, nous présentons un protocole simple et rapide pour détecter et évaluer l'étendue de la cellule à cellule transport macromoléculaire in planta. Dans ce protocole, une fluorescence taggés-protéine d'intérêt est transitoirement exprimé dans les tissus végétaux suivant la livraison de ses biolistique d'ADN codant pour construire. La distribution intra-et intercellulaires de la protéine marquée est ensuite analysée par microscopie confocale. Nous décrivons en détail cette technologie, offrant, étape par étape, des protocoles d'essai et d'évaluer l'ampleur du transport des protéines symplastique en trois espèces de plantes, Arabidopsis thaliana, Nicotiana benthamiana et N. tabacum (tabac).
Protocole
Contexte
Le transport des macromolécules symplastique par des connexions intercellulaires des plantes, les plasmodesmes, est d'intérêt pour les pathologistes de nombreuses plantes et des biologistes. Par exemple, plusieurs protéines virales sont connues pour réguler plasmodesmal limites d'exclusion de taille pour permettre un mouvement virale 1-3. En outre, certaines protéines endogènes, parmi eux d'importants régulateurs du développement, sont supposés évoluer de cellule à cellule, vraisemblablement par plasmodesmes, à la fonction des cellules non-autonome 4. Ainsi, une méthodologie fiable pour identifier et visualiser transport macromoléculaire entre les cellules végétales est très en demande.
1) Cultiver les plantes cibles
Pour une efficacité de transformation élevé, sain, plantes robustes devraient être utilisés.
Des plantes d'Arabidopsis 1.
Cultiver une plante Arabidopsis sur le Pro-Mix BX dans un pot (10 cm x 10 cm x 10 cm) dans une chambre à environnement contrôlé avec une photopériode courte (8 heures de 130-150 uE m -2 s -1 à 23 ° de lumière C/16 h obscurité à 20 ° C) et humidité relative de 40 à 65% 6 à 8 semaines 5. Les fertiliser parfois avec des produits disponibles dans le commerce tel que décrit 5. Feuilles avec la plus grande taille de 15 mm x 35 mm (la mesure de la longueur du pétiole comprend) sont sélectionnés pour les expériences.
2. N. benthamiana et N. tabacum
Cultivez une usine sur le Pro-Mix BX dans un pot (20 cm x 20 cm x 20 cm) dans une chambre à environnement contrôlé avec une photopériode longue (16 heures de 130-150 uE m -2 s -1 légers à 23 ° C / 8 h obscurité à 20 ° C) et humidité relative de 40-65% 7 à 10 semaines. Les fertiliser parfois avec des produits disponibles dans le commerce que de décrire. Feuilles de taille supérieure à 50 mm x 70 mm pour N. benthamiana mm ou 100 x 125 mm pour N. tabacum (ces mesures ne comprennent pas la longueur du pétiole) sont sélectionnés pour les expériences.
2) Préparation de la cartouche de pistolet à gènes enrobées d'ADN Or microparticules
Le protocole de cette démarche expérimentale a été décrite en détail précédemment 6. Il est très important de bien l'utiliser ADN plasmidique purifié à des concentrations élevées (~ 1 ug / ul) pour obtenir le meilleur rendement de transformation de la facilité d'analyse par microscopie confocale pendant les derniers stades de l'expérimentation.
Pour ce dosage, il est important de s'assurer que la cartouche ne se transforme pas préparés deux ou plusieurs cellules adjacentes simultanément à haute fréquence, car le nombre de cellules avec un cluster associant signal fluorescent est utilisé comme un indicateur de l'étendue des transports symplastique (ie , une seule cellule contenant le signal indique l'absence de mouvement, alors que le signal d'une grappe multicellulaire indique le mouvement). La qualité de la cartouche de chacun peut être vérifiée par l'analyse de l'expression de la protéine de 16 à 20 heures après le bombardement. Notre protocole de 6 cartouches produit que le rendement des grappes d'expression multicellulaire seulement dans <3% de tous les événements d'expression dans ce laps de temps, donc adaptée à cette expérience.
3) La livraison de l'ADN Biolistic microparticules tapissées
- Retirez les feuilles de la même étape de développement (c'est à dire avec la taille et de même âge, voir étape 1) avec une lame de rasoir et les placent immédiatement avec les côtés abaxiale face sur une surface plane en styromousse. Le côté abaxiale de la feuille représente un meilleur substrat pour le bombardement en raison de sa faible densité de trichomes et plus mince cuticule. Feuilles d'Arabidopsis, en raison de leur taille relativement petite, devrait être couvert avec un morceau de grillage moustiquaire, et le maillage, puis fixé avec des punaises à la surface de styromousse. Maintenir feuilles plates augmente l'efficacité de la livraison de particules et réduit les dommages aux tissus au cours microbombardment.
- Insérez la cartouche avec de l'ADN microparticules tapissées (préparé à l'étape 1) dans le pistolet. Pour Arabidopsis, le tir est effectué à des pressions de 80-110 psi pour le 1-um microparticules, et 140 à 160 psi pour 0,6 um microparticules. Pour N. benthamiana et le tabac, le tir est effectué à des pressions de 100-120 psi pour le 1-um microparticules, et 160 à 180 psi pour 0,6 um microparticules. Pour Arabidopsis, nous avons l'habitude d'utiliser une cartouche par feuille, parce que chaque feuille a une surface suffisante pour un seul coup de feu qui se propage microparticules sur une superficie de 10-12 mm de diamètre. Avec de plus grandes N. benthamiana et les feuilles de tabac, les bombardements multiples de la même feuille sont possibles, cependant, ils doivent être fait à des positions symétriques de chaque côté de la nervure centrale pour cibler les zones de feuilles au même stade de développement (voir discussion).
- Retirer les feuilles de la surface de styromousse et placez-les ipas une boîte de Pétri sur 3 couches de papier filtre Whatman mouillés, sceller la boîte de Pétri avec du Parafilm, et il incuber à température ambiante pendant 36-48 heures pour permettre l'expression des transgènes livré et le potentiel de cellule à cellule-circulation de leurs produits protéiques .
4) Imagerie d'expression de protéines
Le signal de fluorescence des protéines exprimées transitoirement étiqueté est visualisé par microscopie confocale. Des précautions doivent être prises pour trouver les réglages optimaux pour la détection de la microscopie de chaque protéine testée. Par exemple, les protéines qui montrent limitée accumulation intracellulaire avec des intensités de signal faible, tels que la localisation de la protéine plasmodesmal la mosaïque du tabac mouvement du virus (TMV MP) 1-3,6, doit être observé sous un objectif de 40X, ce qui offre une meilleure résolution et sensibilité, tandis que les protéines qui montrent la distribution cytoplasmique avec des intensités signal fort, comme sans YFP, peuvent être visualisées sous un objectif 10X avec fonction zoom confocal pour l'imagerie rapide (voir Figure 1).
Transports symplastique est déduite de l'apparition de grappes multicellulaire qui contiennent le signal fluorescent. Le nombre de ces pôles et le nombre de cellules dans chaque grappe est révélatrice de l'ampleur de la cellule à cellule de transport. Pour obtenir des données fiables, au moins 100 groupes d'expression doivent être enregistrées par chaque système expérimental. Par exemple, si le mouvement de cellule à cellule d'une protéine est comparée dans deux contextes génétiques différents (par exemple, de type sauvage et des plantes transgéniques), d'un total de 200 grappes d'expression doivent être enregistrées. Surtout, des expériences, dont les résultats doivent être comparés les uns aux autres, doivent être menées simultanément.
5. Les résultats représentatifs
La figure ci-dessous illustre expériences représentatives pour la détection du transport des protéines par fluorescence symplastique marqués. Les panneaux A et B montrent les images typiques confocale qui sont obtenus à la suite d'une microbombardment N. feuilles benthamiana avec une TMV MP-YFP-exprimant la construction. Dans le panneau, un mouvement, symplastique de TMV MP-YFP est observée basée sur l'apparition de grappes multicellulaire du signal YFP. Pas tous transitoirement exprimé TMV MP-YFP est capable de se déplacer comme en témoigne une seule cellule du signal dans certains microbombardments (panneau B). Statistiquement, dans <40% de l'amas de signal compté, TMV MP-YFP est incapable de se déplacer entre les cellules alors que dans> 60% des grappes, la protéine se déplace entre 2-5 cellules, avec la diffusion de deux cellules étant les plus fréquents (ca. ~ 50% des cas) (figure 1C).
Les protéines avec la taille moléculaire relativement faible sans activité mouvement inné peuvent diffuser à travers PD de se déplacer de cellule à cellule. Par exemple, YFP libre, ou 1xYFP (environ 27 kDa, partie D), les écarts entre plusieurs cellules dans 30% des glomérules comptés (panneaux C). Cette diffusion non-spécifique n'a pas lieu pour un gradateur YFP translationnelle, ou 2xYFP (54 kDa, panneau E), ce qui est comparable en taille à la protéine de fusion TMV MP-YFP (57 kDa), et qui est complètement cellulaire autonome (figure 1C).
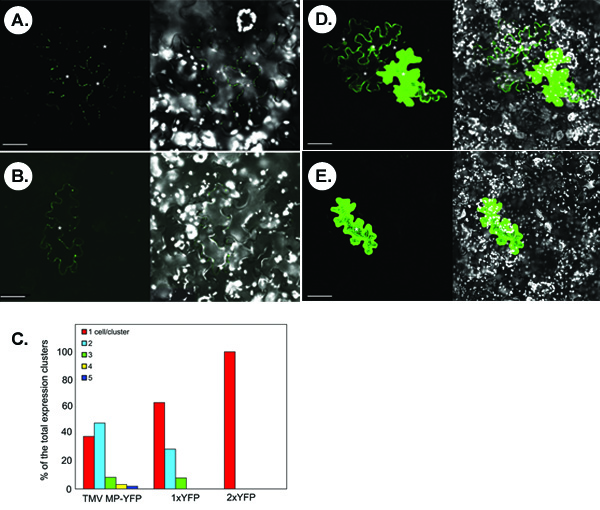
Résultats de la figure 1. Typiques obtenus à partir de l'essai de transport symplastique dans N. benthamiana tissus foliaires. (A, B) Visualisation de TMV MP-YFP. (C) Quantification des pôles du signal. 1xYFP et 2xYFP, sans YFP et translationnelle YFP dimère, respectivement. (D) Visualisation des 1xYFP. (E) Visualisation des 2xYFP. En micrographies, les panneaux de gauche montrent le signal YFP et les panneaux de droite montrent des images fusionnées YFP (en vert) et autofluorescence chloroplaste (en blanc) des signaux. Les images sont simples sections confocale. Les astérisques dans les micrographies montrent les cellules de l'épiderme montrant le signal YFP. Bars = 50 um.
Discussion
La clé de la réussite de l'essai de transport symplastique est d'obtenir une efficacité de transformation élevé, ce qui permet la production de grappes de signal statistiquement significative et facilement détectable. Ceci peut être réalisé en utilisant les feuilles récoltées à partir plants sains et robustes, et la préparation de particules d'or recouvertes par une préparation d'ADN pur et concentré.
Utiliser les feuilles au même stade de croissance est égal...
Déclarations de divulgation
Remerciements
Notre travail est soutenu par des subventions du NIH / NIGMS, NSF, USDA / NIFA et BARD à VC.
matériels
| Name | Company | Catalog Number | Comments |
| Gold microparticles, 1.0 μm in diameter | Bio-Rad | 165-2262 | |
| Gold microparticles, 0.6 μm in diameter | Bio-Rad | 165-2263 | |
| Spermidine | Sigma-Aldrich | S0266-1G | |
| Tefzel tubing | Bio-Rad | 165-2441 | |
| Helios cartridge preparatory station | Bio-Rad | 165-2420 | |
| Tubing cutter | Bio-Rad | 165-2422 | |
| Helios gene gun | Bio-Rad | 165-2432 | |
| Helium gas regulator | Bio-Rad | 165-2413 |
Références
- Waigmann, E., Ueki, S., Trutnyeva, K., Citovsky, V. The ins and outs of non-destructive cell-to-cell and systemic movement of plant viruses. . Crit Rev Plant Sci. 23, 195-250 (2004).
- Lucas, W. J. Plant viral movement proteins: agents for cell-to-cell trafficking of viral genomes. Virology. 344, 169-184 (2006).
- Epel, B. L. Plant viruses spread by diffusion on ER-associated movement-protein-rafts through plasmodesmata gated by viral induced host beta-1,3-glucanases. Semin Cell Dev Biol. 20, 1074-1081 (2009).
- Zambryski, P. C., Crawford, K. Plasmodesmata: gatekeepers for cell-to-cell transport of developmental signals in plants. Annu Rev Cell Dev Biol. 16, 393-421 (2000).
- Rivero-Lepinckas, L., Crist, D., Scholl, R. Growth of plants and presercation of seeds. Methods Mol Biol. 323, 3-12 (2006).
- Ueki, S., Lacroix, B., Krichevsky, A., Lazarowitz, S. G., Citovsky, V. Functional transient genetic transformation of Arabidopsis leaves by biolistic bombardment. Nat Protoc. 4, 71-77 (2009).
- Oparka, K. J. Simple, but not branched, plasmodesmata allow the nonspecific trafficking of proteins in developing tobacco leaves. Cell. 97, 743-754 (1999).
- Imlau, A., Truernit, E., Sauer, N. Cell-to-cell and long-distance trafficking of the green fluorescent protein in the phloem and symplastic unloading of the protein into sink tissues. Plant Cell. 11, 309-322 (1999).
- Gisel, A., Barella, S., Hempel, F. D., Zambryski, P. C. Temporal and spatial regulation of symplastic trafficking during development in Arabidopsis thaliana apices. Development. 126, 1879-1889 (1999).
- Kim, I., Cho, E., Crawford, K. M., Hempel, F. D., Zambryski, P. C. Cell-to-cell movement of GFP during embryogenesis and early seedling development in Arabidopsis. Proc Natl Acad Sci USA. 102, 2227-2231 (2005).
- Crawford, K. M., Zambryski, P. C. Non-targeted and targeted protein movement through plasmodesmata in leaves in different developmental and physiological states. Plant Physiol. 125, 1802-1812 (2001).
- Roberts, A. G. Phloem unloading in sink leaves of Nicotiana benthamiana: comparison of a fluorescent solute with a fluorescent virus. Plant Cell. 9, 1381-1396 (1997).
- Guenoune-Gelbart, D., Elbaum, M., Sagi, G., Levy, A., Epel, B. L. Tobacco mosaic virus (TMV) replicase and movement protein function synergistically in facilitating TMV spread by lateral diffusion in the plasmodesmal desmotubule of Nicotiana benthamiana. Mol Plant Microbe Interact. 21, 335-345 (2008).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon