Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
En electroporación in vivo de la retina del ratón en desarrollo
En este artículo
Resumen
Un método para la incorporación de ADN plásmido en murino células de la retina con el propósito de llevar a cabo ya sea ganancia o pérdida de los estudios de función In vivo Se presenta. Este método aprovecha el aumento transitorio de la permeabilidad de las membranas plasmáticas de células inducida por la aplicación de un campo eléctrico externo.
Resumen
La caracterización funcional de genes expresados durante el desarrollo de la retina de mamíferos sigue siendo un reto importante. La orientación de genes para generar la pérdida constitutiva o condicional de nocauts función sigue siendo de costos y mano de obra intensiva, así como mucho tiempo. Además de estos retos, la retina expresan los genes pueden tener un papel esencial fuera de la retina que conduce a confunde no deseados cuando se utiliza un enfoque de octavos de final. Además, la capacidad de expresar ectópica de un gen en una ganancia de experimento de la función puede ser muy valioso cuando se intenta identificar un papel en la especificación del destino celular y / o diferenciación terminal.
Se presenta un método para la incorporación rápida y eficiente de los plásmidos de ADN en la retina del ratón neonatal mediante electroporación. La aplicación de impulsos eléctricos cortos por encima de una cierta fuerza los resultados de campo en un aumento transitorio de la permeabilidad de la membrana plasmática, lo que facilita la transferencia de material a través de la membrana 1,2,3,4. Trabajo pionero demuestra que la electroporación podría ser utilizado como un método de transferencia de genes en células de mamífero mediante la inducción de la formación de poros hidrofílicos de la membrana plasmática que permite el paso de ADN altamente cargadas a través de la bicapa lipídica 5. Continuo desarrollo técnico, ha dado como resultado la viabilidad de la electroporación como un método para la transferencia de genes in vivo en tejidos de ratón múltiples, incluyendo la retina, el método que se describe en este documento 6, 7, 8, 9, 10.
Solución de ADN se inyecta en el espacio subretiniano para que el ADN se encuentra entre el epitelio retinal pigmentado y la retina del recién nacido (P0) del ratón y los impulsos eléctricos se aplican mediante un electrodo de pinza. La colocación lateral de los ojos en el ratón permite la fácil orientación del electrodo de la pinza es necesario alineación polo negativo de polo-DNA-retina-positivo. Incorporación extensiva y expresión de los genes transferidos pueden ser identificados por el día postnatal 2 (P2). Debido a la falta de una importante migración lateral de las células de la retina, las regiones y no electroporated electroporación, se generan. No electroporated regiones pueden servir como controles internos histológico en su caso.
Electroporación de retina pueden ser utilizadas para expresar un gen bajo un promotor ubicuo, como CAG, o para alterar la función de genes usando construcciones ARNhc o la recombinasa Cre. La expresión más específica se puede lograr mediante el diseño de las construcciones con los promotores de genes específicos de células. La visualización de las células por electroporación se consigue mediante construcciones bicistrónico que expresan GFP o co-electroporating una expresión GFP construir. Además, múltiples construcciones puede ser electroporación para el estudio de los efectos de genes combinatoria o ganancia simultánea y pérdida de función de genes diferentes. Electroporación retina también puede ser utilizado para el análisis genómico de elementos reguladores cis-mediante la generación de construcciones apropiadas expresión y mutantes de deleción. Estos experimentos pueden ser utilizados para identificar regiones reguladoras cis-suficientes o necesarios para la expresión genética en células específicas 11. Experimentos potenciales sólo están limitadas por la disponibilidad de la construcción.
Protocolo
1. Preparación de plásmidos para la electroporación
La concentración de ADN necesarias para la electroporación es 5μg/μl. Esto requiere típicamente los plásmidos deseados que se amplifica con un Maxi-prep (Qiagen) o un método equivalente seguida por una purificación y concentración del ADN a la cantidad de trabajo. Los pasos siguientes describen la preparación de ADN a la cantidad de trabajo.
- Alícuota de 100 ug de ADN (de Maxi-prep o equivalente) y se diluye el volumen de 100 L para la facilidad de manipulación.
- Añadir fenol, la cantidad de fenol se debe calcular para obtener una aproximadamente el 60% del ADN / volumen (ADN mg: volumen total), es decir: 100 mg de ADN (en 100 l), además de 67 l de fenol (mg 100: 167 l). Mezclar bien, no pipeta hacia arriba y abajo, ya que puede causar una ruptura excesiva de la DNA.
- Girar el ADN durante 5 minutos a 14.000 rpm a temperatura ambiente.
- Recoger el líquido sobrenadante y añadir cloroformo utilizando el mismo ADN: la relación de volumen total en el paso 1.2; mezcla como se describe en el paso 1.2 y giran a 14.000 rpm durante 5 minutos a temperatura ambiente.
- Recoger el sobrenadante, añadir 10% de volumen sobrenadante de acetato de sodio 3 M a la solución de ADN, mezclar suavemente y añadir 2,5 veces el volumen del sobrenadante de etanol al 100%. Mezclar por inversión. ADN se precipitan fuera de la solución durante la mezcla.
- Girar el ADN a 4 ° C durante 10 minutos a 14.000 RPM.
- Enjuagar con 350 l de etanol al 70%, giran a 14.000 rpm durante 5 minutos a 4 ° C.
- Deje secar al aire el precipitado se disuelve el ADN de un X PBS (grado de Biología celular) a 5μg/μL. No resecar la muestra, ya que esto lo hacen muy difíciles de disolver en PBS.
- Agregar colorante verde rápido (10% de acciones) a la solución de ADN, la concentración final de tinte es de 0,1%, para actuar como un indicador de inyección.
2. Inyección subretiniana de ADN
Los pasos siguientes se realizan con la ayuda de un microscopio estereoscópico. Una vez practicado el proceso de apertura de los ojos, la incisión, y la inyección en menos de 1,5 minutos, lo que no es tiempo suficiente para que un cachorro adecuadamente anestesiado para recuperar. El uso de un fuerte de calibre 30 agujas, abra cuidadosamente el ojo cortando a lo largo del epitelio de la unión fundida (Fig. 1C). No aplique una fuerza excesiva ya que esto puede resultar en el corte del ojo subyacente. Evite cortar más allá del alcance de la unión del párpado ya que esto dará lugar a hemorragias que pueden oscurecer la inyección.
- Anestesiar a los ratones recién nacidos en el hielo durante varios minutos (Fig. 1A), no se entierran las crías en el hielo ya que esto puede provocar la muerte. La longitud de tiempo en el hielo es variable desde cachorro a las crías, por lo general de 5 minutos es suficiente, pero los ratones deben ser monitoreados cuidadosamente como los individuos pueden responder muy rápidamente, o puede requerir una mayor exposición a garantizar la anestesia adecuada. Llevar a cabo una pizca de pata con pinzas hemostáticas para comprobar si hay reflejo de retirada.
- Con el fin de facilitar la inyección de ADN al espacio subretiniano el primer ojo debe estar abierto. Limpie el ojo para ser inyectado con un 70% de preparación alcohol isopropílico (Tyco Healthcare) e identificar el epitelio de la unión fundida en los dos párpados se juntan (Fig. 1B).
- El uso de un fuerte de calibre 30 agujas, abra cuidadosamente el ojo cortando a lo largo del epitelio de la unión fundida (Fig. 1C). No aplique una fuerza excesiva ya que esto puede resultar en el corte del ojo subyacente. Evite cortar más allá del alcance de la unión del párpado ya que esto dará lugar a hemorragias que pueden oscurecer la inyección.
- Para facilitar la penetración de los ojos por la aguja roma terminó inyección utilice la punta de una aguja de calibre 30 hace una pequeña incisión en la esclera cerca del cruce con la córnea (Fig. 1E). No penetran muy profundamente, ya que puede dar lugar a una punción de la lente.
- Dibuja 0,3 l de solución de ADN en un 33 calibre contundente aguja de inyección terminó con los gradientes de la jeringa para medir el volumen de forma individual por cada inyección (aguja de diámetro exterior de 0,52 mm, diámetro interior de 0,13 mm; Exmire microjeringa; Ito corp). Insertar la aguja en la incisión hasta que la resistencia de la pared opuesta escleral se siente. Tenga cuidado de no penetrar la lente cuando la aguja pasa a través de la cámara vítrea (Fig. 2B).
- Inyecte lentamente 0,3 l de solución de ADN en el espacio subretiniano usando el dedo índice o el pulgar para presionar el émbolo de la jeringa. El experimentador debe tener cuidado de controlar la velocidad de la depresión del émbolo de modo que la velocidad a la que se inyecta la solución de ADN en el espacio subretinal no superan la velocidad a la que la solución de ADN se extiende en el espacio subretinal (Fig. 2C). La solución de ADN es muy viscoso por lo que es importante que la aguja no se presiona con demasiada fuerza contra la pared opuesta escleral ya que esto puede resultar en el ADN no se inyecta o no se propaga de manera uniforme. Una inyección de éxito dará lugar a una aúndifusión de la solución de ADN en una porción del espacio subretiniano. Regiones de la retina con y sin base marcador verde debería ser evidente cuando se gira el animal inyectado.
3. Electroporación
- La electroporación se realiza mediante un electrodo de 10 mm de diámetro con pinzas (Modelo # 522; Instrumentos BTX). Sumerja el electrodo en la pinza de PBS con el fin de maximizar la conductividad eléctrica del electrodo para el animal y el lugar de la cabeza del cachorro inyectado entre los electrodos con los ojos inyectados adyacente al electrodo polo positivo y el ojo no inyecta junto al polo negativo electrodo (Fig. 3B).
- Aplique cinco pulsos cuadrados con un generador de impulsos: cada pulso es de 80 voltios y 50 milisegundos de duración con un intervalo de 950 milisegundos entre los pulsos.
- Los cachorros electroporated ahora debe ser calentado hasta que se recupere de la anestesia de hielo. Esto se puede hacer mediante la colocación de los cachorros en una lámpara de calentamiento o en la parte superior de una diapositiva más cálido. Si se utiliza una diapositiva más cálido asegurarse de que una plataforma adecuada se coloca entre la superficie del metal y el cachorro se recupera. Tras la recuperación de volver a los cachorros electroporated a su madre.
4. Preparación de los ojos para el análisis
- El momento de la recolección y el análisis de las retinas electroporated se lleva a cabo con sujeción a los objetivos del experimento. La expresión de GFP puede ser extremadamente visualizar tres días después de la electroporación. Para cryoembedding y corte haga lo siguiente.
- Sacrificio de animales por electroporación en el punto de tiempo deseado. Diseccionar el ojo electroporación y fijar en el 4% de paraformaldehído a 4 ° C durante 50 minutos.
- Retire con cuidado la retina del ojo por micro-disección de distancia de la esclerótica, córnea, el cristalino, la coroides y epitelio pigmentario retiniano. Las retinas disecados pueden ser analizados bajo fluorescencia para determinar enormemente la eficiencia de la electroporación. Transferencia de las retinas de solución de sacarosa al 30% de la noche a 4 ° C.
- Congelar la retina en octubre crio-incrustación de los medios de comunicación (Sakura Finetek EE.UU.) y almacenar a -80 ° C. Retinas ahora puede ser seccionado en un cryotome y capturado en portaobjetos de vidrio.
5. Los resultados representativos:
Ejemplos de P0 retinas neonatal electroporated con un plásmido de expresión pCAG-EGFP se presentan en 3 días después de la electroporación (P3) y 14 días después de la electroporación (P14) en la figura 4. La zona de tejido de la retina electroporación es variable de experimento a experimento en función de la magnitud del daño tisular se haya incurrido durante la inyección y la uniformidad de la propagación de la solución de ADN en el espacio subretiniano. Normalmente, el 90-100% de retinas electroporated contará con las células que han incorporado con éxito y expresó el plásmido introducido. Sin embargo, cuando se toma en morfología de los tejidos y la eficiencia de electroporación sólo el 40-60% de las retinas de electroporación son adecuados para el análisis comparativo. Formación de rosetas y desprendimiento de retina en el sitio de penetración de la aguja es casi siempre observado y esta región no se debe utilizar para el análisis. ADN exitosa difusión en los resultados de microinyección en el tejido de manera eficiente electroporated lateral al sitio de penetración de la aguja libre de rosetas y el desapego. Gliosis es también una preocupación importante experimental y casi siempre ocurre en el sitio de penetración de la aguja. Sin embargo, como con formación de rosetas y desprendimiento de retina, gliosis no suele ser significativa en el tejido lateral electroporación. Marcadores inmunohistoquímicos como la proteína ácida glial fibrilar (GFAP) se puede utilizar para determinar si los niveles de gliosis reactiva en las regiones analizadas caen dentro de límites aceptables. Retinas seccionado lo que demuestra que la morfología de la retina electroporated se mantiene intacto y que las etiquetas EGFP expresión individual electroporated células se presentan. Ejemplos 3 días siguientes a la electroporación P0 (Fig. 4A-C) y 14 días después de una electroporación P0 (Fig. 4D-F) se presentan.
En las retinas de P3 a la mayoría de las células por electroporación se encuentran en la capa de neuroblástico (NBL) de la retina, y no demuestran distintas características morfológicas de cualquiera de las células diferenciadas neuronales o gliales de la retina (Fig. 4B, C). Por P14 células por electroporación se puede encontrar en la capa nuclear externa (ONL) y la capa nuclear interna (INL) de la retina. Además, la presencia de varias células etiquetadas ahora muestran señas de identidad características morfológicas de las neuronas diferenciadas como las interneuronas de la INL, los fotorreceptores y las células de Müller (Fig. 4E, F).
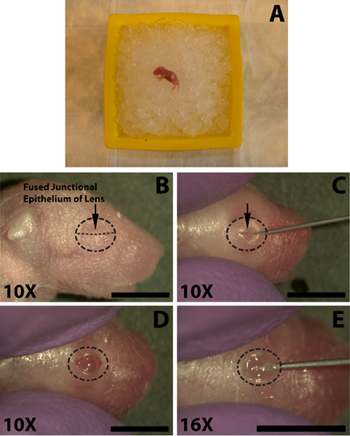
Figura 1. Anestesia de un recién nacido (P0) cría de ratón y la apertura de los ojos para inyección subretiniana de solución de ADN. A) Neonatal cachorro puesto enuna cama de hielo picado para anestesia. Ojo que se inyecta se pone abajo contra el hielo. B) La ubicación del epitelio de unión fusionada (B, flecha) de los párpados que cortar para abrir los ojos. C) El corte de los párpados a lo largo del epitelio de unión fusionada (C, flecha) para exponer a los ojos. D) Los ojos abiertos después del corte en la unión fundida. E) Se hace una incisión en el ojo por debajo de la esclerótica por debajo de la córnea para facilitar una fácil inserción de los romos de micro-inyección de la jeringa. Las barras de escala, B, C, D, E: 4mm.
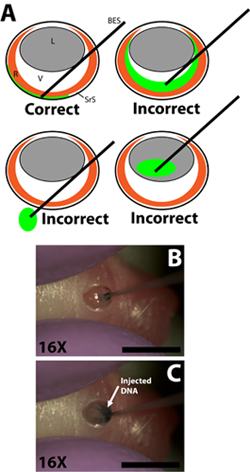
Inserción de la figura 2. Romos de la micro-inyección de la jeringa y la inyección de solución de ADN plásmido en el espacio subretiniano. A) Esquema de dibujos animados que demuestran la correcta inserción de la jeringa de inyección de micro en el ojo y la liquidación de la punta de la jeringa en el espacio subretiniano. La inyección de la solución de ADN en la cámara vítrea, la aprobación de la jeringa a través del ojo en el zócalo, o la inyección en la lente se traducirá en experimentos fallidos con pocas o ninguna las células por electroporación. B) La penetración de la aguja en la incisión en la pared escleral y la liquidación de la punta de la jeringa en el espacio subretiniano. C) La inyección de la solución de ADN en el espacio subretiniano. Las barras de escala, B, C: de 4 mm. Abreviaturas de la siguiente manera: R-retina, lente L, V-vítreo, el espacio SRS-subretinal, BES-romos jeringa.

Figura 3. Orientación del electrodo de pinza en el ratón por electroporación. A) Esquema de dibujos animados que demuestran la orientación de las palas positivos y negativos de la pinza del electrodo con respecto al ojo electroporación. El verde representa la ubicación de ADN se inyecta en el espacio subretiniano. Flechas discontinuas representan el movimiento electroforético de ADN cargado negativamente inyectada hacia el electrodo positivo. Electroforesis de ADN se produce desde el espacio subretiniano adyacente al electrodo negativo en la retina, que está orientada hacia el electrodo positivo. B) La pala positivo de la pinza se coloca junto a la microinyección de ADN del ojo y la paleta negativo se coloca al lado del ojo no se inyecta. C) Ampliación de imagen en alta de la colocación de las pinzas de electrodos en el ratón recién nacido. Las líneas discontinuas representan la dirección del movimiento electroforético de ADN hacia el electrodo positivo. Escala de barras, C: 5 mm.

Figura 4. Neonatal del ratón retinas (P0) a electroporación con pCAG-EGFP y se analizaron en el día postnatal 3 (P3) y el día postnatal 14 (P14). AC) Confocal de imágenes de la retina P3 seccionado electroporación con pCAG-EGFP en P0. La mayoría de las células por electroporación se sientan en la capa de la retina neuroblástico (NBL). (DF) Confocal de imágenes de un seccionado P14 retina electroporación con pCAG-EGFP en P0. Electroporated células pueden ser identificados en la capa nuclear externa (ONL) y la capa nuclear interna (INL) de la retina. Las barras de escala, AF: 50 micras.
Discusión
En vivo electroporación representa un método rápido y eficaz para la transformación de células de la retina con plásmidos de expresión de ADN. Este método permite al investigador para llevar a cabo estudios de ganancia de función por ectópica introducción de un gen de interés bajo el control de un promotor de expresión ubicua o para realizar estudios de pérdida de función mediante el uso de las construcciones del shRNA objetivo genes de interés. Además, múltiples plásmidos de ADN puede ser el...
Divulgaciones
Agradecimientos
Este trabajo fue financiado por el NIH R01EY020560-01 y por una beca WM Keck jóvenes en el Premio de Investigación Médica. Los autores desean agradecer a José Bedont por su ayuda durante el estudio de las preparaciones de retina y las inyecciones.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | Comentarios |
|---|---|---|---|
| Buffer de fenol saturado | Invitrogen | 15513-039 | N / A |
| Cloroformo | JT Baker | 9180-03 | N / A |
| Acetato de sodio | JT Baker | 3470-05 | 3 M de valores |
| Fast Green FCF | Fisher Biotecnología | BP123-10 | 10% de acciones |
| El alcohol isopropílico preparación | Tyco Healthcare | 6918 | N / A |
| 30 de calibre de aguja | Terumo Medical Corp. | SG2-3013 | N / A |
| Exmire microjeringa | Ito Corporación | MS * E05 | N / A |
| Tweezertrode (electrodo pinza) | BTX instrumento, Genetronics Inc. | 522 | N / A |
| Electro Plaza del evaporador (electroporador) | BTX instrumento, Genetronics Inc. | ECM 830 | N / A |
| Compuesto octubre | Sakura Finetek EE.UU. | 4583 | N / A |
Referencias
- Neumann, E., Rosenheck, K. Permeability changes induced by electric impulses in vesicular membranes. J. Membr. Biol. 10, 279-290 (1972).
- Turnbull, R. J. Letter: Letter: An alternate explanation for the permeability changes induced by electrical impulses in vesicular membranes. J. Membr. Biol. 14, 193-196 (1973).
- Zimmermann, U., Schulz, J., Pilwat, G. Transcellular ion flow in Escherichia coli B and electrical sizing of bacterias. Biophys. J. 13, 1005-1013 (1973).
- Kinosita, K., Tsong, T. Y. Voltage-induced pore formation and hemolysis of human erythrocytes. Biochim. Biophys. Acta. 471, 227-242 (1977).
- Neumann, E., Schaefer-Ridder, M., Wang, Y., Hofschneider, P. H. Gene transfer into mouse lyoma cells by electroporation in high electric fields. EMBO J. 1, 841-845 (1982).
- Swartz, M., Eberhart, J., Mastick, G. S., Krull, C. E. Sparking new frontiers: using in vivo electroporation for genetic manipulations. Dev. Biol. 233, 13-21 (2001).
- Matsuda, T., Cepko, C. L. Electroporation and RNA interference in the rodent retina in vivo and in vitro. Proc. Natl. Acad. Sci. U. S. A. 101, 16-22 (2004).
- Matsuda, T., Cepko, C. L. Controlled expression of transgenes introduced by in vivo electroporation. Proc. Natl. Acad. Sci. U. S. A. 104, 1027-1032 (2007).
- Onishi, A. Pias3-dependent SUMOylation directs rod photoreceptor development. Neuron. 61, 234-246 (2009).
- Onishi, A. The orphan nuclear hormone receptor ERRbeta controls rod photoreceptor survival. Proc. Natl. Acad. Sci. U. S. A. 107, 11579-11584 (2010).
- Kim, D. S. A Core Paired-Type and POU Homeodomain-Containing Transcription Factor Program Drives Retinal Bipolar Cell Gene Expression. J. Neurosci. 28, 7748-7764 (2008).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados