需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
在发展中国家小鼠视网膜体内电穿孔
摘要
一个执行要么增益或丧失功能的研究目的,方法纳入到小鼠的视网膜细胞的质粒DNA在体内提交。这种方法利用瞬态外部电场的应用诱导细胞质膜的渗透性增加。
摘要
哺乳动物的视网膜发育过程中基因表达的功能特性仍然是一个重大的挑战。基因打靶生成功能击倒构或有条件的损失仍然是成本和劳动强度大,以及耗时。除了这些挑战,视网膜表达基因可能导致意想不到的困惑以外的视网膜中有重要作用,当使用基因敲除方法。此外,试图找出一个细胞的命运规范和/或终末分化的作用时,能够在增益功能实验的基因异位表达可以是极其宝贵的。
我们提出了DNA质粒的快速和有效地纳入到由新生小鼠视网膜电的方法。短的电脉冲,上述某一个领域在质膜透性的瞬态增加强度 ,促进跨1,2,3,4膜材料转让,应用程序。开创性的工作表明,可以利用哺乳动物细胞的基因转移的方法诱导形成了亲水性的细胞膜,使高电荷的DNA通过脂质双分子层通过5毛孔电。不断的技术发展导致的电作为在体内的基因转移方法,在多个鼠标组织,包括视网膜,这是本文所述6,7,8,9,10的方法的可行性。
DNA溶液注入视网膜下腔,使DNA之间的视网膜色素上皮细胞和视网膜的新生(P0),鼠标和电脉冲,适用于使用镊子电极。鼠标眼睛外侧的位置可以容易镊子电极必要的负面极DNA视网膜正极对齐方向。可确定产后第2天(P2),广泛采纳和转移的基因的表达。由于缺乏显着的视网膜细胞的横向迁移,电穿孔和非电穿孔地区产生。内部组织学控制在适当情况下可作为非电穿孔地区。
视网膜电可以用来表示下一个无处不在的启动子的基因,如冠状动脉造影,或扰乱使用shRNA结构或Cre重组酶基因的功能。更有针对性的表达,可以实现设计与细胞特异性基因的启动子的结构。电穿孔细胞的可视化是通过使用双顺反子结构表达GFP或电穿孔共同构建一个绿色荧光蛋白的表达。此外,多重结构的组合基因的影响或不同基因的功能,同时增益和损失研究可能会被电。视网膜电也可能被用于分析基因顺式调控元件,通过产生适当的表达结构和缺失突变体。可以用这样的实验,找出不足或细胞特异性基因表达11规定的独联体监管区域。潜在的实验是有限的,只有通过构建可用性。
研究方案
1。质粒准备为电
电所需的DNA浓度为5μg/μl。这通常需要使用一个马克西准备(QIAGEN)或等效的方法,由净化和DNA浓度的工作金额被放大所需的质粒。以下步骤描述了DNA的工作金额的准备。
- 分装100微克的DNA(从最大的预习或同等学历),并稀释到100μL为便于操纵的音量。
- 加入苯酚;苯酚的量应计算以获得约60%的DNA /体积比(微克DNA总量),即:100微克的DNA(100μL)加67μL,苯酚(100微克:167μL)。充分混匀;不吸管向上和向下,因为这可能导致过量的DNA剪切。
- 旋转在14000 RPM,在室温下5分钟的DNA。
- 收集上清,并使用相同的DNA:在步骤1.2的总体积比混合在步骤1.2和自旋为5分钟,在室温下,14000 RPM加氯仿。
- 收集上清,加入10%的3 M醋酸钠上清体积的DNA溶液,轻轻混匀,并添加2.5 × 100%的乙醇上清液体积。混合颠倒。 DNA应该沉淀的溶液在搅拌。
- 10分钟14000转,旋转的DNA在4 ° C。
- 与350μL70%的乙醇,在5分钟14000转的旋转冲洗4 ° C。
- 空气干燥的颗粒,然后溶于1 × PBS(细胞生物学级)5μg/μL的DNA。不要overdry的样本,因为这会使它很难溶于至PBS。
- 快速绿色染料(10%的股份)的DNA溶液,染料的终浓度为0.1%,作为一个注射示踪。
2。视网膜下注射的DNA
立体显微镜的协助下执行以下步骤。一旦实行开眼,切口,注射过程所需的时间小于1.5分钟,这是不正确麻醉小狗恢复足够的时间。使用锋利的30号针头,小心地打开眼,沿切割融合的结合上皮(图1C)。不要用力过猛,这可能会导致切割底层的眼睛。避免切割,因为这会导致出血,可以掩盖注射眼睑交界处的范围之外。
- 麻醉新生小鼠在冰上几分钟( 图1A),不埋在冰幼崽,因为这可能导致的死亡率。在冰上的时间长度是从小狗小狗,通常5分钟就足够了,但小鼠应仔细监测,作为个人的反应非常迅速,可能需要更长的曝光,以确保适当的麻醉变量。一爪子掐进行止血检查撤退反射。
- 为了方便的DNA注射到视网膜下腔的眼睛必须先打开。拭注射70%的异丙醇准备(泰科医疗),并确定两个眼皮走到一起( 图 1B)的熔融结合上皮的眼睛。
- 使用锋利的30号针头,小心地打开眼,沿切割融合的结合上皮( 图 1C )。不要用力过猛,这可能会导致切割底层的眼睛。避免切割,因为这会导致出血,可以掩盖注射眼睑交界处的范围之外。
- 为了便于渗透眼睛钝端注射针头使用30 - guage针的尖端小切口在巩膜交界处附近的角膜(图 1E) 。不要渗透得太深,因为这可能会导致镜头穿刺。
- 绘制成33计钝截至注射用注射器梯度测量,每次注射(针外径0.52毫米,内径0.13毫米; Exmire microsyringe;伊藤公司)量单独针0.3μlDNA溶液。针插入切口,直到反对巩膜壁的阻力感觉。要小心,以避免针穿透镜头是通过vitreal室( 图2B)通过。
- 缓慢注入0.3μlDNA溶液,用食指或拇指压下注射器的柱塞视网膜空间。实验者必须小心地控制柱塞抑郁症的速度,因此,在DNA溶液注射到视网膜下腔率不超过DNA溶液在视网膜下腔(图2C)传播的速率。 DNA溶液是粘稠的,所以重要的是针对反对巩膜壁按得太紧,因为这可能导致在不被注入或不扩散均匀的DNA。一个成功的注入将导致更传播的DNA在视网膜下腔的部分解决方案。视网膜的地区,并没有相应的绿色示踪剂应该是明显的,旋转时,注入动物。
3。电穿孔
- 电穿孔是使用10毫米直径镊子的电极(型号#522; BTX的仪器)。为了最大限度地从动物电极的导电性和地方注入眼毗邻的正极电极和非注射眼相邻负极电极之间注入小狗的头,浸泡镊子电极在PBS电极( 图3B)。
- 五,使用脉冲发生器方波:每个脉冲为80伏特,持续50毫秒,950毫秒脉冲之间的时间间隔。
- 电穿孔幼崽现在必须预热,直到他们从冰麻醉恢复。这是可以做到变暖灯或置于幻灯片温暖的顶部的幼崽。如果使用幻灯片温暖,确保适当的垫之间的金属表面,并恢复小狗。痊愈后返回电穿孔幼仔他们的母亲。
4。分析眼睛的制备
- 电穿孔视网膜的收获和分析的时间进行实验的目标。 GFP的表达可以是严重的可视化后第3天电。 cryoembedding和切片的步骤如下。
- 牺牲所需的时间点的电穿孔动物。 Disect电穿孔眼和固定在4%多聚甲醛于4℃50分钟的彗星。
- 小心地从眼睛的视网膜微解剖远离巩膜,角膜,晶状体,脉络膜和视网膜色素上皮细胞的。可剥离的视网膜下荧光分析粗暴确定的电效率。传输视网膜30%的蔗糖溶液中过夜,4 ° C。
- 冻结视网膜到10月冷冻嵌入媒体(樱花仁昌美国)和存储在-80 ° C。视网膜现在可以切片cryotome到玻片上捕获。
5。代表性的成果:
P0新生儿视网膜与pCAG - EGFP表达质粒电穿孔的例子是在3天以下电(P3)和14天以下电(P13)在图4。电穿孔,视网膜组织的面积是可变的实验,实验在进入视网膜下腔注射和DNA溶液的扩散均匀发生的组织损伤的程度而定。通常90-100%的电穿孔视网膜的功能,已成功注册成立,并表示推出质粒的细胞。然而,在保理业务的组织形态和电效率只有40-60%的电穿孔视网膜时将适合比较分析。花环形成和视网膜脱离针穿透网站几乎总是观察和本地区不应该用于分析。成功的传播过程中的DNA高效电穿孔的针穿透花环和支队的网站组织的横向显微注射结果。胶质细胞增生也是一个重要的实验的关注,并几乎总是发生在针穿透网站。然而,与花环形成,视网膜脱离,胶质细胞增生通常是不显着横向电穿孔的组织。如胶质纤维酸性蛋白(GFAP)的免疫组织化学标记,可以用来确定是否在可接受的阈值分析地区的反应性胶质化水平下降。切片视网膜表明电穿孔视网膜形态保持完好和EGFP的表达标签,个别电穿孔细胞。例子是一个P0电( 图4A - C)和14天以下一个P0电( 图4D - F),3天以下。
多数在P3的视网膜电穿孔细胞位于视网膜(NBL)在成神经细胞层,并没有表现出任何分化的神经元或神经胶质细胞的视网膜(图4B,C),不同的形态特征。通过P14的电穿孔细胞外核层(ONL)和内核层视网膜(INL)中可以找到。此外,现在的各种标记细胞显示有区别的神经元的特性,包括interneurons的INL,感光器,和Müller胶质细胞(图4E,F)的形态特点。
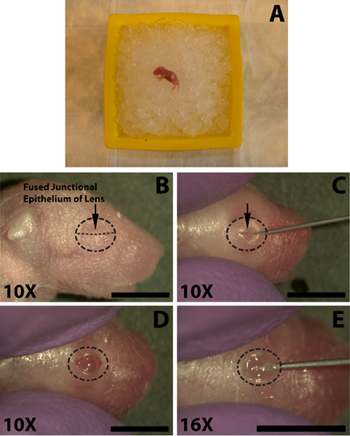
图1:一个新生(P0),鼠标小狗眼视网膜下注射DNA溶液开放麻醉。一)新生儿小狗放在碎冰麻醉床。对冰眼注入放置。要削减二)融合的结合上皮的位置(B,箭头)眼睑的眼开。 c)切割沿融合交界上皮细胞( 箭头 )的眼睑暴露眼球。四)张开眼睛,在融合的交界处切割。 e)一个切口进入眼睛下方角膜巩膜下方,以方便容易插入钝结束的微型注射器。比例尺,B,C,D,E:4MM。
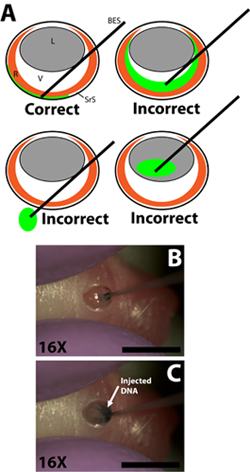
图2。生硬的插入结束进入视网膜下腔微量注射的注射器和注射DNA质粒的解决方案。一)卡通示意图展示微型注射器的正确插入到眼睛和进入视网膜下腔注射器尖端的解决。注射到玻璃体腔的DNA溶液,通过插入插座,或注射进入镜头的注射器通过眼睛将导致失败的实验,如果任何电穿孔细胞数。二)渗透的注射器到在巩膜壁进入视网膜下腔注射器尖端的解决切口。 c)注射进入视网膜下腔的DNA溶液。比例尺,B,C:4MM。缩写如下:的R -视网膜,L型镜头,V型玻璃体,视网膜SRS -空间,截至BES -钝的注射器。

图3。镊子电极到电鼠标的定位。一)卡通示意图展示的镊子电极的电穿孔眼相对的正面和负面的桨方向。绿色代表DNA注入到视网膜下腔的位置。虚线箭头表示带负电荷向正极注入DNA的电泳运动。 DNA电泳出现视网膜下的空间相邻到视网膜,这是面向正极负极。二)积极桨的镊子放在相邻的DNA注射眼和负桨放在相邻的非注射眼。三)对新生小鼠的镊子电极放置的高倍率图像。虚线表示对正极的DNA电泳运动方向。比例尺,C:5MM。

图4。新生小鼠视网膜(P0),电穿孔pCAG - EGFP和分析,在产后第3天(P3)和产后14天(P13) 。 AC)的一个切片视网膜电穿孔在P0 P3 pCAG - EGFP共焦图像。坐在大部分电穿孔细胞在视网膜成神经细胞层(NBL)。 (DF)的一个切片P14的视网膜电穿孔在P0 pCAG - EGFP的共聚焦图像。外核层(ONL)和视网膜内核层(INL) - 电穿孔细胞可以识别。比例尺,自动对焦:50微米。
Access restricted. Please log in or start a trial to view this content.
讨论
在体内电穿孔代表了视网膜细胞DNA的表达质粒转化的快速和有效的方法。此方法允许实验者执行增益功能研究异位引入一个广泛表达的启动子的控制下一个感兴趣的基因或执行使用shRNA结构针对感兴趣的基因功能研究的损失。此外,多个DNA质粒可同时电穿孔,使实验者分析多个基因的影响,或打掉一个基因,同时引入利益的第二个基因。驾驶表达Cre重组质粒电穿孔也可以利用,以消除在时?...
Access restricted. Please log in or start a trial to view this content.
披露声明
致谢
这项工作是由美国国立卫生研究院R01EY020560 - 01和一个WM凯克青年医学研究奖的学者。作者想感谢他的帮助,在视网膜制剂和注射的成像约瑟夫Bedont。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| 试剂名称 | 公司 | 目录编号 | 评论 |
|---|---|---|---|
| 缓冲区饱和酚 | Invitrogen公司 | 15513-039 | N / A |
| 氯仿 | JT贝克 | 9180-03 | N / A |
| 醋酸钠 | JT贝克 | 3470-05 | 3个中号的股票 |
| 快绿FCF | 费舍尔生物技术 | BP123 - 10 | 10%的股票 |
| 异丙醇备考 | 泰科医疗 | 6918 | N / A |
| 30 - guage针 | 泰尔茂医疗公司 | SG2 - 3013 | N / A |
| Exmire microsyringe | 伊藤公司 | MS * E05 | N / A |
| Tweezertrode(镊子电极) | BTX的仪器,Genetronics公司 | 522 | N / A |
| 电广场Porator(electroporator) | BTX的仪器,Genetronics公司 | 流脑830 | N / A |
| 华侨城复合 | 美国樱花仁昌 | 4583 | N / A |
参考文献
- Neumann, E., Rosenheck, K. Permeability changes induced by electric impulses in vesicular membranes. J. Membr. Biol. 10, 279-290 (1972).
- Turnbull, R. J. Letter: Letter: An alternate explanation for the permeability changes induced by electrical impulses in vesicular membranes. J. Membr. Biol. 14, 193-196 (1973).
- Zimmermann, U., Schulz, J., Pilwat, G. Transcellular ion flow in Escherichia coli B and electrical sizing of bacterias. Biophys. J. 13, 1005-1013 (1973).
- Kinosita, K., Tsong, T. Y. Voltage-induced pore formation and hemolysis of human erythrocytes. Biochim. Biophys. Acta. 471, 227-242 (1977).
- Neumann, E., Schaefer-Ridder, M., Wang, Y., Hofschneider, P. H. Gene transfer into mouse lyoma cells by electroporation in high electric fields. EMBO J. 1, 841-845 (1982).
- Swartz, M., Eberhart, J., Mastick, G. S., Krull, C. E. Sparking new frontiers: using in vivo electroporation for genetic manipulations. Dev. Biol. 233, 13-21 (2001).
- Matsuda, T., Cepko, C. L. Electroporation and RNA interference in the rodent retina in vivo and in vitro. Proc. Natl. Acad. Sci. U. S. A. 101, 16-22 (2004).
- Matsuda, T., Cepko, C. L. Controlled expression of transgenes introduced by in vivo electroporation. Proc. Natl. Acad. Sci. U. S. A. 104, 1027-1032 (2007).
- Onishi, A. Pias3-dependent SUMOylation directs rod photoreceptor development. Neuron. 61, 234-246 (2009).
- Onishi, A. The orphan nuclear hormone receptor ERRbeta controls rod photoreceptor survival. Proc. Natl. Acad. Sci. U. S. A. 107, 11579-11584 (2010).
- Kim, D. S. A Core Paired-Type and POU Homeodomain-Containing Transcription Factor Program Drives Retinal Bipolar Cell Gene Expression. J. Neurosci. 28, 7748-7764 (2008).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。