このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
開発マウス網膜の in vivoエレクトロポレーションで
要約
ゲインまたは機能研究の損失のいずれかを実行する目的のためのマウス網膜細胞へのプラスミドDNAの取り込みのための方法 in vivoで提示されます。このメソッドは、外部電場の印加によって誘導される細胞の細胞膜の透過性の一過性増加を利用しています。
要約
哺乳類の網膜の開発の過程で発現する遺伝子の機能解析は重要な課題である。関数のノックアウトの構成的または条件付き損失を生成するためにジーンターゲッティングは、コストや手間が、同様に時間のかかる作業のまま。これらの課題に加えて、網膜はノックアウトのアプローチを使用するときに遺伝子が意図しない困惑さにつながる網膜の外側に不可欠な役割を持っていることが表明した。細胞の運命の仕様および/または分化における役割を同定しようとすると、さらに、異所的機能の実験の利得の遺伝子を発現する能力は非常に価値があります。
我々は、エレクトロポレーションにより新生児マウスの網膜へのDNAプラスミドの迅速かつ効率的な組み込みのための方法を提示する。膜1,2,3,4にわたって材料の移転を促進する細胞膜透過性の一過性増加に一定の電界強度の結果、上記の短い電気インパルスのアプリケーション。画期的な作品は、エレクトロポレーションは、脂質二重膜5を介して高度に荷電したDNAの通過を可能にする親水性の原形質膜の細孔の形成を誘導することにより、哺乳動物細胞への遺伝子導入の方法として利用され得ることを実証した。継続的な技術開発は、網膜、ここ6、7、8、9、10に記載されているメソッドを含む複数のマウス組織におけるin vivoでの遺伝子導入のための方法として、エレクトロポレーションの実行可能性をもたらした。
そのDNAが新生児(P0)のマウス及び電気パルスの網膜色素上皮と網膜の間に配置されるようにDNA溶液をピンセット電極を使用して適用される網膜下腔に注入される。マウスの眼の横方向の配置が必要な負極- DNA -網膜-正極配置にピンセット電極を容易に方向することができます。挿入遺伝子の大規模な組み込みと発現は生後2日目(P2)によって識別できます。網膜の細胞の重要な側方移動の不足のため、エレクトロポレーションおよび非エレクトロポレーション領域が生成されます。非エレクトロ地域はどこに適切な内部組織学的コントロールとして機能することができる。
網膜エレクトロポレーションは、CAGのように、ユビキタスプロモーター下に遺伝子を発現する、またはshRNAコンストラクトまたはクレアンリコンビナーゼを用いて遺伝子機能を破壊するために使用することができます。よりターゲットを絞った発現は細胞特異的遺伝子のプロモーターと構造を設計することにより達成することができます。エレクトロポレーションした細胞の可視化は、GFPを発現したり、GFPの発現構築物の共同electroporatingでバイシストロン構文を使用して実現されます。さらに、複数の構成要素は、コンビナトリアル遺伝子の効果や異なる遺伝子の機能の同時利得と損失の研究のためにエレクトロポレートされることがあります。網膜エレクトロポレーションは、適切な発現コンストラクトおよび欠失変異体を生成することで、ゲノムのシス調節エレメントの解析に利用することができる。このような実験は、細胞特異的遺伝子発現11の十分なまたは必要なシス調節領域を同定するために使用することができます。潜在的な実験は、構造可用性によって制限されます。
プロトコル
1。エレクトロポレーションのためのプラスミド調製
エレクトロポレーションに必要なDNAの濃度は5μg/μlです。これは典型的には、所望のプラスミドは、作業量のDNAの精製と濃縮しマキシプレップ(キアゲン社)またはそれと同等のメソッドを使用して増幅する必要があります。次の手順は、作業量のDNAの調製を記載する。
- 注し100はDNAのμgの(マキシプレップまたは同等の)と操作の容易さのために100μLにボリュームを希釈する。
- フェノール追加、フェノールの量は約60%のDNA /体積比(μgのDNA:総容積)を得るために計算する必要がありますすなわち:100μgのDNA(100μLで)プラス67μLフェノール(100μgの:167μLを)。充分に混和、これはDNAの過剰なせん断が発生する可能性があるため、上下にピペッティングしていません。
- 室温で14000rpmで5分間、DNAを回転させる。
- 上清を収集し、同じDNAを用いてクロロホルムに追加:ステップ1.2の総体積比、ミックスなど、室温で5分間、14000rpmでステップ1.2とスピンで説明を。
- DNA溶液の3 M酢酸ナトリウムの10%上清ボリュームを追加し、上清を収集し、穏やかに混合し、2.5 X 100%エタノールの上清ボリュームを追加します。転倒混和します。 DNAは、ミキシングの際に溶液から沈殿してください。
- 14000rpmで10分間4℃DNA ° Cを回転させる。
- 70%エタノール350μlですすぎ、4℃で5分間、14000rpmでスピン℃に
- 空気乾燥したペレットは、5μg/μLに1 X PBS(細胞生物学のグレード)でDNAを溶かす。これはそれが非常に困難にPBSに溶解するようになるので、サンプルを乾燥し過ぎたしないでください。
- DNA溶液にファストグリーンの色素(10%株式を)追加し、染料の最終濃度は、注入トレーサーとして機能するように、0.1%です。
2。 DNAの網膜下注入
次の手順は、実体顕微鏡の支援を受けて実行されます。一度慣れた目のオープニング、切開、及び注入のプロセスが回復するために適切に麻酔子犬のための十分な時間ではないが1.5未満分かかります。シャープな30ゲージの針を使用して、慎重に溶融接合上皮(図1C)に沿って切断して目を開く。この基礎となる目の切断に繋がる可能性があるので、無理な力を加えないでください。これは注射を隠すことができます出血につながるとして、まぶたの接合の範囲を超えて切断は避けてください。
- これは死亡に繋がる可能性があるので、氷の子犬を埋葬しないで、数分間氷( 図1A)で新生児マウスを麻酔。氷の上で時間の長さは子犬から子犬の変数である、通常は5分で十分ですが、マウスは、慎重に個人は非常に迅速に対応したり、適切な麻酔を確保するために長い露出が必要かもしれないので監視する必要があります。撤退の反射を確認するために止血と足のピンチを実施する。
- 網膜下腔へのDNAの注入を容易にするために目を開く必要があります。綿棒70%イソプロピルアルコールプレップ(タイコヘルスケア)を注入された二まぶたが( 図1B)一緒に来て溶融接合上皮を識別する眼。
- シャープな30ゲージの針を使用して、慎重に溶融接合上皮( 図1C)に沿って切断して目を開く。この基礎となる目の切断に繋がる可能性があるので、無理な力を加えないでください。これは注射を隠すことができます出血につながるとして、まぶたの接合の範囲を超えて切断は避けてください。
- 平滑末端注射針は、角膜との接合部( 図1E)の近くに強膜に小切開を作る30 guage針の先端を使用することによって眼の浸透を促進する。これはレンズのパンクに繋がる可能性があるので、あまりにも深く浸透しないでください。
- 各注射(; Exmireマイクロシリンジ、伊藤corpの針外径0.52ミリメートル、内径0.13ミリメートル)のために個別に音量を測定するために注射器の勾配を使用して33ゲージ平滑末端注射針にDNA溶液0.3μlを描く。反対の強膜の壁の抵抗が感じられるまで切開に針を挿入します。針が硝子体チャンバー( 図2B)を通過するようにレンズを貫通しないように注意してください。
- ゆっくりとシリンジのプランジャーを押し下げるために人差し指または親指を使って網膜下腔へのDNA溶液を0.3μLを注入する。実験は、DNA溶液を網膜下腔に注入される速度がDNA溶液は、網膜下腔( 図2C)内に広がる速度を上回るしないようにプランジャーのうつ病の速度を制御するように注意する必要があります。それはこれがDNAを注入されていない、または均等に拡散しない恐れがあるので、針が反対側の強膜の壁にきつく押されていないことが重要であるので、DNA溶液が粘稠になります。成功した注入もになります網膜下腔の部分のDNA溶液の広がり。注入された動物を回転させるときと、緑のトレーサーの基礎となることなく、網膜の領域には明らかであろう。
3。エレクトロポレーション
- エレクトロポレーションは、直径10mmのピンセット電極(; BTXインスツルメンツモデル#522)を使用して実行されます。電極から動物への電気伝導度を最大化し、正極電極と負極に隣接する非注入眼に隣接して充血した目で電極間に注入された子犬の頭を置くためにPBSでピンセット電極を浸す電極( 図3B)。
- パルスジェネレータを使用して5矩形パルスを適用する:各パルスは、パルス間の950ミリ秒間隔で80ボルトと持続時間に50ミリ秒です。
- 彼らは氷の麻酔から回復するまで、エレクトロ仔は今まで温めておく必要があります。これは、温暖化のランプの下でまたはスライドウォーマーの上に子犬を置くことによって行うことができます。暖かいスライドを使用している場合は、適切なパッドが金属表面と回復子犬の間に配置されていることを確認してください。リカバリ時に母親にエレクトロポレーション子犬を返します。
4。分析のための目の準備
- エレクトロポレーション網膜の収穫と解析の時間は、実験の目的の対象に実行されます。 GFPの発現は3日、エレクトロポレーション後に肉眼的に可視化することができる。 cryoembeddingと以下の手順に従ってセクショニングの。
- 希望のタイムポイントでのエレクトロポレーションの動物を生け贄に捧げる。エレクトロ目をDisectと4で4%パラホルムアルデヒドで固定し° Cを50分間。
- 慎重に強膜、角膜、レンズ、脈絡膜と網膜色素上皮を離れて、マイクロ切開によって眼から網膜を削除します。解剖網膜を著しくエレクトロポレーションの効率を決定するために蛍光で分析することができます。 4℃で一晩30%ショ糖溶液に網膜を転送℃に
- OCT凍結埋め込む-80メディア(サクラファインテック米国)とストアを℃に凍結網膜網膜は、今cryotome上で区分し、ガラススライド上にキャプチャされた可能性があります。
5。代表的な結果:
プラスミドpCAG - EGFPの発現とエレクトロP0新生児網膜の例としては、エレクトロポレーション(P3)と図4のエレクトロポレーション(P14)14日後には、次の3日間で発表されています。エレクトロ網膜組織の面積は、実験から網膜下腔へのDNA溶液の拡散の注入と均一中に発生した組織の損傷の程度に応じて実験の変数です。典型的にはエレクトロポレーション網膜の百分の90から100までは正常に組み込まれ、導入したプラスミドを発現している細胞を特色にする。しかし、エレクトロポレーション網膜の際に組織の形態とエレクトロポレーションの効率を考慮にのみ40〜60パーセントは、比較分析に適したものとなる。針貫通部位のロゼット形成と網膜剥離はほぼ常に観察され、この領域は、分析には使用しないでください。成功したDNAは、ロゼットと剥離のない針の浸透のサイトへの外側効率的にエレクトロ組織内マイクロインジェクションの結果の間に広がった。グリオーシスはまた、重要な実験的な関心事であり、ほぼ常に針貫通部位に発生します。しかし、ロゼット形成と網膜剥離と同様、グリオーシスは横方向にエレクトロ組織に典型的に重要ではない。このようなグリア線維性酸性タンパク質(GFAP)のような免疫組織化学的マーカーは、分析領域における反応性グリオーシスのレベルが許容されるしきい値内に収まるかどうかを判断するために利用することができる。区分された網膜は、エレクトロポレーション網膜の形態がそのまま残っていると、個々のエレクトロポレーションした細胞が提示されるEGFP発現ラベルことを実証する。 P0エレクトロポレーション( 図4A - C)とP0エレクトロ( 図4D - F)14日後には、次の例は3日が表示されます。
P3網膜にエレクトロポレーションした細胞の大部分は、網膜の神経芽細胞層(NBL)に位置しており、網膜の分化神経またはグリア細胞( 図4B、C)のいずれかの明確な形態的特徴を示すものではありません。 P14によるエレクトロポレーションした細胞は外顆粒層(ONL)と網膜の内顆粒層(INL)で見つけることができます。さらに様々な標識された細胞は、現在INL、光受容体、およびミュラーグリアの介在( 図4E、F)を含む分化した神経細胞の特徴的な形態学的特徴を表示します。
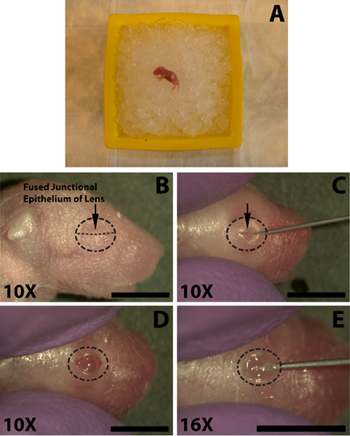
図1新生児(P0)子犬マウスとDNA溶液の網膜下注入のためのアイの開口部の麻酔。 A)新生児子犬が上に配置麻酔のための砕いた氷のベッド。注入される目は、氷属性に対する防御ダウンに配置されます。 B)アイ開口のため切断されるまぶたの融合接合上皮(B、 矢印 )の位置を。 C)目を公開するための溶融接合上皮(C、 矢印 )に沿ってまぶたをカット。 D)溶融接合でのカットは、次の目を開いたが。 E)切開は、平滑末端マイクロインジェクションシリンジを簡単に挿入を容易にするために角膜の下にある強膜の下に目に行われます。スケールバー、B、C、D、E:4ミリメートル。
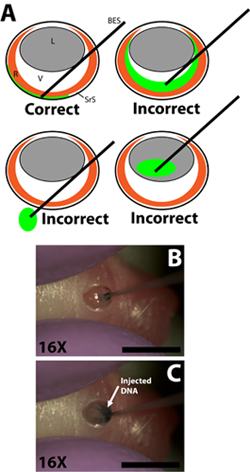
図2。鈍の挿入は、網膜下腔へのDNAプラスミド溶液のマイクロインジェクションシリンジと注入を終えた。 A)網膜下腔に注射器の先端の目と和解にマイクロインジェクションシリンジの正しい挿入を示す漫画の回路図は。硝子体腔へのDNA溶液の注入、レンズへのソケット、または注射に目を通して注射器の通過は、あらゆるエレクトロポレーションした細胞であれば、いくつかで失敗した実験になります。網膜下腔に注射器の先端部の強膜の壁との和解で行われた切開に注射器のB)浸透。網膜下腔へのDNA溶液のC)注入。スケールバー、B、C:4ミリメートル。次のように略語:R -網膜、L -レンズ、V -硝子、SRS -網膜下腔、BES -鈍は、注射器を終えた。

図3。エレクトロポレーションのためのマウスの上にピンセット電極のオリエンテーション。 A)漫画の回路図は、エレクトロポレーションの目には相対ピンセット電極のプラスとマイナスのパドルの向きを実証。グリーンは、網膜下腔に注入されたDNAの位置を表します。破線の矢印は正極に向かって負に帯電注入DNAの電気泳動の移動を表しています。 DNAの電気泳動では、正極に向かって配向している網膜に負極に隣接して網膜下腔から発生します。 B)ピンセットの正のパドルがDNAに隣接して配置されて目をマイクロインジェクションし、負のパドルは、非注入眼に隣接して配置されます。新生児マウスのピンセットの電極配置のC)高倍率像。破線は、正極に向かってDNAの電気泳動移動方向を表しています。スケールバー、C:5ミリメートル。

図4新生児マウスの網膜(P0)pCAG - EGFPとエレクトロと生後3日目(P3)と生後14日目(P14)で分析した。 AC)P0でpCAG - EGFPとエレクトロ区分P3の網膜の共焦点画像。エレクトロポレーションした細胞の大部分は、網膜神経芽細胞層(NBL)で座っている。 P0でpCAG - EGFPとエレクトロ区分P14網膜の(DF)共焦点画像。エレクトロポレーションした細胞は外顆粒層(ONL)と網膜の内顆粒層(INL)で識別できます。スケールバー、AF:50μmである。
Access restricted. Please log in or start a trial to view this content.
ディスカッション
in vivoでエレクトロポレーションは、DNAの発現プラスミドと網膜細胞の形質転換のための迅速かつ効率的な方法を表します。このメソッドは、実験者が異所的に普遍的に発現プロモーターの制御下に目的の遺伝子を導入することにより、機能研究のゲインを実行したり、関心のある遺伝子を標的とするshRNAコンストラクトを使用して、関数の研究の損失を実行することができます。さら...
Access restricted. Please log in or start a trial to view this content.
開示事項
謝辞
この作品は、NIH R01EY020560 - 01でと医学研究賞のWMケックヤングの学者によって賄われていた。著者らは、網膜の調製と注射の撮影中に彼の援助のためにジョセフBedontに感謝します。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名前 | 会社 | カタログ番号 | コメント |
|---|---|---|---|
| バッファが飽和フェノール | インビトロジェン | 15513-039 | N / |
| クロロホルム | JTベイカー | 9180〜03 | N / |
| 酢酸ナトリウム | JTベイカー | 3470〜05 | 3 Mの株式 |
| ファストグリーンFCF | フィッシャーバイオテック | BP123 - 10 | 10%の株式 |
| イソプロピルアルコール準備 | タイコヘルスケア | 6918 | N / |
| 30 guage針 | テルモメディカル社 | SG2 - 3013 | N / |
| Exmireマイクロシリンジ | 株式会社イトー | MS * E05 | N / |
| Tweezertrode(ピンセット電極) | BTXインストゥルメント、Genetronics株式会社 | 522 | N / |
| 電気スクエアPorator(エレクトロ) | BTXインストゥルメント、Genetronics株式会社 | ECM 830 | N / |
| OCTコンパウンド | サクラファインテック米国 | 4583 | N / |
参考文献
- Neumann, E., Rosenheck, K. Permeability changes induced by electric impulses in vesicular membranes. J. Membr. Biol. 10, 279-290 (1972).
- Turnbull, R. J. Letter: Letter: An alternate explanation for the permeability changes induced by electrical impulses in vesicular membranes. J. Membr. Biol. 14, 193-196 (1973).
- Zimmermann, U., Schulz, J., Pilwat, G. Transcellular ion flow in Escherichia coli B and electrical sizing of bacterias. Biophys. J. 13, 1005-1013 (1973).
- Kinosita, K., Tsong, T. Y. Voltage-induced pore formation and hemolysis of human erythrocytes. Biochim. Biophys. Acta. 471, 227-242 (1977).
- Neumann, E., Schaefer-Ridder, M., Wang, Y., Hofschneider, P. H. Gene transfer into mouse lyoma cells by electroporation in high electric fields. EMBO J. 1, 841-845 (1982).
- Swartz, M., Eberhart, J., Mastick, G. S., Krull, C. E. Sparking new frontiers: using in vivo electroporation for genetic manipulations. Dev. Biol. 233, 13-21 (2001).
- Matsuda, T., Cepko, C. L. Electroporation and RNA interference in the rodent retina in vivo and in vitro. Proc. Natl. Acad. Sci. U. S. A. 101, 16-22 (2004).
- Matsuda, T., Cepko, C. L. Controlled expression of transgenes introduced by in vivo electroporation. Proc. Natl. Acad. Sci. U. S. A. 104, 1027-1032 (2007).
- Onishi, A. Pias3-dependent SUMOylation directs rod photoreceptor development. Neuron. 61, 234-246 (2009).
- Onishi, A. The orphan nuclear hormone receptor ERRbeta controls rod photoreceptor survival. Proc. Natl. Acad. Sci. U. S. A. 107, 11579-11584 (2010).
- Kim, D. S. A Core Paired-Type and POU Homeodomain-Containing Transcription Factor Program Drives Retinal Bipolar Cell Gene Expression. J. Neurosci. 28, 7748-7764 (2008).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved