A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
ב electroporation vivo של הרשתית עכבר פיתוח
In This Article
Summary
שיטה שילוב של פלסמיד דנ"א לתוך תאים ברשתית Murine לצורך ביצוע או רווח או הפסד של מחקרים פונקציה In vivo מוצג. שיטה זו מנצל להגדיל את חולף על החדירות של קרום התא פלזמה המושרה על ידי יישום של שדה חשמלי חיצוני.
Abstract
אפיון פונקציונלי של גנים הביע במהלך התפתחות הרשתית יונקים עדיין מהווה אתגר משמעותי. ג'ין מיקוד ליצור הפסד או מותנה המכונן של knockouts פונקציה נשאר עלות עבודה אינטנסיבית, כמו גם זמן רב. הוספת לאתגרים אלה, הרשתית הביע גנים ייתכן תפקידים חיוניים מחוץ הרשתית המוביל בלבול מכוון בעת שימוש בגישה בנוקאאוט. יתר על כן, היכולת להביע ectopically גן ברווח של הניסוי פונקציה יכול להיות יקר מאוד כאשר מנסים לזהות את תפקיד מפרט תא גורל ו / או בידול סופנית.
אנו מציגים שיטה שילוב מהיר ויעיל של פלסמידים DNA לתוך הרשתית עכבר בילוד ידי electroporation. היישום של דחפים חשמליים קצר מעל כוח תוצאות מסוימות בתחום לעלייה זמנית בחדירות הממברנה הפלסמטית, להקל על העברת החומר על פני קרום 1,2,3,4. עבודתו פורצת הוכיח כי electroporation יכול להיות מנוצל כאמצעי להעברת גנים לתאי יונקים ידי גרימת היווצרות קרום הידרופילי הנקבוביות פלזמה המאפשר מעבר של DNA טעון דרך bilayer השומנים 5. הפיתוח הטכני רציף הביא לקיומה של electroporation כשיטה ב vivo העברת גנים ברקמות עכבר מרובים כולל הרשתית, השיטה המתוארת להלן 6, 7, 8, 9, 10.
פתרון ה-DNA מוזרק אל תוך החלל subretinal כך DNA ממוקם בין אפיתל הפיגמנט ברשתית הרשתית של העכבר (P0) בילוד ו פולסים חשמליים מוחלים באמצעות אלקטרודה פינצטה. מיקום רוחבי של העיניים העכבר מאפשר התמצאות קלה של האלקטרודה פינצטה את היישור הכרחי מוט ה-DNA הרשתית חיובי שלילי מוט. שילוב ביטוי נרחב של הגנים הועבר ניתן לזהות על ידי יום לאחר הלידה 2 (P2). בשל העדר ההגירה רוחבי משמעותי של תאים ברשתית, אזורים electroporated ולא electroporated נוצרות. Non-electroporated אזורים עשויה לשמש היסטולוגית בקרות פנימיות ובמידת הצורך.
Electroporation רשתית ניתן להשתמש כדי לבטא את הגן תחת מקדם בכל מקום, כגון החטיבה, או לשבש את תפקוד הגן באמצעות בונה shRNA או Cre-recombinase. ביטוי ממוקד יותר ניתן להשיג על ידי תכנון בונה עם היזמים תאים ספציפיים גן. ויזואליזציה של תאים electroporated מושגת באמצעות בונה bicistronic להביע GFP או על ידי שיתוף electroporating ביטוי של GFP לבנות. יתר על כן, בונה מרובות ניתן electroporated לחקר תופעות גן קומבינטורית או רווח והפסד בו זמנית של פונקציה של גנים שונים. Electroporation רשתית עשוי גם להיות מנוצל לצורך ניתוח של cis-הרגולציה אלמנטים גנומית ידי יצירת בונה ביטוי הולם מוטנטים המחיקה. ניסויים כאלה יכולים לשמש כדי לזהות cis-הרגולציה האזורים מספיק או נדרש ביטוי גנים ספציפיים תא 11. ניסויים אפשריים מוגבלים רק על ידי זמינות לבנות.
Protocol
1. הכנה פלסמיד עבור electroporation
ריכוז ה-DNA הנדרש electroporation הוא 5μg/μl. זה בדרך כלל דורש פלסמידים הרצוי להיות מוגבר באמצעות מקסי-prep (Qiagen) או בשיטה שוות ערך ואחריו טיהור וריכוז הדנ"א לכמות העבודה. השלבים הבאים מתארים את הכנת ה-DNA לכמות העבודה.
- Aliquot 100 מיקרוגרם של ה-DNA (מ prep-מקסי או שווה ערך) לדלל את נפח μL 100 על מנת להקל על מניפולציה.
- הוסף פנול; כמות של פנול יש לחשב להשיג 60 כ DNA / נפח% יחס (DNA מיקרוגרם: הנפח הכולל), דהיינו: 100 מיקרוגרם DNA (ב μL 100) בתוספת 67 μL פנול (100 מיקרוגרם: 167 μL). מערבבים היטב, אל פיפטה למעלה ולמטה מכיוון שהדבר עלול לגרום מריחה מוגזמת של ה-DNA.
- ספין ה-DNA במשך 5 דקות ב 14,000 סל"ד בטמפרטורת החדר.
- איסוף supernatant ולהוסיף כלורופורם באמצעות ה-DNA זהה: יחס הנפח הכולל בשלב 1.2, לערבב כמתואר ב 14,000 סל"ד בשלב 1.2 ו - ספין במשך 5 דקות בטמפרטורת החדר.
- אסוף את supernatant, להוסיף נפח supernatant 10% נתרן אצטט M 3 לפתרון ה-DNA, מערבבים בעדינות ומוסיפים 2.5 X נפח supernatant של אתנול 100%. מערבבים על ידי היפוך. ה-DNA צריך לזרז את הפתרון במהלך הערבוב.
- ספין ה-DNA על 4 מעלות צלזיוס במשך 10 דקות ב 14,000 סל"ד.
- שטפו עם 350 μl של אתנול 70%, ספין ב 14000 סל"ד במשך 5 דקות ב 4 ° C.
- האוויר יבש גלולה ואז לפזר את ה-DNA 1 X PBS (ביולוגיה בכיתה נייד) כדי 5μg/μL. אל overdry מדגם כמו זה יקשה מאוד להתמוסס אל תוך PBS.
- הוסף מהיר צבע ירוק (10% מניות) לפתרון ה-DNA, את הריכוז הסופי של צבע היא 0.1%, לשמש נותב זריקה.
2. הזרקת Subretinal של דנ"א
השלבים הבאים מתבצעים בסיוע stereomicroscope. התאמן לאחר סיום תהליך של פתיחת העין, חתך, הזרקת לוקח פחות מ -1.5 דקות וזה לא מספיק זמן גור הרדים שצריך להתאושש. באמצעות מחט חדה של 30 מד, לפתוח בזהירות את העין על ידי חיתוך לאורך האפיתל junctional התמזגו (איור 1C). אין להפעיל כוח מוגזם כמו זה עלול לגרום חיתוך של העין הבסיסית. הימנע חיתוך מעבר לטווח של צומת העפעף כמו זה יגרום לדימום שיכול לטשטש את הזריקה.
- להרדים את העכברים היילוד על קרח למשך מספר דקות (איור 1 א), לא לקבור את הגורים בקרח, זה עלול לגרום לתמותה. משך הזמן משתנה על הקרח מן הגור אל גור, בדרך כלל 5 דקות מספיקה אבל העכברים צריכים להיות במעקב צמוד כפרטים עלול להגיב מהר מאוד או עשוי לדרוש חשיפה ארוך יותר על מנת להבטיח הרדמה המתאים. התנהגות קמצוץ כפה עם hemostats כדי לבדוק רפלקס נסיגה.
- על מנת להקל על ההזרקה של ה-DNA למרחב subretinal העין חייב להיות הראשון נפתח. ספוגית העין להיות מוזרק עם 70% אלכוהול איזופרופיל הכנה (Tyco הבריאות) ולזהות את האפיתל junctional שבו התמזגו שני העפעפיים באים ביחד (איור 1B).
- באמצעות מחט חדה של 30 מד, לפתוח בזהירות את העין על ידי חיתוך לאורך האפיתל junctional התמזגו (איור 1C). אין להפעיל כוח מוגזם כמו זה עלול לגרום חיתוך של העין הבסיסית. הימנע חיתוך מעבר לטווח של צומת העפעף כמו זה יגרום לדימום שיכול לטשטש את הזריקה.
- כדי להקל על חדירה של העין על ידי מחט קהה הזרקת הסתיים להשתמש קצה מחט 30-guage לעשות חתך קטן בלובן העין סמוך לצומת עם הקרנית (איור 1E). לא לחדור עמוק מדי כי זה עלול לגרום לנקב של העדשה.
- צייר 0.3 μl של פתרון ה-DNA לתוך 33 מד בוטה מחט הזריקה הסתיים באמצעות הדרגתיים מזרק כדי למדוד את נפח בנפרד עבור כל הזרקה (מחט קוטר חיצוני 0.52 מ"מ, קוטר פנימי 0.13 מ"מ; Exmire microsyringe; איטו קורפ). הכנס את המחט לתוך החתך עד ההתנגדות של הקיר scleral מנוגדות מורגשת. להיזהר חודר את העדשה כמו את המחט עובר דרך תא vitreal (איור 2B).
- לאט לאט להזריק 0.3 μl של פתרון ה-DNA לתוך החלל subretinal באמצעות האצבע או האגודל כדי לוחץ על המתג מזרק. הנסיין חייב להיות זהיר כדי לשלוט על מהירות של דיכאון הבוכנה כך את הקצב שבו הפתרון הדנ"א מוזרק לתוך חלל subretinal לא לעבור את הקצב שבו הפתרון DNA מתפשט במרחב subretinal (איור 2C). פתרון ה-DNA הוא צמיג כל כך חשוב כי את המחט לא נלחץ חזק מדי על הקיר scleral מנוגדים כמו זה עלול לגרום הדנ"א לא להיות מוזרק או לא מתפשט באופן שווה. זריקה מוצלחת תביא עודהתפשטות של פתרון ה-DNA חלק משטח subretinal. אזורים של הרשתית עם ובלי הבסיס נותב ירוק צריך להיות ברור מתי לסובב את החיה מוזרק.
3. Electroporation
- Electroporation מבוצעת באמצעות בקוטר 10 מ"מ פינצטה אלקטרודה (דגם # 522; מכשירים BTX). משרים את האלקטרודה פינצטה ב PBS על מנת למקסם את המוליכות החשמלית של האלקטרודה לחיה מקום ראש הגור הזריק בין האלקטרודות בעין מוזרק הסמוכים אלקטרודה הקוטב החיובי וגם את העין הלא מוזרק סמוך לקוטב שלילי אלקטרודה (איור 3B).
- החל בחמש לחיצות מרובע באמצעות גנרטור הדופק: הדופק כל 80 וולט ו 50 אלפיות השנייה באורכה עם מרווח 950 אלפית השנייה בין הפולסים.
- הגורים electroporated כעת יש חימם עד שהם להתאושש מן ההרדמה את הקרח. ניתן לעשות זאת על ידי הצבת את הגורים מתחת לפנס ההתחממות או על גבי שקופית חם. אם באמצעות שקופיות חם להבטיח כי כרית מתאימה ממוקם בין משטח המתכת הגור מחלים. לאחר התאוששות להחזיר את הגורים electroporated לאמא שלהם.
4. הכנת עיניים לניתוח
- השעה של קצירת וניתוח של הרשתית electroporated מבוצע בכפוף מטרות הניסוי. ביטוי של GFP ניתן דמיינו גסה 3 ימים לאחר electroporation. עבור cryoembedding ואת חתך המשך כדלהלן.
- הקורבן חיות electroporated ב timepoint הרצוי. Disect את העין electroporated ולתקן paraformaldehyde ב -4% ב -4 מעלות צלזיוס למשך 50 דקות.
- הסר בזהירות את הרשתית של העין על ידי מיקרו לנתח משם את בלובן העין, הקרנית, העדשה, דמית העין ו אפיתל הפיגמנט ברשתית. הרשתיות גזור עשוי להיות מנותח תחת פלואורסצנטי גסה לקבוע את היעילות של electroporation. מעבירים את הרשתיות לפתרון סוכרוז 30% לילה בשעה 4 ° C.
- הקפאת הרשתיות לתוך אוקטובר cryo-הטמעת המדיה (סאקורה Finetek ארה"ב) ולאחסן ב -80 ° C. הרשתיות יכול עכשיו להיות מחולק על cryotome וכבש על שקופיות הזכוכית.
5. נציג תוצאות:
דוגמאות P0 הרשתיות בילוד electroporated עם הביטוי pCAG-EGFP פלסמיד מוצגים 3 ימים לאחר electroporation (P3) ו 14 הימים הבאים electroporation (P14) בתרשים 4. אזור של רקמת הרשתית electroporated משתנה מניסוי לניסוי, תלוי במידה של נזק לרקמות שנגרם במהלך ההזרקה ואת שויון התפשטותה של פתרון ה-DNA לתוך החלל subretinal. בדרך כלל 9-10% של הרשתית electroporated יכלול תאים שילבו בהצלחה והביע פלסמיד הציג. עם זאת, כאשר הפקטורינג מורפולוגיה רקמות יעילות electroporation רק 40-60% של הרשתית electroporated יהיה מתאים ניתוח השוואתי. היווצרות רוזט ועל ניתוק הרשתית באתר של חדירת המחט הוא כמעט תמיד ציין את האזור הזה לא אמור לשמש לניתוח. DNA בהצלחה להפיץ במהלך התוצאות microinjection ברקמות electroporated ביעילות לרוחב לאתר של חדירת מחט ללא רוזטות וניתוק. דבקת היא גם דאגה הניסוי חשוב וכמעט תמיד מתרחשת באתר של חדירת המחט. עם זאת, כמו היווצרות שושנת ועל ניתוק הרשתית, דבקת הוא בדרך כלל לא משמעותי ברקמת electroporated רוחבית. סמנים immunohistochemical כגון חלבון גליה חומצי fibrillary (GFAP) יכול להיות מנוצל כדי לקבוע אם רמות דבקת תגובתי באזורים ניתח בגדר סף מקובל. הרשתית מחולק הוכחת כי את המורפולוגיה של הרשתית electroporated נשאר שלם וכי תוויות EGFP ביטוי בתאים בודדים electroporated מוצגים. דוגמאות 3 ימים לאחר electroporation P0 (איור 4A-C) 14 ימים לאחר electroporation P0 (איור F-4D) מוצגים.
ב הרשתיות P3 רוב התאים electroporated ממוקמות בשכבת neuroblastic (העל) של הרשתית, ולא להפגין מאפיינים מורפולוגיים ברורים של כל אחד תאים עצביים או גליה מובחן של הרשתית (איור 4 ב ', ג'). על ידי P14 תאים electroporated ניתן למצוא שכבת הגרעין החיצוני (ONL) לבין שכבת הגרעין הפנימית (INL) של הרשתית. יתר על כן התאים שכותרתו שונים עכשיו להציג סימני ההיכר המורפולוגיים האופייניים של נוירונים הבדיל כולל interneurons של INL, photoreceptors, ואת גליה מולר (איור 4E, F).
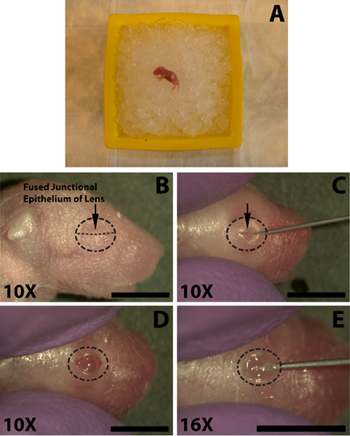
באיור 1. הרדמה של עכבר (P0) הגור הנולד ופתיחת עין הזרקת subretinal של פתרון ה-DNA. א) גור ילודים דגש עלמצע של קרח כתוש עבור הרדמה. Eye להיות מוזרק ממוקם מטה נגד הקרח. ב) המיקום של האפיתל junctional התמזגו (B, חץ) של העפעפיים כדי לגזור על פתיחת העין. ג) חיתוך של העפעפיים לאורך האפיתל junctional התמזגו (C, חץ) כדי לחשוף את העין. ד) עין שנפתחו בעקבות חיתוך בצומת התמזגו. E), מבצעים חתך מתחת לעין ב sclera מתחת הקרנית כדי להקל על הכניסה קלה של המזרק בוטה הסתיים מיקרו הזרקה. סולם ברים, B, C, D, E: 4 מ"מ.
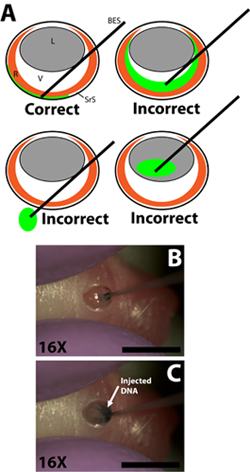
איור 2. החדרת הבוטה הסתיים הזרקת מיקרו מזרק זריקה של פתרון ה-DNA פלסמיד לחלל subretinal. א) סכמטית Cartoon הוכחת את הכניסה הנכונה של המזרק מיקרו הזרקה לתוך העין והתיישבות של קצה מזרק לחלל subretinal. הזרקה של פתרון ה-DNA לתוך תא זגוגי, מעבר של המזרק דרך עין לשקע, או הזרקה לתוך העדשה תגרום ניסויים נכשל עם כמה אם בכלל תאים electroporated. ב) חדירה של המזרק לתוך החתך עשוי בקיר ההתיישבות scleral של קצה מזרק לחלל subretinal. ג) הזרקה של פתרון ה-DNA לתוך החלל subretinal. סולם ברים, B, C: 4 מ"מ. קיצורים כדלקמן: R-הרשתית, L-עדשה, V-זגוגי, SRS-subretinal בחלל, BES-בוטה הסתיים מזרק.

איור 3. אוריינטציה של האלקטרודה פינצטה על העכבר עבור electroporation. א) סכמטית Cartoon הוכחת את הכיוון של משוטים החיוביים והשליליים של האלקטרודה פינצטה יחסית העין electroporated. הירוק מייצג את המיקום של ה-DNA מוזרק אל תוך החלל subretinal. חיצים רצתי מייצגים את התנועה electrophoretic של דנ"א מוזרק טעונים שלילית כלפי האלקטרודה החיובית. אלקטרופורזה הד.נ. א מתרחש מהחלל subretinal הסמוכים האלקטרודה השלילית לתוך הרשתית אשר מכוונת לעבר האלקטרודה החיובית. ב) ההנעה החיובית של פינצטה ממוקם בסמוך ל-DNA microinjected העין ואת ההנעה שלילי ממוקם סמוך לעין הלא מוזרק. ג) הגדלה של התמונה גבוהה פינצטה מיקום האלקטרודה על העכבר הילוד. כקווים מקווקווים מייצגים את כיוון התנועה של ה-DNA electrophoretic לעבר האלקטרודה החיובית. סרגל קנה מידה, C: 5mm.

איור 4. העכבר הרשתיות ילודים (P0) electroporated עם pCAG-EGFP ונותחו ביום הלידה 3 (P3) יום לאחר הלידה 14 (P14). AC) תמונות Confocal של הרשתית P3 מחולק electroporated עם pCAG EGFP ב-P0. רוב התאים electroporated לשבת בשכבה neuroblastic הרשתית (העל). (DF) תמונות Confocal של הרשתית P14 מחולק electroporated עם pCAG EGFP ב-P0. תאים Electroporated ניתן לזהות שכבת הגרעין החיצוני (ONL) לבין שכבת הגרעין הפנימית (INL) של הרשתית. סולם ברים, AF: 50 מיקרומטר.
Access restricted. Please log in or start a trial to view this content.
Discussion
בשנת vivo electroporation מייצג שיטה מהירה ויעילה לטרנספורמציה של תאים ברשתית עם פלסמידים ביטוי ה-DNA. שיטה זו מאפשרת לבצע את הניסוי רווח של מחקרים לתפקד ectopically על ידי החדרת גן של עניין בשליטת היזם הביע בכל מקום בגוף או לבצע אובדן של מחקרים לתפקד באמצעות בונה shRNA מיקוד גנים ?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
Acknowledgements
עבודה זו מומנה על ידי NIH R01EY020560-01 ועל ידי חוקר WM Keck יאנג פרס למחקר רפואי. המחברים מבקשים להודות יוסף Bedont עזרתו במהלך הדמיה של ההכנות זריקות הרשתית.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| שם מגיב | חברה | מספר קטלוגי | תגובות |
|---|---|---|---|
| מאגר רווי פנול | Invitrogen | 15513-039 | N / A |
| כלורופורם | JT בייקר | 9180-03 | N / A |
| נתרן אצטט | JT בייקר | 3470-05 | 3 מ 'מניות |
| מהיר גרין FCF | פישר ביוטק | BP123-10 | 10% מניות |
| איזופרופיל אלכוהול הכנה | Tyco Healthcare | 6918 | N / A |
| 30 guage מחט | Terumo רפואי קורפ | SG2-3013 | N / A |
| Exmire microsyringe | איטו Corporation | MS * E05 | N / A |
| Tweezertrode (אלקטרודה פינצטה) | כלי BTX, Genetronics בע"מ | 522 | N / A |
| אלקטרו כיכר Porator (electroporator) | כלי BTX, Genetronics בע"מ | ECM 830 | N / A |
| אוקטובר מתחם | סאקורה Finetek ארה"ב | 4583 | N / A |
References
- Neumann, E., Rosenheck, K. Permeability changes induced by electric impulses in vesicular membranes. J. Membr. Biol. 10, 279-290 (1972).
- Turnbull, R. J. Letter: Letter: An alternate explanation for the permeability changes induced by electrical impulses in vesicular membranes. J. Membr. Biol. 14, 193-196 (1973).
- Zimmermann, U., Schulz, J., Pilwat, G. Transcellular ion flow in Escherichia coli B and electrical sizing of bacterias. Biophys. J. 13, 1005-1013 (1973).
- Kinosita, K., Tsong, T. Y. Voltage-induced pore formation and hemolysis of human erythrocytes. Biochim. Biophys. Acta. 471, 227-242 (1977).
- Neumann, E., Schaefer-Ridder, M., Wang, Y., Hofschneider, P. H. Gene transfer into mouse lyoma cells by electroporation in high electric fields. EMBO J. 1, 841-845 (1982).
- Swartz, M., Eberhart, J., Mastick, G. S., Krull, C. E. Sparking new frontiers: using in vivo electroporation for genetic manipulations. Dev. Biol. 233, 13-21 (2001).
- Matsuda, T., Cepko, C. L. Electroporation and RNA interference in the rodent retina in vivo and in vitro. Proc. Natl. Acad. Sci. U. S. A. 101, 16-22 (2004).
- Matsuda, T., Cepko, C. L. Controlled expression of transgenes introduced by in vivo electroporation. Proc. Natl. Acad. Sci. U. S. A. 104, 1027-1032 (2007).
- Onishi, A. Pias3-dependent SUMOylation directs rod photoreceptor development. Neuron. 61, 234-246 (2009).
- Onishi, A. The orphan nuclear hormone receptor ERRbeta controls rod photoreceptor survival. Proc. Natl. Acad. Sci. U. S. A. 107, 11579-11584 (2010).
- Kim, D. S. A Core Paired-Type and POU Homeodomain-Containing Transcription Factor Program Drives Retinal Bipolar Cell Gene Expression. J. Neurosci. 28, 7748-7764 (2008).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved