É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Em Eletroporação vivo de Retina do rato em desenvolvimento
Neste Artigo
Resumo
Um método para a incorporação de DNA plasmidial em células da retina de camundongos com o propósito de realizar qualquer ganho ou perda de função de estudos In vivo É apresentado. Este método capitaliza sobre o aumento transitório da permeabilidade da membrana plasmática celular induzida pela aplicação de um campo elétrico externo.
Resumo
A caracterização funcional de genes expressos durante o desenvolvimento da retina de mamíferos ainda é um desafio significativo. Gene targeting para gerar perda constitutivo ou condicional de nocautes função permanece custo e mão de obra intensiva, bem como demorado. Adicionando a estes desafios, retina expressa genes podem ter um papel essencial fora da retina levando a confunde involuntária ao usar uma abordagem nocaute. Além disso, a capacidade de ectopicamente expressar um gene em um ganho de experiência função pode ser extremamente valiosa quando se tenta identificar um papel na especificação célula destino e / ou diferenciação terminal.
Nós apresentamos um método para a incorporação rápida e eficiente de plasmídeos de DNA na retina do rato neonatal por eletroporação. A aplicação de impulsos elétricos curtos resultados acima de um determinado campo de força em um aumento transitório da permeabilidade da membrana plasmática, facilitando a transferência de material através da membrana 1,2,3,4. Trabalho inovador demonstrou que eletroporação poderia ser utilizada como um método de transferência de genes em células de mamíferos, induzindo a formação de poros da membrana plasmática hidrofílica permitindo a passagem de DNA altamente carregada através da bicamada lipídica 5. Desenvolvimento técnico contínuo resultou na viabilidade da eletroporação como um método para transferência de genes in vivo nos tecidos dos camundongos múltiplos, incluindo a retina, o método pelo qual é aqui descrito 6, 7, 8, 9, 10.
Solução de DNA é injetado no espaço sub-retiniano assim que o DNA é colocado entre o epitélio pigmentado da retina e retina do mouse (P0) neonatal e pulsos elétricos são aplicadas usando um eletrodo de pinça. A colocação lateral dos olhos no mouse permite a fácil orientação do eletrodo de pinça para o alinhamento do pólo negativo necessário pole-DNA-retina-positivos. Incorporação extensiva e expressão de genes transferidos podem ser identificados por dia pós-natal 2 (P2). Devido à falta de migração lateral significativo de células da retina, regiões electroporated e não electroporated são gerados. Não electroporated regiões podem servir como controles internos histológico se for o caso.
Eletroporação da retina pode ser usado para expressar um gene sob um promotor onipresente, como o CAG, ou para perturbar a função do gene usando construções shRNA ou Cre-recombinase. Expressão mais específica pode ser conseguida através da concepção de construções com os promotores de célula específica do gene. Visualização de células electroporated é conseguido usando construções bicistronic expressando GFP ou por co-electroporating uma expressão de GFP construir. Além disso, constrói múltiplas podem ser electroporated para o estudo dos efeitos do gene combinatorial ou ganho simultânea e perda de função de genes diferentes. Eletroporação da retina também podem ser utilizados para a análise genômica de cis-regulatórias elementos, gerando construções de expressão apropriada e mutantes exclusão. Tais experiências podem ser usados para identificar regiões cis-regulatórias suficiente ou necessária para a expressão gênica de células específicas 11. Experiências potenciais são limitados apenas pela disponibilidade de construir.
Protocolo
1. Preparação plasmídeo para eletroporação
A concentração de DNA necessária para eletroporação é 5μg/μl. Isso normalmente requer os plasmídeos desejava ser amplificados em um Maxi-prep (Qiagen) ou método equivalente seguido de uma purificação e concentração do DNA com a quantidade de trabalho. Os passos seguintes descrevem a preparação de DNA com a quantidade de trabalho.
- Alíquota de 100 mg de DNA (de Maxi prep ou equivalente) e diluir o volume de 100 mL para a facilidade de manipulação.
- Adicionar fenol, a quantidade de fenol deve ser calculado para obter um rácio de aproximadamente 60% de DNA / volume (DNA mg: volume total), ou seja: 100 mg DNA (em 100 mL) com 67 mL de fenol (100 mg: 167 mL). Misturar bem, não pipeta cima e para baixo, pois isso pode causar corte excessivo do DNA.
- Girar o DNA por 5 minutos a 14000 RPM à temperatura ambiente.
- Recolher o sobrenadante e adicionar clorofórmio usando o mesmo DNA: a relação volume total no passo 1.2; mix como descrito no passo 1.2 e girar a 14.000 RPM por 5 minutos em temperatura ambiente.
- Recolher o sobrenadante, adicionar 10% de volume sobrenadante de 3 M acetato de sódio à solução de DNA, misture delicadamente e adicionar 2,5 X o volume sobrenadante de etanol a 100%. Misture por inversão. DNA deve precipitar para fora da solução durante a mistura.
- Girar o DNA a 4 ° C por 10 minutos a 14.000 RPM.
- Enxágüe com 350 mL de etanol 70%, giram em 14.000 RPM por 5 minutos a 4 ° C.
- O ar seco do sedimento, em seguida, dissolver o DNA em 1 X PBS (grau Biologia celular) para 5μg/μL. Não overdry a amostra, pois isso fará com que seja muito difícil de se dissolver em PBS.
- Adicionar corante verde rápido (10% de ações) para a solução de DNA, a concentração final do corante é de 0,1%, para agir como um traçador de injeção.
2. Injeção sub-retiniana de DNA
As seguintes etapas são realizadas com o auxílio de um estereomicroscópio. Uma vez praticado o processo de abertura dos olhos, a incisão, e injeção leva menos de 1,5 minutos que não é tempo suficiente para um filhote de cachorro adequadamente anestesiados para se recuperar. Usando uma agulha de calibre 30 afiada, abra cuidadosamente o olho, cortando ao longo do epitélio juncional fundidos (Fig. 1C). Não aplique força excessiva, pois isso pode resultar em corte do olho subjacente. Evitar o corte além do alcance da junção das pálpebras, pois isso irá resultar em hemorragia que pode obscurecer a injeção.
- Anestesiar os ratos recém-nascidos no gelo por alguns minutos (Fig. 1A), não enterrar filhotes no gelo, pois isso pode resultar em mortalidade. O período de tempo no gelo é variável de cachorro para cachorro, normalmente 5 minutos é suficiente, mas os ratos devem ser cuidadosamente monitorizados como indivíduos podem responder muito rapidamente ou pode exigir mais tempo de exposição para garantir anestesia adequada. Realizar uma pitada de pata com hemostats para verificar se há reflexo de retirada.
- A fim de facilitar a injeção de DNA para o espaço sub-retiniano no olho deve primeiro ser aberto. Swab o olho a ser injetado com um 70% álcool isopropílico prep (Tyco Healthcare) e identificar o epitélio juncional, onde fundiu as duas pálpebras se unem (Figura 1B).
- Usando uma agulha de calibre 30 afiada, abra cuidadosamente o olho, cortando ao longo do epitélio juncional fundidos (Fig. 1C). Não aplique força excessiva, pois isso pode resultar em corte do olho subjacente. Evitar o corte além do alcance da junção das pálpebras, pois isso irá resultar em hemorragia que pode obscurecer a injeção.
- Para facilitar a penetração do olho pela agulha de injeção blunt terminou use a ponta de uma agulha de 30 guage fazer uma pequena incisão na esclera perto da junção com a córnea (Fig. 1E). Não penetram muito profundamente, pois isso pode resultar em um furo da lente.
- Desenhe 0,3 ml de solução de DNA em uma agulha de injeção calibre 33 blunt acabou usando os gradientes de seringa para medir o volume individualmente para cada injecção (exterior da agulha 0,52 milímetros de diâmetro, diâmetro interno 0,13 mm; Exmire micro; Ito corp). Insira a agulha a incisão até que a resistência da parede escleral oposto é sentida. Ter cuidado para evitar penetrar na lente, pois a agulha é passada através da câmara vítrea (Fig. 2B).
- Lentamente injetar 0,3 ml de solução de DNA para o espaço sub-retiniano com o dedo indicador ou o polegar para pressionar o êmbolo da seringa. O experimentador deve ter cuidado para controlar a velocidade de depressão êmbolo de modo que a taxa na qual a solução de DNA é injetado no espaço sub-retiniano não ultrapassar a velocidade com que a solução de DNA se espalha no espaço sub-retiniano (Fig. 2C). A solução DNA é viscoso por isso é importante que a agulha não é pressionado com muita força contra a parede escleral oposto, pois isso pode resultar no DNA não sendo injetado ou não espalhar uniformemente. A injeção de sucesso resultará em um mesmopropagação da solução de DNA em uma porção do espaço sub-retiniano. Regiões da retina, com e sem base marcador verde deve ser evidente ao girar o animal injetado.
3. Eletroporação
- Eletroporação é realizada usando um eletrodo de 10 milímetros de diâmetro pinça (Modelo # 522; Instruments BTX). Mergulhe o eletrodo pinça em PBS, a fim de maximizar a condutividade elétrica do eletrodo para o animal e colocar a cabeça do cachorro injetado entre os eletrodos com o olho injetado adjacente ao eletrodo de pólo positivo eo olho não injetados adjacente ao pólo negativo eletrodo (Fig. 3B).
- Aplique cinco pulsos quadrados utilizando um gerador de pulsos: cada pulso é de 80 volts e 50 milissegundos de duração com um intervalo de 950 milissegundos entre os pulsos.
- Os filhotes electroporated agora deve ser aquecido até se recuperar da anestesia gelo. Isto pode ser feito colocando os filhotes sob uma lâmpada de aquecimento ou em cima de um aquecedor de slides. Se estiver usando uma lâmina quente garantir que uma almofada apropriada é colocado entre a superfície do metal e do filhote se recuperando. Após a recuperação retornar os filhotes electroporated à sua mãe.
4. Preparação de olhos para análise
- O tempo de colheita e análise dos retinas electroporated é realizada sem prejuízo dos objectivos da experiência. Expressão GFP pode ser grosseiramente visualizado 3 dias após a eletroporação. Para cryoembedding e secção proceder da seguinte forma.
- Sacrificam animais electroporated no timepoint desejado. Disect o olho electroporated e corrigir em paraformaldeído 4% a 4 ° C por 50 minutos.
- Remova cuidadosamente a retina do olho por micro-dissecção afastado da esclera, córnea, cristalino, coróide e epitélio pigmentar da retina. O retinas dissecadas pode ser analisada sob fluorescência para determinar a eficiência bruta de eletroporação. Transferir o retinas a solução de sacarose 30% durante a noite a 4 ° C.
- Congelar retinas em outubro crio-incorporação de mídia (Sakura Finetek EUA) e armazenar a -80 ° C. Retinas agora pode ser seccionado em um cryotome e capturado em lâminas de vidro.
5. Resultados representativos:
Exemplos de P0 retinas neonatal electroporated com uma expressão pCAG-EGFP plasmídeo são apresentados em 3 dias após eletroporação (P3) e 14 dias após a eletroporação (P14) na figura 4. A área do tecido da retina electroporated é variável de experimento para experimento, dependendo da extensão do dano tecidual incorridos durante a injeção e uniformidade da dispersão da solução de DNA para o espaço sub-retiniano. Tipicamente 90-100% de retinas electroporated contará com células que têm incorporado com sucesso e expressou o plasmídeo introduzido. No entanto, quando factoring na morfologia dos tecidos e eficiência eletroporação apenas 40-60% de retinas electroporated serão adequados para análise comparativa. Formação de roseta e descolamento de retina no local da penetração da agulha é quase sempre observada e esta região não deve ser usado para análise. DNA de sucesso se estendeu durante a microinjeção resultados no tecido de forma eficiente electroporated lateral ao local da penetração da agulha livre de rosetas e desprendimento. Gliose também é uma preocupação importante experimental e quase sempre ocorre no local de penetração da agulha. No entanto, como com a formação de roseta e descolamento de retina, gliose normalmente não é significativa no tecido lateralmente electroporated. Marcadores imunohistoquímicos, tais como proteína glial fibrilar ácida (GFAP) pode ser utilizado para determinar se os níveis de gliose reativa em regiões analisadas caem dentro de limites aceitáveis. Retinas seccionados demonstrando que a morfologia da retina electroporated permanece intacta e que os rótulos expressão EGFP células individuais electroporated são apresentados. Exemplos três dias após um eletroporação P0 (Fig. 4A-C) e 14 dias após o eletroporação P0 (Fig. 4D-F) são apresentados.
Em retinas P3 a maioria das células electroporated estão localizados na camada neuroblastic (NBL) da retina, e não demonstram características morfológicas distintas de qualquer das células diferenciadas neural ou glial da retina (Fig. 4B, C). Por células P14 electroporated pode ser encontrado na camada nuclear externa (ONL) ea camada nuclear interna (INL) da retina. Além disso, a várias células rotuladas agora exibem características morfológicas características de neurônios diferenciados incluindo interneurônios do INL, fotorreceptores, células gliais e Müller (Fig. 4E, F).
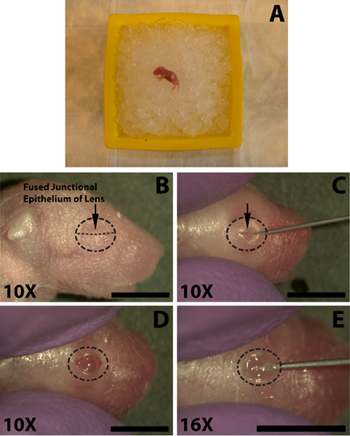
Figura 1. Anestesia de um rato (P0) recém-nascidos das crias e abertura de olhos para injeção sub-retiniana de solução de DNA. A) filhote Neonatal colocadouma cama de gelo picado para anestesiados. Olho a ser injetado é colocado para baixo contra o gelo. B) A localização do epitélio juncional fundidas (B, seta) das pálpebras a ser cortado para a abertura dos olhos. C) corte das pálpebras ao longo do epitélio juncional fundido (C, seta) para expor o olho. D) O olho aberto na sequência de corte na junção fundida. E) É feita uma incisão no olho embaixo na esclera abaixo da córnea para facilitar a inserção fácil da seringa blunt terminou micro-injeção. Barra de escala, B, C, D, E: 4mm.
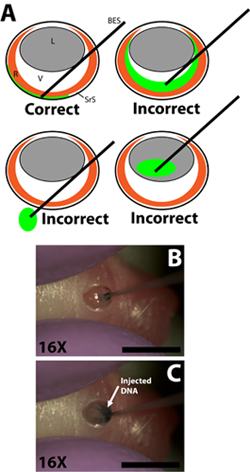
Figura 2. Inserção da blunt terminou injeção de micro-seringa e injeção de solução de DNA plasmidial para o espaço sub-retiniano. A) dos desenhos esquemáticos mostrando a inserção correta da seringa de injeção no olho micro e liquidação da ponta da seringa para dentro do espaço sub-retiniano. Injeção da solução de DNA na câmara vítrea, a passagem da seringa através do olho no soquete, ou injeção para a lente irá resultar em experiências fracassadas com poucas ou nenhumas células electroporated. B) Penetração da seringa para a incisão feita na parede escleral e liquidação da ponta da seringa para dentro do espaço sub-retiniano. C) Injeção de DNA a solução para o espaço sub-retiniano. Barras de escala, B, C: 4mm. Abreviaturas da seguinte forma: R retina, L-lente, V-vítrea, SRS-subretiniana espaço, BES-blunt terminou seringa.

Figura 3. Orientação do eletrodo de pinça para o mouse para eletroporação. A) dos desenhos esquemáticos mostrando a orientação das pás positivos e negativos do eletrodo de pinça em relação ao olho electroporated. Verde representa a localização do DNA injetado no espaço sub-retiniano. Setas tracejadas representam o movimento eletroforético de DNA carregados negativamente injetadas em direção ao eletrodo positivo. Eletroforese de DNA ocorre a partir do espaço sub-retiniano adjacente ao eletrodo negativo para a retina, que é orientada para o eletrodo positivo. B) O paddle positivo da pinça é colocada ao lado do DNA microinjeção olho ea remar negativo é colocado ao lado do olho não-injetada. C) imagem de alta ampliação da colocação do eletrodo de pinça com o mouse neonatal. Linhas tracejadas representam a direção do movimento eletroforético de DNA para o eletrodo positivo. Barra de escala, C: 5mm.

Figura 4. Neonatal do mouse retinas (P0) electroporated com pCAG-EGFP e analisadas no dia pós-natal 3 (P3) e dia pós-natal 14 (P14). AC) imagens Confocal de uma retina P3 seccionado electroporated com pCAG-EGFP em P0. A maioria das células electroporated sentar-se na camada da retina neuroblastic (NBL). (DF) imagens Confocal de uma retina P14 seccionado electroporated com pCAG-EGFP em P0. Electroporated células podem ser identificados na camada nuclear externa (ONL) ea camada nuclear interna (INL) da retina. Bares escala, AF: 50 mm.
Discussão
Eletroporação in vivo representa um método rápido e eficiente para a transformação de células da retina com plasmídeos de expressão de DNA. Este método permite que o pesquisador para realizar estudos de ganho de função por ectopicamente introdução de um gene de interesse sob o controle de um promotor ubiquitously expressas ou para realizar estudos de perda de função usando construções shRNA alvo genes de interesse. Além disso, cosmídeos múltiplas podem ser electroporated simultaneamente, pe...
Divulgações
Agradecimentos
Este trabalho foi financiado pelo NIH R01EY020560-01 e por um WM Keck jovem estudioso no Prêmio de Pesquisa Médica. Os autores gostariam de agradecer a Joseph Bedont por sua ajuda durante a imagens dos preparativos da retina e injeções.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Número Catálogo | Comentários |
|---|---|---|---|
| Tampão saturada de fenol | Invitrogen | 15513-039 | N / A |
| Clorofórmio | JT Baker | 9180-03 | N / A |
| Acetato de sódio | JT Baker | 3470-05 | 3 M de ações |
| Fast Green FCF | Fisher Biotech | BP123-10 | Estoque de 10% |
| Álcool isopropílico prep | Tyco Healthcare | 6918 | N / A |
| 30 guage agulha | Terumo Medical Corp | SG2-3013 | N / A |
| Exmire microsseringa | Ito Corporação | MS * E05 | N / A |
| Tweezertrode (eletrodo pinça) | BTX Instrumento, Genetronics Inc. | 522 | N / A |
| Electro Praça Porator (electroporator) | BTX Instrumento, Genetronics Inc. | ECM 830 | N / A |
| Composto outubro | Sakura Finetek EUA | 4583 | N / A |
Referências
- Neumann, E., Rosenheck, K. Permeability changes induced by electric impulses in vesicular membranes. J. Membr. Biol. 10, 279-290 (1972).
- Turnbull, R. J. Letter: Letter: An alternate explanation for the permeability changes induced by electrical impulses in vesicular membranes. J. Membr. Biol. 14, 193-196 (1973).
- Zimmermann, U., Schulz, J., Pilwat, G. Transcellular ion flow in Escherichia coli B and electrical sizing of bacterias. Biophys. J. 13, 1005-1013 (1973).
- Kinosita, K., Tsong, T. Y. Voltage-induced pore formation and hemolysis of human erythrocytes. Biochim. Biophys. Acta. 471, 227-242 (1977).
- Neumann, E., Schaefer-Ridder, M., Wang, Y., Hofschneider, P. H. Gene transfer into mouse lyoma cells by electroporation in high electric fields. EMBO J. 1, 841-845 (1982).
- Swartz, M., Eberhart, J., Mastick, G. S., Krull, C. E. Sparking new frontiers: using in vivo electroporation for genetic manipulations. Dev. Biol. 233, 13-21 (2001).
- Matsuda, T., Cepko, C. L. Electroporation and RNA interference in the rodent retina in vivo and in vitro. Proc. Natl. Acad. Sci. U. S. A. 101, 16-22 (2004).
- Matsuda, T., Cepko, C. L. Controlled expression of transgenes introduced by in vivo electroporation. Proc. Natl. Acad. Sci. U. S. A. 104, 1027-1032 (2007).
- Onishi, A. Pias3-dependent SUMOylation directs rod photoreceptor development. Neuron. 61, 234-246 (2009).
- Onishi, A. The orphan nuclear hormone receptor ERRbeta controls rod photoreceptor survival. Proc. Natl. Acad. Sci. U. S. A. 107, 11579-11584 (2010).
- Kim, D. S. A Core Paired-Type and POU Homeodomain-Containing Transcription Factor Program Drives Retinal Bipolar Cell Gene Expression. J. Neurosci. 28, 7748-7764 (2008).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados