È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
In elettroporazione in vivo di Retina topo in via di sviluppo
In questo articolo
Riepilogo
Un metodo per l'incorporazione di DNA plasmidico in cellule murine della retina allo scopo di effettuare sia guadagno o la perdita di studi di funzione In vivo È presentato. Questo metodo sfrutta l'aumento transitorio della permeabilità delle membrane plasmatiche delle cellule indotte con l'applicazione di un campo elettrico esterno.
Abstract
La caratterizzazione funzionale di geni espressi durante lo sviluppo della retina dei mammiferi rimane una sfida significativa. Gene targeting per generare la perdita costitutivo o condizionale di knockouts funzione rimane costi e manodopera, oltre che in termini di tempo. Aggiungendo a queste sfide, retina espresso geni possono avere ruoli fondamentali al di fuori della retina che porta alla confonde involontaria quando si utilizza un approccio ad eliminazione diretta. Inoltre, la capacità di esprimere ectopica di un gene in un guadagno di esperimento funzione può essere estremamente utile quando si cerca di identificare un ruolo nella determinazione del fato cellulare e / o di differenziazione terminale.
Vi presentiamo un metodo per l'inserimento rapido ed efficiente di plasmidi DNA nella retina topo neonatale mediante elettroporazione. L'applicazione di impulsi elettrici brevi risultati di sopra di una certa intensità di campo in un aumento transitorio della permeabilità della membrana plasmatica, agevolando il trasferimento di materiale attraverso la membrana 1,2,3,4. Lavoro pionieristico ha dimostrato che l'elettroporazione potrebbe essere utilizzato come metodo di trasferimento genico in cellule di mammifero inducendo la formazione di pori della membrana plasmatica consentendo il passaggio di DNA altamente caricato attraverso il doppio strato lipidico 5. Continuo sviluppo tecnico, ha portato alla vitalità di elettroporazione come metodo di trasferimento genico in vivo nei tessuti di topo multiple, tra cui la retina, il metodo per il quale è qui descritto 6, 7, 8, 9, 10.
Soluzione di DNA viene iniettato nello spazio sottoretinico in modo che il DNA si trova tra l'epitelio pigmentato retinico e della retina neonatale (P0) del mouse e impulsi elettrici sono applicati utilizzando un elettrodo pinzetta. Il posizionamento laterale degli occhi nel topo permette la facile orientamento dell'elettrodo pinzetta per le necessarie polo negativo-DNA-positiva retina allineamento palo. Incorporazione vasta ed espressione di geni trasferiti possono essere identificati per giorno post-natale 2 (P2). A causa della mancanza di significative migrazione laterale delle cellule della retina, le regioni elettroporate e non elettroporate vengono generati. Non elettroporate regioni possono servire come controlli interni istologici, se del caso.
Elettroporazione della retina possono essere usate per esprimere un gene con un promotore ubiquitario, come CAG, o di distruggere la funzione del gene utilizzando costrutti shRNA o Cre-ricombinasi. Espressione più mirata può essere raggiunto attraverso la progettazione costruisce con i promotori dei geni cellulari specifici. Visualizzazione di cellule elettroporate si ottiene utilizzando i costrutti bicistronic esprimono GFP o da co-electroporating un'espressione GFP costrutto. Inoltre, costruisce multiple possono essere elettroporate per lo studio degli effetti gene combinatoria o aumento simultaneo e la perdita di funzione di geni diversi. Elettroporazione retina può anche essere utilizzato per l'analisi di genomica cis-normativo elementi generando costruisce espressione appropriata e mutanti di delezione. Tali esperimenti possono essere usati per identificare le regioni sufficienti o necessari per l'espressione genica delle cellule specifiche 11 cis-normativo. Esperimenti potenziali sono limitati solo dalla disponibilità di costruire.
Protocollo
1. Preparazione plasmide per l'elettroporazione
La concentrazione del DNA necessario per elettroporazione è 5μg/μl. Ciò richiede in genere i plasmidi desiderato di essere amplificato utilizzando un maxi-prep (Qiagen) o metodo equivalente seguita da una purificazione e concentrazione del DNA per la quantità di lavoro. Di seguito viene descritto la preparazione del DNA per la quantità di lavoro.
- Aliquota 100 mg di DNA (da maxi-prep o equivalente) e diluire il volume di 100 l per la facilità di manipolazione.
- Aggiungi fenolo, la quantità di fenolo deve essere calcolata per ottenere un circa 60% di DNA / volume (mg DNA: volume totale), cioè: 100 mg di DNA (in 100 mL), più 67 microlitri fenolo (100 mcg: 167 mL). Mescolare accuratamente, non pipettare su e giù come questo può causare un eccessivo taglio del DNA.
- Spin il DNA per 5 minuti a 14000 rpm a temperatura ambiente.
- Raccogliere il supernatante e aggiungere cloroformio con lo stesso DNA: rapporto tra volume totale al punto 1.2; mix come descritto al punto 1.2 e girano a 14000 rpm per 5 minuti a temperatura ambiente.
- Raccogliere il surnatante, aggiungere il 10% del volume surnatante di 3 acetato di sodio M per la soluzione di DNA, mescolare delicatamente e aggiungere 2,5 volte il volume surnatante del 100% di etanolo. Mescolare per inversione. DNA dovrebbe precipitare dalla soluzione durante la miscelazione.
- Spin il DNA a 4 ° C per 10 minuti a 14000 RPM.
- Sciacquare con 350 ml di etanolo al 70%, girano a 14000 rpm per 5 minuti a 4 ° C.
- Aria secca il pellet poi sciogliere il DNA in 1 X PBS (biologia grado Cell) a 5μg/μL. Non asciugare eccessivamente il campione in quanto ciò rende molto difficile da sciogliere in PBS.
- Aggiungi veloce colorante verde (10% azioni) per la soluzione di DNA, la concentrazione finale di tintura è 0,1%, di agire come un tracciante di iniezione.
2. Iniezione sottoretinica del DNA
Le seguenti operazioni vengono eseguite con l'assistenza di uno stereomicroscopio. Una volta praticato il processo di apertura degli occhi, incisione, e l'iniezione richiede meno di 1,5 minuti che non c'è abbastanza tempo per un cucciolo adeguatamente anestetizzato per recuperare. Utilizzando un acuto da 30 gauge, aprire con cautela l'occhio dal taglio lungo l'epitelio giunzionale fuso (Fig. 1C). Non applicare eccessiva forza poiché ciò potrebbe comportare il taglio degli occhi sottostante. Evitare di tagliare oltre il campo della giunzione palpebra come questo si tradurrà in sanguinamento che può oscurare l'iniezione.
- Anestetizzare i topi appena nati in ghiaccio per alcuni minuti (Fig. 1A), non seppellire cuccioli nel ghiaccio in quanto ciò potrebbe provocare la mortalità. Il periodo di tempo sul ghiaccio è variabile da cucciolo a cucciolo, di solito 5 minuti è sufficiente, ma i topi devono essere attentamente monitorati come individui possono rispondere molto rapidamente o potrebbe richiedere l'esposizione più appropriata per garantire l'anestesia. Condurre un pizzico zampa con hemostats per verificare la reflex ritiro.
- Al fine di facilitare l'iniezione di DNA nello spazio sottoretinico dell'occhio deve prima essere aperto. Tampone l'occhio da iniettare con un 70% di alcool isopropilico preparazione (Tyco Healthcare) e identificare l'epitelio giunzionale fusa dove le due palpebre si uniscono (Fig. 1B).
- Utilizzando un acuto da 30 gauge, aprire con cautela l'occhio dal taglio lungo l'epitelio giunzionale fuso (Fig. 1C). Non applicare eccessiva forza poiché ciò potrebbe comportare il taglio degli occhi sottostante. Evitare di tagliare oltre il campo della giunzione palpebra come questo si tradurrà in sanguinamento che può oscurare l'iniezione.
- Per facilitare la penetrazione dell'occhio con l'ago smussato iniezione concluso utilizzare la punta di un 30-ago spessore e trattati fare una piccola incisione nella sclera in prossimità dell'incrocio con la cornea (Fig. 1E). Non penetrano troppo profondamente in quanto ciò può causare una foratura della lente.
- Disegna 0,3 ml di soluzione di DNA in un ago da 33 gauge smussato iniezione conclusa con i gradienti siringa per misurare il volume singolarmente per ogni iniezione (ago diametro esterno 0,52 millimetri, diametro interno 0,13 millimetri; Exmire microsiringa; Ito corp). Inserire l'ago nel incisione fino alla resistenza del muro avversario sclerale si fa sentire. Fare attenzione a non penetrare l'obiettivo, l'ago è passato attraverso la camera vitreale (Fig. 2B).
- Iniettare lentamente 0,3 ml di soluzione di DNA nello spazio sottoretinico con il dito indice o pollice per premere lo stantuffo della siringa. Lo sperimentatore deve essere attenti a controllare la velocità del pistone depressione in modo che la velocità con cui viene iniettata la soluzione di DNA nello spazio sottoretinico non supererà il tasso a cui la soluzione di DNA si diffonde all'interno di spazio sottoretinico (Fig. 2C). La soluzione di DNA è viscoso ed è quindi importante che l'ago non viene premuto troppo stretto contro il muro avversario sclerale in quanto ciò potrebbe comportare il DNA non essere iniettati o non diffondere in modo uniforme. Una iniezione di successo si tradurrà in un ancoradiffusione della soluzione di DNA in una porzione di spazio sottoretinico. Regioni della retina con e senza base tracciante verde dovrebbe essere evidente durante la rotazione l'animale iniettato.
3. Elettroporazione
- Elettroporazione viene eseguita utilizzando un elettrodo di diametro 10 millimetri pinzetta (Model # 522; Instruments BTX). Immergere l'elettrodo pinzetta in PBS in modo da massimizzare la conduttività elettrica dall'elettrodo per l'animale e posizionare la testa del cucciolo iniettato tra gli elettrodi con l'occhio iniettato adiacente alla elettrodo polo positivo e il non-iniettati occhio adiacente al polo negativo elettrodo (Fig. 3B).
- Applicare cinque impulsi quadrati utilizzando un generatore di impulsi: ogni impulso è di 80 volt e 50 millisecondi di durata con un intervallo di 950 millisecondi tra gli impulsi.
- I cuccioli elettroporate deve ora essere scaldato fino a riprendersi dalla anestesia ghiaccio. Questo può essere fatto mettendo i cuccioli sotto una lampada riscaldamento o sulla cima di una diapositiva più caldo. Se si utilizza una diapositiva più caldo in modo che un pad appropriato è posto tra la superficie metallica e il cucciolo di recupero. Al recupero di ritorno i cuccioli elettroporate alla loro madre.
4. Preparazione degli occhi per l'analisi
- Il momento della raccolta e analisi delle retine elettroporate viene eseguita nel rispetto degli obiettivi dell'esperimento. Espressione GFP può essere grossolanamente visualizzati 3 giorni dopo l'elettroporazione. Per cryoembedding e sezionamento procedere come segue.
- Sacrificio degli animali elettroporate al timepoint desiderato. Disect l'occhio elettroporate e fissare in paraformaldeide 4% a 4 ° C per 50 minuti.
- Rimuovere con attenzione la retina dall'occhio di micro-dissezione via la sclera, cornea, cristallino, retina e coroide epitelio pigmentato. La retina dissezionato può essere analizzato sotto fluorescenza per determinare l'efficienza della grossolanamente elettroporazione. Trasferire la retina di soluzione di saccarosio 30% di notte a 4 ° C.
- Congelare retine in ottobre crio-mezzi di inclusione (Sakura Finetek USA) e conservare a -80 ° C. Retine possono ora essere sezionato in un cryotome e catturato su vetrini.
5. Rappresentante dei risultati:
Esempi di P0 retine neonatale elettroporate con un pCAG-EGFP plasmide di espressione sono presentati in 3 giorni successivi elettroporazione (P3) e 14 giorni dopo elettroporazione (P14) in figura 4. L'area di tessuto retinico elettroporate è variabile da esperimento a esperimento a seconda della entità del danno tessutale sostenute durante l'iniezione e l'uniformità della diffusione della soluzione di DNA nello spazio sottoretinico. Tipicamente 90-100% della retina elettroporate sarà caratterizzato da cellule che hanno incorporato con successo e hanno espresso il plasmide introdotto. Tuttavia, se si considera la morfologia del tessuto e di efficienza elettroporazione solo il 40-60% delle retine elettroporate sarà adatto per l'analisi comparativa. Formazione rosetta e distacco della retina nel sito di puntura è quasi sempre osservato e questa regione non deve essere utilizzato per l'analisi. DNA successo diffuso durante i risultati microiniezione nel tessuto in modo efficiente elettroporate laterale al sito di puntura libero da rosette e distacco. Gliosi è anche una preoccupazione importante sperimentale e quasi sempre si verifica nel sito di puntura. Tuttavia, come con la formazione rosetta e distacco di retina, gliosi non è in genere significativa nel tessuto lateralmente elettroporate. Marcatori immunoistochimici quali proteina acidica fibrillare gliale (GFAP) può essere utilizzato per determinare se i livelli di gliosi reattiva nelle regioni analizzate rientrano nella soglie accettabili. Retine sezionato dimostrando che la morfologia della retina elettroporate rimane intatto e che le etichette espressione EGFP singole cellule elettroporate sono presentati. Esempi 3 giorni a seguito di un elettroporazione P0 (Fig. 4A-C) e 14 giorni a seguito di un elettroporazione P0 (Fig. 4D-F) sono presentati.
In retine P3 la maggioranza delle cellule elettroporate si trovano nello strato neuroblastiche (NBL) della retina, e non dimostrare distinte caratteristiche morfologiche di una qualsiasi delle cellule differenziate neurali o gliale della retina (Fig. 4B, C). Da cellule P14 elettroporate si trovano nello strato nucleare esterno (ONL) e lo strato interno nucleare (INL) della retina. Inoltre le varie cellule etichettate ora visualizzare caratteristica caratteristiche morfologiche dei neuroni differenziati tra interneuroni della INL, fotorecettori, e glia Müller (Fig. 4E, F).
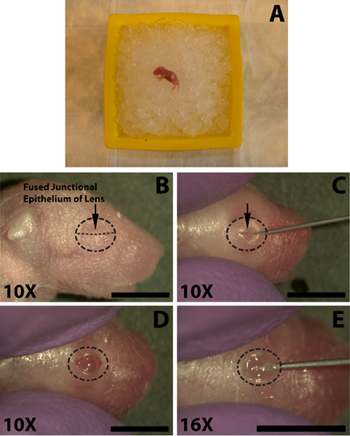
Figura 1. Anestesia di un neonato (P0) topo cucciolo e apertura dell'occhio per l'iniezione sottoretinica di soluzione di DNA. A) cucciolo neonatale immessi sulun letto di ghiaccio tritato per anestesia. Occhio da iniettare viene posizionato in basso contro il ghiaccio. B) La posizione del fuso epitelio giunzionale (B, freccia) delle palpebre da tagliare per l'apertura degli occhi. C) Taglio delle palpebre lungo l'epitelio giunzionale fusa (C, freccia) per esporre l'occhio. D) L'occhio aperto dopo il taglio a livello della giunzione fuso. E) L'incisione è fatta nell'occhio sotto della sclera sotto la cornea per facilitare l'inserimento facile del conclusa micro-iniezione siringa smussato. Barre di scala, B, C, D, E: 4mm.
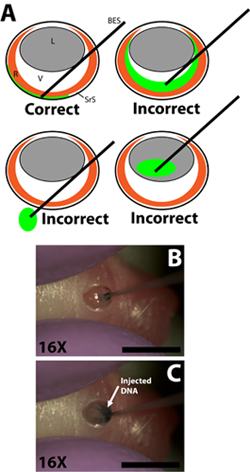
Inserimento Figura 2. Smussato fine del micro-iniezione siringa e l'iniezione di soluzione di DNA plasmide nello spazio sottoretinico. A) Schema Cartoon dimostrando il corretto inserimento della siringa di iniezione micro nell'occhio e la liquidazione delle siringa nello spazio sottoretinico. L'iniezione di soluzione di DNA nella camera vitrea, il passaggio della siringa attraverso l'occhio nella presa, o iniezione nella lente si tradurrà in esperimenti falliti con poche o nessuna cellule elettroporate. B) La penetrazione della siringa nel incisione nella parete sclerale e la liquidazione delle siringa nello spazio sottoretinico. C) L'iniezione di soluzione di DNA nello spazio sottoretinico. Barre di scala, B, C: 4mm. Abbreviazioni come segue: R-retina, L-lente, V-vitreo, SRS-sottoretinica spazio, BES-smussato conclusa siringa.

Figura 3. Orientamento dell'elettrodo pinzetta sul mouse per elettroporazione. A) Schema Cartoon dimostrando l'orientamento delle pale positivi e negativi degli elettrodi pinzetta relativa ad occhio elettroporate. Verde rappresenta la posizione del DNA iniettato nello spazio sottoretinico. Frecce tratteggiate rappresentano il movimento di carica negativa elettroforetica del DNA iniettato verso l'elettrodo positivo. Elettroforesi del DNA avviene da spazio sottoretinico adiacente l'elettrodo negativo nella retina, che è orientata verso l'elettrodo positivo. B) La pagaia positivo della pinzetta è posizionato accanto al DNA microiniettati occhio e la pagaia negativo è posizionato adiacente alla non-iniettati occhi. C) l'immagine Alto ingrandimento posizionamento dell'elettrodo pinzetta sul mouse neonatale. Linee tratteggiate rappresentano la direzione del movimento elettroforetica del DNA verso l'elettrodo positivo. Scala grafica, C: 5 mm.

Figura 4. Neonatale del mouse retina (P0) elettroporate con pCAG-EGFP e analizzati al giorno postnatale 3 (P3) e il giorno dopo la nascita 14 (P14). AC) immagini confocale di una retina P3 sezionato elettroporate con pCAG-EGFP a P0. La maggior parte delle cellule elettroporate siedono nello strato retinico neuroblastiche (NBL). (DF) immagini confocale di un sezionato P14 retina elettroporate con pCAG-EGFP a P0. Elettroporate cellule possono essere identificati nello strato nucleare esterno (ONL) e lo strato interno nucleare (INL) della retina. Bar scala, AF: 50 micron.
Access restricted. Please log in or start a trial to view this content.
Discussione
Elettroporazione in vivo rappresenta un metodo rapido ed efficiente per la trasformazione delle cellule della retina con plasmidi di espressione del DNA. Questo metodo permette di effettuare lo sperimentatore guadagno di studi funzione ectopica l'introduzione di un gene di interesse sotto il controllo di un promotore ubiquitariamente espressa o per effettuare la perdita di studi di funzione utilizzando i costrutti shRNA targeting dei geni di interesse. Inoltre, i plasmidi di DNA multipli possono essere elet...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Riconoscimenti
Questo lavoro è stato finanziato dal NIH R01EY020560-01 e da uno studioso WM Keck Young Award ricerca medica. Gli autori desiderano ringraziare Giuseppe Bedont per la sua assistenza durante l'imaging di preparati della retina e iniezioni.
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reagente | Azienda | Numero di catalogo | Commenti |
|---|---|---|---|
| Buffer saturi fenolo | Invitrogen | 15513-039 | N / A |
| Cloroformio | JT Baker | 9180-03 | N / A |
| Di sodio acetato | JT Baker | 3470-05 | 3 M magazzino |
| Verde fast FCF | Fisher Biotech | BP123-10 | 10% di magazzino |
| Alcool isopropilico prep | Tyco Healthcare | 6918 | N / A |
| 30-ago spessore e trattati | Terumo Medical Corp. | SG2-3013 | N / A |
| Exmire microsiringa | Ito Corporation | MS * E05 | N / A |
| Tweezertrode (elettrodo pinzetta) | BTX strumento, Genetronics Inc. | 522 | N / A |
| Electro Piazza Porator (elettroporatore) | BTX strumento, Genetronics Inc. | ECM 830 | N / A |
| Ottobre Compound | Sakura Finetek USA | 4583 | N / A |
Riferimenti
- Neumann, E., Rosenheck, K. Permeability changes induced by electric impulses in vesicular membranes. J. Membr. Biol. 10, 279-290 (1972).
- Turnbull, R. J. Letter: Letter: An alternate explanation for the permeability changes induced by electrical impulses in vesicular membranes. J. Membr. Biol. 14, 193-196 (1973).
- Zimmermann, U., Schulz, J., Pilwat, G. Transcellular ion flow in Escherichia coli B and electrical sizing of bacterias. Biophys. J. 13, 1005-1013 (1973).
- Kinosita, K., Tsong, T. Y. Voltage-induced pore formation and hemolysis of human erythrocytes. Biochim. Biophys. Acta. 471, 227-242 (1977).
- Neumann, E., Schaefer-Ridder, M., Wang, Y., Hofschneider, P. H. Gene transfer into mouse lyoma cells by electroporation in high electric fields. EMBO J. 1, 841-845 (1982).
- Swartz, M., Eberhart, J., Mastick, G. S., Krull, C. E. Sparking new frontiers: using in vivo electroporation for genetic manipulations. Dev. Biol. 233, 13-21 (2001).
- Matsuda, T., Cepko, C. L. Electroporation and RNA interference in the rodent retina in vivo and in vitro. Proc. Natl. Acad. Sci. U. S. A. 101, 16-22 (2004).
- Matsuda, T., Cepko, C. L. Controlled expression of transgenes introduced by in vivo electroporation. Proc. Natl. Acad. Sci. U. S. A. 104, 1027-1032 (2007).
- Onishi, A. Pias3-dependent SUMOylation directs rod photoreceptor development. Neuron. 61, 234-246 (2009).
- Onishi, A. The orphan nuclear hormone receptor ERRbeta controls rod photoreceptor survival. Proc. Natl. Acad. Sci. U. S. A. 107, 11579-11584 (2010).
- Kim, D. S. A Core Paired-Type and POU Homeodomain-Containing Transcription Factor Program Drives Retinal Bipolar Cell Gene Expression. J. Neurosci. 28, 7748-7764 (2008).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon