Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
En électroporation in vivo de la rétine de souris en développement
Dans cet article
Résumé
Une méthode pour l'incorporation de l'ADN plasmidique dans des cellules murines rétine dans le but d'effectuer soit du gain ou de perte d'études de la fonction In vivo Est présenté. Cette méthode s'appuie sur l'augmentation transitoire de la perméabilité des membranes plasmiques cellulaire induite par l'application d'un champ électrique externe.
Résumé
La caractérisation fonctionnelle des gènes exprimés au cours du développement des mammifères rétine demeure un défi important. Le ciblage de gènes pour générer une perte constitutive ou conditionnelle de KOs fonction reste des coûts et de main-d'oeuvre, ainsi que beaucoup de temps. Ajoutant à ces défis, la rétine peut gènes exprimés ont un rôle essentiel en dehors de la rétine conduisant à confond involontaires lors de l'utilisation d'une approche à élimination directe. Par ailleurs, la capacité à exprimer un gène ectopique par un gain d'expérience fonction peut être extrêmement précieux lorsque l'on tente d'identifier un rôle dans la spécification du destin cellulaire et / ou la différenciation terminale.
Nous présentons une méthode pour l'incorporation rapide et efficace de plasmides ADN dans la rétine de souris néonatales par électroporation. L'application de courtes impulsions électriques au dessus d'un certains résultats intensité du champ dans une augmentation transitoire de la perméabilité de la membrane plasmatique, en facilitant le transfert de matériel à travers la membrane 1,2,3,4. Travail de pionnier a démontré que l'électroporation pourrait être utilisé comme une méthode de transfert de gène dans les cellules de mammifères en induisant la formation de pores hydrophiles membrane plasmique permettant le passage de l'ADN hautement chargé à travers la bicouche lipidique 5. Continue le développement technique a conduit à la viabilité de l'électroporation comme une méthode pour le transfert de gènes in vivo dans les tissus de souris multiples, y compris la rétine, la méthode pour ce qui est décrit aux présentes 6, 7, 8, 9, 10.
Solution d'ADN est injecté dans l'espace sous-rétinien, de sorte que l'ADN est placé entre les épithélium pigmentaire rétinien et la rétine de l'néonatale (P0) de la souris et impulsions électriques sont appliquées en utilisant une électrode de pincette. Le placement latéral de l'oeil chez la souris permet de s'orienter facilement de l'électrode de pince à l'alignement nécessaire pole pôle négatif de l'ADN-rétine positif. L'incorporation étendue et l'expression des gènes transférés peuvent être identifiés par jour postnatal 2 (P2). En raison de l'absence de migration latérale importante des cellules de la rétine, des régions et non électroporées électroporées sont générés. Non-électroporées régions peuvent servir de contrôles internes histologique, le cas échéant.
Électroporation la rétine peut être utilisé pour exprimer un gène sous un promoteur ubiquitaire, comme l'ACG, ou de perturber la fonction des gènes en utilisant des constructions ou des shRNA Cre-recombinase. Expression plus ciblée peut être atteint par la conception des constructions avec des promoteurs de gènes spécifiques de cellules. Visualisation des cellules par électroporation est réalisée en utilisant des constructions bicistronique exprimant la GFP ou par co-électroporation une expression de la GFP construire. Par ailleurs, les constructions peuvent être multiples électroporées pour l'étude des effets des gènes combinatoire ou le gain simultané et perte de fonction des gènes différents. Électroporation rétine peut également être utilisé pour l'analyse de la génomique éléments cis-régulateurs en générant des constructions d'expression approprié et mutants de délétion. De telles expériences peuvent être utilisés pour identifier les régions cis-régulatrices suffisante ou nécessaire pour l'expression des gènes cellulaires spécifiques 11. Expériences potentielles ne sont limitées que par la disponibilité de construire.
Protocole
1. Préparation de plasmide pour l'électroporation
La concentration d'ADN requis pour électroporation est 5μg/μl. Cela nécessite généralement des plasmides voulu être amplifié en utilisant un Maxi-prep (Qiagen) ou une méthode équivalente suivie d'une purification et la concentration de l'ADN à la quantité de travail. Les étapes suivantes décrivent la préparation de l'ADN à la quantité de travail.
- Aliquot de 100 pg d'ADN (de Maxi-prep ou équivalent) et diluer le volume à 100 ul pour la facilité de manipulation.
- Ajouter le phénol, la quantité de phénol devraient être calculés pour obtenir un ADN d'environ 60% / volume (ug d'ADN: volume total), soit: 100 ug d'ADN (dans 100 pi) plus 67 uL de phénol (100 mg: 167 uL). Bien mélanger, ne pas pipeter de haut en bas, car cela pourrait provoquer de cisaillement excessif de l'ADN.
- Spin de l'ADN pendant 5 minutes à 14000 rpm à température ambiante.
- Recueillir le surnageant et ajouter le chloroforme en utilisant le même ADN: ratio volume total à l'étape 1.2, mélanger comme décrit dans l'étape 1.2 et centrifuger à 14000 rpm pendant 5 minutes à température ambiante.
- Recueillir le surnageant, ajouter 10% du volume surnageant acétate de sodium 3 M pour la solution d'ADN, mélanger doucement et ajouter 2,5 X le volume surnageant d'éthanol à 100%. Mélanger par inversion. ADN devrait précipiter hors de la solution au cours du mélange.
- Spin de l'ADN à 4 ° C pendant 10 minutes à 14000 RPM.
- Rincer avec 350 ul d'éthanol à 70%, tournent à 14000 rpm pendant 5 minutes à 4 ° C.
- Sécher à l'air le culot puis dissoudre l'ADN dans une X PBS (grade biologie cellulaire) pour 5μg/μL. Ne pas trop sécher l'échantillon que cela rendra très difficile de se dissoudre dans du PBS.
- Ajouter rapide colorant vert (10% d'actions) à la solution d'ADN, la concentration finale de colorant est de 0,1%, à agir comme un traceur d'injection.
2. Injection sous-rétinienne de l'ADN
Les étapes suivantes sont effectuées avec l'aide d'un stéréomicroscope. Une fois pratiqué le processus d'ouverture des yeux, l'incision, et l'injection prend moins de 1,5 minutes, ce qui n'est pas assez de temps pour un chiot correctement anesthésié pour récupérer. En utilisant une forte aiguille de calibre 30, ouvrir avec précaution les yeux en coupant le long de l'épithélium fusionné jonctionnelle (Fig. 1C). Ne pas appliquer une force excessive car cela peut conduire à la coupe de l'œil sous-jacent. Évitez de couper au-delà de la gamme de la jonction paupière comme cela va entraîner des saignements qui peuvent masquer l'injection.
- Anesthésier les souris nouveau-nés sur la glace pendant plusieurs minutes (Fig. 1A), ne pas enterrer les chiots dans la glace car cela peut entraîner la mort. La longueur de temps sur la glace est variable de chiot chiot, typiquement 5 minutes est suffisant, mais les souris doivent être surveillés attentivement que les individus peuvent réagir très rapidement ou peut exiger d'exposition plus long pour assurer une anesthésie appropriée. Mener une pincée patte avec hémostatiques pour vérifier réflexe de retrait.
- Afin de faciliter l'injection de l'ADN à l'espace sous-rétinien de l'œil doit d'abord être ouvert. Swab l'œil pour être injecté avec une préparation de 70% d'alcool isopropylique (Tyco Healthcare) et d'identifier l'épithélium fusionné jonctionnelle où les deux paupières sont réunis (Fig. 1B).
- En utilisant une forte aiguille de calibre 30, ouvrir avec précaution les yeux en coupant le long de l'épithélium fusionné jonctionnelle (Fig. 1C). Ne pas appliquer une force excessive car cela peut conduire à la coupe de l'œil sous-jacent. Évitez de couper au-delà de la gamme de la jonction paupière comme cela va entraîner des saignements qui peuvent masquer l'injection.
- Afin de faciliter la pénétration de l'œil par l'aiguille d'injection extrémités franches utiliser la pointe d'une aiguille 30-guage faire une petite incision dans la sclérotique près de la jonction avec la cornée (Fig. 1E). Ne pas pénétrer trop profondément car cela peut entraîner une perforation de la lentille.
- Dessinez 0,3 ul de solution d'ADN dans une jauge de 33 d'injection sans aiguille émoussée fini en utilisant les gradients de la seringue pour mesurer le volume individuellement pour chaque injection (aiguille diamètre extérieur 0,52 mm, diamètre intérieur de 0,13 mm; Exmire microseringue; Ito corp). Insérez l'aiguille dans l'incision jusqu'à la résistance de la paroi opposée scléral est ressenti. Soyez prudent pour éviter de pénétrer dans l'objectif que l'aiguille est passée dans la chambre vitréenne (figure 2B).
- Injecter lentement 0,3 ul de solution d'ADN dans l'espace sous-rétinien en utilisant l'index ou le pouce pour enfoncer le piston. L'expérimentateur doit prendre soin de contrôler la vitesse de la dépression plongeur de sorte que la vitesse à laquelle la solution d'ADN est injecté dans l'espace sous-rétinien, ne dépassera la vitesse à laquelle la solution d'ADN se répand dans l'espace sous-rétinien (figure 2C). La solution d'ADN est visqueux, il est important que l'aiguille n'est pas enfoncée trop serrés contre la paroi opposée scléral car cela pourrait entraîner dans l'ADN ne pas être injectés ou ne se propage pas uniformément. Une injection de succès se traduira par une mêmepropagation de la solution d'ADN dans une partie de l'espace sous-rétinien. Régions de la rétine, avec et sans sous-jacente traceuses vertes devrait être évident lors de la rotation de l'animal injecté.
3. L'électroporation
- L'électroporation est réalisée en utilisant une électrode de 10 mm de diamètre pince (Modèle # 522; Instruments BTX). Tremper l'électrode dans le PBS pince afin de maximiser la conductivité électrique de l'électrode à l'animal et le lieu de la tête du chiot injecté entre les électrodes à l'œil injecté adjacente à l'électrode de pôle positif et l'oeil non injectée adjacente au pôle négatif électrode (figure 3B).
- Appliquer cinq impulsions carrées en utilisant un générateur d'impulsions: chaque impulsion est de 80 volts et 50 millisecondes dans la durée avec un intervalle de 950 millisecondes entre les impulsions.
- Les chiots électroporées doit maintenant être réchauffés jusqu'à ce qu'ils se remettre de l'anesthésie de la glace. Cela peut être fait en plaçant les chiots sous une lampe réchauffement ou au sommet d'un réchauffement de diapositives. Si vous utilisez un chauffe glisser assurer qu'un tampon approprié est placé entre la surface du métal et du chiot récupération. Lors de la récupération retourner les chiots électroporées à leur mère.
4. Préparation des yeux pour l'analyse
- Le moment de la récolte et l'analyse de la rétine est effectuée par électroporation soumis à des objectifs de l'expérimentation. Expression de la GFP peut être grossièrement visualisé 3 jours après l'électroporation. Pour cryoembedding et le sectionnement, procédez comme suit.
- Sacrifice des animaux électroporation à l'timepoint désiré. Disect à l'œil électroporées et fixer dans du paraformaldéhyde 4% à 4 ° C pendant 50 minutes.
- Retirez délicatement la rétine de l'œil par des micro-dissection loin de la sclère, la cornée, le cristallin, la choroïde et l'épithélium pigmentaire rétinien. Les rétines disséqué peut être analysée sous fluorescence grossièrement déterminer l'efficacité de l'électroporation. Transférer la rétine à la solution de saccharose à 30% pendant une nuit à 4 ° C.
- Gel dans les rétines octobre cryo-intégration des médias (Sakura Finetek USA) et stocker à -80 ° C. Rétines peuvent maintenant être sectionnée sur une cryotome et capturé sur lames de verre.
5. Les résultats représentatifs:
Exemples de P0 rétines néonatale électroporation avec une expression pCAG-EGFP plasmide sont présentés à 3 jours suivant l'électroporation (P3) et 14 jours après l'électroporation (P14) dans la figure 4. La zone du tissu rétinien électroporées est variable d'une expérience à fonction de l'étendue des dommages tissulaires encourus lors de l'injection et la régularité de la propagation de la solution d'ADN dans l'espace sous-rétinien. Typiquement 90-100% de rétines électroporées mettra en vedette les cellules qui ont intégré avec succès et ont exprimé le plasmide introduit. Toutefois, lorsque l'affacturage dans la morphologie des tissus et l'efficacité d'électroporation que 40-60% des rétines électroporées sera adapté à l'analyse comparative. Formation de rosettes et de décollement de la rétine à l'endroit de pénétration de l'aiguille est presque toujours observé et cette région ne doit pas être utilisé pour l'analyse. L'ADN réussie réparties pendant la microinjection des résultats dans les tissus de manière efficace électroporées latéraux sur le site de pénétration de l'aiguille libre de rosaces et de détachement. Gliose est également une préoccupation importante expérimentales et presque toujours lieu sur le site de pénétration de l'aiguille. Cependant, comme avec la formation de rosettes et de décollement de la rétine, gliose n'est généralement pas significatifs dans le tissu latéralement électroporé. Marqueurs immunohistochimiques tels que protéine acide fibrillaire gliale (GFAP) peuvent être utilisés pour déterminer si les niveaux de la gliose réactive dans les régions analysées relèvent des seuils acceptables. Rétines sectionné démontrant que la morphologie de la rétine électroporées reste intact et que les étiquettes expression de l'EGFP cellules individuelles électroporées sont présentés. Exemples 3 jours après une électroporation P0 (Fig. 4A-C) et 14 jours après une électroporation P0 (Fig. 4D-F) sont présentées.
En rétines P3 la majorité des cellules par électroporation sont situés dans la couche neuroblastiques (NBL) de la rétine, et ne montrent pas les caractéristiques morphologiques distinctes l'une quelconque des cellules différenciées de neurones ou cellules gliales de la rétine (Fig. 4B, C). Par P14 cellules électroporées peut être trouvée dans la couche nucléaire externe (ONL) et la couche nucléaire interne (INL) de la rétine. Par ailleurs les différentes cellules étiquetées maintenant afficher caractéristique caractéristiques morphologiques des neurones différenciés, y compris les interneurones de l'INL, photorécepteurs et cellules gliales Müller (figure 4E, F).
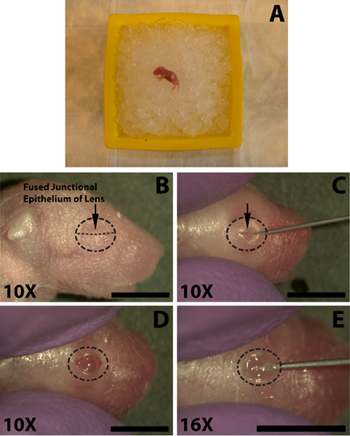
Figure 1. Anesthésie d'un nouveau-né (P0) de souris nouveau-nés et d'ouverture de l'œil pour l'injection sous-rétinienne de solution d'ADN. A) chiot néonatale placé surun lit de glace pilée pour l'anesthésie. Oeil pour être injecté est placée vers le bas contre la glace. B) L'emplacement de l'épithélium fusionné jonctionnelle (B, flèche) de la paupière à couper pour ouvrir l'œil. C) La coupe des paupières ainsi que l'épithélium fusionné jonctionnelle (C, flèche) pour exposer l'œil. D) L'oeil ouvert après la coupe à la jonction fusionnées. E) Une incision est faite dans l'œil en dessous de la sclère sous la cornée afin de faciliter l'insertion facile des extrémités franches de micro-injection à la seringue. Barres d'échelle, B, C, D, E: 4mm.
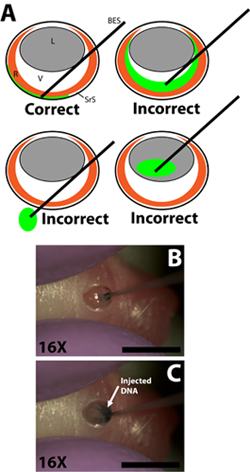
Insertion Figure 2. De l'extrémité franche de micro-injection à la seringue et l'injection de solution d'ADN plasmidique dans l'espace sous-rétinien. A) Schéma montrant Cartoon l'insertion correcte de la seringue d'injection de micro dans l'œil et le règlement de la pointe de la seringue dans l'espace sous-rétinien. L'injection de la solution d'ADN dans la chambre vitrée, passage de la seringue à travers l'œil dans la prise, ou l'injection dans l'objectif se traduira par des expériences ratées avec peu ou pas de cellules par électroporation. B) La pénétration de la seringue dans l'incision pratiquée dans la paroi scléral et le règlement de la pointe de la seringue dans l'espace sous-rétinien. C) L'injection de la solution d'ADN dans l'espace sous-rétinien. Barres d'échelle, B, C: 4mm. Abréviations comme suit: R-rétine, L-lentilles, V-vitreux, SRS-rétinien espace, BES-extrémités franches seringue.

Figure 3. Orientation de l'électrode de pince sur la souris pour l'électroporation. A) Schéma montrant Cartoon l'orientation de la pagaie positifs et négatifs de l'électrode de pince par rapport à l'œil électroporé. Le vert représente l'emplacement de l'ADN injecté dans l'espace sous-rétinien. Flèches en pointillés représentent le mouvement électrophorétique de l'ADN injecté chargée négativement vers l'électrode positive. Électrophorèse d'ADN se produit à partir de l'espace sous-rétinien adjacent à l'électrode négative dans la rétine qui est orienté vers l'électrode positive. B) La palette positif de la pince à épiler est placé à côté de l'ADN microinjectés oeil et la pagaie négatif est placé à côté de l'œil non injectées. C) l'image à fort grossissement de placement des électrodes pince sur la souris néonatales. Les lignes en pointillés représentent la direction du mouvement électrophorétique de l'ADN vers l'électrode positive. Échelle bar, C: 5mm.

Figure 4. Rétines de souris néonatales (P0) électroporation avec pCAG-EGFP et analysés au jour postnatal 3 (P3) et jour postnatal 14 (P14). AC) des images confocale d'une rétine P3 sectionné électroporation avec pCAG-EGFP à P0. La majorité des cellules électroporées s'asseoir dans la couche rétinienne neuroblastiques (LBN). (DF) des images confocale d'un sectionné P14 rétine électroporation avec pCAG-EGFP à P0. Cellules électroporées peuvent être identifiés dans la couche nucléaire externe (ONL) et la couche nucléaire interne (INL) de la rétine. Barres d'échelle, AF: 50 pm.
Discussion
In vivo électroporation représente une méthode rapide et efficace pour la transformation de cellules de la rétine avec des plasmides d'expression d'ADN. Cette méthode permet à l'expérimentateur d'effectuer des études de gain de fonction en introduisant ectopique un gène d'intérêt sous le contrôle d'un promoteur ubiquitaire ou pour effectuer des études de perte de fonction en utilisant des constructions shRNA ciblant des gènes d'intérêt. Par ailleurs, plusieurs plasmid...
Déclarations de divulgation
Remerciements
Ce travail a été financé par le NIH R01EY020560-01 et par un érudit WM Keck Young en bourse de recherche médicale. Les auteurs tiennent à remercier Joseph Bedont pour son aide lors de l'imagerie de la rétine et de préparations injectables.
matériels
| Name | Company | Catalog Number | Comments |
| Nom de réactif | Société | Numéro de catalogue | Commentaires |
|---|---|---|---|
| Tampon phénol saturé | Invitrogen | 15513-039 | N / A |
| Chloroforme | JT Baker | 9180-03 | N / A |
| Acétate de sodium | JT Baker | 3470-05 | 3 M d'actions |
| Fast Green FCF | Fisher Biotech | BP123-10 | Stock de 10% |
| L'alcool isopropylique de préparation | Tyco Healthcare | 6918 | N / A |
| 30-guage aiguille | Terumo Medical Corp | SG2-3013 | N / A |
| Exmire microseringue | Ito Corporation | MS * E05 | N / A |
| Tweezertrode (électrode pince) | BTX Instrument, Inc Genetronics | 522 | N / A |
| Electro Place Porator (électroporateur) | BTX Instrument, Inc Genetronics | ECM 830 | N / A |
| Composé OCT | Sakura Finetek USA | 4583 | N / A |
Références
- Neumann, E., Rosenheck, K. Permeability changes induced by electric impulses in vesicular membranes. J. Membr. Biol. 10, 279-290 (1972).
- Turnbull, R. J. Letter: Letter: An alternate explanation for the permeability changes induced by electrical impulses in vesicular membranes. J. Membr. Biol. 14, 193-196 (1973).
- Zimmermann, U., Schulz, J., Pilwat, G. Transcellular ion flow in Escherichia coli B and electrical sizing of bacterias. Biophys. J. 13, 1005-1013 (1973).
- Kinosita, K., Tsong, T. Y. Voltage-induced pore formation and hemolysis of human erythrocytes. Biochim. Biophys. Acta. 471, 227-242 (1977).
- Neumann, E., Schaefer-Ridder, M., Wang, Y., Hofschneider, P. H. Gene transfer into mouse lyoma cells by electroporation in high electric fields. EMBO J. 1, 841-845 (1982).
- Swartz, M., Eberhart, J., Mastick, G. S., Krull, C. E. Sparking new frontiers: using in vivo electroporation for genetic manipulations. Dev. Biol. 233, 13-21 (2001).
- Matsuda, T., Cepko, C. L. Electroporation and RNA interference in the rodent retina in vivo and in vitro. Proc. Natl. Acad. Sci. U. S. A. 101, 16-22 (2004).
- Matsuda, T., Cepko, C. L. Controlled expression of transgenes introduced by in vivo electroporation. Proc. Natl. Acad. Sci. U. S. A. 104, 1027-1032 (2007).
- Onishi, A. Pias3-dependent SUMOylation directs rod photoreceptor development. Neuron. 61, 234-246 (2009).
- Onishi, A. The orphan nuclear hormone receptor ERRbeta controls rod photoreceptor survival. Proc. Natl. Acad. Sci. U. S. A. 107, 11579-11584 (2010).
- Kim, D. S. A Core Paired-Type and POU Homeodomain-Containing Transcription Factor Program Drives Retinal Bipolar Cell Gene Expression. J. Neurosci. 28, 7748-7764 (2008).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon