Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
В естественных условиях Электропорация развивающихся Мышь Retina
В этой статье
Резюме
Метод включения плазмидной ДНК в мышиных клеток сетчатки для целей осуществления любой выигрыш или потеря функции исследования В естественных условиях Представлена. Этот метод капитализирует на кратковременное повышение проницаемости клеточных мембран плазмы индуцированных применением внешнего электрического поля.
Аннотация
The functional characterization of genes expressed during mammalian retinal development remains a significant challenge. Gene targeting to generate constitutive or conditional loss of function knockouts remains cost and labor intensive, as well as time consuming. Adding to these challenges, retina expressed genes may have essential roles outside the retina leading to unintended confounds when using a knockout approach. Furthermore, the ability to ectopically express a gene in a gain of function experiment can be extremely valuable when attempting to identify a role in cell fate specification and/or terminal differentiation.
We present a method for the rapid and efficient incorporation of DNA plasmids into the neonatal mouse retina by electroporation. The application of short electrical impulses above a certain field strength results in a transient increase in plasma membrane permeability, facilitating the transfer of material across the membrane 1,2,3,4. Groundbreaking work demonstrated that electroporation could be utilized as a method of gene transfer into mammalian cells by inducing the formation of hydrophilic plasma membrane pores allowing the passage of highly charged DNA through the lipid bilayer 5. Continuous technical development has resulted in the viability of electroporation as a method for in vivo gene transfer in multiple mouse tissues including the retina, the method for which is described herein 6, 7, 8, 9, 10.
DNA solution is injected into the subretinal space so that DNA is placed between the retinal pigmented epithelium and retina of the neonatal (P0) mouse and electrical pulses are applied using a tweezer electrode. The lateral placement of the eyes in the mouse allows for the easy orientation of the tweezer electrode to the necessary negative pole-DNA-retina-positive pole alignment. Extensive incorporation and expression of transferred genes can be identified by postnatal day 2 (P2). Due to the lack of significant lateral migration of cells in the retina, electroporated and non-electroporated regions are generated. Non-electroporated regions may serve as internal histological controls where appropriate.
Retinal electroporation can be used to express a gene under a ubiquitous promoter, such as CAG, or to disrupt gene function using shRNA constructs or Cre-recombinase. More targeted expression can be achieved by designing constructs with cell specific gene promoters. Visualization of electroporated cells is achieved using bicistronic constructs expressing GFP or by co-electroporating a GFP expression construct. Furthermore, multiple constructs may be electroporated for the study of combinatorial gene effects or simultaneous gain and loss of function of different genes. Retinal electroporation may also be utilized for the analysis of genomic cis-regulatory elements by generating appropriate expression constructs and deletion mutants. Such experiments can be used to identify cis-regulatory regions sufficient or required for cell specific gene expression 11. Potential experiments are limited only by construct availability.
протокол
1. Плазмиды подготовки к электропорации
Концентрации ДНК, необходимые для электропорации является 5μg/μl. Обычно для этого требуется, чтобы желаемое плазмид быть усилен использованием Maxi-приготовительные (Qiagen) или эквивалентного метода последующей очистки и концентрации ДНК, чтобы рабочий объем. Следующие шаги описывают подготовки ДНК, чтобы рабочий объем.
- Алиготе 100 мкг ДНК (от Maxi-приготовительные или эквивалент) и разбавленных объема до 100 мкл для удобства манипулирования.
- Добавить фенола; количество фенола следует рассчитывать получить около 60% ДНК / объему (мкг ДНК: общий объем), т.е.: 100 мкг ДНК (в 100 мкл) плюс 67 мкл фенола (100 мкг: 167 мкл). Тщательно перемешать, не пипетку вверх и вниз, так как это может привести к чрезмерной стрижка ДНК.
- Спиновые ДНК в течение 5 минут при 14000 оборотов при комнатной температуре.
- Сбор супернатант и добавить хлороформ, используя тот же ДНК: соотношение общего объема в шаге 1.2; смеси, как описано в пункте 1.2 и вращаются на 14000 RPM в течение 5 минут при комнатной температуре.
- Сбор супернатант, добавить 10% супернатанта объемом 3 М ацетата натрия на раствор ДНК, аккуратно перемешать и добавить 2,5 X супернатанта объемом 100% этанола. Смешайте по инверсии. ДНК должна выпадают из раствора в процессе перемешивания.
- Спиновые ДНК при температуре 4 ° С в течение 10 минут при 14000 оборотов в минуту.
- Промыть 350 мкл 70% этанола, вращаются на 14000 RPM в течение 5 минут при 4 ° C.
- Воздух сухой осадок затем растворить ДНК в 1 X PBS (степень Клеточная биология) для 5μg/μL. Не пересушивать образца, так как это делают его очень трудно растворяются в PBS.
- Добавить Быстрый краситель зеленый (10% акций), чтобы раствор ДНК, конечной концентрации красителя 0,1%, в качестве инъекций индикатора.
2. Субретинальной инъекции ДНК
Следующие шаги выполняются с помощью стереомикроскопа. После практикуется процесс открытия глаз, разрез, и инъекции занимает не более 1,5 минут, что не успевает должным образом наркозом щенка, чтобы оправиться. Используя острый 30-иглы, осторожно откройте глаза разрезанием вдоль плавленого соединительного эпителия (рис. 1в). Не прикладывайте чрезмерных усилий, поскольку это может привести к резкой основной глаза. Избегайте резки за пределы века стык, поскольку это приведет к кровотечение, которое может скрыть инъекции.
- Обезболивания новорожденных мышей на льду в течение нескольких минут (рис. 1А), не хоронят щенков в лед, поскольку это может привести к смерти. Времени на льду переменную из щенка к щенку, как правило, 5 минут достаточно, но мышей необходимо тщательно контролировать, как люди могут реагировать очень быстро и могут потребовать более длительного воздействия для обеспечения надлежащей анестезии. Поведение лапу шнура с hemostats для проверки вывода рефлекс.
- Для того чтобы облегчить введение ДНК субретинальной пространство глаза сначала должен быть открыт. Тампон глаз, который будет введен с 70% изопропиловый спирт приготовительные (Tyco Healthcare) и определить плавленого соединительного эпителия, где два веки собрались вместе (рис. 1В).
- Используя острый 30-иглы, осторожно откройте глаза разрезанием вдоль плавленого соединительного эпителия (рис. 1в). Не прикладывайте чрезмерных усилий, поскольку это может привести к резкой основной глаза. Избегайте резки за пределы века стык, поскольку это приведет к кровотечение, которое может скрыть инъекции.
- Для облегчения проникновения глаз тупыми концами инъекционной иглой использовать кончик 30-guage иглой делают небольшой разрез в склере недалеко от перекрестка с роговицы (рис. 1E). Не проникает слишком глубоко, как это может привести к проколу линзы.
- Нарисуйте 0,3 мкл раствора ДНК в 33 калибр тупыми концами инъекционной иглой шприца использованием градиентов для измерения объема индивидуально для каждой инъекции (игла наружным диаметром 0,52 мм, внутренний диаметр 0,13 мм; Exmire микрошприца; Ито корпорации). Вставьте иглу в разрез, пока сопротивление противоположной стене склеры ощущается. Будьте осторожны, чтобы избежать проникновения линзы, как игла прошла через vitreal камеры (рис. 2б).
- Медленно вводят 0,3 мкл раствора ДНК в субретинальной пространстве, используя указательный палец или большой палец, чтобы угнетать поршень шприца. Экспериментатор должен быть осторожным, чтобы контролировать скорость депрессии поршень так, что скорость, с которой раствор ДНК вводится в субретинальной пространство не опережать скорость, с которой ДНК решение распространяется в субретинальной пространства (рис. 2). ДНК решение вязкой, поэтому важно, чтобы игла не нажата слишком сильно против противоположных склеры стены, как это может привести к ДНК не вводили и не распространяется равномерно. Успешное введение приведет к ещеРаспространение ДНК решение в части субретинальной пространства. Регионы сетчатки и без основного зеленого трассирующими должны быть очевидны при повороте вводили животным.
3. Электропорация
- Электропорация осуществляется с помощью 10 мм в диаметре пинцет электрод (модель # 522; BTX Instruments). Замочите пинцет электрода в ФБР, чтобы максимизировать электропроводности от электрода к животным и место главы вводят щенка между электродами с глазу вводят прилегающих к положительному электроду полюса и неинъекционные глаз, прилегающих к отрицательному полюсу электрод (рис. 3б).
- Применить пяти квадратных импульсов использованием генератора импульсов: каждый импульс на 80 вольт и 50 миллисекунд по продолжительности с 950 миллисекунд интервал между импульсами.
- Электропорации щенки должны теперь быть прогреты, пока они не оправиться от льда анестезии. Это может быть сделано путем размещения щенков под потепления лампы или на верхней части слайда теплее. При использовании слайд теплее обеспечить соответствующую площадку помещается между поверхностью металла и восстановление щенка. После восстановления возвращения электропорации щенков к матери.
4. Подготовка глаз для анализа
- Время сбора и анализа электропорации сетчатки производится при условии целей эксперимента. GFP выражение может быть грубо визуализируется через 3 дня после электропорации. Для cryoembedding и секционирования поступить следующим образом.
- Жертва электропорации животных в нужном timepoint. Disect из электропорации глаз и зафиксировать в 4% параформальдегида при 4 ° С в течение 50 минут.
- Осторожно снимите сетчатку от глаз, микро-рассечение от склеры, роговицы, хрусталика, сосудистой оболочки и сетчатки пигментный эпителий. Расчлененный сетчатки могут быть проанализированы при флуоресценции грубо определить эффективность электропорации. Передача сетчатки до 30% раствором сахарозы течение ночи при 4 ° C.
- Замораживание сетчатки в октябре крио-вложение средств массовой информации (Sakura Finetek США) и хранят при температуре -80 ° C. Сетчатки может теперь быть подразделяются на замораживающий микротом и захватили на стеклах.
5. Представитель Результаты:
Примеры P0 новорожденных сетчатки электропорации с pCAG-EGFP плазмиды экспрессии представлены в 3 дней после электропорации (P3) и 14 дней после электропорации (P14) на рисунке 4. Площадь ткани сетчатки электропорации переменная от эксперимента к эксперименту в зависимости от степени повреждения тканей, понесенные во время инъекции и равномерность распространения раствора ДНК в субретинальной пространства. Как правило 90-100% электропорации сетчатки будут представлены клетки, которые успешно включил и выразил введен плазмиды. Однако, когда факторинга в морфологии тканей и электропорации эффективность только 40-60% электропорации сетчатки будут пригодны для сравнительного анализа. Формирование Розетки и отслойки сетчатки в месте проникновения иглы почти всегда наблюдаются и эта область не должна использоваться для анализа. Успешное распространение ДНК во время микроинъекции приводит эффективно электропорации ткани боковое к месту проникновения иглы свободны от розетки и отрешенности. Глиоз также важные экспериментальные озабоченность, и почти всегда происходит в месте проникновения иглы. Однако, как с образованием розетки и отслойки сетчатки, глиоз, как правило, не имеет существенного значения в сторону электропорации ткани. Иммуногистохимических маркеров, таких как глиальные фибриллярный кислый белок (GFAP) могут быть использованы для определения уровня реактивной глиоз в анализируемых регионах падение в пределах допустимых порогов. Секционного сетчатки демонстрируя, что морфология электропорации сетчатке остается неизменной и что этикетки EGFP выражение отдельных электропорации клетки представлены. Примеры 3 дней после P0 электропорации (рис. 4A-C) и 14 дней после P0 электропорации (рис. 4D-F) представлены.
В P3 сетчатки большинство электропорации клетки расположены в neuroblastic слой (НБЛ) сетчатки, и не демонстрируют различные морфологические характеристики любого из дифференцированных нейронных или глиальные клетки сетчатки (рис. 4, б, С). По P14 электропорации клетки могут быть найдены в наружный ядерный слой (ONL) и внутренний ядерный слой (INL) сетчатки. Кроме различных меченых клеток теперь отображаются характерные морфологические признаки дифференцированных нейронов, включая интернейронов INL, фоторецепторы, и Мюллер глии (рис. 4E, F).
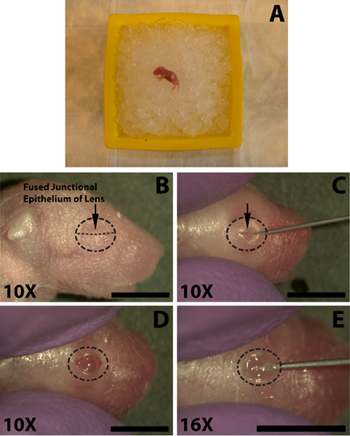
Рисунок 1. Анестезия у новорожденного (P0) мыши щенка и открытие глаз для субретинальной инъекции раствора ДНК. ) Новорожденных щенков размещены накровать дробленого льда для обезболивания. Глаз, который будет введен помещается вниз против льда. Б) расположение плавленого соединительного эпителия (B, стрелкой) век быть сокращены за око открытия. С) Резка веки вместе плавленого соединительного эпителия (С, стрелка), чтобы выставить на первый взгляд. D) открыл глаза следующее резки на сплавной переход. Е) разрез делается в глаз под в склеры под роговицу для облегчения вставки тупыми концами микро-инъекции шприцем. Шкала бары, B, C, D, E: 4 мм.
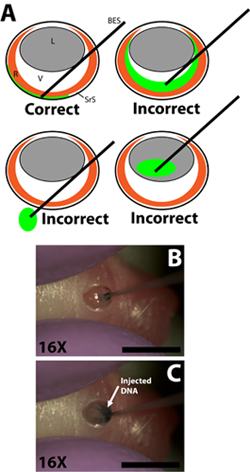
Рисунок 2. Введение тупыми концами микро-инъекции шприц и инъекцию ДНК плазмиды раствора в субретинальной пространства. ) Мультфильм схема демонстрирует правильное вставки микро шприца инъекции в глаза и урегулирования шприц наконечник в субретинальной пространства. Инъекция раствора ДНК в стекловидное тело камеры, прохождение шприцем через глаз в розетку, или инъекции в объектив приведет неудачных экспериментов с мало, если вообще электропорации клеток. Б) Проникновение шприца в разрез, сделанный в склеры стены и урегулирования шприц наконечник в субретинальной пространства. С) Инъекция раствора ДНК в субретинальной пространства. Шкала бары, B, C: 4 мм. Сокращения следующим образом: R-сетчатки, L-объектив, V-стекловидное тело, SRS-субретинальной пространства, BES-тупыми концами шприц.

Рисунок 3. Ориентация пинцет электрода на мышь для электропорации. ) Мультфильм схема демонстрирует ориентацию положительные и отрицательные весла из пинцет электрода по отношению к электропорации глаз. Зеленый представляет расположение вводили ДНК в субретинальной пространства. Пунктирные стрелки обозначают электрофоретического движения отрицательно заряженной ДНК вводят в направлении положительного электрода. ДНК-электрофорез происходит из субретинальной пространстве, прилегающем к отрицательным электродом в сетчатку, которая ориентирована на положительном электроде. В) положительное весло из пинцет помещается рядом с ДНК microinjected глаз и отрицательные весло находится рядом с неинъекционные глаз. С) Изображение с высоким увеличением пинцет электрода размещения на новорожденных мышей. Пунктирные линии показывают направление движения электрофоретической ДНК в направлении положительного электрода. Шкала бар, C: 5 мм.

Рисунок 4. Новорожденных мышей сетчатки (P0) электропорации с pCAG-EGFP и проанализированы в послеродовой день 3 (Р3) и послеродовой день 14 (P14). AC) конфокальной образы секционного сетчатки P3 электропорации с pCAG-EGFP в точке Р0. Большинство электропорации сидеть в клетках сетчатки neuroblastic слой (НБЛ). (DF) конфокальной образы секционного P14 сетчатки электропорации с pCAG-EGFP в точке Р0. Электропорации клетки могут быть выявлены в наружный ядерный слой (ONL) и внутренний ядерный слой (INL) сетчатки. Шкала Бары, AF: 50 мкм.
Access restricted. Please log in or start a trial to view this content.
Обсуждение
В естественных условиях электропорации представляет быстрый и эффективный метод для преобразования клеток сетчатки с помощью плазмидов экспрессии ДНК. Этот метод позволяет экспериментатору выполнить усиление функции исследования эктопически введения гена под контролем повсе...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Благодарности
Эта работа финансировалась NIH R01EY020560-01 и WM Keck молодой ученый в области медицинской премии Research. Авторы хотели бы поблагодарить Иосифа Bedont за его помощь во время визуализации сетчатки препаратов и инъекций.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер по каталогу | Комментарии |
|---|---|---|---|
| Буфер Насыщенные Фенол | Invitrogen | 15513-039 | N / A |
| Хлороформ | JT Baker | 9180-03 | N / A |
| Ацетата натрия | JT Baker | 3470-05 | 3 М акции |
| Быстрый зеленый FCF | Фишер Biotech | BP123-10 | 10% акций |
| Изопропиловый спирт приготовительные | Tyco Healthcare | 6918 | N / A |
| 30-guage иглы | Terumo медицинской корпорации | SG2-3013 | N / A |
| Exmire микрошприца | Ито корпорации | MS * E05 | N / A |
| Tweezertrode (пинцет электрода) | BTX Инструмент, ООО Genetronics | 522 | N / A |
| Electro площади Porator (electroporator) | BTX Инструмент, ООО Genetronics | ECM-830 | N / A |
| Октябрь соединения | Сакура Finetek США | 4583 | N / A |
Ссылки
- Neumann, E., Rosenheck, K. Permeability changes induced by electric impulses in vesicular membranes. J. Membr. Biol. 10, 279-290 (1972).
- Turnbull, R. J. Letter: Letter: An alternate explanation for the permeability changes induced by electrical impulses in vesicular membranes. J. Membr. Biol. 14, 193-196 (1973).
- Zimmermann, U., Schulz, J., Pilwat, G. Transcellular ion flow in Escherichia coli B and electrical sizing of bacterias. Biophys. J. 13, 1005-1013 (1973).
- Kinosita, K., Tsong, T. Y. Voltage-induced pore formation and hemolysis of human erythrocytes. Biochim. Biophys. Acta. 471, 227-242 (1977).
- Neumann, E., Schaefer-Ridder, M., Wang, Y., Hofschneider, P. H. Gene transfer into mouse lyoma cells by electroporation in high electric fields. EMBO J. 1, 841-845 (1982).
- Swartz, M., Eberhart, J., Mastick, G. S., Krull, C. E. Sparking new frontiers: using in vivo electroporation for genetic manipulations. Dev. Biol. 233, 13-21 (2001).
- Matsuda, T., Cepko, C. L. Electroporation and RNA interference in the rodent retina in vivo and in vitro. Proc. Natl. Acad. Sci. U. S. A. 101, 16-22 (2004).
- Matsuda, T., Cepko, C. L. Controlled expression of transgenes introduced by in vivo electroporation. Proc. Natl. Acad. Sci. U. S. A. 104, 1027-1032 (2007).
- Onishi, A. Pias3-dependent SUMOylation directs rod photoreceptor development. Neuron. 61, 234-246 (2009).
- Onishi, A. The orphan nuclear hormone receptor ERRbeta controls rod photoreceptor survival. Proc. Natl. Acad. Sci. U. S. A. 107, 11579-11584 (2010).
- Kim, D. S. A Core Paired-Type and POU Homeodomain-Containing Transcription Factor Program Drives Retinal Bipolar Cell Gene Expression. J. Neurosci. 28, 7748-7764 (2008).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены