Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Receptor de imagen acoplados a proteína G (GPCR) mediada por eventos de señalización que la quimiotaxis de control de Dictyostelium discoideum
En este artículo
Resumen
A continuación, describimos los métodos detallados en vivo de imágenes de células para la investigación de la quimiotaxis. Se presenta fluorescencia microscópica métodos para controlar la dinámica espacio-temporal de los eventos de señalización en las células que migran. La medición de la señalización de eventos nos permite entender mejor cómo una red de señalización de GPCR logra gradiente de detección de factores quimiotácticos y los controles de la migración direccional de las células eucariotas.
Resumen
Muchas células eucariotas pueden detectar gradientes de señales químicas en sus entornos y en consecuencia la migración 1. Esta migración de las células guiadas se conoce como quimiotaxis, que es esencial para varias células para llevar a cabo sus funciones, como el tráfico de las células inmunes y los patrones de las células neuronales 2, 3. Una gran familia de receptores de la proteína G-acoplada (GPCR) detecta variable de péptidos pequeños, conocidos como quimiocinas, para dirigir la migración celular in vivo 4. El objetivo final de la quimiotaxis de investigación es entender cómo un GPCR sentidos maquinaria gradientes de quimioquinas y los controles de los eventos de señalización que conducen a la quimiotaxis. Para ello, utilizamos técnicas de imagen para controlar, en tiempo real, las concentraciones de espacio-temporal del movimiento quimiotácticos de células, en un gradiente de quimioatrayente, mediada por la activación de GPCR heterotrimeric G-proteína, y los eventos intracelulares de señalización implicadas en la quimiotaxis de las células eucariotas 5.8 . El organismo simple eucariotas, Dictyostelium discoideum, muestra comportamientos quimiotaxis que son similares a los de los leucocitos, y D. discoideum es un modelo de sistema clave para el estudio de la quimiotaxis de eucariotas. Como amebas de vida libre, D. las células se dividen discoideum en medio rico. Sobre el hambre, las células entran en un programa de desarrollo en el que agregada a través de AMPc mediada la quimiotaxis para formar estructuras multicullular. Muchos de los componentes involucrados en la quimiotaxis de los campamentos han sido identificados en el D. discoideum. La unión del AMPc a un GPCR (CAR1) induce la disociación de heterotrimeric proteínas G en Gγ y 7 subunidades Gβγ, 9, 10. Subunidades Gβγ activar Ras, que a su vez activa la PI3K, convirtiendo PIP PIP 2 en 3 en la membrana celular 11-13. PIP 3 sirven como sitios de unión para las proteínas con homología pleckstrin (PH) dominios, con lo que reclutar a estas proteínas de la membrana 14, 15. La activación de receptores CAR1 también controla las asociaciones de la membrana de PTEN, que desfosforila PIP PIP 3 a 2 16, 17. Los mecanismos moleculares que son conservadas evolutivamente en las quimiocinas GPCR mediada por quimiotaxis de las células humanas, como los neutrófilos 18. Se presentan los siguientes métodos para el estudio de la quimiotaxis de D. células discoideum. 1. Preparación de las células componentes quimiotácticos. 2. Imágenes de la quimiotaxis de las células en un gradiente de cAMP. 3. Vigilancia de la activación inducida por GPCR de heterotrimeric G-proteína en las células individuales en vivo. 4. Imágenes quimioatrayente activada por PIP dinámica 3 respuestas en una sola las células vivas en tiempo real. Nuestra desarrollado métodos de imagen se pueden aplicar para estudiar la quimiotaxis de los leucocitos humanos.
Protocolo
1. Preparación de células competentes quimiotáctica de Dictyostelium discoideum
- Para generar células D. discoideum que son quimiotácticas al campo quimiotáctica, las células de la cosecha que crece en D3-T de medios enriquecidos a partir de una cultura de agitación a 22 ° C.
- Lavar las células dos veces en buffer no nutrientes en el desarrollo (DB buffer conteniendo 5 mM Na 2 HPO 4, 5 mM KH 2 PO 4, 2 mM de MgCl 2 y 0,1 mM CaCl 2).
- Vuelva a suspender las células en un tampón de DB a una densidad de 2x10 7 células / ml.
- Agitar 10 ml de células en un frasco de 250 ml a 100 rpm a 22 ° C durante una hora.
- Entregar 100 l de 7,5 M de valores de AMPc a las 10 células ml cada seis minutos más de 6 horas para conseguir una concentración final de 75 nM de cAMP, un proceso designado como el tratamiento de cAMP pulso. Después de 5-6 horas de tratamiento AMPc pulso, D. células discoideum se quimiotáctica competentes hacia gradiente de cAMP.
- Recoger las células por centrifugación a 200 g por 5 min y luego suspender las células con tampón DB contiene 2,5 mM de cafeína, y agitar a 200 rpm a 22 ° C durante 20 minutos para basolate celular a una situación quimiotácticos.
2. Imágenes chemotaxing células en un gradiente quimiotáctico visible y manipulable
- Relleno de una micropipeta con un recién preparada la solución de 30 l de AMPc M 1 y Alexa 594 en 0.1μg/μl en tampón DB.
- Conecte el Femtotip al titular de la micropipeta y conectar el tubo a un aparato de presión de alimentación, sistema de Eppendorf FemtoJet.
- Fije el conjunto de micropipeta a un micromanipulador (Eppendorf TransferMan NK2) motorizados micromanipulador para proporcionar una presión constante a fin de establecer un gradiente estable.
- Montar una cámara de un bien Labtek lleno con 6 ml de tampón de DB en una lente de 40x de aceite en un microscopio confocal y el uso brillante campo de la óptica, el centro de la Femtotip en el campo de visión.
- Abra el suministro de presión y establecer la compensación de presión (Pc) por 70 hPa para establecer un gradiente de la cAMP / Alexa 594 mezcla.
- Visualizar gradiente de AMPc por el control de la mezcla de concentración deseada de AMPc y Alexa 594 fluorescencia utilizando la excitación con una línea de 543 nm láser.
- El uso de auto-posicionamiento en función de la micropipeta micromanipulador para poner a las posiciones deseadas y los puso como la posición 1, posición 2, y 3 posiciones para manipular el gradiente de la celda que están expuestos.
3. Sistema inmóvil de células no polarizadas facilita eventos de imagen de señalización implicadas en la detección de gradiente de AMPc
- Después de tratamiento con cafeína, eliminar una parte alícuota de las células y se centrifuga a 500 g por 3 min.
- Quitar buffer y diluir las células a 5x10 5 células / ml con tampón DB fresco que contiene 2,5 mM de cafeína.
- Aplicar 1 ml de suspensión celular a una cámara de un solo bien o 0,4 ml a cada pocillo de una cámara de cuatro pozos.
- Permiten que las células se adhieran durante 10 minutos, con cuidado de la pipeta tampón para eliminar las células sueltas y reemplazar con el mismo volumen.
- Localizar las células deseadas bajo el microscopio y empezar de imágenes.
- Para un experimento diseñado para controlar la dinámica de componentes de señalización en las células de la exposición a un gradiente estable, el tratamiento de las células con 5,0 M (concentración final) latrunculin B durante 10 minutos antes de los experimentos.
4. Heterotrimeric simultánea de vigilancia y activación de la proteína G PIP 3 producción
- AMPc pulso del desarrollo de células co-expresando GαCFP y YFPGβ (células G) y las células que expresan PIP 3 indicador de PH-GFP (células PH) 7.
- Mezclar estos dos tipos de células con una relación 1:1 y la placa de ellos en cámaras de un solo bien o 4 bien.
- Crear y guardar las emisiones de huellas dactilares curva de referencia de la PPC, YFP y las buenas prácticas agrarias con la pila Lambda modo de adquisición en el rango espectral desde 464 hasta 624 nm con una anchura de 10 nm.
- Al mismo tiempo la imagen G activación de la proteína en las células G y PIP 3 en células PH se utiliza con el modo de adquisición de Lambda misma pila en el rango espectral desde 464 hasta 544 nm con incrementos de 10 nm.
- Aplicar la función desmezcla lineal de Zeiss con software 510META salvado CFPand YFP y las huellas digitales de emisión para calcular matemáticamente la contribución de cada fluoróforo en la pila de Lambda para separar la política pesquera común y la intensidad YFP en canales individuales de G.
- Con la misma estrategia, aplicar la función desmezcla lineal utilizando GFP salvado y las huellas digitales de fondo de emisión para calcular matemáticamente la intensidad de GFP en las células PH.
5. Los resultados representativos:
- Un excelente sistema modelo de D. discoideum de quimiotaxis mediada por GPCR. Una ameba social, D. discoideum exhibe una quimiotaxis en huelga durante el ciclo de vida. Debido a sus ventajas genéticas y bioquímicas, D. D proporciona un potente sistema para estudiar la quimiotaxis.
- Quimiotaxis de las células bajo un campo visible y manipulable chemoattract. Aquí, lo primero que muestran una metodología sencilla para obtener una relación lineal entre los campos de concentración y la intensidad de un tinte fluorescente Alexa 594 por una serie de dilución de AMPc M 2 con 10 mg / ml Alexa 594 (Fig. 2A). A continuación, ofrecemos una forma sencilla de visualizar la pendiente, por otra parte, para establecer una medida cuantitativa de la concentración de cAMP de un gradiente de la intensidad de Alexa 594 (Fig. fig. 2B).
- Motilidad celular no se acopla con la polarización celular y la detección de dirección. Un inhibidor de la polimerización de la actina elimina preexistentes polaridad morfológica y también evita el movimiento de células, manteniendo la capacidad de las células de detección de dirección (Fig. 3A). El empleo de la estimulación AMPc visible y manipulable garantiza la entrada, por ejemplo, los estímulos aplicados de manera uniforme o un degradado. Este método permite un análisis cuantitativo de AMPc inducida por la redistribución de los componentes clave de señalización en el mecanismo de detección de gradiente. Mide la dinámica espacio-temporal de los componentes de señalización nos permite entender cómo la red de señalización logra la adaptación a los estímulos uniforme mientras que la generación polarizada respuestas bioquímicas de los gradientes (Fig. 3B).
- Medidas sistémicas de la cinética de chemosensing red de señalización con la exposición a un gradiente estable. Es muy importante para medir la dinámica / cinética de la dirección de detección de componentes de señalización para entender cómo cada componente contribuye a la creación de la polarización intracelular cuando las células de la experiencia primer gradiente. Aplicación de imágenes de células vivas, con un tempo-espacial de alta resolución, lo primero que muestran una bifásica PIP3 producción de células que se expone a un gradiente de AMPc constante (Fig. 4A-C). La aplicación de imágenes de células vivas, hemos medido sistemáticamente la dinámica de la dirección de detección de la red de señalización específica de la estimulación de la producción de cAMP a PIP3 (Fig. 4D, E).
- El monitoreo simultáneo heterotrimeric activación de la proteína G y PIP 3 producción a la estimulación AMPc aplicación uniforme. Förster resonancia de transferencia de energía (FRET abreviado) proporciona un método eficiente para controlar la activación de la proteína G heterotrimeric (disociación) a la estimulación del AMPc. En este sentido, se describe una práctica fácil de adoptar el sistema para la medición simultánea de la activación de proteínas G heterotrimeric y la producción de PIP 3 por el control de la FRET cambio y el desplazamiento de la membrana de la sonda PIP 3, PH-GFP en las células G y PH, respectivamente (Fig. 5 ). Una estimulación AMPc aplicación uniforme provoca una persistente activación de la proteína G, mientras que desencadena una PIP transitoria 3 de producción.
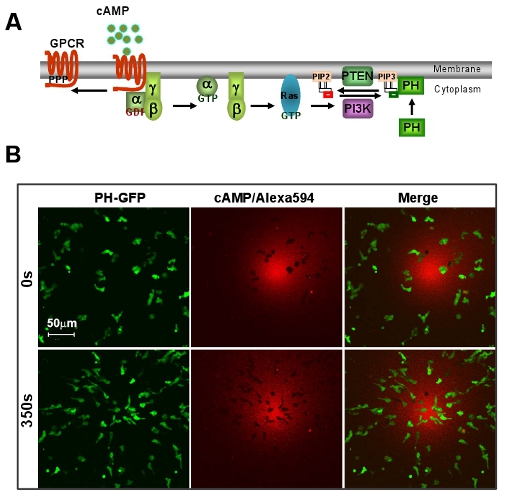
Figura 1: Un sistema excelente modelo de D. discoideum de quimiotaxis mediada por GPCR. A. Esquema muestra una vía de señalización breve de detección de dirección. B. gradiente de AMPc induce la quimiotaxis rápida de D. células discoideum. Células expresan PIP 3 de la sonda, PH-GFP (Green). Gradiente (rojo) se visualiza por Alexa 594. Barra de escala = 50 micras.
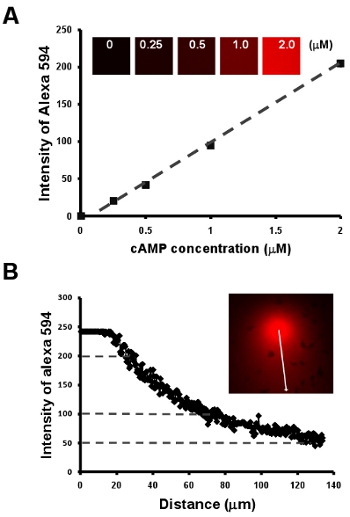
Figura 2: La quimiotaxis de las células bajo un campo visible y manipulable chemoattract. A. El gráfico muestra una relación lineal entre los campos de concentración y la intensidad de un tinte fluorescente Alexa 594 por una serie de dilución de AMPc M 2 con 10 mg / mL Alexa 594. Medición B. cuantitativa de los campos de concentración de un gradiente de la relación lineal de los campos de concentración y la intensidad de fluorescencia tinte Alexa 594 en A.

Figura 3: la motilidad celular no se acopla con la polarización celular y la detección de dirección. A. Imagen muestra que las células inmóviles por el tratamiento de inhibidor de la polimerización de la actina B latrunculin mantener la capacidad de detección de dirección. Células expresan PIP 3 de la sonda, PH-GFP (Green). Gradiente (rojo) se visualiza por Alexa 594. B. AMPc manipulables estimulación e inmóvil sistema celular permite hacer frente a cuestiones clave de la detección de dirección. Barra de escala = 10μm.

Figura 4: Medidas sistémicas de la cinética de chemosensing red de señalización con la exposición a un gradiente estable. A. Montaje muestra un PIP bifásica producción de 3 (verde) de la célula que está expuesto a un gradiente de AMPc constante (rojo). B. La imagen muestra las regiones de interés (ROI) para la medición de la cinética de la producción de PIP 3 se presentan en C. C . cinética oPIP f 3 en la producción de las células expuestas a un gradiente estable. D. esquema muestra la red de señalización de los sensores de dirección de la estimulación del AMPc a la producción de PIP 3. Su cinética de la exposición a un gradiente constante se presenta en las líneas del mismo color sólido en E.

Figura 5: Simultánea de monitoreo multi-eventos de las redes de señalización de GPCR. A. Esquema muestra la medición simultánea de la activación de proteínas G heterotrimeric y la producción de PIP 3 por el control de la FRET cambio y el desplazamiento de la membrana de la sonda PIP3, PH-GFP en las células G y PH, respectivamente. B. Montaje de imágenes de arco iris de G y las células PH muestra que la estimulación AMPc aplicación uniforme provoca una persistente activación de la proteína G en el periférico de células, mientras que provoca un transitorio PIP3 producción. Los dos momentos son antes (0s) y después de la estimulación de 4.9s, y 10.2s 20.4s. C. Cinética de la activación de la proteína G y PIP3 de producción en una estimulación AMPc aplicación uniforme.
Access restricted. Please log in or start a trial to view this content.
Discusión
El proceso de llegar a la etapa quimiotáctica de las células competentes
De tipo salvaje D. células discoideum, se tarda unos 5 a 6 horas pulsando el desarrollo a temperatura ambiente para inducir a un estado competente bien quimiotácticas durante el cual las células presentan una morfología celular y la migración celular polarizada y rápida (Fig. 1). Varios factores, tales como los campos de concentración de pulso, temperatura, y diferentes fondos genéticos, pueden ...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Este trabajo es apoyado por el fondo de intramuros del NIAID, NIH.
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | Comentarios |
|---|---|---|---|
| D3-T medios de cultivo | KD Médico | ||
| Cafeína | Sigma | ||
| Latrunculin B | Las sondas moleculares | ||
| Alexa 594 | Las sondas moleculares | ||
| AMPc | Sigma | ||
| ChronTrol XT temporizador programable | ChronTrol Corp | ||
| Miniplus 3 bomba peristáltica | Gilbson | ||
| Plataforma agitador rotatorio | |||
| FemtoJet fuente de presión capilar se | Eppendorf | ||
| De uno y cuatro bien Lab-Tek II cubreobjetos cámaras | Nalge Nunc Internacional | ||
| LSM 510 META microscopio de fluorescencia o equivalente | Zeiss | un 40X 60X o 1.3 NA 1.4 NA petróleo DIC Plan-Neofluar lente objetivo | |
| Olympus X81 o equivalente | Olimpo | Requiere un 100X 1,47 NA TIRF lente del objetivo |
Referencias
- Lijima, M., Huang, Y. E., Devreotes, P. Temporal and spatial regulation of chemotaxis. Dev Cell. 3, 469-469 (2002).
- Murphy, P. M. The molecular biology of leukocyte chemoattractant receptors. Annu Rev Immunol. 12, 593-593 (1994).
- Devreotes, P. N. G protein-linked signaling pathways control the developmental program of Dictyostelium. Neuron. 12, 235-235 (1994).
- Jin, T., Xu, X., Hereld, D. Chemotaxis, chemokine receptors and human disease. Cytokine. 44, 1-1 (2008).
- Meier-Schellersheim, M. Key role of local regulation in chemosensing revealed by a new molecular interaction-based modeling method. PLoS Comput Biol. 2, e82-e82 (2006).
- Xu, X. Coupling mechanism of a GPCR and a heterotrimeric G protein during chemoattractant gradient sensing in Dictyostelium. Sci Signal. 3, 71-71 (2010).
- Xu, X., Meier-Schellersheim, M., Jiao, X., Nelson, L. E., Jin, T. Quantitative imaging of single live cells reveals spatiotemporal dynamics of multistep signaling events of chemoattractant gradient sensing in Dictyostelium. Mol Biol Cell. 16, ra71-ra71 (2005).
- Xu, X., Meier-Schellersheim, M., Yan, J., Jin, T. Locally controlled inhibitory mechanisms are involved in eukaryotic GPCR-mediated chemosensing. J. Cell Biol. 178, 141-141 (2007).
- Jin, T., Zhang, N., Long, Y., Parent, C. A., Devreotes, P. N. Localization of the G protein betagamma complex in living cells during chemotaxis. Science. 287, 1034-1034 (2000).
- Janetopoulos, C., Jin, T., Devreotes, P. Receptor-mediated activation of heterotrimeric G-proteins in living cells. Science. 291, 2408-2408 (2001).
- Funamoto, S., Milan, K., Meili, R., Firtel, R. A. Role of phosphatidylinositol 3' kinase and a downstream pleckstrin homology domain-containing protein in controlling chemotaxis in dictyostelium. J. Cell Biol. 153, 795-795 (2001).
- Li, Z. Roles of PLC-beta2 and -beta3 and PI3Kgamma in chemoattractant-mediated signal transduction. Science. 287, 1046-1046 (2000).
- Sasaki, A. T., Chun, C., Takeda, K., Firtel, R. A. Localized Ras signaling at the leading edge regulates PI3K, cell polarity, and directional cell movement. J. Cell Biol. 167, 505-505 (2004).
- Meili, R. Chemoattractant-mediated transient activation and membrane localization of Akt/PKB is required for efficient chemotaxis to cAMP in Dictyostelium. EMBO J. 18, 2092-2092 Forthcoming.
- Parent, C. A., Blacklock, B. J., Froehlich, W. M., Murphy, D. B., Devreotes, P. N. G protein signaling events are activated at the leading edge of chemotactic cells. Cell. 95, 81-81 (1998).
- Funamoto, S., Meili, R., Lee, S., Parry, L., Firtel, R. A. Spatial and temporal regulation of 3-phosphoinositides by PI 3-kinase and PTEN mediates chemotaxis. Cell. 109, 611-611 (2002).
- Iijima, M., Devreotes, P. Tumor suppressor PTEN mediates sensing of chemoattractant gradients. Cell. 109, 599-599 (2002).
- Haastert, P. J. V. an, Devreotes, P. N. Chemotaxis: signalling the way forward. Nat Rev Mol Cell Biol. 5, 626-626 (2004).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados