Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Récepteur d'imagerie couplés aux protéines G (RCPG) à médiation événements de signalisation qui contrôle chimiotactisme des Dictyostelium discoideum
Dans cet article
Résumé
Ici, nous décrivons les méthodes détaillées direct imagerie cellulaire pour enquêter sur le chimiotactisme. Nous présentons la fluorescence des méthodes microscopiques pour surveiller la dynamique spatio-temporelle des événements de signalisation dans les cellules en migration. Mesure des événements de signalisation nous permet de mieux comprendre comment un réseau de signalisation GPCR réalise gradient de détection et de contrôle des chimiotactiques migration directionnelle des cellules eucaryotes.
Résumé
Beaucoup de cellules eucaryotes peuvent détecter des gradients de signaux chimiques dans leur environnement et de migrer en conséquence 1. Cette migration cellulaire guidée est mentionné que le chimiotactisme, qui est essentiel pour différentes cellules pour mener à bien leurs fonctions telles que le trafic des cellules immunitaires et la structuration des cellules neuronales 2, 3. Une grande famille de G-récepteurs couplés aux protéines (RCPG) détecte la variable de petits peptides, connu sous le nom de chimiokines, de diriger la migration cellulaire in vivo 4. L'objectif final de chimiotactisme de recherche est de comprendre comment un gradient de chimiokine GPCR machines et des commandes de signalisation sens des événements menant à la chimiotaxie. À cette fin, nous utilisons des techniques d'imagerie pour suivre, en temps réel, les concentrations spatio-temporelle des mouvements chimiotactiques cellulaire, dans un gradient de chimiotactique, GPCR activation médiée par des protéines G hétérotrimériques, et les signaux intracellulaires impliqués dans le chimiotactisme des cellules eucaryotes 5-8 . L'organisme simple eucaryotes, Dictyostelium discoideum, affiche des comportements chemotaxic qui sont similaires à celles des leucocytes, et D. discoideum est un système modèle pour l'étude des principaux chimiotactisme eucaryotes. Comme amibes libres, D. discoideum cellules se divisent en milieu riche. Après la famine, les cellules entrer dans un programme de développement global dans lequel elles par le biais de l'AMPc à médiation chimiotactisme pour former des structures multicullular. De nombreux composants impliqués dans le chimiotactisme au camp ont été identifiés dans D. discoideum. La liaison de l'AMPc à un GPCR (CAR1) induit la dissociation des protéines G hétérotrimériques dans Gγ et 7 sous-unités Gßy, 9, 10. Sous-unités Gßy activer Ras, qui active à son tour la PI3K, la conversion PIP PIP 2 en 3 sur la membrane cellulaire de 11 à 13. PIP 3 servent de sites de liaison pour des protéines ayant une homologie avec pleckstrine (PH) domaines, recrutant ainsi ces protéines à la membrane 14, 15. L'activation des récepteurs CAR1 contrôle également les associations de la membrane de PTEN, qui déphosphoryle PIP PIP 3 à 2 16, 17. Les mécanismes moléculaires sont évolutivement conservées dans des chimiokines GPCR médiée par le chimiotactisme des cellules humaines telles que les neutrophiles 18. Nous présentons des méthodes suivantes pour étudier le chimiotactisme des D. cellules discoideum. 1. Préparation des cellules composant chimiotactiques. 2. Imagerie chimiotactisme des cellules dans un gradient d'AMPc. 3. Surveillance d'une activation induite des RCPG G hétérotrimériques protéines dans des cellules vivantes simples. 4. Imagerie chimioattractive déclenché PIP dynamique 3 réponses simples cellules vivantes en temps réel. Nos méthodes d'imagerie développée peut être appliquée à l'étude du chimiotactisme des leucocytes humains.
Protocole
1. Préparation du chimiotactisme des cellules compétentes de Dictyostelium discoideum
- Pour générer des cellules D. discoideum qui sont chimiotactiques au camp chimiotactique, la récolte des cellules de plus en plus D3-t rich media à partir d'une culture en agitant à 22 ° C.
- Laver les cellules deux fois en mémoire tampon non nutritifs développement (buffer DB contenant 5 mM Na 2 HPO 4, 5 mM KH 2 PO 4, MgCl2 2 mM, 0,1 mM CaCl et 2).
- Re-suspendre les cellules dans un tampon de DB à une densité de 2x10 7 cellules / ml.
- Agiter 10 ml de cellules dans un flacon de 250 ml à 100 rpm à 22 ° C pendant une heure.
- Livrer 100 ul de 7,5 uM AMPc stocks aux 10 cellules par ml toutes les six minutes de plus de 6 heures pour obtenir une concentration finale de 75 nM d'AMPc, un processus désigné comme le traitement de l'AMPc pulsation. Après 5-6 heures de traitement pulsation AMPc, D. cellules discoideum deviennent compétents chimiotactiques envers gradient d'AMPc.
- Recueillir les cellules par centrifugation à 200 g pendant 5 min puis remettre les cellules avec le tampon DB contenant 2,5 mM de caféine, et secouer à 200 rpm à 22 ° C pendant 20 min à basolate cellule à une situation chimiotactiques.
2. Imagerie cellules chemotaxing dans un gradient chimiotactique visible et manipulable
- Remblai d'une micropipette avec un fraîchement préparés solution à 30 pi de 1 uM AMPc et Alexa 594 au 0.1μg/μl dans le tampon de la DB.
- Fixez le Femtotip à un titulaire de micropipette et raccorder le tuyau à un appareil d'alimentation de pression, Eppendorf FemtoJet système.
- Fixez l'ensemble micropipette pour un micromanipulateur (Eppendorf TransferMan NK2) motorisé micromanipulateur pour fournir une pression constante en vue d'établir un gradient stable.
- Monter une chambre d'un bien LabTek rempli de 6 ml de tampon DB sur une lentille d'huile 40X sur un microscope confocal et l'utilisation brillante optique de champ, le centre Femtotip dans le champ de vision.
- Allumez l'alimentation de pression et régler la pression de compensation (PC) pour 70 hPa pour établir un gradient de l'AMPc / Alexa 594 mélange.
- Visualisez gradient d'AMPc par la surveillance du mélange de concentration souhaitée de l'AMPc et Alexa 594 fluorescence à l'aide d'excitation avec une ligne de 543 nm du laser.
- Utiliser l'auto-positionnement en fonction de la micromanipulateur pour mettre micropipette pour les positions souhaitées et de les définir comme la position 1, position 2, 3 et position de manipuler le gradient à laquelle la cellule sont exposés.
3. Immobile système cellulaire non polarisé facilite des événements de signalisation impliquées dans l'imagerie de l'AMPc gradient de détection
- Après le traitement de caféine, enlever une partie aliquote de cellules et centrifuger à 500 g pendant 3 min.
- Retirer du tampon et de diluer les cellules à 5x10 5 cellules / ml avec le tampon DB frais contenant 2,5 mM de caféine.
- Appliquer 1 ml de suspension cellulaire à une chambre simple bien ou 0,4 ml dans chaque puits d'une chambre de quatre puits.
- Laisser les cellules adhèrent pendant 10 min, soigneusement la pipette hors du tampon pour enlever les cellules seules et remplacer par le même volume.
- Repérez les cellules sous le microscope désirée et commencer l'imagerie.
- Pour une expérience conçue pour surveiller la dynamique de la signalisation dans les cellules composantes exposer à un gradient constant, de traiter les cellules avec 5,0 uM (concentration finale) Latrunculin B pendant 10 min avant les expériences.
4. Simultanée hétérotrimériques surveillance protéine G activation et la production PIP 3
- AMPc pulsation développer des cellules co-exprimant GαCFP et YFPGβ (cellules G) et des cellules exprimant le PIP 3 Indicateur PH-GFP (cellules PH) 7.
- Mélanger ces deux types de cellules avec un rapport 1:1 et plaque eux dans les chambres d'un bien ou 4-même.
- Créez et enregistrez des émissions de référence d'empreintes digitales courbe de CFP, YFP et la GFP en utilisant le mode d'acquisition Lambda Stack dans la gamme spectrale de 464 à 624 nm avec une largeur de 10 nm.
- Simultanément activation de la protéine G d'image dans les cellules G et 3 PIP production dans des cellules en utilisant PH avec mode Lambda Acquisition même pile dans la gamme spectrale de 464 à 544 nm avec un incrément de 10 nm.
- Appliquer la fonction linéaire de Déconvolution Zeiss 510META logiciels utilisant sauvé CFPand YFP et les empreintes digitales d'émission pour calculer mathématiquement la contribution de chaque fluorophore dans la pile lambda de se séparer de la PCP et de l'intensité YFP dans les canaux individuels dans G.
- Avec la même stratégie, appliquer la fonction linéaire Déconvolution utilisant la GFP et les empreintes digitales enregistrées des émissions de fond pour calculer mathématiquement l'intensité de GFP dans les cellules PH.
5. Les résultats représentatifs:
- Un excellent modèle de D. discoideum pour chimiotactisme GPCR médiation. Une amibe sociale, D. discoideum présente un chimiotactisme frappante durant le cycle de vie. En raison de ses avantages génétiques et biochimiques, D. D fournit une puissante système d'étudier le chimiotactisme.
- Chimiotactisme des cellules sous un champs visible et manipulable chemoattract. Ici, nous montrons d'abord une méthode simple pour obtenir une relation linéaire entre la concentration d'AMPc et l'intensité d'un colorant fluorescent Alexa 594 par une série de dilution de 2 uM AMPc mélangé avec 10 ug / ml Alexa 594 (figure 2A). Ensuite, nous offrent un moyen facile de visualiser la pente, en outre, d'établir une mesure quantitative de la concentration d'AMPc d'un gradient de l'intensité des Alexa 594 (fig. Fig. 2B).
- Motilité cellulaire est découplée de la polarisation cellulaire et la détection directionnelle. Un inhibiteur polymérisation de l'actine élimine pré-existantes de polarité morphologique et empêche également le mouvement des cellules tout en préservant la capacité des cellules de détection directionnel (figure 3A). Emploi de la stimulation de l'AMPc visible et manipulable garantit l'entrée, par exemple des stimulations appliquées uniformément ou avec un dégradé. Cette méthode permet une analyse quantitative de l'AMPc induite par la redistribution des principaux composants de signalisation dans les machines de détection de gradient. Mesuré dynamique spatio-temporelle de ces composants de signalisation nous permettent de comprendre comment le réseau de signalisation réalise l'adaptation aux stimulations uniforme tout en générant des réponses biochimiques polarisée aux gradients (figure 3B).
- Mesures systémiques de la cinétique des chemosensing réseau de signalisation à l'exposition à un gradient constant. Il est essentiel de mesurer la dynamique / cinétique de la signalisation directionnelle de détection de composantes de comprendre comment chaque élément contribue à l'établissement de la polarisation intracellulaire lorsque les cellules d'expérience du premier gradient. Application de l'imagerie de cellules vivantes avec un tempo-spatiale haute résolution, nous montrons d'abord une biphasique PIP3 production de cellule qui est exposée à un gradient d'AMPc stable (Fig. 4A-C). Application imagerie des cellules vivantes, nous avons systématiquement mesuré dynamique de direction à détection de réseau de signalisation spécifiques de la stimulation de la production d'AMPc d'PIP3 (Fig. 4D, E).
- Contrôle de l'activation simultanée des protéines G hétérotrimériques et PIP 3 lors de la stimulation de production d'AMPc appliquées uniformément. Förster énergie de résonance de transfert (en abrégé FRET) fournit une approche efficace pour contrôler l'activation des protéines G hétérotrimériques (dissociation) lors de la stimulation de l'AMPc. Ici, nous avons décrit une pratique et facile d'adopter le système pour une mesure simultanée de l'activation des protéines G hétérotrimériques et PIP 3 Production en surveillant le FRET changement et translocation membranaire de PIP 3 sonde, PH-GFP dans les cellules G et PH, respectivement (Fig. 5 ). Une stimulation de l'AMPc appliquée uniformément déclenche une activation de la protéine G persistante tout ce qui déclenche un PIP transitoires de production 3.
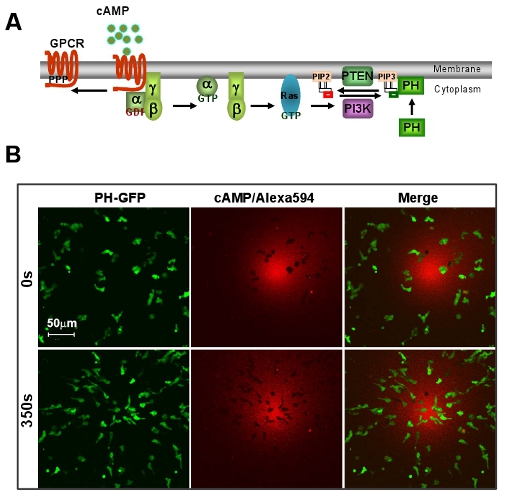
Figure 1: un excellent modèle de D. discoideum de la chimiotaxie médiée GPCR. A. Schéma montre une voie de signalisation de détection brève directionnelle. B. AMPc induit le chimiotactisme gradient rapide de D. cellules discoideum. Cellules expriment PIP 3 sonde, PH-GFP (Green). Dégradé (rouge) est visualisée par Alexa 594. Barre d'échelle = 50 microns.
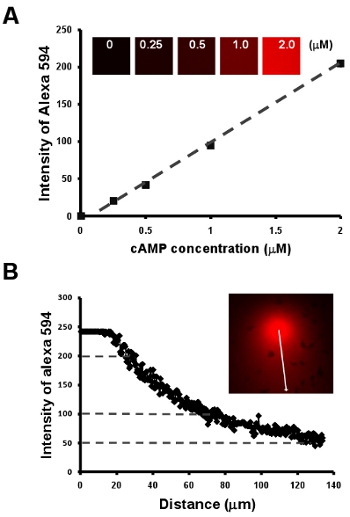
Figure 2: chimiotactisme des cellules sous un champs visible et manipulable chemoattract. A. Le graphique montre une relation linéaire entre la concentration d'AMPc et l'intensité d'un colorant fluorescent Alexa 594 par une série de dilution de 2 uM AMPc mélangé avec 10 ug / ml Alexa 594. B. La mesure quantitative de la concentration d'AMPc d'un gradient par la relation linéaire de la concentration de l'AMPc et l'intensité des colorant fluorescent Alexa 594 dans A.

Figure 3: la motilité cellulaire est découplée de la polarisation cellulaire et la détection directionnelle. A. Image montre que les cellules immobile par le traitement de l'inhibiteur de la polymérisation de l'actine Latrunculin B maintenir la capacité de détection directionnel. Cellules expriment PIP 3 sonde, PH-GFP (Green). Dégradé (rouge) est visualisée par Alexa 594. B. AMPc cellulaire manipulable système de stimulation et immobile permet de répondre aux questions clés de la détection directionnelle. Barre d'échelle = 10 microns.

Figure 4: mesures systémiques de la cinétique des chemosensing réseau de signalisation à l'exposition à un gradient constant. A. Montage montre un PIP biphasique de production 3 (verte) de la cellule qui est exposée à un gradient d'AMPc constante (rouge). B. image montre les régions d'intérêt (ROI) pour la mesure de la cinétique de PIP 3 de production présentées dans C. C . Kinetics oPIP F 3 la production dans les cellules exposées à un gradient constant. D. schéma montre le réseau de signalisation de détection directionnelle de la stimulation de l'AMPc à la PIP 3 de la production. Leur cinétique après exposition à un gradient d'équilibre est présenté dans les lignes de même couleur solide dans E.

Figure 5: simultanée de surveillance multi-événements des réseaux de signalisation des RCPG. Schéma A. montre la mesure simultanée de l'activation des protéines G hétérotrimériques et PIP 3 Production en surveillant le FRET changement et la translocation membranaire des PIP3 sonde, PH-GFP dans les cellules G et PH, respectivement. B. Montage d'images d'arc-en-G et les cellules PH montre qu'une stimulation de l'AMPc appliquée uniformément déclenche une activation de la protéine G persistante à la cellule périphérique, tout ce qui déclenche une passagère PIP3 production. Les points de temps sont avant (0s) et après stimulation par 4.9s, 10.2s et 20.4s. C. Cinétique de l'activation des protéines G et PIP3 production sur une stimulation de l'AMPc appliquées uniformément.
Discussion
Le processus d'atteindre l'étape chimiotactiques compétentes des cellules
Pour type sauvage D. cellules discoideum, il faut environ 5 ~ 6 heures pulsation de développement à la température ambiante pour les inciter à une étape bien chimiotactiques compétents au cours de laquelle les cellules présentent une morphologie bien polarisée cellulaire et la migration cellulaire rapide (Fig. 1). Plusieurs facteurs, tels que la concentration d'AMPc d'impulsions...
Déclarations de divulgation
Aucun conflit d'intérêt déclaré.
Remerciements
Ce travail est soutenu par le fonds intra-muros du NIAID, NIH.
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Société | Numéro de catalogue | Commentaires |
|---|---|---|---|
| Médias croissance D3-T | KD médicale | ||
| La caféine | Sigma | ||
| Latrunculin B | Molecular Probes | ||
| Alexa 594 | Molecular Probes | ||
| AMPc | Sigma | ||
| ChronTrol XT minuterie programmable | ChronTrol Corp | ||
| Miniplus 3 pompe péristaltique | Gilbson | ||
| Platform agitateur rotatif | |||
| Approvisionnement FemtoJet pression microcapillaire | Eppendorf | ||
| Simple et quatre ainsi Lab-Tek II lamelle chambres | Nalge Nunc International | ||
| LSM 510 META ou équivalent microscope à fluorescence | Zeiss | une 40X 60X 1,3 NA ou NA 1.4 du pétrole lentilles DIC objectif du Plan-Neofluar | |
| Olympus X81 ou équivalent | Olympus | Nécessite un 100X 1,47 NA TIRF lentille d'objectif |
Références
- Lijima, M., Huang, Y. E., Devreotes, P. Temporal and spatial regulation of chemotaxis. Dev Cell. 3, 469-469 (2002).
- Murphy, P. M. The molecular biology of leukocyte chemoattractant receptors. Annu Rev Immunol. 12, 593-593 (1994).
- Devreotes, P. N. G protein-linked signaling pathways control the developmental program of Dictyostelium. Neuron. 12, 235-235 (1994).
- Jin, T., Xu, X., Hereld, D. Chemotaxis, chemokine receptors and human disease. Cytokine. 44, 1-1 (2008).
- Meier-Schellersheim, M. Key role of local regulation in chemosensing revealed by a new molecular interaction-based modeling method. PLoS Comput Biol. 2, e82-e82 (2006).
- Xu, X. Coupling mechanism of a GPCR and a heterotrimeric G protein during chemoattractant gradient sensing in Dictyostelium. Sci Signal. 3, 71-71 (2010).
- Xu, X., Meier-Schellersheim, M., Jiao, X., Nelson, L. E., Jin, T. Quantitative imaging of single live cells reveals spatiotemporal dynamics of multistep signaling events of chemoattractant gradient sensing in Dictyostelium. Mol Biol Cell. 16, ra71-ra71 (2005).
- Xu, X., Meier-Schellersheim, M., Yan, J., Jin, T. Locally controlled inhibitory mechanisms are involved in eukaryotic GPCR-mediated chemosensing. J. Cell Biol. 178, 141-141 (2007).
- Jin, T., Zhang, N., Long, Y., Parent, C. A., Devreotes, P. N. Localization of the G protein betagamma complex in living cells during chemotaxis. Science. 287, 1034-1034 (2000).
- Janetopoulos, C., Jin, T., Devreotes, P. Receptor-mediated activation of heterotrimeric G-proteins in living cells. Science. 291, 2408-2408 (2001).
- Funamoto, S., Milan, K., Meili, R., Firtel, R. A. Role of phosphatidylinositol 3' kinase and a downstream pleckstrin homology domain-containing protein in controlling chemotaxis in dictyostelium. J. Cell Biol. 153, 795-795 (2001).
- Li, Z. Roles of PLC-beta2 and -beta3 and PI3Kgamma in chemoattractant-mediated signal transduction. Science. 287, 1046-1046 (2000).
- Sasaki, A. T., Chun, C., Takeda, K., Firtel, R. A. Localized Ras signaling at the leading edge regulates PI3K, cell polarity, and directional cell movement. J. Cell Biol. 167, 505-505 (2004).
- Meili, R. Chemoattractant-mediated transient activation and membrane localization of Akt/PKB is required for efficient chemotaxis to cAMP in Dictyostelium. EMBO J. 18, 2092-2092 .
- Parent, C. A., Blacklock, B. J., Froehlich, W. M., Murphy, D. B., Devreotes, P. N. G protein signaling events are activated at the leading edge of chemotactic cells. Cell. 95, 81-81 (1998).
- Funamoto, S., Meili, R., Lee, S., Parry, L., Firtel, R. A. Spatial and temporal regulation of 3-phosphoinositides by PI 3-kinase and PTEN mediates chemotaxis. Cell. 109, 611-611 (2002).
- Iijima, M., Devreotes, P. Tumor suppressor PTEN mediates sensing of chemoattractant gradients. Cell. 109, 599-599 (2002).
- Haastert, P. J. V. a. n., Devreotes, P. N. Chemotaxis: signalling the way forward. Nat Rev Mol Cell Biol. 5, 626-626 (2004).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon