このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
イメージングG -タンパク質共役受容体(GPCR)を介するシグナル伝達事象その制御走キイロタマホコリカビ
要約
ここでは、走化性を調査するための詳細な生細胞イメージングの方法を説明します。我々は、遊走細胞のシグナル伝達事象の時空間ダイナミクスを監視するために蛍光顕微鏡の方法を提示する。シグナル伝達イベントの測定は、私たちはさらにGPCRシグナリングネットワークは真核細胞の化学誘引物質とコントロールの方向マイグレーションの勾配のセンシングを実現する方法を理解することが可能。
要約
多くの真核細胞は、その環境での化学信号の勾配を検出し、それに応じて1を移行することができます。このガイド付きの細胞遊走は、免疫細胞や神経細胞2、3のパターニングの人身売買など、その機能を遂行するために様々な細胞に不可欠な走化性、と呼ばれます。 G -タンパク質共役受容体(GPCR)の大家族は、in vivoで 4 の細胞移動を指示するために、ケモカインとして知られている変数の小さなペプチドを、検出する。走化性研究の最終目標は、GPCRの機械感覚のケモカインの勾配とコントロールが走化性につながるイベントを通知する方法を理解することです。この目的のために、我々は、リアルタイムで、化学誘引物質の勾配に誘引物質、細胞運動の時空間濃度を監視するためのイメージング技術を使って、GPCRは三量体G -タンパク質の活性化を仲介し、5月8日真核細胞の走化性に関与する細胞内シグナル伝達イベント。単純な真核生物、 キイロタマホコリカビは 、白血球のに似ているchemotaxic動作を表示し、D.カビは真核生物の化学走性を研究するための重要なモデル系である。自由生活アメーバ、D.などdiscoideumの細胞が豊富な培地で割ります。飢餓時には、細胞は、multicullular構造を形成するためにcAMPを介した走化性を介して集約した発生プログラムを入力してください。 cAMPに走化性に関与する多くのコンポーネントは、Dで確認されているカビ 。 GPCR(CAR1)へのcAMPの結合はGγとGβγサブユニット7、9、10にヘテロ三量体G -タンパク質の解離を誘導する。 Gβγサブユニットは、順番に細胞膜11-13 PIP 3にPIP 2を変換し、PI3Kを活性化Rasを活性化する。 PIP 3はこのように膜14、15にこれらのタンパク質を募集し、プレクストリン相同(PH)ドメインを持つタンパク質の結合部位として機能する。 CAR1受容体の活性化はまた、PIP 2 16、17にPIP 3を脱リン酸化PTEN、の膜の関連付けを制御します。分子メカニズムは、進化的にそのような好中球18のようなヒト細胞のケモカインGPCRを介した走化性で保存されている。我々は、D.の走化性を研究するための次の方法を提示discoideumの細胞 。 1。走化性成分の細胞の調製。 2。 cAMPの勾配における細胞のイメージングは、走化性。 3。単一の生細胞におけるGタンパク質ヘテロのGPCR誘導活性を監視する。 4。リアルタイムで単一の生細胞のイメージングは、化学誘引物質トリガダイナミックPIP 3の応答。私たちの開発した撮像法は、ヒト白血球の走化性を研究するために適用することができます。
プロトコル
1。 キイロタマホコリカビの走コンピテントセルの調製
- 化学誘引物質cAMPに走ているD. discoideumの細胞、22で振とう培養からD3 - Tリッチメディアに成長して収穫の細胞を生成するには℃、
- (DBバッファは5mMのNa 2 HPO 4、5mMのKH 2 PO 4、2mMのMgCl 2、及び0.1mMのCaCl 2を含む)非栄養発達バッファーで細胞を2回洗浄する。
- 2 × 10 7細胞/ mlの密度でDBのバッファーで細胞を再懸濁する。
- 一時間では22で100回転℃で250mlのフラスコに10ミリリットルのセルを横に振る。
- 75 nMのcAMPの最終濃度、cAMPの脈打つ治療として指定されたプロセスを達成するために6時間以上6分毎に10ミリリットルの細胞を7.5μMのcAMPの株式の100μlを提供します。 cAMPのパルスの治療、D.の5-6時間後にdiscoideumの細胞は、cAMPの勾配に向かって有能な走化性となる。
- 5分の200 gで遠心分離により細胞を収集し、DBバッファと再懸濁し、細胞は、2.5 mMのカフェインを含む、22で200 rpmで振とう℃で20分間走の状況にセルをbasolateする。
2。イメージングが表示され、操作可能な化学誘引物質の勾配で細胞をchemotaxing
- 埋め戻しDBのバッファー中で1μMのcAMPおよび0.1μg/μlでアレクサ594、新たに調製した30μlの溶液によるマイクロピペット。
- マイクロピペットホルダーにFemtotipを取り付け、圧力供給装置、エッペンドルフFemtoJetシステムにチューブを接続します。
- 安定勾配を確立するために、安定した圧力を提供するために、マイクロマニピュレーターを電動マイクロマニピュレータ(エッペンドルフTransferMan NK2)にマイクロピペットのアセンブリを取り付けます。
- 共焦点顕微鏡で40倍の油レンズを介してDBバッファー6mlを充填した1ウェルLabTekチャンバーをマウントし、明視野光学系を使用して、中心視野にFemtotip。
- 圧力を投入し、cAMPを/アレクサ594混合物の勾配を確立するために70 hPaのための補償の圧力(PC)を設定します。
- 543 nmのレーザラインで励起を用いてcAMPおよびアレクサ594蛍光の所望の濃度の混合物を監視することでのcAMPの勾配を可視化する。
- セルにさらされている勾配を操作するために、目的の位置にマイクロピペットを置くと位置1、位置2のようにそれらを設定するには、マイクロマニピュレータの自動位置決め機能を使用して、ポジション3。
3。不動の非極性細胞システムは、cAMP勾配感知に関与してイベントをシグナル伝達のイメージングを容易に
- カフェイン処理した後、3分間500グラムで細胞と遠心のアリコートを削除します。
- バッファを削除し、2.5mMのカフェインを含む新鮮なDB用緩衝液で5 × 10 5細胞/ mlに細胞を希釈する。
- 四ウェルチャンバーの各ウェルに単一のウェルチャンバーに細胞懸濁液の1 mlあるいは0.4 mlを適用します。
- 10分間、注意深くアタッチされていないセルを削除し、同じボリュームに置き換えるためのバッファをオフにピペッティング細胞が付着することができます。
- 顕微鏡下で所望の細胞を見つけて、イメージングを起動します。
- 安定した勾配にさらす細胞におけるシグナル伝達成分の動態を監視するために設計された実験では、実験前に10分は、5.0μM(最終濃度)Latrunculin Bで細胞を扱う。
4。同時モニタリングのヘテロ三量体Gタンパク質活性化およびPIP 3生産
- 細胞を共発現GαCFPとYFPGβ(G細胞)とPIP 3インジケータPH - GFP(PH細胞)7を発現する細胞を開発する。パルス状のcAMP
- 1:1の比率とプレートそれらを一つウェルまたは4ウェルチャンバー内での細胞のこれらの2つのタイプを混在させること。
- CFP、YFPとGFPが10nm幅の464から624 nmの波長範囲内のラムダスタックアクイジションモードを使用して排出指紋の基準曲線を作成して保存します。
- 同時にG細胞内の画像Gタンパク質の活性化と10 nm刻みで464から544 nmの波長範囲内で同一のラムダスタックアクイジションモードで使用してPH細胞におけるPIP 3生産。
- G.における個々のチャネルにCFPとYFPの強度を分離するために数学的にラムダのスタック内の各蛍光体の寄与を計算するために保存CFPand YFPと放出された指紋を使用してツァイス510METAソフトウェアの線形アンミキシング機能を適用する
- 同戦略では、数学的にPHの細胞でGFPの強度を計算するために保存されているGFPと背景放射の指紋を使用して線形アンミキシング機能を適用します。
5。代表的な結果:
- D.の優れたモデルシステムGPCRを介した走化性のためのカビ 。ソーシャルアメーバ、D. discoideumのは、ライフサイクルの間に顕著な走化性を示す。その遺伝的および生化学的な利点のために、D. dは強力なのが用意されています走化性を研究するystem。
- 目に見えると操作可能な化学的に誘引するフィールドの下で細胞の走化性。ここでは、我々は最初の10μg/ mLのと混合2μMのcAMPの希釈系列によるcAMPの濃度と蛍光染料アレクサ594強の間に直線関係を得るために、単純な方法論を示すアレクサ594(図2A)。次に、我々はAlexa 594(図図2B)の強度が勾配のcAMP濃度の定量測定を確立するために、また、勾配を可視化する簡単な方法を提供しています。
- 細胞運動は細胞の極性と方向感知と非結合されています。アクチンの重合阻害剤は既存の形態学的極性を排除し、方向感知の細胞の機能(図3A)を維持しながらも、細胞の動きを防ぐことができます。目に見えると操作可能な cAMP刺激の雇用は、入力、たとえば、一律に適用される刺激や勾配を保証します。このメソッドは、グラデーション感知機械の重要なシグナル伝達成分のcAMP誘発性再分布の定量的な分析を行うことができます。これらのシグナル伝達成分の測定時空間ダイナミクスは、私たちは勾配(図3B)に偏光生化学的応答の生成中にシグナル伝達ネットワークが均一な刺激への適応を実現する方法を理解することができます。
- 安定した勾配に曝されるとシグナル伝達ネットワークを化学的感覚の動態の全身測定。これは、細胞は最初のグラデーションを経験するときに細胞内の偏光の設立に各成分が寄与する方法を理解するためにコンポーネントに信号を送る方向を感知するの力学/動力学を測定することが重要です。ハイテンポ-空間分解能でのライブセルイメージングのアプリケーションは、まず安定したcAMPの勾配(図4A - C)にさらされているセルの相性PIP3産生を示す。生細胞イメージングを適用して、体系的にcAMP刺激によるPIP3産生(図4D、E)への方向を感知する特異的シグナル伝達ネットワークのダイナミクスを測定した。
- 一様に適用されるcAMP刺激時に 同時モニタリングヘテロ三量体Gタンパク質活性化およびPIP 3生産。フェルスター共鳴エネルギー移動(省略形はFRET)のcAMP刺激によりヘテロ三量体Gタンパク質の活性化(解離)を監視するための効率的なアプローチを提供します。ここで、我々は、FRETが変化し、それぞれPIP 3プローブ、GとPHの細胞内PH - GFP、(図5の膜輸送を監視することにより、ヘテロ三量体Gタンパク質活性化およびPIP 3生産の同時測定のために便利な簡単な導入システムを説明)。これは一時的なPIP 3の生産をトリガしながら均一に適用されるcAMP刺激は、永続的なGタンパク質の活性化をトリガーします。
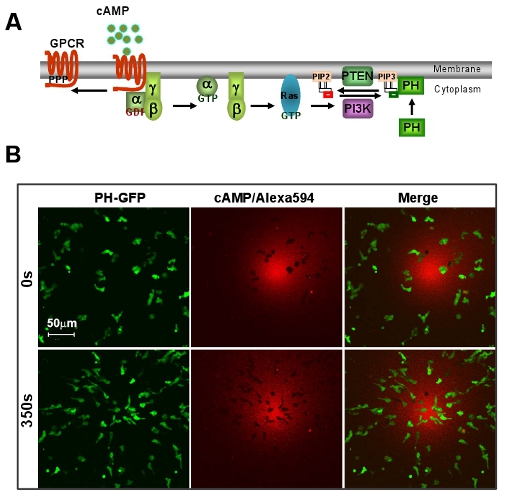
図1:D.の優れたモデルシステムGPCRを介した走化性のためのカビ 。 A.スキームは、方向感知の簡単なシグナル伝達経路を示しています。B. cAMPの勾配は、D.の急速な走化性を誘導するdiscoideumの細胞 。細胞は、PIP 3プローブ、PH - GFP(緑)を発現。グラデーション(赤)がアレクサ594で可視化。スケールバー=50μmの。
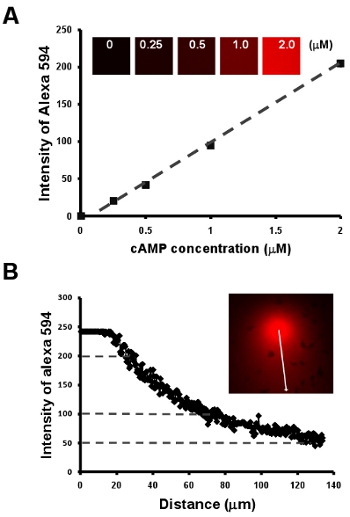
図2:目に見えると操作可能な化学的に誘引するフィールドの下で細胞の走化。 A.グラフは、10μg/ mLのアレクサ594と混合2μMのcAMPの希釈系列によるcAMPの濃度と蛍光染料アレクサ594強の間に直線関係を示しています。線形関係で勾配のcAMP濃度のB.定量的測定は、 Aの蛍光色素アレクサ594 cAMP濃度と強度の

図3:細胞運動は細胞の極性と方向感知と切り離されている。 A.イメージは、アクチン重合阻害剤Latrunculin Bの治療によって不動の細胞が方向感知の能力を維持することを示しています。細胞は、PIP 3プローブ、PH - GFP(緑)を発現。グラデーション(赤)がアレクサ594で可視化される。B.操作可能なcAMP刺激や不動電池システムは、方向感知の重要な問題に対処することができます。スケールバー=10μmの。

図4:安定した勾配に曝されるとシグナル伝達ネットワークを化学的感覚の動態の全身測定。 A.モンタージュは、安定したcAMPの勾配(レッド)にさらされているセルの相性のPIP 3生産(グリーン)。B.画像がC. Cで提示さPIP 3生産の動態の測定のための利益の領域(ROI)を、それぞれ示す。キネティクスO安定した勾配に曝露した細胞におけるfのPIP 3生産。D.スキームでは、PIP 3生産へのcAMPの刺激から方向センシングのシグナル伝達ネットワークを示します。安定した勾配に曝されると、その反応速度はEで同じ色の実線で表示されます。

図5:GPCRシグナル伝達ネットワークの同時監視、マルチイベント。 A.スキームはそれぞれ、変更およびPIP3プローブ、GとPHの細胞内PH - GFPの細胞膜の転座をFRETが。Gの虹のイメージとPHの細胞のショーのB.モンタージュ監視することにより、ヘテロ三量体Gタンパク質活性化およびPIP 3生産の同時測定を示しています。これは一時的なPIP3産生をトリガしながら均一に適用されるcAMP刺激は、末梢細胞での永続的なGタンパク質の活性化をトリガーすること。タイムポイントは、4.9s、10.2sと20.4sのために前に(0)と刺激後です。Gタンパク質の活性化と一様に適用されるcAMPの刺激によりPIP3産のC.速度論は。
ディスカッション
細胞の走化性有能な段階に到達するプロセス
野生型のためのD. discoideumの細胞 、それは細胞がうまく偏光細胞形態と迅速な細胞の遊走(図1)が表示される間も、走化性有能な段階にそれらを誘導するために、室温で開発をパルス〜5約6時間かかります。このようなcAMPのパルスの濃度、温度、および異なる遺伝的背景など、いくつかの要因は、走化性有能なステージに...
開示事項
利害の衝突は宣言されません。
謝辞
この作品は、NIAID、NIHから学内資金でサポートされています。
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名前 | 会社 | カタログ番号 | コメント |
|---|---|---|---|
| D3 - Tの増殖培地 | KDメディカル | ||
| カフェイン | シグマ | ||
| Latrunculin B | 分子プローブ | ||
| アレクサ594 | 分子プローブ | ||
| cAMPの | シグマ | ||
| ChronTrol XTプログラマブルタイマ | ChronTrolコーポレーション | ||
| Miniplus 3蠕動ポンプ | Gilbson | ||
| プラットフォームロータリーシェーカー | |||
| FemtoJetマイクロキャピラリー圧力供給 | エッペンドルフ | ||
| シングル四ウェルのLab - Tek社IIカバーガラスチャンバー | Nalgeヌンクインターナショナル | ||
| LSM 510 METAまたは同等の蛍光顕微鏡 | ツァイス | 40X 1.3 NAまたは60X 1.4 NA油DICプラン- Neofluarの対物レンズ | |
| オリンパスX81または同等の | オリンポス | 100X 1.47 NA TIRF対物レンズが必要です。 |
参考文献
- Lijima, M., Huang, Y. E., Devreotes, P. Temporal and spatial regulation of chemotaxis. Dev Cell. 3, 469-469 (2002).
- Murphy, P. M. The molecular biology of leukocyte chemoattractant receptors. Annu Rev Immunol. 12, 593-593 (1994).
- Devreotes, P. N. G protein-linked signaling pathways control the developmental program of Dictyostelium. Neuron. 12, 235-235 (1994).
- Jin, T., Xu, X., Hereld, D. Chemotaxis, chemokine receptors and human disease. Cytokine. 44, 1-1 (2008).
- Meier-Schellersheim, M. Key role of local regulation in chemosensing revealed by a new molecular interaction-based modeling method. PLoS Comput Biol. 2, e82-e82 (2006).
- Xu, X. Coupling mechanism of a GPCR and a heterotrimeric G protein during chemoattractant gradient sensing in Dictyostelium. Sci Signal. 3, 71-71 (2010).
- Xu, X., Meier-Schellersheim, M., Jiao, X., Nelson, L. E., Jin, T. Quantitative imaging of single live cells reveals spatiotemporal dynamics of multistep signaling events of chemoattractant gradient sensing in Dictyostelium. Mol Biol Cell. 16, ra71-ra71 (2005).
- Xu, X., Meier-Schellersheim, M., Yan, J., Jin, T. Locally controlled inhibitory mechanisms are involved in eukaryotic GPCR-mediated chemosensing. J. Cell Biol. 178, 141-141 (2007).
- Jin, T., Zhang, N., Long, Y., Parent, C. A., Devreotes, P. N. Localization of the G protein betagamma complex in living cells during chemotaxis. Science. 287, 1034-1034 (2000).
- Janetopoulos, C., Jin, T., Devreotes, P. Receptor-mediated activation of heterotrimeric G-proteins in living cells. Science. 291, 2408-2408 (2001).
- Funamoto, S., Milan, K., Meili, R., Firtel, R. A. Role of phosphatidylinositol 3' kinase and a downstream pleckstrin homology domain-containing protein in controlling chemotaxis in dictyostelium. J. Cell Biol. 153, 795-795 (2001).
- Li, Z. Roles of PLC-beta2 and -beta3 and PI3Kgamma in chemoattractant-mediated signal transduction. Science. 287, 1046-1046 (2000).
- Sasaki, A. T., Chun, C., Takeda, K., Firtel, R. A. Localized Ras signaling at the leading edge regulates PI3K, cell polarity, and directional cell movement. J. Cell Biol. 167, 505-505 (2004).
- Meili, R. Chemoattractant-mediated transient activation and membrane localization of Akt/PKB is required for efficient chemotaxis to cAMP in Dictyostelium. EMBO J. 18, 2092-2092 .
- Parent, C. A., Blacklock, B. J., Froehlich, W. M., Murphy, D. B., Devreotes, P. N. G protein signaling events are activated at the leading edge of chemotactic cells. Cell. 95, 81-81 (1998).
- Funamoto, S., Meili, R., Lee, S., Parry, L., Firtel, R. A. Spatial and temporal regulation of 3-phosphoinositides by PI 3-kinase and PTEN mediates chemotaxis. Cell. 109, 611-611 (2002).
- Iijima, M., Devreotes, P. Tumor suppressor PTEN mediates sensing of chemoattractant gradients. Cell. 109, 599-599 (2002).
- Haastert, P. J. V. a. n., Devreotes, P. N. Chemotaxis: signalling the way forward. Nat Rev Mol Cell Biol. 5, 626-626 (2004).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved