Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Imaging G-Protein-gekoppelten Rezeptor (GPCR)-vermittelten Signaltransduktion, die Steuerung der Chemotaxis Dictyostelium discoideum
In diesem Artikel
Zusammenfassung
Hier beschreiben wir detailliert Live Cell Imaging Verfahren zur Untersuchung Chemotaxis. Wir präsentieren fluoreszenzmikroskopische Methoden zur raum-zeitlichen Dynamik der Signalwege bei der Migration von Zellen zu überwachen. Die Messung der Signal-Ereignisse ermöglicht es uns, besser zu verstehen, wie ein GPCR-Signalisierung Netzwerk Gradienten Erfassung Lockstoffe und steuert direktionale Migration von eukaryotischen Zellen erreicht.
Zusammenfassung
Viele eukaryotischen Zellen können Steigungen von chemischen Signalen in ihrer Umgebung erkennen und wandern entsprechend 1. Diese geführte Zellmigration als Chemotaxis, die wesentlich für verschiedene Zellen zur Erfüllung ihrer Funktionen wie Handel von Immunzellen und Strukturierung von neuronalen Zellen 2, 3 bezeichnet wird. Eine große Familie von G-Protein-gekoppelte Rezeptoren (GPCRs) erkennt variable kleine Peptide, wie Chemokine bekannt, die Zellmigration in vivo 4 Direktwahltasten. Das Endziel der Chemotaxis Forschung ist zu verstehen, wie ein GPCR Maschinen Sinne Chemokin-Gradienten und steuert Ereignisse, die zu Chemotaxis-Signalisierung. Zu diesem Zweck haben wir bildgebende Techniken verwenden, um zu überwachen, in Echtzeit, räumlich-zeitliche Konzentrationen von Lockstoffen, Zellbewegung in einem Gefälle von Lockstoff, vermittelt GPCR Aktivierung heterotrimerer G-Protein-und intrazellulären Signalwege in Chemotaxis von eukaryotischen Zellen 5-8 beteiligt . Die einfache eukaryotischen Organismus, Dictyostelium discoideum, zeigt chemotaxic Verhaltensweisen, die ähnlich denen der Leukozyten, und D. discoideum ist ein wichtiges Modellsystem für die Untersuchung eukaryotischer Chemotaxis. Wie frei lebenden Amöben, D. discoideum Zellen teilen in Vollmedium. Bei Hunger, in die Zellen eine Entwicklungsstörung Programm, in dem sie durch cAMP-vermittelte Chemotaxis Aggregat multicullular Strukturen zu bilden. Viele Komponenten in Chemotaxis auf cAMP beteiligt haben in D. identifiziert discoideum. Die Bindung von cAMP an einem GPCR (car1) induziert Dissoziation heterotrimerer G-Proteine in Gγ und Gβγ-Untereinheiten 7, 9, 10. Gβγ-Untereinheiten aktivieren Ras, was wiederum aktiviert PI3K, Konvertieren PIP 2 in PIP 3 auf der Zellmembran 11-13. PIP 3 dienen als Bindungsstellen für Proteine mit Pleckstrin Homologie (PH)-Domänen, wodurch Rekrutierung dieser Proteine auf die Membran 14, 15. Die Aktivierung der Rezeptoren car1 steuert auch die Membran Verbände der PTEN, die PIP 3 dephosphoryliert PIP 2 16, 17. Die molekularen Mechanismen sind evolutionär in Chemokin GPCR-vermittelte Chemotaxis von humanen Zellen wie Neutrophile 18 erhalten. Wir präsentieren folgende Methoden zur Untersuchung von Chemotaxis von D. discoideum Zellen. 1. Vorbereitung der chemotaktische Komponente Zellen. 2. Imaging Chemotaxis von Zellen in einem cAMP-Gradienten. 3. Überwachung eines GPCR induzierte Aktivierung von heterotrimeren G-Protein in einzelnen lebenden Zellen. 4. Imaging chemoattractant ausgelösten dynamischen PIP 3 Antworten in einzelnen lebenden Zellen in Echtzeit. Unsere entwickelten bildgebenden Verfahren angewendet, um Chemotaxis von humanen Leukozyten zu studieren.
Protokoll
1. Vorbereitung der chemotaktischen kompetente Zellen von Dictyostelium discoideum
- Zur Erzeugung von D. discoideum-Zellen, die chemotaktisch auf die chemoattractant cAMP, Ernte wachsenden Zellen in D3-T Rich-Media aus einer Schüttelkultur bei 22 ° C sind
- Waschen Sie die Zellen zweimal in non-Nährstoff-Entwicklungs-Puffer (DB-Puffer mit 5 mM Na 2 HPO 4, 5 mM KH 2 PO 4, 2 mM MgCl 2 und 0,1 mM CaCl 2).
- Re-suspend-Zellen in DB-Puffer bei einer Dichte von 2x10 7 Zellen / ml.
- Schütteln 10 ml Zellen in einem 250 ml-Kolben bei 100 rpm bei 22 ° C für eine Stunde.
- Deliver 100 ul von 7,5 pM cAMP Lager an die 10 ml Zellen alle sechs Minuten über 6 Stunden bis zu einer Endkonzentration von 75 nM cAMP, ein Verfahren, wie cAMP pulsierende Behandlung bezeichnet erreichen. Nach 5-6 Stunden cAMP pulsierende Behandlung, D. discoideum Zellen werden chemotaktisch zuständige gegenüber cAMP-Gradienten.
- Sammeln Sie die Zellen durch Zentrifugation bei 200 g für 5 min und dann die Zellen mit DB-Puffer mit 2,5 mM Koffein, und schütteln mit 200 UpM bei 22 ° C für 20 min zu Zelle zu einer chemotaktischen Situation basolate.
2. Imaging chemotaxing Zellen in eine sichtbare und manipulierbare Lockstoff-Gradienten
- Backfill einer Mikropipette mit einem frisch zubereiteten 30 ul Lösung von 1 nM cAMP und Alexa 594 bei 0.1μg/μl in DB-Puffer.
- Bringen Sie die Femtotip zu einer Mikropipette Inhaber und verbinden Sie den Schlauch mit einer Druckversorgung Apparat, Eppendorf FemtoJet System.
- Bringen Sie die Mikropipette Montage an einem Mikromanipulator (Eppendorf TransferMan NK2) motorisierten Mikromanipulator zu einem stetigen Druck bereitzustellen, um eine stabile Gradienten zu etablieren.
- Montieren Sie einen Ein-und LabTek Kammer mit 6 ml DB-Puffer über einen 40x Öl Objektiv gefüllt auf einem konfokalen Mikroskop und verwenden Hellfeld-Optik, in der Mitte der Femtotip in das Blickfeld.
- Schalten Sie die Druckluftversorgung und stellen Sie die Entschädigung Druck (Pc) für 70 hPa auf einen Gradienten des cAMP / Alexa 594-Gemisch herzustellen.
- Visualisieren cAMP-Gradienten durch die Überwachung der Mischung der gewünschten Konzentration von cAMP und Alexa 594-Fluoreszenz unter Anregung mit 543 nm Laserlinie.
- Verwenden Sie auto-Positionierung der Mikromanipulator zu Mikropipette in die gewünschte Position bringen und sie als Position 1, Position 2 und Position 3 auf den Verlauf, um die Zelle ausgesetzt sind, zu manipulieren.
3. Immobile nicht polarisierten Zelle System erleichtert die Bildgebung Signalwege in cAMP Gradienten Sensing beteiligt
- Nach Coffein-Behandlung, entfernen Sie ein Aliquot von Zellen und Zentrifuge bei 500g für 3 min.
- Remove-Puffer und verdünnten Zellen auf 5x10 5 Zellen / ml mit frischem DB-Puffer mit 2,5 mM Koffein.
- Es wird 1 ml der Zellsuspension auf eine Single-well Kammer oder 0,4 ml in jede Vertiefung eines Vier-well Kammer.
- Lassen Zellen haften für 10 min, sorgfältig Pipette aus dem Puffer zu losen Zellen zu entfernen und ersetzen mit dem gleichen Volumen.
- Suchen Sie die gewünschten Zellen unter dem Mikroskop und starten Bildgebung.
- Für ein Experiment entworfen, um die Dynamik der Signalkomponenten in die Zellen ausgesetzt, um eine stetige Steigung Überwachung, Behandlung der Zellen mit 5,0 nM (Endkonzentration) Latrunculin B für 10 min vor den Experimenten.
4. Gleichzeitige Überwachung heterotrimeren G-Protein-Aktivierung und PIP 3-Produktion
- cAMP pulsierende entwickeln Zellen co-exprimierenden GαCFP und YFPGβ (G-Zellen) und Zellen, PIP 3 Indikator PH-GFP (PH-Zellen) 7.
- Diese beiden Arten von Zellen, die mit 1:1-Verhältnis und die Platte sie in einem Brunnen oder 4-Well Kammern.
- Erstellen und speichern Sie die Emission Fingerabdruck Referenzkurve CFP, YFP und GFP mit Lambda Stack Acquisition mode im Spektralbereich von 464 bis 624 nm mit 10 nm Breite.
- Gleichzeitig Bild G-Protein-Aktivierung in G-Zellen und PIP 3-Produktion in PH-Zellen mit mit gleichem Lambda Stack Acquisition mode im Spektralbereich von 464 bis 544 nm mit einer 10 nm-Schritten.
- Bewerben Linear Unmixing Funktion Zeiss 510META Software mit gespeicherten CFPand YFP-und Emissionswerte Fingerabdrücke mathematisch berechnen den Anteil der einzelnen Fluorophors in der Lambda Stack mit der GFP und YFP-Intensität in einzelnen Kanäle in G. trennen
- Mit der gleichen Strategie, gelten Linear Unmixing-Funktion mit gespeichert GFP und Hintergrund-Emission Fingerabdrücke mathematisch berechnen GFP-Intensität in PH-Zellen.
5. Repräsentative Ergebnisse:
- Ein hervorragendes Modellsystem von D. discoideum für GPCR-vermittelte Chemotaxis. Eine soziale Amöbe, D. discoideum zeigt eine markante Chemotaxis während des Lebenszyklus. Aufgrund seiner genetischen und biochemischen Vorteile bietet D. d eine starke system zu studieren Chemotaxis.
- Chemotaxis von Zellen unter einem sichtbaren und manipulierbare chemoattract Felder aus. Hier zeigen wir zunächst eine einfache Methode, um eine lineare Beziehung zwischen cAMP-Konzentration und die Intensität der einen Fluoreszenzfarbstoff Alexa 594 durch eine Verdünnungsreihe von 2 pM cAMP mit 10 pg / mL gemischt erhalten Alexa 594 (Abb. 2A). Als nächstes stellen wir eine einfache Möglichkeit, den Verlauf visualisieren darüber hinaus eine quantitative Messung der cAMP-Konzentration eines Gradienten von der Intensität der Alexa 594 (Abb. Abb.. 2B) zu etablieren.
- Zellbewegung ist mit Zell-Polarisation und Richtungserkennung entkoppelt. Eine Aktin Polymerisationsinhibitor eliminiert bereits bestehenden morphologischen Polarität und verhindert auch, dass Zellbewegung unter Beibehaltung der Zellen Fähigkeit Richtungserkennung (Abb. 3A). Beschäftigung von sichtbaren und manipulierbare cAMP Stimulation garantiert die Eingabe, zum Beispiel einheitlich angewandt Anregungen oder einen Farbverlauf. Diese Methode erlaubt eine quantitative Analyse der cAMP-induzierte Umverteilung der Taste signalisiert Komponenten in der Steigung sensing Maschinen. Gemessen raumzeitliche Dynamik dieser Signalkomponenten ermöglichen es uns zu verstehen, wie die Signalisierung Netzwerk Anpassung erreicht, um eine einheitliche Anregungen bei der Erzeugung polarisierten biochemische Reaktionen auf Gradienten (Abb. 3B).
- Systemische Messungen der Kinetik der chemosensing Signalisierungsnetz bei Einwirkung einer stetigen Steigung. Es ist wichtig, um die Dynamik / Kinetik der Richtungs-Sensing-Signalkomponenten zu verstehen, wie jede Komponente trägt zum Aufbau der intrazellulären Polarisation, wenn die Zellen ersten Gradienten Erfahrung zu messen. Die Anwendung des Live Cell Imaging mit einem hohen Tempo-räumlichen Auflösung zeigen wir zunächst einen biphasischen PIP3 Produktion von Zellen, die zu einem stetigen cAMP-Gradienten (Abb. 4A-C) ausgesetzt ist. Anwenden von Live Cell Imaging, haben wir systematisch Dynamik der gemessenen direktionalen-Sensing-spezifische Signalisierung Netzwerk von cAMP Stimulation PIP3 Produktion (Abb. 4D, E).
- Gleichzeitige Überwachung heterotrimeren G-Protein-Aktivierung und PIP 3-Produktion auf einheitlich angewandt cAMP Stimulation. Förster resonance energy transfer (FRET abgekürzt) bietet einen effizienten Ansatz zur heterotrimeren G-Protein-Aktivierung (Dissoziation) auf cAMP Stimulation zu überwachen. Hier beschrieben wir eine bequeme einfach übernehmen für eine gleichzeitige Messung von heterotrimeren G-Protein-Aktivierung und PIP 3-Produktion durch die Überwachung der FRET ändern und Membran-Translokation von PIP 3-Sonde, PH-GFP in G und PH-Zellen, bzw. (Abb. 5 ). Ein einheitlich angewandt cAMP Stimulation löst ein hartnäckiges G-Protein-Aktivierung, während die Auslöser einer transienten PIP 3-Produktion.
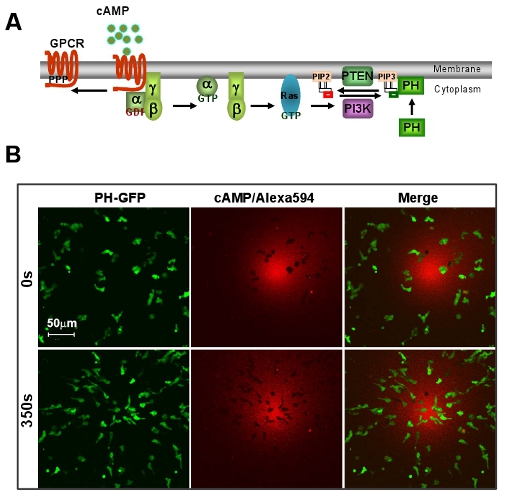
Abbildung 1: Ein hervorragendes Modellsystem von D. discoideum für GPCR-vermittelte Chemotaxis. A. Schema zeigt eine kurze Signalweg des Richtungserkennung. B. cAMP Gradienten induziert eine schnelle Chemotaxis von D. discoideum Zellen. Zellen exprimieren PIP 3-Sonde, PH-GFP (Green). Gradient (Red) wird visualisiert durch Alexa 594. Balken = 50 um.
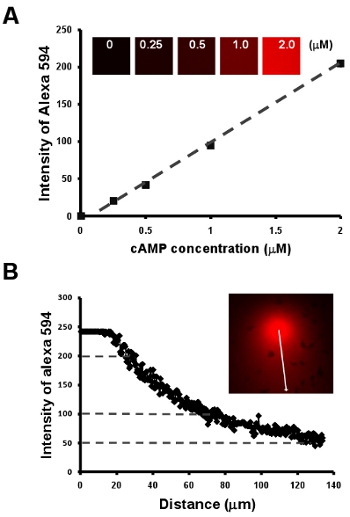
Abbildung 2: Chemotaxis von Zellen unter einem sichtbaren und manipulierbare chemoattract Felder aus. A. Graph zeigt eine lineare Beziehung zwischen cAMP-Konzentration und die Intensität der einen Fluoreszenzfarbstoff Alexa 594 durch eine Verdünnungsreihe von 2 pM cAMP mit 10 pg / mL Alexa 594 gemischt. B. Quantitative Messung der cAMP-Konzentration eines Gradienten von der linearen Beziehung der cAMP-Konzentration und Intensität der fluoreszierenden Farbstoff Alexa 594 in A.

Abbildung 3: Cell Motilität ist mit Zell-Polarisation und Richtungserkennung entkoppelt. A. Bild zeigt, dass immobile Zellen durch die Behandlung von Aktin Polymerisationsinhibitor Latrunculin B die Fähigkeit Richtungserkennung aufrecht zu erhalten. Zellen exprimieren PIP 3-Sonde, PH-GFP (Green). Gradient (Red) wird visualisiert durch Alexa 594. B. manipulierbare cAMP Stimulation und immobile Zelle System erlaubt es, zentrale Fragen der Richtungserkennung Adresse. Balken = 10 um.

Abbildung 4: Systemische Messungen der Kinetik der chemosensing Signalisierungsnetz bei der Belichtung zu einem stetigen Gefälle. A. Montage zeigt eine biphasische PIP 3-Produktion (Grüne) der Zelle, die zu einem stetigen cAMP-Gradienten (Red) ausgesetzt ist. B. Das Bild zeigt die Regionen von Interesse (ROI) für die Messung der Kinetik der PIP 3-Produktion in C. C vorgestellt . Kinetics of PIP 3-Produktion in den Zellen, die einen stetigen Verlauf. D. Schema zeigt die Signalisierung Netzwerk von Richtungserkennung von cAMP Stimulation PIP 3-Produktion. Ihre Kinetik bei der Belichtung mit einem stetigen Gefälle ist in der gleichen Farbe durchgezogenen Linien in E vorgestellt.

Abbildung 5: Gleichzeitige Überwachung multi-Ereignisse von GPCR Signalnetzwerke. A. Schema zeigt die gleichzeitige Messung von heterotrimeren G-Protein-Aktivierung und PIP 3-Produktion durch die Überwachung der FRET ändern und Membran-Translokation von PIP3 Sonde, PH-GFP in G und PH Zellen. B. Montage der Regenbogen Bilder von G-und PH-Zellen zeigt dass eine einheitliche Anwendung der cAMP Stimulation löst ein hartnäckiges G-Protein-Aktivierung in der Zelle peripheren, während die Auslöser einer transienten PIP3 Produktion. Die Zeitpunkte sind vor (0s) und nach Stimulation für 4,9 s, 10.2s und 20.4s. C. Kinetik der G-Protein-Aktivierung und PIP3 Produktion auf eine einheitliche Anwendung der cAMP Stimulation.
Diskussion
Die Prozesse der chemotaktischen kompetente Stadium von Zellen
Für Wildtyp D. discoideum Zellen, dauert es etwa 5 ~ 6 Stunden pulsierende Entwicklung bei Raumtemperatur, um sie in einem gut chemotaktische kompetente Stadium, in dem Zellen zeigen eine gut polarisiert zelluläre Morphologie und schnelle Zellmigration (Abb. 1) zu induzieren. Mehrere Faktoren, wie zum Beispiel cAMP-Konzentration für die Taktung, Temperatur und verschiedenen genetischen Hintergründen, kann sich auf den P...
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Diese Arbeit wird durch die intramuralen Fonds von NIAID, NIH unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Firma | Katalog-Nummer | Kommentare |
|---|---|---|---|
| D3-T Growth Medien | KD Medical | ||
| Koffein | Sigma | ||
| Latrunculin B | Molecular Probes | ||
| Alexa 594 | Molecular Probes | ||
| cAMP | Sigma | ||
| ChronTrol XT programmierbaren Timer | ChronTrol Corp | ||
| Miniplus 3 Schlauchpumpe | Gilbson | ||
| Platform Rotationsschüttler | |||
| FemtoJet Mikrokapillare Druckversorgung | Eppendorf | ||
| Einzel-und vier-und Lab-Tek II Deckglas Kammern | Nalge Nunc International | ||
| LSM 510 META oder gleichwertig Fluoreszenzmikroskop | Zeiss | einem 40X 1,3 NA oder 60X 1.4 NA Öl DIC Plan-Neofluar Objektiv | |
| Olympus X81 oder gleichwertig | Olymp | Benötigt ein 100X 1,47 NA TIRF Objektiv |
Referenzen
- Lijima, M., Huang, Y. E., Devreotes, P. Temporal and spatial regulation of chemotaxis. Dev Cell. 3, 469-469 (2002).
- Murphy, P. M. The molecular biology of leukocyte chemoattractant receptors. Annu Rev Immunol. 12, 593-593 (1994).
- Devreotes, P. N. G protein-linked signaling pathways control the developmental program of Dictyostelium. Neuron. 12, 235-235 (1994).
- Jin, T., Xu, X., Hereld, D. Chemotaxis, chemokine receptors and human disease. Cytokine. 44, 1-1 (2008).
- Meier-Schellersheim, M. Key role of local regulation in chemosensing revealed by a new molecular interaction-based modeling method. PLoS Comput Biol. 2, e82-e82 (2006).
- Xu, X. Coupling mechanism of a GPCR and a heterotrimeric G protein during chemoattractant gradient sensing in Dictyostelium. Sci Signal. 3, 71-71 (2010).
- Xu, X., Meier-Schellersheim, M., Jiao, X., Nelson, L. E., Jin, T. Quantitative imaging of single live cells reveals spatiotemporal dynamics of multistep signaling events of chemoattractant gradient sensing in Dictyostelium. Mol Biol Cell. 16, ra71-ra71 (2005).
- Xu, X., Meier-Schellersheim, M., Yan, J., Jin, T. Locally controlled inhibitory mechanisms are involved in eukaryotic GPCR-mediated chemosensing. J. Cell Biol. 178, 141-141 (2007).
- Jin, T., Zhang, N., Long, Y., Parent, C. A., Devreotes, P. N. Localization of the G protein betagamma complex in living cells during chemotaxis. Science. 287, 1034-1034 (2000).
- Janetopoulos, C., Jin, T., Devreotes, P. Receptor-mediated activation of heterotrimeric G-proteins in living cells. Science. 291, 2408-2408 (2001).
- Funamoto, S., Milan, K., Meili, R., Firtel, R. A. Role of phosphatidylinositol 3' kinase and a downstream pleckstrin homology domain-containing protein in controlling chemotaxis in dictyostelium. J. Cell Biol. 153, 795-795 (2001).
- Li, Z. Roles of PLC-beta2 and -beta3 and PI3Kgamma in chemoattractant-mediated signal transduction. Science. 287, 1046-1046 (2000).
- Sasaki, A. T., Chun, C., Takeda, K., Firtel, R. A. Localized Ras signaling at the leading edge regulates PI3K, cell polarity, and directional cell movement. J. Cell Biol. 167, 505-505 (2004).
- Meili, R. Chemoattractant-mediated transient activation and membrane localization of Akt/PKB is required for efficient chemotaxis to cAMP in Dictyostelium. EMBO J. 18, 2092-2092 .
- Parent, C. A., Blacklock, B. J., Froehlich, W. M., Murphy, D. B., Devreotes, P. N. G protein signaling events are activated at the leading edge of chemotactic cells. Cell. 95, 81-81 (1998).
- Funamoto, S., Meili, R., Lee, S., Parry, L., Firtel, R. A. Spatial and temporal regulation of 3-phosphoinositides by PI 3-kinase and PTEN mediates chemotaxis. Cell. 109, 611-611 (2002).
- Iijima, M., Devreotes, P. Tumor suppressor PTEN mediates sensing of chemoattractant gradients. Cell. 109, 599-599 (2002).
- Haastert, P. J. V. a. n., Devreotes, P. N. Chemotaxis: signalling the way forward. Nat Rev Mol Cell Biol. 5, 626-626 (2004).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten