È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Receptor Imaging proteina G accoppiata (GPCR)-mediata eventi di segnalazione che chemiotassi di controllo di Dictyostelium discoideum
In questo articolo
Riepilogo
Qui, descriviamo dettagliati vivere metodi di imaging per lo studio delle cellule chemiotassi. Vi presentiamo fluorescenza metodi microscopici di monitorare le dinamiche spazio-temporali di segnalazione eventi nella migrazione delle cellule. Misurazione di eventi di segnalazione ci permette di capire meglio come un GPCR di segnalazione rete raggiunge gradiente di rilevamento di fattori chemiotattici e controlli migratori direzionale delle cellule eucariotiche.
Abstract
Molte cellule eucariotiche in grado di rilevare gradienti di segnali chimici nei loro ambienti e di conseguenza migrano 1. Questa migrazione delle cellule guidata è denominato come chemiotassi, che è essenziale per varie cellule di svolgere le loro funzioni come il traffico delle cellule immunitarie ed il modello di cellule neuronali 2, 3. Una grande famiglia di proteine G recettori accoppiati (GPCR) rileva variabile piccoli peptidi, noto come chemochine, per dirigere la migrazione delle cellule in vivo 4. L'obiettivo finale della chemiotassi ricerca è quello di capire come un macchinario sensi GPCR chemochine gradienti ei controlli di segnalazione eventi che portano alla chemiotassi. A tal fine, usiamo tecniche di imaging per monitorare, in tempo reale, le concentrazioni di fattori chemiotattici spazio-temporale, il movimento delle cellule in un gradiente di chemiotattico, GPCR mediata eterotrimerica attivazione di proteine G, e gli eventi di segnalazione intracellulare coinvolte nella chemiotassi di cellule eucariotiche 5-8 . L'organismo semplice eucariotiche, Dictyostelium discoideum, display chemotaxic comportamenti che sono simili a quelli dei leucociti, e D. discoideum è un modello di sistema chiave per lo studio chemiotassi degli eucarioti. Come amebe a vita libera, D. discoideum cellule si dividono in media ricchi. Al momento la fame, le cellule entrare in un programma di sviluppo in cui si aggregano attraverso cAMP-mediata chemiotassi per formare strutture multicullular. Molti componenti coinvolte nella chemiotassi di cAMP sono stati identificati in D. discoideum. Il legame di cAMP ad un GPCR (car1) induce la dissociazione di eterotrimeriche G-proteine in Gγ e subunità Gβγ 7, 9, 10. Subunità Gβγ attivare Ras, che a sua volta attiva PI3K, la conversione PIP 2 nel PIP 3 sulla membrana cellulare 11-13. PIP 3 fungono da siti di legame per le proteine con omologia Pleckstrin (PH) domini, in modo da reclutare queste proteine alla membrana 14, 15. Attivazione dei recettori car1 controlla anche le associazioni membrana di PTEN, che defosforila PIP PIP 3 a 2 16, 17. I meccanismi molecolari sono evolutivamente conservati in chemochine GPCR-mediata chemiotassi di cellule umane come i neutrofili 18. Vi presentiamo i seguenti metodi per lo studio della chemiotassi D. discoideum cellule. 1. Preparazione delle cellule componente chemiotattici. 2. Imaging chemiotassi di cellule in un gradiente di cAMP. 3. Monitoraggio di una attivazione indotta GPCR di eterotrimeriche G-proteina in cellule vive sola. 4. Imaging chemoattractant-triggered PIP dinamico 3 risposte a singole cellule vive in tempo reale. I nostri metodi di imaging sviluppato può essere applicato per studiare chemiotassi dei leucociti umani.
Protocollo
1. Preparazione delle cellule competenti chemiotattici di Dictyostelium discoideum
- Per generare cellule di D. discoideum che sono chemiotattica al campo chemoattractant, le cellule crescono in vendemmia rich media D3-T da una cultura agitazione a 22 ° C.
- Lavare le cellule due volte in non-nutrienti sviluppo tampone (buffer DB contenente 5 mM Na 2 HPO 4, 5 mM KH 2 PO 4, 2 mM MgCl 2, e 0,1 mM CaCl 2).
- Risospendere le cellule nel buffer DB ad una densità di 2x10 7 cellule / ml.
- Agitare 10 cellule ml in un pallone da 250 ml a 100 rpm a 22 ° C per un'ora.
- Consegnare 100 l di 7,5 mM magazzino cAMP al 10 celle ml ogni sei minuti più di 6 ore per raggiungere una concentrazione finale di 75 nM cAMP, un processo designato come trattamento cAMP pulsante. Dopo 5-6 ore di trattamento cAMP pulsante, D. cellule discoideum diventare chemiotattica competente verso gradiente cAMP.
- Raccogliere le cellule per centrifugazione a 200 g per 5 minuti e poi risospendere le cellule con un tampone DB contenente 2,5 mM di caffeina, e si agita a 200 giri al minuto a 22 ° C per 20 min a basolate cella a una situazione chemiotattica.
2. Imaging cellule chemotaxing in un gradiente chemiotattico visibile e manipolabile
- Riporto una micropipetta con appena preparato 30 ml di soluzione 1 mM cAMP e Alexa 594 a 0.1μg/μl nel buffer DB.
- Collegare il Femtotip al titolare micropipetta e collegare il tubo di un apparato pressione di alimentazione, Eppendorf sistema FemtoJet.
- Fissare il gruppo micropipetta ad un micromanipolatore (Eppendorf TransferMan NK2) micromanipolatore motorizzato per assicurare una pressione costante al fine di stabilire un gradiente stabile.
- Montare una sola camera LabTek ben riempito con 6 ml di tampone DB su una lente olio 40X su un microscopio confocale e l'utilizzo luminoso-campo dell'ottica, il centro Femtotip nel campo di vista.
- Accendere l'alimentazione di pressione e di impostare la pressione di compensazione (Pc) per 70 hPa di stabilire un gradiente del campo / Alexa 594 miscela.
- Visualizza gradiente cAMP attraverso il monitoraggio della miscela di concentrazione desiderata di cAMP e Alexa 594 fluorescenza con eccitazione con una linea di 543 nm laser.
- Utilizzare la funzione di auto-posizionamento del micromanipolatore per mettere micropipetta nelle posizioni desiderate e impostarle come posizione 1, posizione 2 e posizione 3 di manipolare il gradiente a cui cellule sono esposti.
3. Immobile sistema a celle nonpolarized facilita eventi di imaging segnale coinvolte nel cAMP gradiente di rilevamento
- Dopo il trattamento la caffeina, rimuovere una aliquota di cellule e centrifugare a 500g per 3 min.
- Eliminare la soluzione tampone e diluire le cellule a 5x10 5 cellule / ml con tampone DB fresco contenente 2,5 mM caffeina.
- Applicare 1 ml di sospensione cellulare in un singolo bene da camera o 0,4 ml di ciascun pozzetto di una ben quattro camera.
- Consentono alle cellule di aderire per 10 minuti, con attenzione pipetta fuori il buffer per rimuovere le cellule distaccati e sostituirlo con lo stesso volume.
- Individuare le cellule al microscopio desiderato e iniziare imaging.
- Per un esperimento progettato per monitorare le dinamiche di componenti di segnalamento nelle cellule esporre ad una pendenza, trattare le cellule con 5,0 mM (concentrazione finale) Latrunculin B per 10 minuti prima degli esperimenti.
4. L'attivazione simultanea di monitoraggio eterotrimeriche G proteine e PIP 3 Produzione
- cAMP pulsare sviluppare cellule co-esprimono GαCFP e YFPGβ (cellule G) e cellule che esprimono PIP 3 Indicatore PH-GFP (cellule PH) 7.
- Mescolare i due tipi di cellule con rapporto 1:1 e piastra in camere di un bene o 4-bene.
- Creare e salvare l'emissione delle impronte digitali di riferimento della curva CFP, YFP e GFP utilizzando la modalità Stack Lambda acquisizione entro l'intervallo spettrale 464-624 nm con una larghezza di 10 nm.
- Contemporaneamente l'attivazione delle proteine G immagine nelle cellule G e PIP 3 Produzione in cellule PH utilizzando con la stessa modalità di acquisizione Stack Lambda all'interno della gamma spettrale 464-544 nm con incrementi di 10 nm.
- Applicare la funzione lineare Unmixing del software Zeiss 510META utilizzando salvato CFPand YFP e le impronte digitali di emissioni di calcolare matematicamente il contributo di ciascun fluoroforo nel Stack Lambda per separare il PCP e l'intensità YFP nei singoli canali in G.
- Con la stessa strategia, applicare la funzione lineare Unmixing usando GFP salvate e le impronte digitali emissione sfondo per calcolare matematicamente intensità GFP in cellule PH.
5. Rappresentante dei risultati:
- Un sistema eccellente modello di D. discoideum per chemiotassi mediata GPCR. un'ameba sociale, D. discoideum esibisce una chemiotassi colpisce durante il ciclo di vita. Grazie ai vantaggi genetici e biochimici, D. D offre una potente system studiare chemiotassi.
- Chemiotassi di cellule al campo visibile e manipolabile chemoattract. Qui, prima mostra una metodologia semplice per ottenere una relazione lineare tra la concentrazione di cAMP e l'intensità di un colorante fluorescente Alexa 594 da una serie di diluizioni di 2 cAMP mM mescolati con 10 mg / ml Alexa 594 (Fig. 2A). Successivamente, forniamo un modo semplice per visualizzare la pendenza, inoltre, a stabilire una misura quantitativa delle concentrazioni di cAMP di un gradiente per l'intensità di Alexa 594 (Fig. fig. 2B).
- Motilità cellulare è staccata con polarizzazione delle cellule e di rilevamento direzionale. Un inibitore di polimerizzazione di actina elimina preesistenti polarità morfologica e impedisce anche il movimento delle cellule, pur mantenendo la capacità delle cellule 'di rilevamento direzionale (Fig. 3A). Occupazione di stimolazione cAMP visibile e manipolabile garantisce l'ingresso, per esempio stimolazioni applicate uniformemente o un gradiente. Questo metodo permette un'analisi quantitativa di cAMP indotta redistribuzione dei principali componenti di segnalazione nel macchinario gradiente di rilevamento. Misurata la dinamica spazio-temporale di queste componenti di segnalazione ci permettono di capire come la rete di segnalazione raggiunge adattamento alle stimolazioni uniforme, mentre la generazione polarizzata risposte biochimiche a gradienti (Fig. 3B).
- Misure sistemiche di cinetica di chemosensing rete di segnalazione in caso di esposizione ad una pendenza. E 'fondamentale per misurare la dinamica / cinetica di direzionale-sensing componenti di segnalamento per capire come ogni componente contribuisce alla creazione di polarizzazione intracellulare quando le cellule esperienza primo gradiente. Applicazione di imaging cellulare dal vivo con un ritmo alto-risoluzione spaziale, per prima cosa mostrano un bifasico PIP3 produzione di cellule che è esposto ad un gradiente di cAMP costante (Fig. 4A-C). L'applicazione di immagini dal vivo di cellule, abbiamo misurato sistematicamente le dinamiche del direzionale-sensing specifica rete di segnalazione da stimolazione cAMP a PIP3 produzione (Fig. 4D, E).
- Monitoraggio simultaneo eterotrimeriche attivazione della proteina G e PIP 3 Produzione su stimolazione cAMP applicata uniformemente. Förster risonanza trasferimento di energia (abbreviato FRET) fornisce un approccio efficace per il monitoraggio eterotrimeriche attivazione della proteina G (dissociazione) al momento della stimolazione cAMP. Qui, abbiamo descritto un conveniente facile adottare sistemi per la misurazione simultanea di eterotrimeriche attivazione della proteina G e PIP 3 di produzione attraverso il monitoraggio della FRET cambiamento e traslocazione della membrana del PIP 3 sonda, PH-GFP in G e cellule PH, rispettivamente (Fig. 5 ). Una stimolazione cAMP applicate uniformemente innesca una persistente attivazione della proteina G, mentre che innesca un transitorio PIP 3 di produzione.
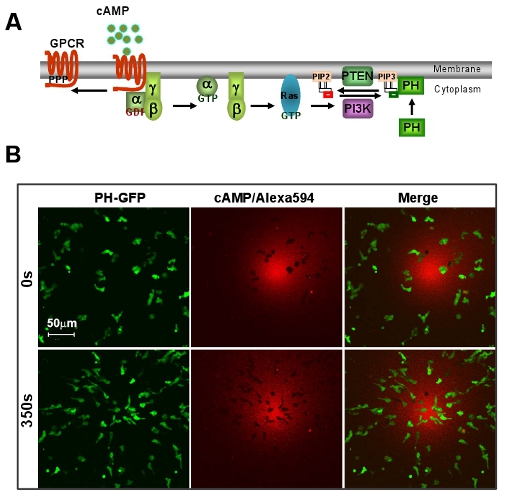
Figura 1: Un sistema eccellente modello di D. discoideum per chemiotassi mediata GPCR. A. Schema mostra un percorso breve di segnalazione del rilevamento direzionale. B. gradiente cAMP induce la chemiotassi rapida D. discoideum cellule. Cellule esprimono PIP 3 sonda, PH-GFP (Green). Gradiente (Red) è visualizzato da Alexa 594. Barra di scala = 50 micron.
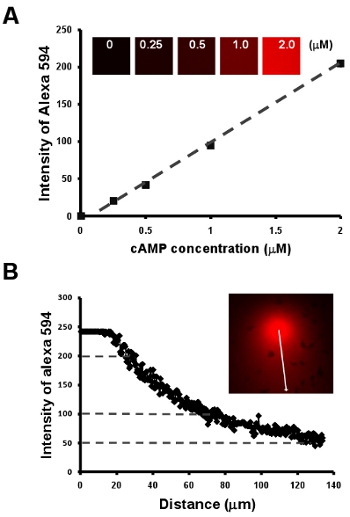
Figura 2: chemiotassi di cellule al campo visibile e manipolabile chemoattract. A. Il grafico mostra una relazione lineare tra la concentrazione di cAMP e l'intensità di un colorante fluorescente Alexa 594 da una serie di diluizioni di 2 cAMP mM mescolati con 10 mg / ml Alexa 594. B. misura quantitativa della concentrazione di cAMP di un gradiente dalla relazione lineare della concentrazione di cAMP e l'intensità del colorante fluorescente Alexa 594 in A.

Figura 3: motilità cellulare è staccata con polarizzazione delle cellule e di rilevamento direzionale. Immagine A. dimostra che le cellule immobile dal trattamento degli inibitori della polimerizzazione Latrunculin B mantenere la capacità di rilevamento direzionale. Cellule esprimono PIP 3 sonda, PH-GFP (Green). Gradiente (Red) è visualizzato da Alexa 594. B. cAMP manipolabile stimolazione e immobili sistema a celle permette di affrontare le questioni chiave di rilevamento direzionale. Barra di scala = 10μm.

Figura 4: misure sistemiche di cinetica di chemosensing rete di segnalazione in caso di esposizione ad una pendenza. A. Montage mostra un bifasico PIP 3 Produzione (verde) della cellula, che è esposto ad un gradiente di cAMP costante (rosso). B. immagine mostra le regioni di interesse (ROI) per la misura della cinetica di PIP 3 Produzione presentato in C. C . Cinetica oPIP f 3 della produzione nelle cellule esposte a una pendenza costante. D. schema mostra la rete di segnalazione del rilevamento direzionale dalla stimolazione cAMP al PIP 3 di produzione. La cinetica in caso di esposizione ad una pendenza è presentato nelle linee dello stesso colore solido in E.

Figura 5: monitoraggio simultaneo a più eventi di reti GPCR segnalazione. Schema A. mostra misurazione simultanea di eterotrimeriche attivazione della proteina G e PIP 3 di produzione attraverso il monitoraggio della FRET cambiamento e traslocazione della membrana di PIP3 sonda, PH-GFP in G e cellule PH, rispettivamente. B. Montaggio di immagini arcobaleno di G e cellule PH mostra che una stimolazione cAMP applicate uniformemente innesca una persistente attivazione della proteina G al cellulare periferico, mentre che innesca un transitorio PIP3 produzione. I punti ora vengono prima (0s) e dopo stimolazione per 4.9s, e 10.2s 20.4s. C. Cinetica di attivazione delle proteine G e PIP3 produzione su una stimolazione cAMP applicata uniformemente.
Access restricted. Please log in or start a trial to view this content.
Discussione
I processi di raggiungere chemiotattici stadio competente delle cellule
Per il tipo selvaggio D. cellule discoideum, ci vogliono circa 5 ~ 6 ore pulsare lo sviluppo a temperatura ambiente per indurli in un pozzo-chemiotattica fase competenti durante il quale le cellule visualizzare una morfologia ben polarizzata cellulare e la migrazione cellulare rapida (Fig. 1). Diversi fattori, quali la concentrazione di cAMP per pulsare, la temperatura e diversi background genetico, posson...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Nessun conflitto di interessi dichiarati.
Riconoscimenti
Questo lavoro è supportato dal fondo intramurale dal NIAID, NIH.
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reagente | Azienda | Numero di catalogo | Commenti |
|---|---|---|---|
| D3-T crescita media | KD medici | ||
| Caffeina | Sigma | ||
| Latrunculin B | Molecular Probes | ||
| Alexa 594 | Molecular Probes | ||
| cAMP | Sigma | ||
| ChronTrol XT timer programmabile | ChronTrol Corp | ||
| Miniplus 3 pompa peristaltica | Gilbson | ||
| Piattaforma rotativo | |||
| FemtoJet pressione di alimentazione microcapillare | Eppendorf | ||
| Singolo e quattro ben Lab-Tek II coprioggetti camere | Nalge Nunc internazionale | ||
| LSM 510 META o equivalente microscopio a fluorescenza | Zeiss | uno 1,3 NA 40X o 60X 1,4 NA olio DIC Plan-Neofluar obiettivo lente | |
| Olympus X81 o equivalente | Olimpo | Richiede un 100X 1,47 NA TIRF lente dell'obiettivo |
Riferimenti
- Lijima, M., Huang, Y. E., Devreotes, P. Temporal and spatial regulation of chemotaxis. Dev Cell. 3, 469-469 (2002).
- Murphy, P. M. The molecular biology of leukocyte chemoattractant receptors. Annu Rev Immunol. 12, 593-593 (1994).
- Devreotes, P. N. G protein-linked signaling pathways control the developmental program of Dictyostelium. Neuron. 12, 235-235 (1994).
- Jin, T., Xu, X., Hereld, D. Chemotaxis, chemokine receptors and human disease. Cytokine. 44, 1-1 (2008).
- Meier-Schellersheim, M. Key role of local regulation in chemosensing revealed by a new molecular interaction-based modeling method. PLoS Comput Biol. 2, e82-e82 (2006).
- Xu, X. Coupling mechanism of a GPCR and a heterotrimeric G protein during chemoattractant gradient sensing in Dictyostelium. Sci Signal. 3, 71-71 (2010).
- Xu, X., Meier-Schellersheim, M., Jiao, X., Nelson, L. E., Jin, T. Quantitative imaging of single live cells reveals spatiotemporal dynamics of multistep signaling events of chemoattractant gradient sensing in Dictyostelium. Mol Biol Cell. 16, ra71-ra71 (2005).
- Xu, X., Meier-Schellersheim, M., Yan, J., Jin, T. Locally controlled inhibitory mechanisms are involved in eukaryotic GPCR-mediated chemosensing. J. Cell Biol. 178, 141-141 (2007).
- Jin, T., Zhang, N., Long, Y., Parent, C. A., Devreotes, P. N. Localization of the G protein betagamma complex in living cells during chemotaxis. Science. 287, 1034-1034 (2000).
- Janetopoulos, C., Jin, T., Devreotes, P. Receptor-mediated activation of heterotrimeric G-proteins in living cells. Science. 291, 2408-2408 (2001).
- Funamoto, S., Milan, K., Meili, R., Firtel, R. A. Role of phosphatidylinositol 3' kinase and a downstream pleckstrin homology domain-containing protein in controlling chemotaxis in dictyostelium. J. Cell Biol. 153, 795-795 (2001).
- Li, Z. Roles of PLC-beta2 and -beta3 and PI3Kgamma in chemoattractant-mediated signal transduction. Science. 287, 1046-1046 (2000).
- Sasaki, A. T., Chun, C., Takeda, K., Firtel, R. A. Localized Ras signaling at the leading edge regulates PI3K, cell polarity, and directional cell movement. J. Cell Biol. 167, 505-505 (2004).
- Meili, R. Chemoattractant-mediated transient activation and membrane localization of Akt/PKB is required for efficient chemotaxis to cAMP in Dictyostelium. EMBO J. 18, 2092-2092 Forthcoming.
- Parent, C. A., Blacklock, B. J., Froehlich, W. M., Murphy, D. B., Devreotes, P. N. G protein signaling events are activated at the leading edge of chemotactic cells. Cell. 95, 81-81 (1998).
- Funamoto, S., Meili, R., Lee, S., Parry, L., Firtel, R. A. Spatial and temporal regulation of 3-phosphoinositides by PI 3-kinase and PTEN mediates chemotaxis. Cell. 109, 611-611 (2002).
- Iijima, M., Devreotes, P. Tumor suppressor PTEN mediates sensing of chemoattractant gradients. Cell. 109, 599-599 (2002).
- Haastert, P. J. V. an, Devreotes, P. N. Chemotaxis: signalling the way forward. Nat Rev Mol Cell Biol. 5, 626-626 (2004).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon