Method Article
Derivación de las Culturas enriquecido oligodendrocitos y neuronas oligodendrocitos / myelinating Co-culturas de Post-natal tejidos murinos
En este artículo
Resumen
En este artículo se describen los métodos para obtener poblaciones enriquecidas de células precursoras de oligodendrocitos murinas (OPC) en cultivo primario, que se diferencian para producir oligodendrocitos maduros (MCO). Además, este informe se describen las técnicas para producir murino myelinating co-cultivos de siembra de los OPC del ratón sobre un lecho de neuritas de neuronas de ratón ganglio de la raíz dorsal (DRGNs).
Resumen
Identificar los mecanismos moleculares que subyacen al desarrollo OL no sólo es fundamental para ampliar nuestro conocimiento de la biología OL, pero también tiene implicaciones para la comprensión de la patogénesis de las enfermedades desmielinizantes como la esclerosis múltiple (EM). Desarrollo celular es comúnmente estudiadas con modelos de cultivos celulares primarios. Cultivo de células primarias facilita la evaluación de un tipo de célula, proporcionando un ambiente controlado y libre de las variables externas que están presentes en vivo. Mientras que las culturas OL derivadas de ratas han proporcionado una gran cantidad de conocimiento de la biología OL, esfuerzos similares en el establecimiento de cultivos de OL de los ratones se ha encontrado con obstáculos importantes. El desarrollo de métodos de cultivo primario LB murino es imprescindible a fin de tomar ventaja de las líneas de ratones transgénicos disponibles.
Múltiples métodos para la extracción de OPC a partir de tejido de roedores se han descrito, desde la derivación neuroesfera, purificación y adhesión diferencial inmunopurificación 1-3. Mientras que muchos métodos ofrecen el éxito de la mayoría, requieren tiempos de amplia cultura y / o equipos costosos / reactivos. Para evitar esto, purificación de OPC a partir de tejido murino con una adaptación del método descrito originalmente por McCarthy y de Vellis 2 es preferido. Este método consiste en separar físicamente los OPC a partir de un cultivo mixto gliales derivadas de cortezas de roedores recién nacidos. El resultado es una población purificada OPC que pueden diferenciarse en una cultura OL-enriquecido. Este enfoque es atractivo debido a su tiempo de cultivo relativamente corto y el requisito innecesario para los factores de crecimiento o anticuerpos immunopanning.
Mientras explora los mecanismos de desarrollo OL en una cultura purificada es informativo, no proporciona el entorno más fisiológicamente relevantes para la evaluación de la formación de la vaina de mielina. Co-cultivo LB con las neuronas que ayudan a comprender la las bases moleculares que regulan la OL mediada por la mielinización de los axones. Para muchos OL / co-cultivo de neuronas estudios, las neuronas ganglionares de la raíz dorsal (DRGNs) han demostrado ser el tipo de neurona de la elección. Son ideales para el co-cultivo con LB, debido a su facilidad de extracción, cantidad mínima de células contaminantes, y la formación de neuritas camas densas. Mientras que los estudios con ratas / ratones myelinating xenocultures han sido publicados por 4-6, un método para la obtención de tales OL / DRGN myelinating co-cultivos de post-natal tejido murino no se ha descrito. Aquí se presentan los métodos detallados sobre la manera de producir eficazmente estos cultivos, junto con ejemplos de los resultados esperados. Estos métodos son útiles para abordar cuestiones relacionadas con el desarrollo OL / myelinating función, y son herramientas útiles en el campo de la neurociencia.
Protocolo
Declaración de Ética
Los ratones utilizados en este trabajo fueron atendidos de acuerdo con el Consejo Canadiense de los Animales (CCPA) directrices. La aprobación ética para los experimentos realizados se obtuvo de la Universidad de Ottawa Animal Care Comité en virtud del número de protocolo OGH-119.
1. Disección - corteza del ratón neonatal para la extracción de OPC
- Sacrificio P0-P2 ratón de acuerdo con las directrices institucionales.
- Diseccionar el cerebro y colocar en una placa de Petri que contiene helado MEM (sin antibióticos).
- La transferencia de la antena a un microscopio de disección.
- El uso de un bisturí con la parte dorsal del cerebro para arriba, hacer una incisión superficial sagitalmente lo largo del borde medial de la mayoría de cada una corteza (Fig. 1a). Esta incisión sólo se debe pasar a través de la capa meníngea con el fin de facilitar su eliminación.
- Use unas pinzas de punta fina que se despeguen las meninges de un modo lateral. Si se hace con cuidado, esta capa se puede eliminar en una sola pieza. Durante este paso, quitar los bulbos olfatorios.
- Con el cerebro ventral lado-para arriba, hacer una incisión profunda sagital donde se reúne la corteza de la zona ventral del diencéfalo (Fig 1b).
- Con el dorsal del cerebro lado-para arriba, separar la corteza del cerebro medio, haciendo palanca en el tejido en un medio a la moda lateral (Fig. 1c, c '). Eliminar cualquier meninges residual en este paso.
- Dado en cada uno corteza en unos 4 trozos y suavemente transferir a un tubo cónico de 15 ml que contiene 350 l de cerebro de ratón por MEM. Mantener el tubo en hielo hasta que todos los ratones han sido procesados.
- Repita los pasos 1.1-1.8 para los ratones restantes.
2. La disociación de la corteza neonatal y el mantenimiento de cultivos mixtos de glía
Nota: La introducción de burbujas en la suspensión celular se debe evitar durante todos los pasos siguientes.
- Añadir el tubo cónico de 15 ml que contiene el cerebro recién disecado a un baño de agua 37 ° C durante 3 min.
- La transferencia de los cerebros de una campana de cultivo de tejido estéril.
- Suavemente pase picado corteza a través de una punta de la pipeta P1000 para generar fragmentos más pequeños. Dejar de pipeteo una vez que no hay piezas cerebro lo suficientemente grande como para interrumpir la fluidez de la suspensión a través de la punta de la pipeta.
- Añadir 75 l de solución de papaína OPC por el cerebro en el tubo cónico. La solución de papaína OPC deben ser pre-calentado a 37 ° C durante 20 minutos antes de su uso.
- Incubar en un baño de agua a 37 ° C durante 20 min. Aproximadamente cada 2 minutos, invierta suavemente el tubo para evitar la agregación de los tejidos. Durante este tiempo, añadir 5 ml de mezcla de medios de cultivo gliales a cada poli-L-lisina (PLL) recubierto (1 mg / ml) T25 recipiente (un frasco por el cerebro del ratón), y colóquelo en un 37 ° C de cultivo de tejidos incubadora a 8,5% de CO 2.
- Después de 20 minutos, vuelva a la suspensión del tejido a la campana estéril y agregar 2 ml de mezcla de medios de cultivo por gliales del cerebro y el tubo. Deje reposar durante 10 minutos a temperatura ambiente para permitir la inactivación de la solución OPC papaína.
- Alícuota de la suspensión de tejido en tubos de 5 ml de plástico. El número de tubos debe coincidir con el número de cerebros disecados, lo que resulta en aproximadamente 2,5 ml por tubo.
- Utilizando una aguja estéril llama pulido pipeta Pasteur de vidrio, con cuidado triturar el tejido en cada tubo. Triturar lentamente al principio, y poco a poco aumentar la velocidad como piezas de disociar. Triturar aproximadamente 10 a 15 veces, sin embargo este número puede variar en función de la eficacia de la digestión.
Nota: Bajo-trituración dará lugar a los pobres la disociación de los tejidos, mientras que el exceso de trituración tendrá un impacto negativo sobre la viabilidad celular. Es importante no introducir burbujas en la solución, ya que esto afectaría severamente la viabilidad celular.
- Una vez que no hay grupos visibles del tejido que queda en la suspensión, el traslado a un tubo cónico de 50 ml que contiene 4 ml de mezcla de medios de cultivo por gliales del cerebro (es decir, cuatro cerebros = 16 ml mixta cultura gliales).
- Invierta suavemente el tubo cónico de 50 ml y repetir a los tubos ml restantes 5.
- Alícuota de la suspensión de células agrupadas en tubos de 15 mL cónico (aproximadamente 6,5 ml por tubo de 15 ml). El número de tubos de 15 ml debe coincidir con el número de cerebros disecados.
- Centrifugar los tubos a 1200 rpm (~ 300 g) durante 5 min.
- Con cuidado, aspirar el sobrenadante y agregar 1 ml de calentar el medio de cultivo mixto gliales a cada tubo cónico de 15 ml.
- Poco a poco resuspender el precipitado con un P1000 punta de la pipeta, teniendo cuidado de no introducir burbujas. Añadir la suspensión de células de cada tubo a un pre-equilibrio PLL recubiertos T25 frasco, haciendo que el volumen total de los medios de cultivo a 6 mL.
- Colocar los matraces en una incubadora de cultivo de tejidos durante 3-4 horas para permitir que las células se adhieren a la del sustrato PLL. Realizar un cambio de los medios de comunicación lleno al vaso de los medios de comunicación, y la adición de 6 ml de agua dulce mixta cultura gliales de los frascos. Este paso elimina la mayor parte de los escombroscausado por la trituración, y promueva la viabilidad cultura. Si OL / DRGN co-cultivos se desea, consulte la sección 3 de este protocolo.
- Después de 3 días de cultivo, realizar un cambio de 02.03 medios de comunicación mediante la eliminación de 4 ml de los medios de comunicación, y su sustitución con 4 ml de agua dulce mixta cultura gliales. En este punto, una monocapa de astrocitos se forman en la base de los frascos.
- El día 6, realizar otro medio de comunicación 3.2 cambiar y complementar los frascos con una concentración final de 5 mg / ml de insulina. En este punto, una monocapa de astrocitos debe ser claramente visible, sobre el que los OPC se proliferan.
3. DRGN aislamiento
Nota: Para producir OL / DRGNs co-cultivos, DRGNs debe establecer el día después de la generación de cultura mixta gliales. Ambos tipos de cultura se cultivan de forma independiente, y se combinan después de 90-10 días.
- Sacrificio P5-P10 ratón de acuerdo con las directrices institucionales.
- Extracto de la columna vertebral, y traslado a un lugar limpio placa de Petri.
- Recorte tanto músculo y el hueso de la columna vertebral como sea posible (Fig. 1D, d '), ya que esto facilitará la disección de los ganglios de la raíz dorsal (GRD).
- La transferencia de la columna recortada de un nuevo plato de Petri ventral lado-para arriba. Usando tijeras de disección y caudalmente a partir, cortar en sentido medial a través de la columna vertebral en forma longitudinal.
- El uso de dos pares de pinzas, suavemente forzar la apertura de la columna vertebral para exponer la médula espinal.
- GRD se encuentran por debajo y lateral de la médula espinal. Utilizando unas pinzas de punta fina, retire suavemente la GRD, evitando daños a los ganglios (Fig. 1e).
- La transferencia de los GRD eliminado a la solución helada de Hank salina tamponada (HBSS, sin antibióticos) en una nueva placa de Petri. El disector debe tratar de extraer 40 GRD por ratón (Fig. 1f).
- Una vez que los GRD han sido extraídos, recorte los GRD de las raíces excesivamente largo (Fig. 1 g, g ') para minimizar la introducción de células contaminantes a la cultura (las células gliales, fibroblastos).
- La transferencia de los GRD a un tubo de centrífuga de 1,5 ml que contiene 500 l de HBSS helada.
- Centrifugar a 1200 rpm (~ 300 g) durante 5 min a 4 ° C para que sedimenten los GRD.
- La transferencia de los tubos de centrifugación de una campana de cultivo de tejido estéril y retire la HBSS de los tubos.
- Añadir 500 l de pre-calentado (20 min a 37 ° C) DRG solución de papaína e incubar los tubos en un baño de agua 37 ° C durante 10 min. Invertir los tubos cada 2 minutos para evitar la agregación de tejidos.
- Repita el paso 3.10.
- Retire la solución de papaína DRG y añadir 500 l de pre-calentado (20 min a 37 ° C) Una solución de colagenasa. Incubar en un baño de agua a 37 ° C durante 10 minutos, invirtiendo cada 2 minutos.
- Repita el paso 3.10.
- Quitar el sobrenadante y agregar 1 ml de DRGN medios de comunicación. Invertir el tubo varias veces.
- Repita el paso 3.10.
- Repita el paso 3.16.
- Un abrigo estéril llama cristal pulido pipeta Pasteur con albúmina sérica bovina (BSA) con la pipeta una solución de 0,25% de BSA en HBSS varias veces. El recubrimiento con una solución de BSA evitará que los GRD se adhiera a las paredes de la pipeta de vidrio.
- Triturar los GRD con la pipeta BSA recubierto suavemente al principio, y con creciente intensidad una vez que grupos comienzan disociar. Triturar aproximadamente 10-15 veces, sin embargo este número depende del grado de digestión, y el número de GRD por tubo.
- Una vez que la disociación se consigue, pasar la suspensión a través de un filtro de 50 micras en una placa de Petri estéril que contiene 7 ml de DRGN los medios de comunicación. Filtración eliminará gran parte de los restos de la suspensión de células, aunque este paso no es crítico.
- Incubar la placa de Petri en el 8,5% de CO 2 por aproximadamente 1,25 horas.
- Escudo varios 12 mm cubreobjetos con LN2 (10 mg / ml en PBS) en un plato de 24 pozos durante este tiempo de incubación.
- Una vez que la incubación ha terminado, observe la placa de Petri en campo claro. DRGNs se identifican como grandes células de cuerpo, moreno de fase. Agitar la placa de Petri con suavidad para eliminar todo DRGNs adherido.
Nota: Muchas células contaminantes se han adherido firmemente a la placa de Petri, enriqueciendo de esta manera la suspensión de su celda para DRGNs.
- La transferencia de la suspensión de células a un tubo cónico de 15 ml. Enjuague suavemente el plato con 4 ml de DRGN los medios de comunicación para recoger cualquier DRGNs residual. Transferir el adicional de 4 ml para el tubo cónico.
- Centrifugar durante 5 min a 1200 rpm (~ 300 g).
- Aspirar el sobrenadante y resuspender el precipitado en 500 l de los medios de comunicación DRGN fresco.
- Calcular el número de DRGNs producido utilizando un hemocitómetro. Asegúrese de contar sólo la DRGNs, y otros tipos de células no. DRGNs se pueden identificar por sus grandes cuerpos de células esféricas.
- Semillas de 30.000-50.000 DRGNs a cada cubreobjetos recubiertos LN2 en 1 ml de DRGN medios de comunicación, y colóquelo en un 37 ° C tejidos incubadora de la cultura en el 8,5% de CO 2 durante la noche.
- A la mañana siguiente, realizar un cambio de los medios de comunicación mediante la sustitución completa de la DRGNlos medios de comunicación con los medios de comunicación OL (menos CNTF) con una concentración final de 1% de penicilina / estreptomicina y 10 FUDR M.
- Los días 3 y 5, realizar un cambio de 3 / 4 medios de comunicación con los medios de comunicación como en el paso 3.30.
- El día 7, realizar un cambio de los medios de comunicación plena con los medios de comunicación OL (menos CNTF, penicilina / estreptomicina, FUDR).
- El día 9, el DRGNs debería haber formado una cama amplia neuritas, y ahora están listos para ser co-cultivadas con OPC.
4. Purificación de OPC de cultivos mixtos gliales para el establecimiento de OL enriquecido las culturas o OL / DRGN co-culturas
- En el Día 9 de la cultura gliales mixtos, la transferencia de los frascos de un agitador orbital en un 5% de CO 2 incubadora de cultivo de tejidos. Colocar los frascos en la parte superior de los frascos vacíos T25 para evitar que el calor generado por el agitador orbital afecten negativamente a los cultivos gliales mixtos. Permita que las culturas se equilibre a esta nueva incubadora durante 1 hora.
- Una vez que los frascos han equilibrado, agitar los frascos a 50 rpm durante 45 minutos. El propósito de este movimiento es para eliminar las células de baja adherencia contaminantes de la monocapa.
- A que las células de una campana de cultivo de tejidos y eliminar todos los medios de comunicación de los frascos. Vuelva a colocar con 4 ml de agua dulce mixta cultura gliales suplementado con 5 mg / ml de insulina.
- Colocar los frascos de nuevo en la coctelera, y hasta que se estabilice por aproximadamente 3 horas.
- Una vez que los frascos se equilibran, apriételos firmemente con el agitador orbital, y agitar los frascos durante aproximadamente 16 horas a 220 rpm (la noche).
- A la mañana siguiente, si LB se van a cultivar en la ausencia de DRGNs (es decir, OL-enriquecido la cultura), capa de varios estéril de 12 mm cubreobjetos con LN2 (10 mg / ml en PBS) durante 1 hora. La transferencia de los cubreobjetos de 24 y los platos, lavar con PBS, seguido de un lavado de los medios de comunicación OL. Añadir 1 ml de los medios de comunicación OL a cada pocillo y equilibrar a un 8,5% de CO 2.
- Equilibre 10 cm placas de cultivo de tejidos en el 5% de CO 2 durante 30 min. Un plato se requiere para cada 2 frascos. Estos serán utilizados para la diferencia de adhesión de enriquecimiento de las OPC en suspensión.
- Una vez que el período de 30 minutos de equilibrio ha pasado, la transferencia de los medios de comunicación de los frascos sacudido a los platos. Cada plato debe recibir los medios de comunicación de dos frascos, lo que equivale aproximadamente a 8 ml de suspensión celular por antena de 10 cm.
- Incubar las placas a 5% de CO 2 durante 30 minutos, mientras que proporciona un pequeño empujoncito en la marca de 15 minutos. Este empujón ayudará a evitar que los OPC de la adherido a la cápsula de 10 cm.
- Una vez que la incubación, examinar los platos en campo claro. OPC se identifican como grupos de células pequeñas, típicamente de 3-5 células, pero a veces se forman grandes agregados parecido neuroesferas. Muchos no-OC células de estirpe debe estar firmemente adherido a la base de la placa. Agite suavemente las placas para separar cualquier OPC libremente adheridos, y la transferencia de la suspensión de células de cada placa en un tubo cónico de 15 ml.
- Centrifugar a 1200 rpm (~ 300 g) durante 5 min.
- Resuspender el precipitado en 1 ml de los medios de comunicación OL con una punta de pipeta P1000, seguido de resuspensión con una punta de pipeta P200.
- Contar las células utilizando un hemocitómetro.
- Para enriquecido OL culturas, las semillas de 25.000 - 50.000 OPC para cada una de 12 mm LN2 recubierto cubreobjetos en un volumen final de 1 mL OL medios de comunicación.
- De OL / DRGN co-cultivos, realizar una media total OL (menos CNTF) el cambio en la DRGNs de la sección [3], y con cuidado añadir 50.000 células de la suspensión celular OPC-enriquecido. Tenga cuidado de no perturbar la cama neuritas DRGN durante la adición de las OPC.
- Culturas a cabo en una incubadora a 37 ° C en el 8,5% de CO 2, y evitar que se eliminen hasta la fijación. OPC murinos son sensibles a los cambios en el pH, y la eliminación de la incubadora se altera el pH de los medios de OL. También hay que resaltar, además de dH 2 O de los pozos vacíos alrededor de los cultivos celulares se evite la evaporación de los medios de cultivo, reduciendo así al mínimo las fluctuaciones en la concentración de solutos en los medios de comunicación OL. Esto proporcionará un entorno más coherente de las OPC.
5. Procesamiento de los cultivos para microscopía de inmunofluorescencia
- Fix culturas con 100% de metanol a -20 ° C durante 10 minutos, o 3% de paraformaldehído a temperatura ambiente durante 15 min.
- Permeabilizar cubreobjetos con 0,1% Triton-X-100 durante 10 minutos, lavar con tampón fosfato bloque salino (PBS) y durante 1 hora en suero de cabra al 10%.
- Cubreobjetos se incuban con anticuerpos primarios diluidos en solución de bloqueo durante la noche a 4 ° C.
- Lave cubreobjetos 3 veces con PBS, e incubar con Alexa-flúor anticuerpos conjugados secundaria (Invitrogen) diluido en solución de bloqueo durante 45 min.
- De contraste con 4 ',6-diamidino-2-phenylindole (DAPI) y lavar cubreobjetos varias veces con PBS.
- Monte cubreobjetos en Dako fluorescentes medio de montaje.
- Analizar las diapositivas a través de microscopio de inmunofluorescencia. En este protocolo, las diapositivas se analizan, ya sea con una fluorescencia Zeiss Axiovert 200M invertidomicroscopio o un Zeiss LSM 510 META láser microscopio confocal de barrido.
6. De células enteras de extracción de proteínas a partir de OL enriquecido las culturas
- Retire 24 y culturas de la incubadora y enfriar en hielo durante 3 min.
- Retire con cuidado los medios de comunicación, y añadir 10-20 l de tampón de lisis (50 mM Tris-HCl, 150 mM NaCl, 0,1% SDS, 0,5% de desoxicolato de sodio, 1% Triton-X-100, con un 0,1% pepstatina, aprotinina, PMSF, leupeptina, ortovanadato de sodio) a cada pocillo (un mínimo de 8 pozos por muestra se sugiere).
- Raspe los pozos con un diámetro ancho P1000 punta de la pipeta, y la transferencia del lisado a un tubo centrífugo de 1,5 ml.
- Pasar el lisado a través de un calibre 30 ½ jeringa aproximadamente 15 veces, y se enfría en hielo durante 30 min.
- Centrifugar los tubos a 14.000 rpm (~ 20.000 g) durante 15 min a 4 ° C.
- Transferir el sobrenadante a tubos de centrífuga de nuevo, y guardar a -80 ° C.
7. SDS-PAGE análisis de proteínas enriquecido la cultura-OC
- Resolver 30 g de proteína por muestra en la reducción de buffer por SDS-PAGE en el estándar del 12% de poli-acrilamida geles.
- Semi-seco de transferencia de geles a membranas de PVDF.
- Bloquear las membranas durante 1 hora en un 5% leche desnatada en polvo en TBST (10 mM Tris-HCl pH 8,0, 150 mM NaCl, 0,1% Tween-20).
- Incube las membranas con anticuerpos primarios diluidos en solución de bloqueo durante 1 hora.
- Lave las membranas 3 veces con TBST durante 10 minutos.
- Se incuban las membranas con conjugado HRP-secundaria de anticuerpos durante 45 minutos en solución de bloqueo.
- Lave las membranas varias veces con TBST y se incuban con Amersham ECL Plus Western Blot reactivo de detección (GE Healthcare) durante 5 min.
- Detectar las bandas de proteínas con una película estándar de imágenes científicas.
8. Los resultados representativos:
En este protocolo, los OPC se expanden en una monocapa de astrocitos dentro de una cultura gliales mixtos. Esta cultura gliales mixtos se deriva de la P0-P2 corteza del ratón neonatal. En el día 1 in vitro (DIV1), la cultura gliales mixtos contienen células con morfologías diferentes como se ve al microscopio de contraste de fase (figura 2a). En DIV3, una monocapa de astrocitos se empieza a formar en la base del frasco, y en DIV8, OPC se puede observar claramente en la superficie de monocapa. En DIV9, la proliferación de las OPC han alcanzado una densidad suficiente para ser purificada por la noche a la mañana de alta velocidad agitación orbital. Una vez que el proceso de purificación ha sido completada, el resultado es una población de células OPC-enriquecido. En la purificación DIV1-post, OPC tienen una morfología simple, extendiendo algunos procesos (figura 2b). En la purificación posterior DIV3, las células se han extendido una malla compleja de procesos, que recuerda a LB inmaduros. En la purificación posterior DIV6, el LB purificada han aplanado y proyectado folleto-como las estructuras de la membrana. Este desarrollo morfológico es típico de la maduración in vitro de MCO.
Microscopio de inmunofluorescencia indica que las células son purificadas de OL de linaje (Figura 3a). Cabeza de serie OPC inicialmente expresar sulfato de condroitina proteoglicanos (NG2), y se desarrollan en la mielina glicoproteína asociada (MAG) positivo LB inmaduros dentro de los tres días después de la siembra (Figura 3b). En DIV6, LB muchos expresan proteína básica de mielina (MBP), y poseen la morfología típica OL madura. OL por ciento de linaje células se cuantificaron en diferentes puntos temporales para determinar la pureza de las culturas OL-enriquecido (Fig. 3c). En la purificación posterior DIV1, las culturas son de 50 ± 14% NG2 OPC + ve, que no he MAG + o MBP + LB ve. Esto indica que el purificado OL-linaje de células se encuentran en la etapa previa a la hora de la siembra, con un número insignificante de LB diferenciados. En DIV3, LB muchos se han diferenciado en células MAG he + (24 ± 5,9%) mientras que otros mantienen el fenotipo precursor, y siguen siendo NG2 + (13 ± 8,0%). En DIV3, una pequeña proporción de células MAG + ve (3,2 al 1,2%) también son expresión de MBP. En DIV6, 20 ± 5,9% de MCO son MAG + ve mientras que el 12 ± 7,3% persisten como NG2 + OPC ve. Además, 21 ± 9,3% de las células dentro de la cultura son MBP + LB ve en este punto del tiempo. SDS-PAGE análisis muestra la expresión gradual de 2'3'-cíclico de nucleótido 3'-fosfodiesterasa (CNP) y MBP durante el período de cultivo de 6 días, lo que demuestra la capacidad de los OPC en la cultura de diferenciar en fase terminal en LB maduros (Fig. 3d ). Colectivamente, estos datos se establece a este método como una manera de producir un sistema de cultivo OL enriquecido apto para el estudio de la maduración de OL OPC.
Este protocolo también se describen los métodos para establecer OL / DRGN co-cultivos con murino de sólo fuentes de tejidos. Sin embargo, con el fin de producir el co-cultivo, DRGNs debe ser cultivada sólo para producir una red de neuritas adecuada. Estas culturas murino post-natal de neuronas se producen durante 9 días en los medios de comunicación de baja de suero con 10 suplementos FUDR M para evitar la proliferación de los fibroblastos de la contaminación y gl células ial. En el transcurso de 9 días in vitro, DRGNs aislados producen una cama neuritas densa (Fig. 4a). Esta cama es neuritas inmunopositivas de neurofilamentos marcadores neuronales 200 (NF) y Tuj1 (Fig. 4B). En este punto, los OPC purificada se puede añadir a los lechos de las neuritas, y cultivadas durante 6 días para producir myelinating co-cultivos.
En DIV6 de OL / DRGN co-cultivo, muchas MBP + LB ve se puede observar entre los NF + ve neuritas DRGN (Fig. 5a). Un examen más detenido, la Operación se ponen de manifiesto para hacer contacto con neuritas DRGN numerosas, a menudo ensheathing con una membrana de MBP + ve (Fig. 5b, c).
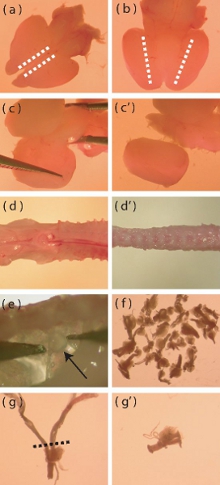
Figura 1. Imágenes de microscopio de disección de los aspectos particulares de la corteza cerebral del ratón neonatal y el aislamiento DRG. (A) Vista dorsal de un cerebro de ratón recién extraído neonatal. Las líneas punteadas indican el área donde las incisiones se debe hacer para facilitar la remoción de la capa meníngea. (B) Vista ventral del cerebro, líneas de puntos indican la zona donde la corteza se reúne el diencéfalo ventral. Incisiones profundas se debe hacer a lo largo de las líneas de puntos para ayudar al aislamiento de las cortezas. (C-c ') la representación visual de la forma de arrancar la corteza de distancia del resto del cerebro. (D) Un recién aisladas P5-P10 columna vertebral del ratón antes de que el recorte de distancia exceso de músculo y hueso (d). (e) Ubicación de los GRD de la columna vertebral. (f) El número aproximado de los GRD que debe estar aislado de un ratón. (g) A DRG con raíces largas que requieren corte antes de la digestión enzimática. La línea punteada indica la zona donde las raíces se deben recortar. (G) DRG después de cortar de raíz.
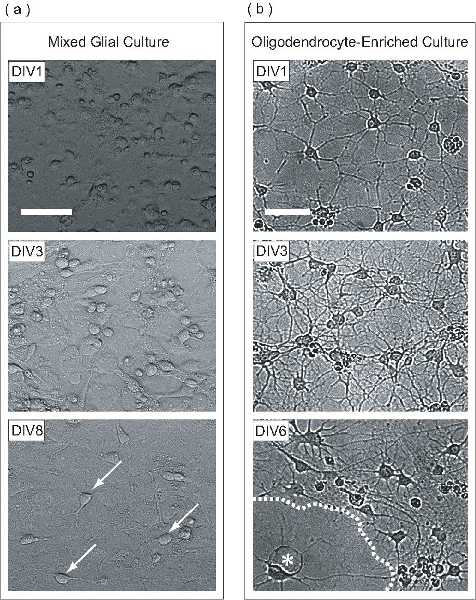
Figura 2. OPC se expanden dentro de una cultura gliales mixtos, se purifica, y, posteriormente, como una cultura diferenciada OL-enriquecido. (A) las imágenes de contraste de fase de cultivos mixtos de glía en diferentes etapas de desarrollo. En DIV1, las células parecen redondas con pocas células aplanadas. La estratificación de la cultura gliales mixtos comienza en DIV3, donde los astrocitos forman una monocapa uniforme en la base del frasco, en el que proliferan los OPC. OPC se ven muchas en DIV8 (flechas) adherida a la superficie de la monocapa de astrocitos. (B) Una vez purificado de la cultura gliales mixtos, DIV1 OPC han extendido sólo unos pocos procesos. En DIV3, las células se han extendido muchos procesos, una reminiscencia de la etapa intermedia de MCO. En DIV6, LB aplanado (asterisco) parecen haber producido hojas membranosas (línea discontinua). Las barras de escala, de 50 micras.
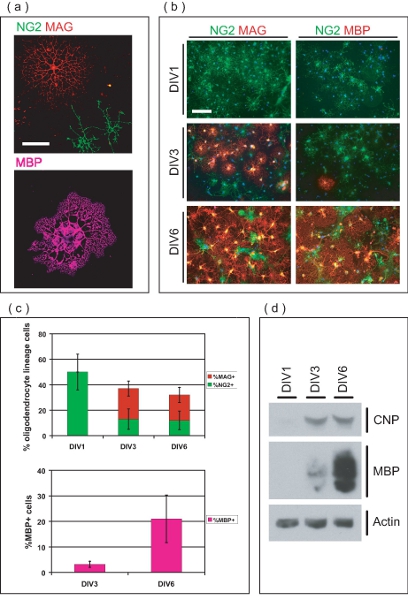
Figura 3. Caracterización de la LO-enriquecido la cultura. (A) Confocal de imágenes de la Operación aisladas en diferentes etapas de desarrollo. NG2 + OPC ve tienen una morfología simple, mientras que MAG LB + ve poseen múltiples procesos arborous. MBP + LB he han extendido membranosa de mielina como las hojas. Barra de escala, de 50 micras. (B) purificada OL-linaje de células se originan como OPC, y se diferencian en MAG + ve, la Operación he MBP + más de 6 DIV. En DIV1, todas las OPC son NG2 + ve, mientras que ninguno se MAG + ve o MBP + ve. En DIV3, MAG + ve y MBP pocos LB + ve ahora son evidentes. La mayoría de las MCO son MAG y MBP + ve en DIV6, con NG2 pocas + OPC ve. Barra de escala, 100 micras. (C) Los valores medios ± desviación estándar del porcentaje OL-linaje células en diferentes etapas de desarrollo de más de 6 DIV. En DIV1, todas las células de linaje son OL NG2 + ve, con un 50 ± 14% del total de células dentro de la cultura. En DIV3 y DIV6, OL-linaje células representan respectivamente el 36 ± 6,8% y 32 ± 8,4% del total de células, que consiste en proporciones variables de NG2 + ve, MAG + ve y MBP + LB ve. (D) SDS-PAGE realizado de proteína derivada de la enriquecido OL-culturas que demuestra la expresión gradual de marcadores OL-CNP y MBP durante el período de 6 DIV cultura.
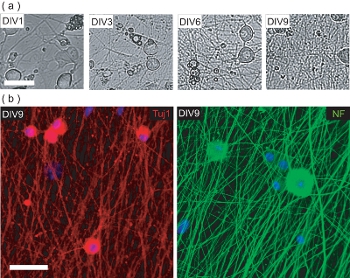
Figura 4. Caracterización de la cultura pre-OPC DRGN siembra. (A) Fase de imágenes de contraste de DRGNs durante el período de nueve DIV cultura pre-OPC siembra. DRGNs se originan como células de cuerpo grande, con pocos procesos, y producir una red de neuritas cada vez más complejo. Barra de escala, 100 micras. (B) Confocal de imágenes de las culturas DRGN fija en DIV9 (pre-siembra OPC) y se tiñeron de las neuronas de marcadores específicos de Tuj1 y NF200. DRGNs han producido una red de neuritas en el que los OPC pueden sembrar para producir OL / DRGN myelinating co-cultivos. Barra de escala, de 50 micras.
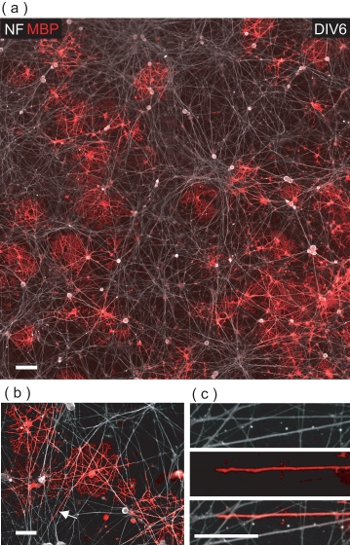
Figura 5. LB co-cultivadas con resultado DRGNs en OL-mediada por la envoltura de las neuritas DRGN con MBP + membrana ve. (A) Una imagen de 4-campo confocal montaje de un DIV6 OL / DRGN co-cultivo. Muchos MBP + LB he puede ver la interacción con el lecho subyacente DRGN neuritas. Barra de escala, 100 micras. (B) A la vista ampliada confocal de MBP + LB he envolver neuritas múltiples DRGN. Barra de escala, de 50 micras. (C) ampliación digital de la región indicada en (b) cuando una neurita DRGN está envuelto con la membrana de la mucosa bucal. Barra de escala, de 25 micras.
Discusión
Este informe describe un método para aislar OPC murino para la diferenciación de las culturas OL-enriquecido o OL / DRGN co-culturas. Cuando se cultiva solo, el OPC se diferencian en MBP + LB ve, la producción de mielina, como las hojas membranosas. Cuando se añade a DRGN camas neuritas, LB envuelven las neuritas DRGN con MBP + membrana ve. Este modelo beneficia a la investigación de los complejos fundamentos que rigen OL mediada ensheathment axonal.
Aunque de gran valor, el establecimiento de estas culturas es un reto técnico. En particular, los aspectos difíciles incluyen la digestión del tejido eficiente / disociación, el mantenimiento de la cultura equilibrada pH del medio, y los cambios DRGN los medios de comunicación. Es importante tener en cuenta que la longitud de la digestión, la cantidad de tejido que se digieren y la cantidad de trituración afecta el resultado de la eficacia y al final de la disociación del tejido. No es inusual para los investigadores con experiencia para obtener bajos rendimientos celulares de disociar los tejidos del sistema nervioso. Además, los OPC murino tienden a ser sensibles a los cambios en el pH del medio de cultivo, especialmente bajo condiciones alcalinas. El mantenimiento de los cultivos en el 8,5% de CO 2 tiene por objeto prevenir esto, ya que los OPC parecen tolerar mejor las condiciones más básicas ligeramente ácido. En cuanto a DRGNs alimentación, cambios en los medios debe realizarse rápidamente ya que no para desecar las neuronas, sin embargo, debe ser suave como para no interrumpir la cama neuritas en desarrollo. Cambios bruscos de medios puede desplazar la cama neuritas del sustrato, y el resultado probable de su disociación completa de la cubreobjetos.
El mérito potencial de este modelo de sistema enormemente eclipsa su naturaleza exigente técnicamente. Una de las ventajas de este sistema es el uso de post-natal para la derivación de los ratones de cultivo celular, evitando la necesidad de sacrificar las hembras reproductoras de la cosecha del tejido embrionario. Otra ventaja es la falta de exigencia de los factores de crecimiento (FC) para la expansión de las OPC. Mezcla de culturas gliales ofrecen un entorno que apoye la difusión de las OPC, presumiblemente debido a la presencia de factores tróficos astrocitos derivados. Otros métodos, como la derivación a través de neuroesferas 7,8, se basan en las propiedades mitogénicas de FC como el factor de crecimiento de fibroblastos básico (bFGF), factor de crecimiento epidérmico (EGF) y el derivado de plaquetas factor de crecimiento (PDGF) para la expansión de OPC. Del mismo modo, el uso postnatal (P5-10) de los ratones DRGNs evita la necesidad de complementar los medios de cultivo con el factor de crecimiento nervioso (NGF), un factor neurotrófico necesarios para la supervivencia in vitro de embriones DRGNs 9, 10. Es de interés para evitar el uso de NGF, ya que influye negativamente en la capacidad de myelinating LB cuando se cultivan con DRGNs 4. Evitar el uso de GF-complementado los medios de comunicación también tiene beneficios económicos, ya que estos reactivos ser costoso cuando se utiliza a gran escala.
Tal vez el beneficio más importante de este modelo de cultivo es su derivación de ratón sólo los tejidos, proporcionando así las oportunidades para obtener los OPC y DRGNs de la amplia variedad de líneas de ratones transgénicos. Esto permite el estudio de ambos DRGN y / o OPC propiedades específicas que rigen la mielinización. Esto será especialmente importante para dilucidar las interacciones receptor / ligando que regulan OL mediada por la mielinización de los axones. En total, esta técnica es de gran valor en cuanto a investigación en neurociencias, debido a sus aplicaciones a la comprensión de las señales moleculares que subyacen en la mielinización.
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Este proyecto fue financiado por una beca de la Sociedad de Esclerosis Múltiple de Canadá a RKRWO es beneficiario de una beca de la Sociedad de Esclerosis Múltiple de Canadá. El DEG es un receptor de becas post-doctorales de la Sociedad de Esclerosis Múltiple de Canadá y de Institutos Canadienses de Investigación en Salud.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del producto | Empresa | Número de producto | |
| Dulbecco Eagle modificado (DMEM) | Multicelda | 319 a 005-CL | |
| Solución salina equilibrada de Hank (HBSS) | Invitrogen | 14170-112 | |
| Mínimo de los medios de comunicación esencial (MEM) | GIBCO | 12360-038 | |
| De suero fetal bovino (FBS) | GIBCO | 10091-148 | |
| Penicilina-estreptomicina (penicilina / estreptomicina) | GIBCO | 15140-122 | |
| Glutamax | Invitrogen | 35050-061 | |
| Poli-L-lisina | Sigma-Aldrich | P2636 | |
| Albúmina de suero bovino (BSA) | Sigma-Aldrich | A4503 | |
| Humanos merosina proteico purificado (LN2) | Millipore | CC085 | |
| El factor recombinante de rata neurotrófico ciliar (CNTF) | PeproTech | 450-50 | |
| L-tiroxina | Biochemika | 89430 | |
| Holo-transferrina | Sigma-Aldrich | T0665 | |
| Suplemento B27 | GIBCO | 0080085-SA | |
| Insulina bovina | Sigma-Aldrich | I6634 | |
| 3,3 ',5-triyodo-L-tironina | Sigma-Aldrich | I6634 | |
| Progesterona | Sigma-Aldrich | P8783 | |
| Putrescina | Sigma-Aldrich | P7505 | |
| Selenita de sodio | Sigma-Aldrich | S5261 | |
| 5-fluoro-2'-desoxiuridina (FUDR) | Sigma-Aldrich | F0503 | |
| La papaína solución | Worthington | LS003126 | |
| DNaseI | ROCHE | 1010159001 | |
| L-cisteína | Sigma-Aldrich | C7352 | |
| 24 y los platos de cultivo de tejidos | Cellstar | 662-160 | |
| Frascos de cultivo de tejidos-T25 con la tapa del respiradero | Corning | 430639 | |
| 10 cm platos de cultivo de tejidos | Corning | 430167 | |
| 10 cm de una caja de petri | Fisher Scientific | 0875713 | |
| Colagenasa A | ROCHE | 103578 | |
| CellTrics 50 micras filtro (opcional) | PARTEC | 04-004-2327 | |
| Proteína básica de mielina (MBP) Anticuerpo | AbD Serotec | MCA409S | |
| NG2 anticuerpos | Millipore | AB5320 | |
| Mielina glicoproteína asociada (MAG) de anticuerpos | Millipore | MAB1567 | |
| 2 ', 3'-cíclico de nucleótido 3'-fosfodiesterasa (CNP) de anticuerpos | Covance | SMI-91R-100 | |
| Actina pan Ab-5 de anticuerpos | Fitzgerald | 10R-A106AX | |
| Neurofilamentos-200 (NF) de anticuerpos | Sigma-Aldrich | N4142 | |
| Beta-3 de cadena tubulina (Tuj1) de anticuerpos | Millipore | MAB5544 | |
| Alexa Fluor 488 cabra anti-conejo IgG (H + L) anticuerpo secundario | Invitrogen | A11008 | |
| Alexa Fluor 555 cabra anti-ratón IgG (H + L) anticuerpo secundario | Invitrogen | A21422 | |
| Alexa Fluor 647 cabra anti-rata (IgG) (H + L) anticuerpo secundario | Invitrogen | A21247 | |
| Cabra anti-ratón IgG (H + L)-HRP anticuerpo secundario conjugado | BioRad | 170-6516 | |
| De cabra anti-IgG de rata (H + L)-HRP anticuerpo secundario conjugado | Santa Cruz de Biotecnología | SC-2065 | |
| 4 ',6-diamidino-2-phenylindole (DAPI) | Sigma-Aldrich | D9542 |
Los medios de comunicación Recetas
OL-100X Suplemento *
| Ingrediente | Cantidad a añadir |
| DMEM | 100 ml |
| BSA | 1,02 g |
| Progesterona | 0,6 mg |
| Putrescina | 161 mg |
| Selenita de sodio | 0,05 mg |
| 3,3 ',5-triyodo-L-tironina | 4 mg |
* Almacene a -80 ° C en 250 alícuotas
t "> los medios de comunicación OL| Ingrediente | Cantidad a añadir |
| DMEM | 23,75 ml |
| OL-100X Suplemento | 250 l |
| Insulina bovina (de 1 mg / ml) | 125 l |
| Glutamax | 250 l |
| Holo-transferrina (de 33 mg / ml) | 37,5 l |
| B27 Suplemento | 500 l |
| FBS | 125 l |
| CNTF (de 50 ng / mL de archivo) | 25 l |
Mezcla de medios de cultivo gliales (compuesta en DMEM)
| Ingrediente | La concentración final |
| FBS | 10% |
| Penicilina / estreptomicina (0,33% del stock) | 33 unidades / ml de penicilina y estreptomicina 33 mg / ml |
| Glutamax | 1% |
DRGN los medios de comunicación (hecho en DMEM)
| Ingrediente | La concentración final |
| FBS | 10% |
| Penicilina / estreptomicina (1% del stock) | 100 unidades / ml de penicilina y estreptomicina 100 mg / ml |
Recetas de la digestión de solución:
OPC papaína solución (compuesto en el MEM)
| Ingrediente | La concentración final |
| La papaína solución | 1,54 mg / mL |
| L-cisteína | 360 mg / ml |
| DNaseI | 60 mg / ml |
DRG papaína solución (hecho en HBSS)
| Ingrediente | La concentración final |
| Papaína | 1,54 mg / mL |
| L-cisteína | 360 mg / ml |
DRG colagenasa Una solución (hecho en HBSS)
| Ingrediente | La concentración final |
| Colagenasa A | 4 mg / mL |
Referencias
- Avellana-Adalid, V. Expansion of rat oligodendrocyte progenitors into proliferative "oligospheres" that retain differentiation potential. J Neurosci Res. 45, 558-570 (1996).
- McCarthy, K. D., de Vellis, J. Preparation of separate astroglial and oligodendroglial cell cultures from rat cerebral tissue. J Cell Biol. 85, 890-902 (1980).
- Barres, B. A. Cell death and control of cell survival in the oligodendrocyte lineage. Cell. 70, 31-46 (1992).
- Chan, J. R. NGF controls axonal receptivity to myelination by Schwann cells or oligodendrocytes. Neuron. 43, 183-1891 (2004).
- Camara, J. Integrin-mediated axoglial interactions initiate myelination in the central nervous system. J Cell Biol. 185, 699-712 (2009).
- Ishibashi, T. Astrocytes promote myelination in response to electrical impulses. Neuron. 49, 823-832 (2006).
- Chen, Y. Isolation and culture of rat and mouse oligodendrocyte precursor cells. Nat Protoc. 2, 1044-1051 (2007).
- Pedraza, C. E. Production, characterization, and efficient transfection of highly pure oligodendrocyte precursor cultures from mouse embryonic neural progenitors. Glia. 56, 1339-1352 (2008).
- Lewin, G. R., Ritter, A. M., Mendell, L. M. On the role of nerve growth factor in the development of myelinated nociceptors. J Neurosci. 12, 1896-1905 (1992).
- Greene, L. A. Quantitative in vitro studies on the nerve growth factor (NGF) requirement of neurons. II. Sensory neurons. Dev Biol. 58, 106-113 (1977).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados