Method Article
Ableitung von Enriched Oligodendrozyten Kulturen und Oligodendrozyten / Neuron myelinisierenden Co-Kulturen von Post-Natal Mausgeweben
In diesem Artikel
Zusammenfassung
Dieser Artikel beschreibt Methoden zur Ableitung von angereicherten Populationen von murinen Oligodendrozyten-Vorläuferzellen (OPC) in primären Kultur, die, um zu reifen Oligodendrozyten (OLS) produzieren differenzieren. Darüber hinaus beschreibt dieser Bericht Techniken zur Herstellung murine myelinisierenden Co-Kulturen durch Impfen Maus OPCs auf einen Neuriten Bett Maus Spinalganglien Neuronen (DRGNs).
Zusammenfassung
Identifizierung der zugrunde liegenden molekularen Mechanismen OL Entwicklung ist nicht nur entscheidend für die Förderung unserer Kenntnis der OL Biologie, sondern hat auch Implikationen für das Verständnis der Pathogenese der demyelinisierenden Erkrankungen wie Multiple Sklerose (MS). Cellular Entwicklung wird allgemein mit primären Zellkultur-Modellen untersucht. Primäre Zellkultur erleichtert die Auswertung eines bestimmten Zelltyp durch die Bereitstellung einer kontrollierten Umgebung, frei von der Störvariablen, die in vivo sind. Während OL Kulturen von Ratten abgeleitet eine große Menge an Einsicht in OL Biologie zur Verfügung gestellt haben, hat ähnliche Bemühungen zur Schaffung OL Kulturen aus Mäusen, die mit großen Hindernissen erfüllt. Entwicklung von Methoden zur Kultur murine primäre OLs ist zwingend notwendig, um die Vorteile der zur Verfügung stehenden transgenen Mauslinien zu nehmen.
Mehrere Methoden zur Extraktion von OPCs von Nagetier Gewebe beschrieben worden, von Neurosphäre Ableitung, Differential Haftung Reinigung und immunopurification 1-3. Während viele Methoden Erfolg bieten, verlangen die meisten umfangreichen Kultur-mal und / oder teure Ausrüstung / Reagenzien. Um dies zu umgehen, ist reinigend OPCs aus murinen Gewebe mit einer Anpassung der Methode ursprünglich von McCarthy & de VELLIS 2 beschrieben bevorzugt. Bei dieser Methode wird die räumliche Trennung OPCs aus einer gemischten Gliazellen Kultur von neugeborenen Nagern Cortex abgeleitet. Das Ergebnis ist eine gereinigte OPC Bevölkerung, die in eine OL-angereicherten Kultur unterschieden werden können. Dieser Ansatz ist aufgrund seiner relativ kurzen Kulturzeit und der unnötige Voraussetzung für Wachstumsfaktoren oder Immunopanning Antikörper ansprechend.
Während der Erkundung der Mechanismen der OL Entwicklung in eine gereinigte Kultur ist informativ, bietet es keine der physiologisch relevanten Umfeld für die Beurteilung der Myelinscheide Bildung. Co-Kultivierung OLS mit Neuronen würden Einblick in die molekularen Grundlagen zur Regelung OL-vermittelte Myelinisierung von Axonen zu verleihen. Für viele OL / Neuron Co-Kultur-Studien haben Spinalganglien Neuronen (DRGNs) nachweislich das Neuron Art der Wahl sein. Sie sind ideal für Co-Kultur mit OLs durch ihre einfache Extraktion, minimale Menge an kontaminierenden Zellen und die Bildung von dichten Neuriten Betten. Während Studien mit Ratte / Maus myelinisierenden xenocultures veröffentlicht worden sind 4-6, ein Verfahren zur Ableitung solcher OL / DRGN myelinisierenden Co-Kulturen von postnatalen murinen Gewebe wurde nicht beschrieben. Hier präsentieren wir Ihnen detaillierte Methoden auf, wie man effektiv produzieren solche Kulturen, zusammen mit Beispielen von den erwarteten Ergebnissen. Diese Methoden sind nützlich für die Behandlung relevanten Fragen OL Entwicklung / myelinisierenden Funktion und sind nützliche Werkzeuge im Bereich der Neurowissenschaften.
Protokoll
Ethics Statement
Die Mäuse in dieser Arbeit verwendet wurden gemäß den kanadischen Rates über Animal Care (CCAC) Richtlinien betreut. Ethische Zulassung für Experimente wurde von der University of Ottawa Animal Care Committee unter Protokoll-Nummer OGH-119 erhalten.
1. Dissection - neonatalen Maus Kortex für die OPC-Extraktion
- Sacrifice P0-P2-Maus nach den Richtlinien des Instituts.
- Präparieren Sie die Gehirn und in eine Petrischale mit eiskaltem MEM (Antibiotika-frei).
- Übertragen Sie die Schüssel zu einer Dissektionsmikroskop.
- Mit einem Skalpell mit dem Gehirn dorsal nach oben, um einen flachen Schnitt sagittal entlang der medialen Kante der Hirnrinde (Abb. 1a). Dieser Schnitt sollte nur durch die Hirnhäute Schicht übergeben, um deren Entfernung zu erleichtern.
- Verwenden Sie feine Spitze Pinzette Abziehen der Meningen in eine seitliche Mode. Wenn es vorsichtig, kann diese Schicht in einem Stück entfernt werden. In diesem Schritt entfernen Sie die Riechkolben.
- Mit dem Gehirn Bauchseite-up, einen tiefen Einschnitt sagittal, wo die Rinde entspricht dem ventralen Bereich des Zwischenhirns (Abb. 1b).
- Mit dem Gehirn dorsal-up, trennen Sie die Rinden vom Mittelhirn von neugierigen das Gewebe in einer medial nach lateral Mode (Abb. 1c, c '). Entfernen Sie alle verbleibenden Meningen bei diesem Schritt.
- Dice jeder Kortex in ca. 4 Stück und schonend in ein 15 ml konische Röhrchen mit 350 ul MEM pro Maus Gehirn zu übertragen. Halten Sie das Röhrchen auf Eis, bis alle Mäuse verarbeitet worden sind.
- Wiederholen Sie die Schritte 1,1-1,8 für die übrigen Mäuse.
2. Die Dissoziation von Neugeborenen Kortex und Wartung von gemischten Gliazellen Kulturen
Hinweis: Die Einführung von Blasen in der Zellsuspension sollte während alle der folgenden Schritte vermieden werden.
- Die 15 ml konische Röhrchen mit den frisch präparierten Gehirnen zu einem 37 ° C Wasserbad für 3 min.
- Transfer Gehirn, um eine sterile Gewebekultur Kapuze.
- Vorsichtig passieren gewürfelt Kortex durch einen P1000 Pipettenspitze in kleinere Fragmente zu generieren. Stoppen Pipettieren einmal dort kein Gehirn Stücke sind groß genug, um einen reibungslosen Ablauf der Suspension durch die Pipettenspitze zu stören.
- Add 75 ul OPC Papain-Lösung pro Kopf in den konischen Rohr. Die OPC-Papain-Lösung muss bei 37 vorgewärmt werden ° C für 20 min vor dem Gebrauch.
- Inkubieren bei 37 ° C Wasserbad für 20 min. Etwa alle 2 Minuten sanft das Röhrchen, um Gewebe-Aggregation verhindern. Während dieser Zeit werden 5 ml der gemischten Gliazellen Kulturmedien zu jedem Poly-L-Lysin (PLL) beschichtet (1 mg / mL) T25 Kolben (eine Flasche pro Maus Gehirn), und in einem 37 ° C Gewebekultur-Inkubator bei 8,5% CO 2.
- Nach 20 min wieder das Gewebe Suspension auf die sterile Haube und 2 mL von gemischten Gliazellen Kulturmedien pro Kopf um das Rohr. Lassen Sie sitzen für 10 Minuten bei Raumtemperatur zur Inaktivierung des OPC Papain-Lösung zu ermöglichen.
- Aliquot des Gewebes Suspension in 5 ml Plastikröhrchen. Die Anzahl der Rohre muss mit der Anzahl der Gehirne seziert, was in etwa 2,5 ml pro Röhrchen.
- Mit einem sterilen schwer poliertem Glas Pasteur Pipette vorsichtig verreiben das Gewebe in jeder Röhre. Man reibt zunächst langsam, nach und nach die Geschwindigkeit erhöhen, als Stücke zu distanzieren. Man reibt ca. 10-15 mal, aber diese Zahl kann basierend auf der Wirksamkeit der Verdauung variieren.
Hinweis: Unter-Verreibung wird in armen Dissoziation des Gewebes führen, während over-Verreibung wird sich negativ auf die Lebensfähigkeit der Zellen auswirken. Es ist wichtig, nicht einführen Blasen in die Lösung, da dies ernsthafte Auswirkungen auf die Lebensfähigkeit der Zellen.
- Sobald keine sichtbaren Gewebe Klumpen übrigen in der Suspension sind, zu einem 50 ml konischen Röhrchen mit 4 ml der gemischten Gliazellen Kulturmedien pro Kopf (dh 4 Köpfe = 16 mL gemischten Gliazellen Kulturmedien) zu übertragen.
- Vorsichtig auf den Kopf der 50 mL konischen Rohr, und wiederholen Sie für die restlichen 5 ml-Röhrchen.
- Aliquot der gepoolten Zellsuspension in 15 ml konische Röhrchen (ca. 6,5 ml pro 15 ml Tube). Die Zahl der 15-ml-Röhrchen mit der Anzahl der Gehirne seziert.
- Zentrifugieren bei 1200 Umdrehungen pro Minute (~ 300 g) für 5 min.
- Vorsichtig absaugen des Überstandes und 1 mL warmen gemischten Gliazellen Kulturmedien zu je 15 ml konischen Rohr.
- Langsam das Pellet mit einem P1000 Pipettenspitze man aufpassen, nicht zu Blasen führen. Fügen Sie die Zellsuspension aus jeder Röhre ein voräquilibriert PLL-beschichteten T25 Kolben, wodurch die Gesamtmenge der Kulturmedien zu 6 mL.
- Legen Sie die Flaschen in einem Gewebekultur-Inkubator für 3-4 Stunden, damit die Zellen an die PLL Substrat befestigen. Führen Sie eine vollständige Medienwechsel durch Pipettieren aus den Medien und Zugabe von 6 ml frischem gemischten Gliazellen von Nährmedien in die Flaschen. Dieser Schritt entfernt einen Großteil der Trümmerverursacht durch die Verreibung und fördert die Kultur Lebensfähigkeit. Wenn OL / DRGN Co-Kulturen gewünscht werden, § 3 dieses Protokolls beziehen.
- Nach 3 Tagen Kultur, führen Sie eine 2 / 3 Medien ändern, indem 4 mL von Medien und Ersetzen mit 4 ml frisch gemischten Gliazellen Kulturmedien. An dieser Stelle sollte ein Astrozyten Monoschicht auf der Basis der Flaschen werden bilden.
- Am Tag 6, führen Sie einen anderen 2 / 3 Medien ändern und ergänzen die Flaschen mit einer Endkonzentration von 5 mg / ml Insulin. An dieser Stelle sollte ein Astrozyten Monoschicht deutlich sichtbar sein, auf dem sich OPCs werden proliferierenden wird.
3. DRGN Isolation
Hinweis: Zur Herstellung von OL / DRGNs Co-Kulturen, DRGNs etablierten sollte am Tag nach gemischten Gliazellen Kultur Generation. Beide Typen sind unabhängig Kultur gewachsen, und kombiniert nach 9-10 Tagen.
- Sacrifice P5-P10 Maus nach den Richtlinien des Instituts.
- Entpacken Sie die Wirbelsäule und die Übertragung auf eine saubere Petrischale.
- Trim entfernt so viel Muskeln und Knochen aus der Wirbelsäule wie möglich (Abb. 1d, d '), da dies die Zerlegung der Spinalganglien (DRGs) zu erleichtern.
- Übertragen Sie die getrimmt Wirbelsäule, um eine neue Petrischale Bauchseite-up. Mit Dissektion Schere und beginnt kaudal, medial Schnitt durch die Wirbelsäule in eine longitudinale Mode.
- Mit zwei Pinzetten, hebeln öffnen Sie die Wirbelsäule das Rückenmark freizulegen.
- DRGs können unter gefunden werden und lateral des Rückenmarks. Mit feinen Spitzen einer Pinzette vorsichtig entfernen Sie die DRGs, während Vermeidung von Schäden an den Ganglien (Abb. 1e).
- Übertragen Sie die entfernt DRGs gepuffert Salz eiskalte Hank-Lösung (HBSS, Antibiotika-frei) in eine neue Petrischale. Die Dissektor sollte Ziel auf 40 DRGs pro Maus (Abb. 1f) zu extrahieren.
- Sobald die DRGs extrahiert wurden, schneiden Sie die DRGs einer übermäßig langen Wurzeln (Abb. 1 g, g '), um die Einführung von kontaminierenden Zellen in der Kultur (Glia-Zellen, Fibroblasten) zu minimieren.
- Übertragen Sie die DRGs zu einer 1,5-ml-Zentrifugenröhrchen mit 500 mL eiskaltem HBSS.
- Zentrifugation bei 1200 rpm (~ 300 g) für 5 min bei 4 ° C zu Pellets der DRGs.
- Übertragen Sie die Zentrifugenröhrchen in eine sterile Gewebekultur Haube und entfernen Sie die HBSS aus den Rohren.
- Add 500 mL vorgewärmtes (20 min bei 37 ° C) DRG Papain-Lösung, und die Röhrchen in einem 37 ° C Wasserbad für 10 min. Kehren Sie die Rohre alle 2 min, um Gewebe-Aggregation verhindern.
- Wiederholen Sie Schritt 3.10.
- Entfernen Sie die DRG Papain-Lösung und fügen 500 mL vorgewärmtes (20 min bei 37 ° C) Collagenase A-Lösung. Inkubieren bei 37 ° C Wasserbad für 10 min, Invertieren alle 2 min.
- Wiederholen Sie Schritt 3.10.
- Überstand entfernen und 1 mL DRGN Medien. Röhrchen mehrmals kippen.
- Wiederholen Sie Schritt 3.10.
- Wiederholen Sie Schritt 3.16.
- Coat ein steriles schwer poliertem Glas Pasteurpipette mit Rinderserumalbumin (BSA) durch Pipettieren einer Lösung von 0,25% BSA in HBSS mehrmals. Die Beschichtung mit BSA-Lösung wird der DRGs aus an den Wänden der Glaspipette zu verhindern.
- Man reibt die DRGs mit dem BSA-beschichteten Pipette vorsichtig auf den ersten, und mit zunehmender Intensität einmal Klumpen beginnen distanziert. Man reibt ca. 10-15 mal, aber diese Zahl ist abhängig vom Grad der Verdauung, und die Anzahl der DRGs pro Röhre.
- Nach Dissoziation erreicht ist, passieren die Suspension durch ein 50 um-Filter in eine sterile Petrischale mit 7 ml DRGN Medien. Filtration beseitigt einen Großteil der Trümmer aus der Zellsuspension, obwohl dieser Schritt ist nicht kritisch.
- Inkubieren Sie die Petrischale mit 8,5% CO 2 für ca. 1,25 Stunden.
- Coat mehrere 12 mm Deckgläser mit LN2 (10 ug / mL in PBS) in einer 24-well Schale während dieser Inkubationszeit.
- Nach der Inkubation beendet ist, beachten Sie die Petrischale unter Hellfeld. DRGNs werden als große Körper, dunkle Phase-Zellen identifiziert. Swirl der Petrischale vorsichtig, um keine eingehalten DRGNs Aufzug.
Hinweis: Viele kontaminierenden Zellen wird stark auf die Petrischale geklebt haben, damit Anreicherung Ihrer Zellsuspension für DRGNs.
- Übertragen Sie die Zellsuspension auf eine 15 ml konischen Rohr. Vorsichtig spülen Sie die Schale mit 4 ml DRGN Medien, um restliche DRGNs sammeln. Übertragen Sie die zusätzlichen 4 mL der konischen Rohr.
- Zentrifugieren Sie für 5 min bei 1200 rpm (~ 300 g).
- Saugen Sie den Überstand und das Pellet in 500 ml frisches DRGN Medien.
- Berechnen Sie die Anzahl der ergab DRGNs mit einer Zählkammer. Achten Sie darauf, zählen nur die DRGNs, und nicht andere Zelltypen. DRGNs können durch ihre großen kugelförmigen Zellkörper identifiziert werden.
- Seed 30.000-50.000 DRGNs jedem LN2-beschichteten Deckglas in 1 ml DRGN Medien und in einem 37 ° C Gewebekultur-Inkubator mit 8,5% CO 2 über Nacht.
- Am nächsten Morgen, führen Sie eine vollständige Medien ändern, indem die DRGNMedien mit OL Medien (minus CNTF) mit einer Endkonzentration von 1% Pen / Strep und 10 uM FUDR.
- An den Tagen 3 und 5, führen Sie eine 3 / 4 Medien ändern sich mit den gleichen Medien wie in Schritt 3.30.
- Am Tag 7, eine vollständige Medien ändern sich mit OL Medien (minus CNTF, Pen / Strep, FUDR).
- Am Tag 9, sollte der DRGNs ein umfangreiches Neuriten Bett gebildet haben, und sind nun bereit zu sein Co-Kultivierung mit OPC.
4. Reinigung von OPCs aus gemischten Gliazellen Kulturen für die Einrichtung eines OL-angereicherten Kulturen oder OL / DRGN Co-Kulturen
- Am Tag 9 der gemischten Gliazellen Kultur, überweisen Sie den Kolben auf einem Schüttler in einer 5% CO 2 Gewebekultur-Inkubator. Legen Sie die Flaschen auf der leeren Flaschen T25 keine Wärme aus dem Orbitalschüttler generiert nicht negativ auf die gemischten Gliazellen Kulturen zu verhindern. Lassen Sie den Kulturen auf diese neue Inkubator für 1 Stunde ausgleichen.
- Sobald der Kolben ausgeglichen haben, schütteln Sie die Kolben bei 50 rpm für 45 min. Der Zweck dieser Shake ist keine lose anhaftenden verunreinigenden Zellen aus dem Monolayer zu entfernen.
- Bewegen Zellen einer Gewebekultur Haube und entfernen Sie alle Medien aus dem Fläschchen. Ersetzen mit 4 ml frisch gemischten Gliazellen Kulturmedien mit 5 pg / ml Insulin ergänzt.
- Setzen Sie den Kolben wieder auf die Shaker, und lassen Sie sie für etwa 3 Stunden ruhen.
- Sobald der Kolben ausgeglichen sind, sind sie fest mit dem Schüttler, und schütteln Sie die Flaschen für ca. 16 Stunden bei 220 Umdrehungen pro Minute (über Nacht).
- Am nächsten Morgen, wenn ole sind in Abwesenheit von DRGNs (dh OL-angereicherten Kultur), Mantel mehrere sterile 12 mm Deckgläser mit LN2 (10 ug / mL in PBS) für 1 Stunde angebaut werden. Übertragen Sie die Deckgläschen in 24-Well-Schalen mit PBS waschen, gefolgt von einer OL Medien zu waschen. 1 ml der OL Medien in jede Vertiefung und Gleichgewicht bei 8,5% CO 2.
- Äquilibrieren 10 cm Gewebekulturschalen bei 5% CO 2 für 30 min. Eine Schüssel wird für jeweils 2 Flaschen benötigt werden. Diese werden für die differentielle Haftung Bereicherung des suspendierten OPCs verwendet werden.
- Sobald die 30 min Äquilibrierung abgelaufen ist, übertragen Sie die Medien aus dem Schüttelkolben auf die Gerichte. Jedes Gericht sollte Medien von 2 Flaschen erhalten, das entspricht ca. 8 ml Zellsuspension pro 10 cm Schüssel.
- Inkubieren Sie die Gerichte bei 5% CO 2 für 30 min und bietet gleichzeitig einen sanften Schubs im 15 min Marke. Dieser Anstoß wird verhindert, OPCs an der Einhaltung der 10 cm Schüssel.
- Nach der Inkubation abgeschlossen ist, prüfen die Gerichte unter Hellfeld. OPCs sind als kleine Zellklumpen, in der Regel aus 3-5 Zellen identifiziert, aber manchmal bilden größere Aggregate ähneln Neurosphären. Viele Nicht-OL Linie Zellen sollten fest auf dem Boden der Platte eingehalten werden. Vorsichtig schwenken die Platten lösen keine lose eingehalten OPCs, und übertragen Sie die Zellsuspension von jeder Platte in eine 15 ml konischen Rohr.
- Zentrifugation bei 1200 rpm (~ 300 g) für 5 min.
- Das Pellet in 1 ml OL Medien mit einer P1000 Pipettenspitze durch Resuspension mit einem P200 Pipettenspitze gefolgt.
- Zählen Sie die Zellen mit Hilfe einer Zählkammer.
- Für angereichert-OL Kulturen, Saatgut 25.000 - 50.000 OPCs zu je 12 mm LN2-beschichteten Deckglas in einem Gesamtvolumen von 1 mL OL Medien.
- Für OL / DRGN Co-Kulturen, führen Sie eine vollständige OL Medien (minus CNTF) zu ändern auf der DRGNs von Abschnitt [3], und sanft add 50.000 Zellen aus dem OPC-angereicherten Zellsuspension. Achten Sie darauf, nicht stören DRGN Neuriten Bett während die Zugabe von OPC.
- Legen Kulturen in einem 37 ° C-Inkubator mit 8,5% CO 2, und vermeiden Sie das Entfernen, bis Fixierung. Murine OPCs reagieren empfindlich auf Veränderungen des pH-Wertes und der Entnahme aus dem Inkubator wird verändert den pH des OL-Medien. Auch der Hinweis, wird zusätzlich von dH 2 O, um den leeren Brunnen rund um die Zellkulturen zu verhindern Verdampfung der Kulturmedien und minimiert so Schwankungen in der Konzentration gelöster Stoffe in der OL-Medien. Dies wird ein einheitlicheres Umfeld für den OPC.
5. Die Verarbeitung von Kulturen für Immunfluoreszenz-Mikroskopie
- Fix Kulturen mit 100% Methanol bei -20 ° C für 10 min oder 3% Paraformaldehyd bei Raumtemperatur für 15 min.
- Permeabilisieren Deckgläschen mit 0,1% Triton-X-100 für 10 min, mit Phosphat-gepufferter Kochsalzlösung (PBS) und Block waschen für 1 Stunde in 10% Ziegenserum.
- Inkubieren Deckgläser mit primären Antikörpern in Blockierungslösung über Nacht bei 4 ° C verdünnt
- Wash Deckgläschen 3 mal mit PBS und Inkubation mit Alexa-Fluor-konjugierten sekundären Antikörper (Invitrogen) in Blocking-Lösung für 45 min verdünnt.
- Gegenfärbung mit 4 ',6-Diamino-2-phenylindole (DAPI) und waschen Deckgläser mehrmals mit PBS.
- Berg Deckgläser in DAKO fluoreszierenden Mounting Medium.
- Analysieren Sie gleitet über Immunfluoreszenzmikroskopie. In diesem Protokoll wurden die Objektträger entweder mit einem Zeiss Axiovert 200M inversen Fluoreszenz-AnalyseMikroskop oder einem Zeiss LSM 510 META Laser-Scanning-konfokalen Mikroskop.
6. Whole Cell Protein-Extraktion aus OL-angereicherten Kulturen
- Nehmen Sie 24-Well-Kulturen von Inkubator und kühlen auf Eis für 3 min.
- Entfernen Sie vorsichtig Medien, und fügen 10-20 ul Lysepuffer (50 mM Tris-HCl, 150 mM NaCl, 0,1% SDS, 0,5% Natriumdeoxycholat, 1% Triton-X-100, mit 0,1% Pepstatin, Aprotinin, PMSF, Leupeptin Natriumorthovanadat) in jede Vertiefung (mindestens 8 Bohrungen pro Probe wird empfohlen).
- Scrape Brunnen mit einem breiten Bohrung P1000 Pipettenspitze und Transfer des Lysats in ein 1,5 ml Zentrifugenröhrchen.
- Pass das Lysat durch eine 30 ½-Gauge-Spritze ca. 15 mal, und Chill auf Eis für 30 min.
- Zentrifugenröhrchen bei 14.000 rpm (~ 20.000 g) für 15 min bei 4 ° C.
- Überstand in neue Röhrchen und lagern bei -80 ° C.
7. SDS-PAGE-Analyse auf angereichert-OL Kultur Protein
- Resolve 30 ug Protein pro Probe bei der Verringerung der Puffer durch SDS-PAGE auf Standard-12% Poly-Acrylamid-Gelen.
- Semi-dry Transfer Gelen auf PVDF-Membranen.
- Block Membranen für 1 Stunde in 5% Magermilchpulver in TBST (10 mM Tris-HCl pH 8,0, 150 mM NaCl, 0,1% Tween-20).
- Inkubieren Membranen mit primären Antikörpern in Blockierungslösung für 1 Stunde verdünnt.
- Wash Membranen 3 mal mit TBST für 10 min.
- Inkubieren Sie die Membran mit HRP-konjugierten Sekundärantikörper für 45 min in Blockierungslösung.
- Wash Membranen mehrmals mit TBST, und inkubieren mit Amersham ECL Plus Western-Blot Nachweisreagenz (GE Healthcare) für 5 min.
- Detect Proteinbanden mit Standard Scientific Imaging Film.
8. Repräsentative Ergebnisse:
In diesem Protokoll werden OPCs auf Astrozyten Monoschicht innerhalb einer gemischten Gliazellen Kultur erweitert. Diese gemischte Gliazellen Kultur ist von P0-P2 neonatalen Maus Cortex abgeleitet. Am Tag 1 in vitro (DIV1), enthält die gemischten Gliazellen Kultur-Zellen mit unterschiedlichen Morphologien wie Phasenkontrast-Mikroskopie (Abb. 2a) zu sehen. Am DIV3, beginnt eine Astrozyten Monoschicht auf der Basis des Kolbens bilden, und bei DIV8, OPCs deutlich auf die Monoschicht Oberfläche beobachtet werden. Am DIV9 haben die wuchernden OPCs ausreichende Dichte erreicht, um über Nacht High-Speed-Orbital Schütteln gereinigt werden. Sobald die Reinigung abgeschlossen ist, ist das Ergebnis eines OPC-angereicherten Zellpopulation. Am DIV1-post Reinigung haben OPCs einfache Morphologie, Erweiterung wenige Prozesse (Abb. 2b). Am DIV3 post Reinigung, haben die Zellen ein komplexes Geflecht von Prozessen, erinnert an unreife OLs verlängert. Am DIV6 post Reinigung wurden die gereinigten OLs abgeflacht und projiziert Flugblatt-like Membranstrukturen. Diese morphologische Entwicklung ist typisch für die in vitro-Reifung von OLS.
Immunfluoreszenzmikroskopie zeigt das gereinigte Zellen sind von OL-Linie (Abb. 3a). Gesetzte OPCs zunächst auszudrücken Chondroitinsulfat Proteoglykan (NG2), und entwickeln sich zu Myelin-assoziierte Glykoprotein (MAG) positive unreifen OLs innerhalb von drei Tagen nach der Aussaat (Abb. 3b). Am DIV6 viele OLs ausdrückliche Myelin basisches Protein (MBP) und besitzen typische reife OL Morphologie. Prozent OL-Linie Zellen wurden zu verschiedenen Zeitpunkten quantifiziert, um die Reinheit der OL-angereicherten Kulturen (Abb. 3c) zu bestimmen. Am DIV1 post Reinigung werden Kulturen von 50 ± 14% NG2 + ve OPCs, ohne MAG + ve oder MBP + ve OLs. Dies zeigt die gereinigte OL-Linie Zellen sind in der Vorstufe bei der Beimpfung Zeit, mit vernachlässigbaren Zahl von differenzierten OLs. Am DIV3, viele OLs haben in MAG + ve Zellen (24 ± 5,9%) differenziert, während einige halten die Vorstufe Phänotyp und bleiben NG2 + (13 ± 8,0%). Am DIV3 sind ein kleiner Teil der MAG + ve Zellen (3,2 1,2%) auch zum Ausdruck MBP. Am DIV6, 20 ± 5,9% von OLS MAG + ve, während 12 ± 7,3% NG2 + ve OPCs bestehen. Darüber hinaus sind 21 ± 9,3% der Zellen innerhalb der Kultur MBP + ve OLs zu diesem Zeitpunkt. SDS-PAGE-Analyse zeigt die abgestufte Ausdruck 2'3'-zyklischen-Nukleotid-3'-Phosphodiesterase (CNP) und MBP über die 6 Tage Kulturzeit, ein weiterer Beweis für die Fähigkeit von OPCs in Kultur zu terminal zu reifen OLs unterscheiden (Abb. 3d ). Zusammen stellt diese Daten dieser Methode als Mittel zur Herstellung eines OL-angereicherten Kultur-System eignet sich für das Studium der OL Reifung von OPCs.
Dieses Protokoll beschreibt auch Methoden zur OL / DRGN Co-Kulturen mit Maus-only Gewebe Quellen zu etablieren. Doch um die Co-Kultur zu erzeugen, müssen DRGNs zuerst allein kultiviert werden, um eine ausreichende Neuriten Netzwerk herzustellen. Diese postnatale murine Neuron Kulturen sind für 9 Tage in niedrigen Serum-Medien mit 10 uM FUDR Ergänzung geworden, um die Verbreitung von kontaminierenden Fibroblasten und gl verhindern ial Zellen. Im Laufe von 9 Tagen in vitro produzieren isoliert DRGNs ein dichtes Neuriten Bett (Abb. 4a). Diese Neuriten Bett ist immunpositive für die neuronalen Marker Neurofilament 200 (NF) und Tuj1 (Abb. 4b). An dieser Stelle können gereinigte OPCs die Neuriten Betten hinzugefügt werden, und kultiviert für einen zusätzlichen 6 Tage zu produzieren myelinisierenden Co-Kulturen.
Am DIV6 der OL / DRGN Co-Kultur, viele MBP + ve OLs können unter den NF + ve DRGN Neuriten (Abb. 5a) beobachtet werden. Bei genauerer Betrachtung sind OLs belegt, um Kontakt mit zahlreichen DRGN Neuriten zu machen, oft einhüllenden sie mit einem MBP + ve-Membran (Abb. 5b, c).
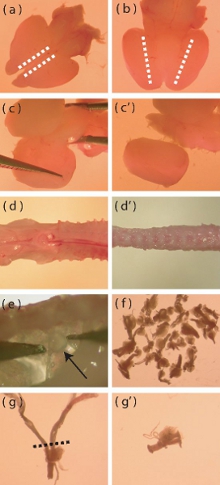
Abbildung 1. Dissektionsmikroskop Bilder bestimmter Aspekte des Neugeborenen Maus Kortex und DRG Isolation. (A) Dorsale Ansicht eines frisch extrahierten neonatalen Gehirn der Maus. Die gestrichelten Linien zeigen den Bereich, wo Einschnitte gemacht, um die Entfernung der Hirnhäute Schicht zu erleichtern muss. (B) Ventrale Ansicht des Gehirns, gestrichelten Linien den Bereich, wo die Rinde trifft der ventralen Zwischenhirn hinweisen. Tiefe Einschnitte müssen entlang der gestrichelten Linien vorgenommen werden, um die Isolation des Kortex zu unterstützen. (C-c ') Visual Darstellung, wie man die Rinde entfernt sie vorsichtig aus dem Rest des Gehirns. (D) Ein frisch isolierten P5-P10 Maus Wirbelsäule vor weg Entfernen überschüssigen Muskeln und Knochen (d '). (e) Lage der DRGs in der Wirbelsäule. (f) Die ungefähre Anzahl der DRGs, die von einer Maus isoliert werden sollten. (g) Ein DRG mit langen Wurzeln, die erforderlich Trimmen vor der enzymatischen Verdauung. Die gestrichelte Linie zeigt den Bereich, wo die Wurzeln beschnitten werden sollte. (G ') DRG post root-Besatz.
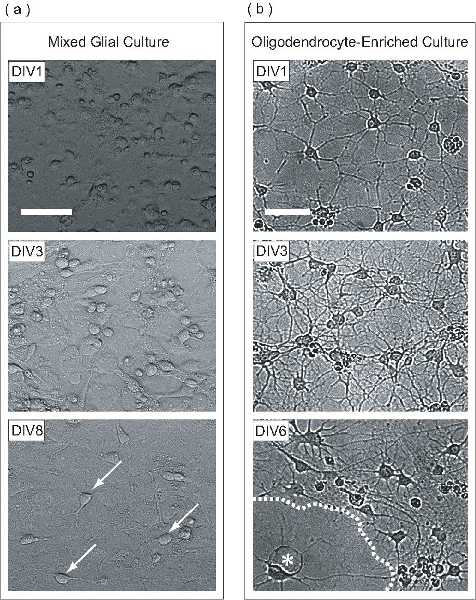
Abbildung 2. OPCs sind innerhalb einer gemischten Gliazellen Kultur ausgebaut, gereinigt und anschließend als OL-angereicherten Kultur unterschieden. (A) Phase kontrastreiche Bilder von gemischten Gliazellen Kulturen in verschiedenen Stadien der Entwicklung. Am DIV1 erscheinen Zellen Runde mit wenigen abgeflachten Zellen. Schichtung von gemischten Gliazellen Kultur beginnt bei DIV3, wo Astrozyten bilden eine einheitliche Monoschicht an der Basis des Kolbens, auf denen OPCs vermehren. Viele OPCs bei DIV8 (Pfeile) haftete an der Oberfläche der Astrozyten Monoschicht zu sehen sind. (B) Wenn aus den gemischten Gliazellen Kultur gereinigt haben DIV1 OPCs nur wenige Prozesse erweitert. Am DIV3 Zellen haben viele Prozesse, die an der Zwischen-Etappe OLs verlängert. Am DIV6 erscheinen abgeflacht OLs (Sternchen) produziert membranöse Platten haben (gestrichelte Linie). Scale-Bars, 50 pm.
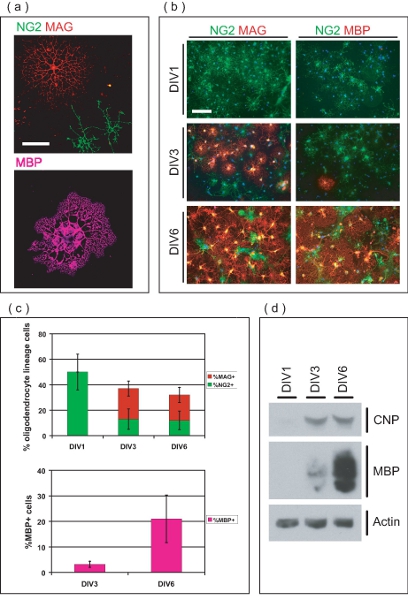
Abbildung 3. Charakterisierung von OL-angereicherten Kultur. (A) Konfokale Bilder von isolierten OLs in verschiedenen Stadien der Entwicklung. NG2 + ve OPCs haben einfache Morphologie, während MAG + ve OLs mehrere arborous Prozesse besitzen. MBP + ve ole verfügen über membranöse Myelin-ähnlichen Blätter verlängert. Scale-bar, 50 pm. (B) Gereinigtes OL-Linie Zellen stammen, wie OPCs und differenzieren sich in MAG + ve, MBP + ve OLs über 6 DIV. Am DIV1, sind alle OPCs NG2 + ve, während keiner MAG + ve oder MBP + ve sind. Am DIV3 sind MAG + ve und einige MBP + ve OLs jetzt evident. Die Mehrheit der OLS MAG und MBP + ve an DIV6, mit wenigen verbliebenen NG2 + ve OPCs. Scale-bar, 100 um. (C) Mittelwerte ± SD der prozentualen OL-Linie Zellen in verschiedenen Stadien der Entwicklung über 6 DIV. Am DIV1, sind alle OL-Linie Zellen NG2 + ve Anteil von 50 ± 14% der gesamten Zellen in der Kultur. Am DIV3 und DIV6, OL-Linie Zellen bzw. Konto für 36 ± 6,8% und 32 ± 8,4% der gesamten Zellen, bestehend aus unterschiedlichen Anteilen von NG2 + ve, MAG + ve und MBP + ve OLs. (D) SDS-PAGE durchgeführt auf Protein aus angereichertem OL-Kulturen zeigen die abgestufte Ausdruck OL-Marker CNP und MBP über die 6 DIV Kultur Periode abgeleitet.
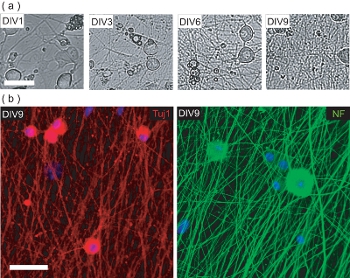
Abbildung 4. Charakterisierung der DRGN Kultur pre-OPC Aussaat. (A) Phase kontrastreiche Bilder von DRGNs über die 9 DIV Kultur Zeitraum pre-OPC Aussaat. DRGNs stammen so groß kräftige Zellen mit wenigen Prozessen und produzieren eine immer komplexer Neuriten Netzwerk. Scale-bar, 100 um. (B) Konfokale Bilder von DRGN Kulturen DIV9 (pre-OPC Aussaat) fixiert und gefärbt für Neuronen-spezifische Marker Tuj1 und NF200. DRGNs einen Neuriten Netzwerk, auf dem OPCs ausgesät, um OL / DRGN myelinisierenden Co-Kulturen hergestellt werden können, erzeugt. Scale-bar, 50 pm.
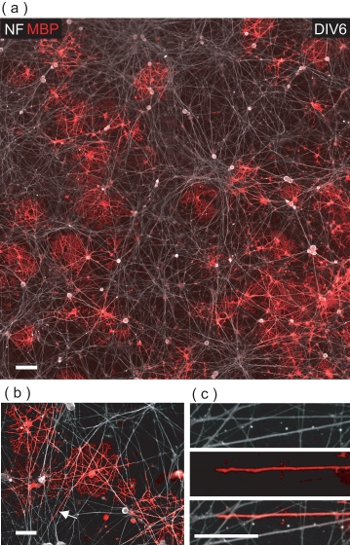
Abbildung 5. OLS mit DRGNs Ergebnis in OL-vermittelte Verpackung von DRGN Neuriten mit MBP + ve Membran co-kultiviert. (A) A 4-Feld-konfokale Bildmontage eines DIV6 OL / DRGN Co-Kultur. Viele MBP + ve OLs sehen die Interaktion mit dem zugrunde liegenden DRGN Neuriten Bett. Scale-bar, 100 um. (B) Eine vergrößerte konfokalen Blick auf MBP + ve OLs Verpackung mehrere DRGN Neuriten. Scale-bar, 50 pm. (C) Digitale Vergrößerung der Region in (b) wenn ein DRGN Neuriten wird mit OL Membran umhüllt bezeichnet. Scale-bar, 25 um.
Diskussion
Dieser Bericht beschreibt ein Verfahren zur Isolierung muriner OPCs für die Differenzierung in OL-angereicherten Kulturen oder OL / DRGN Co-Kulturen. Wenn kultivierte allein, differenzieren die OPCs in MBP + ve OLS, produziert Myelin-like membranöse Blatt. Wenn hinzugefügt, um Neuriten Betten DRGN, umhüllen OLs die DRGN Neuriten mit MBP + ve Membran. Dieses Modell profitiert die Erforschung der komplexen Grundlagen über OL-vermittelte axonale ensheathment.
Während von großem Wert, ist die Einrichtung eines solchen Kulturen technisch anspruchsvoll. Dazu gehören insbesondere anspruchsvolle Aspekte effizienter Gewebe Verdauung / Dissoziation, die Aufrechterhaltung der ausgewogenen Kulturmedien pH-Wert und DRGN Medien ändert. Es ist wichtig zu bedenken, dass die Länge der Verdauung, Menge an Gewebe verdaut wird und die Höhe der Verreibung Einfluss auf die Wirksamkeit und Endergebnis der Gewebedissoziation. Es ist nicht für erfahrene Wissenschaftler ungewöhnlich niedrigen zellulären Erträge aus dissoziierten Nervensystem Gewebe zu erhalten. Darüber hinaus neigen murine OPCs zu empfindlich auf Veränderungen des pH-Wertes der Kultur Medien, insbesondere unter alkalischen Bedingungen. Die Pflege der Kulturen bei 8,5% CO 2 zielt darauf ab, dies zu verhindern, da OPCs besser tolerieren leicht sauren Bedingungen über grundlegende erscheinen. Im Hinblick auf die Fütterung DRGNs, Medien ändert sich schnell durchgeführt werden muss, um nicht auszutrocknen den Neuronen, muss jedoch sanft wie nicht stören die Entwicklung von Neuriten Bett. Abrupte Änderungen können Medien verdrängen die Neuriten Bett aus dem Substrat, und wahrscheinlich zu seiner vollständigen Loslösung von dem Deckglas.
Das Potenzial Verdienst dieses Modellsystem stark überschattet seine technisch anspruchsvollen Natur. Ein Vorteil dieses Systems ist die Verwendung von postnatalen Mäusen für die Zellkultur Ableitung unter Umgehung der Notwendigkeit, weibliche Zuchttiere zu opfern, um embryonale Gewebe zu ernten. Ein weiterer Vorteil ist die fehlende Voraussetzung für Wachstumsfaktoren (GF) für den Ausbau der OPCs. Mixed glialen Kulturen bieten ein Umfeld, das die Ausbreitung von OPCs, vermutlich wegen der Anwesenheit von Astrozyten-derived trophischen Faktoren unterstützt. Andere Methoden, wie z. B. Ableitung über Neurosphären 7,8, vertrauen auf die mitogene Eigenschaften von GF wie basischen Fibroblasten-Wachstumsfaktor (bFGF), epidermalen Wachstumsfaktor (EGF) und platelet-derived growth factor (PDGF) für OPC Expansion. Auch mit der Geburt (P5-10) Mäuse für DRGNs vermeidet das Erfordernis der Ergänzung der Kulturmedien mit nerve growth factor (NGF), einen neurotrophen Faktor für die in vitro das Überleben von embryonalen DRGNs 9, 10 erforderlich. Es ist interessant zu vermeiden, mit NGF, wie es wirkt sich negativ auf myelinisierenden Kapazität von OLS, wenn sie mit DRGNs 4 kultiviert. Vermeidung der Verwendung von GF-ergänzt Medien hat auch wirtschaftliche Vorteile, da diese Reagenzien teuer werden, wenn in großem Maßstab eingesetzt.
Vielleicht der wichtigste Vorteil dieser Kultur Modells ist seine Ableitung aus Maus-only Gewebe, wodurch die Chancen abzuleiten beiden OPCs und DRGNs aus der Vielzahl von transgenen Mauslinien. Dies ermöglicht die Untersuchung der beiden DRGN und / oder OPC-spezifische Eigenschaften, die Myelinisierung zu regieren. Dies ist besonders wichtig für die Aufklärung der Rezeptor / Ligand-Interaktionen regulieren OL-vermittelte Myelinisierung der Axone. Alles in allem ist diese Technik von großem Wert in Bezug auf neurowissenschaftliche Forschung aufgrund ihrer Anwendungen zum Verständnis der molekularen Signale zugrunde liegenden Myelinisierung.
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Dieses Projekt wurde durch einen Zuschuss von der Multiple Sclerosis Society von Kanada bis RKRWO finanziert ist ein Empfänger ein Stipendium von der Multiple Sclerosis Society von Kanada. SDR ist ein Empfänger von Post-Doctoral Fellowships aus dem Multiple-Sklerose-Gesellschaft von Kanada und kanadischen Institutes of Health Research.
Materialien
| Name | Company | Catalog Number | Comments |
| Product Name | Firma | Produktnummer | |
| Dulbecco Modified Eagle Medium (DMEM) | Multicell | 319 bis 005-CL | |
| Hanks Balanced Salt Solution (HBSS) | Invitrogen | 14170-112 | |
| Minimum Essential Media (MEM) | GIBCO | 12360-038 | |
| Fetal Bovine Serum (FBS) | GIBCO | 10091-148 | |
| Penicillin-Streptomycin (Pen / Strep) | GIBCO | 15140-122 | |
| Glutamax | Invitrogen | 35050-061 | |
| Poly-L-Lysin | Sigma-Aldrich | P2636 | |
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | A4503 | |
| Menschliche merosin gereinigtes Protein (LN2) | Millipore | CC085 | |
| Rekombinantes Ratten ciliary neurotrophen Faktors (CNTF) | PeproTech | 450-50 | |
| L-Thyroxin | Biochemika | 89430 | |
| Holo-Transferrin | Sigma-Aldrich | T0665 | |
| B27 ergänzen | GIBCO | 0080085-SA | |
| Rinderinsulin | Sigma-Aldrich | I6634 | |
| 3,3 ',5-Triiod-L-thyronine | Sigma-Aldrich | I6634 | |
| Progesteron | Sigma-Aldrich | P8783 | |
| Putrescin | Sigma-Aldrich | P7505 | |
| Natriumselenit | Sigma-Aldrich | S5261 | |
| 5-Fluoro-2'-desoxyuridin (FUDR) | Sigma-Aldrich | F0503 | |
| Papain-Lösung | Worthington | LS003126 | |
| DNaseI | ROCHE | 1010159001 | |
| L-Cystein | Sigma-Aldrich | C7352 | |
| 24-Well-Platten | CELLSTAR | 662-160 | |
| T25-Zellkulturflaschen mit Entlüftungskappe | Corning | 430639 | |
| 10 cm Gewebekulturschalen | Corning | 430167 | |
| 10 cm Petrischale | Fisher Scientific | 0875713 | |
| Collagenase A | ROCHE | 103578 | |
| CellTrics 50 um Filter (optional) | PARTEC | 04-004-2327 | |
| Myelin Basic Protein (MBP) Antikörper | AbD Serotec | MCA409S | |
| NG2 Antikörper | Millipore | AB5320 | |
| Myelin-assoziierte Glykoprotein (MAG) Antikörper | Millipore | MAB1567 | |
| 2 ', 3'-zyklische Nukleotid-3'-Phosphodiesterase (CNP) Antikörper | Covance | SMI-91R-100 | |
| Actin pan Ab-5-Antikörper | Fitzgerald | 10R-A106AX | |
| Neurofilament-200 (NF)-Antikörper | Sigma-Aldrich | N4142 | |
| Tubulin beta-3-Kette (Tuj1) Antikörper | Millipore | MAB5544 | |
| Alexa Fluor 488 Ziege anti-Kaninchen IgG (H + L) Sekundär-Antikörper | Invitrogen | A11008 | |
| Alexa 555 Ziege anti-Maus IgG (H + L) Sekundär-Antikörper | Invitrogen | A21422 | |
| Alexa Fluor 647 Ziege anti-Ratte (IgG) (H + L) Sekundär-Antikörper | Invitrogen | A21247 | |
| Ziege anti-Maus IgG (H + L)-HRP-konjugierten sekundären Antikörper | BioRad | 170-6516 | |
| Ziege anti-Ratte-IgG (H + L)-HRP-konjugierten sekundären Antikörper | Santa Cruz Biotechnology | SC-2065 | |
| 4 ',6-Diamino-2-phenylindole (DAPI) | Sigma-Aldrich | D9542 |
Medien Rezepte
100X OL-Supplement *
| Zutat | Amount hinzufügen |
| DMEM | 100 mL |
| BSA | 1,02 g |
| Progesteron | 0,6 mg |
| Putrescin | 161 mg |
| Natriumselenit | 0,05 mg |
| 3,3 ',5-Triiod-L-thyronine | 4 mg |
* Lagerung bei -80 ° C in 250 ul Aliquots
t "> OL Medien| Zutat | Amount hinzufügen |
| DMEM | 23,75 mL |
| 100X OL-Supplement | 250 ul |
| Rinderinsulin (von 1 mg / mL Lager) | 125 ul |
| Glutamax | 250 ul |
| Holo-Transferrin (von 33 mg / mL Lager) | 37,5 ul |
| B27 Supplement | 500 ul |
| FBS | 125 ul |
| CNTF (von 50 ng / ul Lager) | 25 ul |
Mixed Gliazellen Kulturmedien (bis in DMEM gemacht)
| Zutat | Endkonzentration |
| FBS | 10% |
| Pen / Strep (0,33% ab Lager lieferbar) | 33 Einheiten / ml Penicillin und 33 ug / ml Streptomycin |
| Glutamax | 1% |
DRGN Medien (bis in DMEM gemacht)
| Zutat | Endkonzentration |
| FBS | 10% |
| Pen / Strep (1% ab Lager lieferbar) | 100 Einheiten / ml Penicillin und 100 ug / ml Streptomycin |
Aufschlusslösung Rezepte:
OPC Papain-Lösung (in MEM gemacht)
| Zutat | Endkonzentration |
| Papain-Lösung | 1,54 mg / mL |
| L-Cystein | 360 pg / mL |
| DNaseI | 60 ug / mL |
DRG Papain-Lösung (in HBSS gemacht)
| Zutat | Endkonzentration |
| Papain | 1,54 mg / mL |
| L-Cystein | 360 pg / mL |
DRG Collagenase A-Lösung (in HBSS gemacht)
| Zutat | Endkonzentration |
| Collagenase A | 4 mg / mL |
Referenzen
- Avellana-Adalid, V. Expansion of rat oligodendrocyte progenitors into proliferative "oligospheres" that retain differentiation potential. J Neurosci Res. 45, 558-570 (1996).
- McCarthy, K. D., de Vellis, J. Preparation of separate astroglial and oligodendroglial cell cultures from rat cerebral tissue. J Cell Biol. 85, 890-902 (1980).
- Barres, B. A. Cell death and control of cell survival in the oligodendrocyte lineage. Cell. 70, 31-46 (1992).
- Chan, J. R. NGF controls axonal receptivity to myelination by Schwann cells or oligodendrocytes. Neuron. 43, 183-1891 (2004).
- Camara, J. Integrin-mediated axoglial interactions initiate myelination in the central nervous system. J Cell Biol. 185, 699-712 (2009).
- Ishibashi, T. Astrocytes promote myelination in response to electrical impulses. Neuron. 49, 823-832 (2006).
- Chen, Y. Isolation and culture of rat and mouse oligodendrocyte precursor cells. Nat Protoc. 2, 1044-1051 (2007).
- Pedraza, C. E. Production, characterization, and efficient transfection of highly pure oligodendrocyte precursor cultures from mouse embryonic neural progenitors. Glia. 56, 1339-1352 (2008).
- Lewin, G. R., Ritter, A. M., Mendell, L. M. On the role of nerve growth factor in the development of myelinated nociceptors. J Neurosci. 12, 1896-1905 (1992).
- Greene, L. A. Quantitative in vitro studies on the nerve growth factor (NGF) requirement of neurons. II. Sensory neurons. Dev Biol. 58, 106-113 (1977).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten