Method Article
Derivazione di Arricchito Culture oligodendrociti e degli oligodendrociti / Neuron mielinizzanti co-culture di tessuti murini post-natale
In questo articolo
Riepilogo
Questo articolo descrive i metodi per ricavare le popolazioni murine arricchito di cellule precursori degli oligodendrociti (OPC) in colture primarie, che differenziano per produrre oligodendrociti maturi (OLS). Inoltre, questo rapporto descrive le tecniche per produrre murino mielinizzanti co-colture da semina OPC del mouse su un letto neurite dei neuroni dei gangli spinali del mouse (DRGNs).
Abstract
Identificare i meccanismi molecolari alla base dello sviluppo OL non solo è fondamentale per approfondire la nostra conoscenza della biologia OL, ma ha anche implicazioni per la comprensione della patogenesi delle malattie demielinizzanti come la sclerosi multipla (SM). Sviluppo cellulare è comunemente studiate con modelli di colture cellulari primarie. Colture cellulari primarie facilita la valutazione di un dato tipo di cellula, fornendo un ambiente controllato, privo di variabili estranee che sono presenti in vivo. Mentre le culture OL derivati da ratti hanno fornito una grande quantità di conoscenza nella biologia OL, iniziative analoghe a stabilire culture OL dai topi è stata accolta con grandi ostacoli. Lo sviluppo di metodi di cultura OL murino primario è indispensabile al fine di sfruttare le linee disponibili nel topo transgenico.
Diversi metodi per l'estrazione di OPC da tessuto roditori sono state descritte, che vanno dalla derivazione neurosfere, adesione purificazione differenziale e immunopurification 1-3. Mentre molti metodi offrire il successo, la maggior parte richiedono tempi di cultura vasta e / o attrezzature costose / reagenti. Per aggirare questo, purificando OPC da tessuti murini con un adattamento del metodo originariamente descritto da McCarthy & de Vellis 2 è preferito. Questo metodo comporta fisicamente OPC separazione da una coltura mista gliali derivati da cortecce roditori neonatale. Il risultato è una popolazione purificata OPC che possono essere differenziati in un OL-arricchito la cultura. Questo approccio è attraente per la sua cultura tempo relativamente breve e il requisito necessario per fattori di crescita o anticorpi immunopanning.
Durante l'esplorazione dei meccanismi di sviluppo OL in una cultura purificato è informativa, non fornisce l'ambiente più fisiologicamente rilevanti per valutare la formazione di guaina mielinica. Co-coltura OLS con i neuroni darebbe comprensione delle basi molecolari che regolano OL-mediata mielinizzazione degli assoni. Per molti OL / neuroni co-coltura studi, i neuroni dei gangli della radice dorsale (DRGNs) hanno dimostrato di essere il tipo neurone di scelta. Sono ideali per co-coltura con OLS per la loro facilità di estrazione, quantità minima di cellule contaminanti, e la formazione di posti letto dei neuriti denso. Mentre gli studi utilizzando ratto / topo mielinizzanti xenocultures sono stati pubblicati 4-6, un metodo per la derivazione di tale OL / DRGN mielinizzanti co-culture post-natale dei tessuti murino non è stata descritta. Qui vi presentiamo metodi dettagliate su come produrre in modo efficace tali colture, insieme a esempi di risultati attesi. Questi metodi sono utili per affrontare questioni rilevanti per lo sviluppo OL / funzione mielinizzanti, e sono strumenti utili nel campo delle neuroscienze.
Protocollo
Dichiarazione etica
I topi utilizzati in questo lavoro sono stati curati secondo il Canadian Consiglio sulla cura degli animali (CCAC) le linee guida. L'approvazione etica per gli esperimenti condotti è stato ottenuto presso l'Università di Ottawa Animal Care Comitato con il numero di protocollo OGH-119.
1. Dissezione - corteccia del mouse neonatale per l'estrazione OPC
- Sacrificio P0-P2 del mouse secondo le linee guida istituzionali.
- Sezionare il cervello e mettere in una capsula di Petri contenente ghiacciata MEM (antibiotico-free).
- Trasferire il piatto ad un microscopio dissezione.
- Usando un bisturi con la parte dorsale del cervello fino, fare una incisione superficiale sagittalmente lungo il bordo più di ogni corteccia mediale (Fig. 1a). Questa incisione deve passare attraverso lo strato meningeo al fine di facilitare la sua rimozione.
- Usare bene pinze punta a staccare le meningi in maniera laterale. Se fatto con attenzione, questo strato può essere rimosso in un unico pezzo. Durante questa fase, rimuovere il bulbo olfattivo.
- Con il cervello lato ventrale-up, fare una profonda incisione sagittale in cui la corteccia incontra l'area ventrale del diencefalo (Fig. 1b).
- Con il dorsale cervello side-up, separare le cortecce dal mesencefalo facendo leva il tessuto in una mediale alla moda laterale (Fig. 1c, c '). Rimuovere eventuali residui di meningi in questa fase.
- Dice ogni corteccia in circa 4 pezzi e delicatamente trasferimento in un tubo da 15 ml contenente 350 ml di MEM al cervello del mouse. Tenere la provetta in ghiaccio fino a quando tutti i topi sono stati elaborati.
- Ripetere i passaggi 1,1-1,8 per topi rimanenti.
2. Dissociazione di cortecce neonatale e la manutenzione delle culture miste gliali
Nota: L'introduzione di bolle nella sospensione cellulare dovrebbe essere evitato durante tutte le fasi seguenti.
- Aggiungere il tubo da 15 ml contenente il cervello sezionato appena ad un bagno d'acqua a 37 ° C per 3 minuti.
- Trasferimento cervello per una cappa sterile coltura di tessuti.
- Delicatamente passare cortecce dadini attraverso un puntale P1000 per generare frammenti più piccoli. Smettere di pipettaggio una volta non ci sono pezzi di cervello abbastanza grande per interrompere un flusso di sospensione attraverso la punta della pipetta.
- Aggiungere 75 ml di soluzione OPC papaina al cervello nel tubo conico. La soluzione OPC papaina devono essere pre-riscaldato a 37 ° C per 20 minuti prima dell'uso.
- Incubare in un bagno d'acqua a 37 ° C per 20 min. Circa ogni 2 minuti, capovolgere delicatamente il tubo per evitare che l'aggregazione del tessuto. Durante questo tempo, aggiungere 5 ml di mixed media cultura gliali ad ogni poli-L-lisina (PLL) rivestito (1 mg / mL) T25 pallone (un pallone al cervello di topo), e mettere in un 37 ° C di coltura tissutale incubatore a 8,5% di CO 2.
- Dopo 20 minuti, riportare la sospensione dei tessuti alla cappa sterile e aggiungere 2 ml di mixed media cultura gliali del cervello per il tubo. Lasciate riposare per 10 minuti a temperatura ambiente per permettere l'inattivazione della soluzione OPC papaina.
- Aliquota della sospensione dei tessuti in provette 5 ml di plastica. Il numero di tubi deve corrispondere al numero di cervelli sezionati, un aumento di circa 2,5 ml per provetta.
- Usando una sterile fiamma pipetta Pasteur in vetro lucido, delicatamente triturare il tessuto in ciascun tubo. Triturare dapprima lentamente e gradualmente aumentare la velocità come pezzi dissociano. Triturare circa 10-15 volte, tuttavia questo numero può variare in base alla efficacia della digestione.
Nota: In-triturazione si tradurrà in scarsa dissociazione del tessuto, considerando che l'eccessiva triturazione avrà un impatto negativo sulla vitalità cellulare. E 'importante non introdurre bolle nella soluzione, in quanto ciò gravi ripercussioni vitalità cellulare.
- Una volta non ci sono grumi di tessuto visibile rimanenti nella sospensione, trasferimento in una provetta da 50 ml contenente 4 ml di misto terreni di coltura per gliali del cervello (cioè, 4 cervelli = 16 mL tecnica mista cultura gliali).
- Capovolgere delicatamente la provetta 50 ml conica e ripetere per il restante 5 mL.
- Aliquota della sospensione cellulare raggruppati in provette da 15 ml conici (circa 6,5 ml per 15 ml tubo). Il numero di provette da 15 ml deve corrispondere al numero di cervelli sezionati.
- Centrifugare le provette a 1200 giri al minuto (~ 300 g) per 5 min.
- Con attenzione aspirare il surnatante e aggiungere 1 ml di caldo mixed media cultura gliali ad ogni provetta 15 ml conica.
- Lentamente risospendere il pellet con una punta P1000 pipetta, facendo attenzione a non introdurre bolle. Aggiungere la sospensione cellulare da ciascun tubo per un pre-equilibrata PLL rivestite T25 fiasco, rendendo il volume totale dei terreni di coltura a 6 ml.
- Posizionare i contenitori in un tessuto culturale incubatore per 3-4 ore per permettere alle cellule di allegare al substrato PLL. Eseguire un cambio completo dei media pipettando i media, e l'aggiunta di 6 ml di fresca mista cultura gliali al fiaschi. Questo passaggio rimuove gran parte dei detriticausato dalla triturazione, e promuove la vitalità della cultura. Se OL / DRGN co-colture sono desiderati, fare riferimento alla sezione 3 del presente protocollo.
- Dopo 3 giorni di cultura, di effettuare un cambiamento di 2 / 3 dei media, rimuovendo 4 ml di media, e la sua sostituzione con 4 ml di fresca mista cultura gliali. A questo punto, un monostrato astrociti dovrebbe formarsi sulla base dei palloni.
- Il 6 ° giorno, eseguire un altro 2 / 3 dei media cambiamenti e completare i palloni con una concentrazione finale di 5 mcg / ml di insulina. A questo punto, un monostrato astrociti dovrebbero essere chiaramente visibile, in cima al quale OPC sarà proliferando.
3. DRGN isolamento
Nota: Per produrre OL / DRGNs co-culture, DRGNs dovrebbe essere stabilito il giorno dopo misti generazione cultura gliali. Entrambi i tipi di coltura sono cresciuti in modo indipendente, e combinati dopo 9-10 giorni.
- Sacrificio P5-P10 del mouse secondo le linee guida istituzionali.
- Estrarre la spina dorsale, e trasferirlo in una scatola di Petri pulita.
- Troncare i muscoli e le ossa molto dalla spina dorsale il più possibile (Fig. 1d, d '), in modo da facilitare la dissezione dei gangli delle radici dorsali (DRG).
- Trasferire la colonna vertebrale tagliata a una nuova piastra di Petri parte ventrale-up. Utilizzando le forbici dissezione e di partenza caudalmente, tagliare medialmente attraverso la colonna vertebrale in modo longitudinale.
- Utilizzando due coppie di pinze, sollevare delicatamente aprire la colonna vertebrale per esporre il midollo spinale.
- DRG può essere trovato al di sotto e lateralmente al midollo spinale. Utilizzando pinze a punta sottile, rimuovere delicatamente il DRG evitando danni ai gangli (Fig. 1e).
- Trasferire il DRG rimosso per soluzione salina tampone ghiacciata di Hank (HBSS, antibiotico-free) in un nuovo piatto di Petri. Il dissettore dovrebbe mirare ad estrarre 40 DRG per il mouse (Fig. 1f).
- Una volta che i DRG sono stati estratti, tagliare i DRG di radici troppo lunghi (Fig. 1 g, g ') per minimizzare l'introduzione di cellule contaminanti nella cultura (cellule gliali, fibroblasti).
- Trasferire il DRG di un tubo da centrifuga 1,5 ml contenente 500 ml di HBSS ghiacciata.
- Centrifugare a 1200 rpm (~ 300 g) per 5 minuti a 4 ° C per far sedimentare il DRG.
- Trasferire il provette di una cappa sterile coltura di tessuti e rimuovere il HBSS dai tubi.
- Aggiungere 500 ml di pre-riscaldato (20 min a 37 ° C) DRG soluzione di papaina, e incubare le provette in un bagno d'acqua a 37 ° C per 10 min. Invertire i tubi ogni 2 minuti per evitare l'aggregazione del tessuto.
- Ripetere il punto 3.10.
- Rimuovere la soluzione di papaina DRG e aggiungere 500 ml di pre-riscaldato (20 min a 37 ° C) Collagenasi Una soluzione. Incubare in un bagno d'acqua a 37 ° C per 10 minuti, capovolgendo ogni 2 minuti.
- Ripetere il punto 3.10.
- Rimuovere il surnatante e aggiungere 1 ml di DRGN media. Capovolgere diverse volte la provetta.
- Ripetere il punto 3.10.
- Ripetere il punto 3.16.
- Cappotto una sterile fiamma lucido vetro pipetta Pasteur con albumina sierica bovina (BSA) pipettando una soluzione di 0,25% BSA in HBSS più volte. Il rivestimento con una soluzione di BSA impedirà al DRG di aderire alle pareti della pipetta di vetro.
- Triturare i DRG con la BSA rivestita pipetta dolcemente in un primo momento, e con crescente intensità, una volta aggregati cominciare dissociare. Triturare circa 10-15 volte, ma questo numero dipende dal grado di digestione, e il numero di DRG per provetta.
- Una volta che la dissociazione è raggiunto, la sospensione passare attraverso un filtro di 50 micron in una piastra di Petri sterile contenente 7 ml di DRGN media. Filtrazione eliminerà gran parte dei detriti dalla sospensione cellulare, anche se questo passaggio non è fondamentale.
- Incubare la piastra Petri al 8,5% di CO 2 per circa 1,25 ore.
- Cappotto diversi coprioggetto 12 mm con LN2 (10 mg / ml in PBS) in un piatto ben 24 nel corso di questo tempo di incubazione.
- Una volta che l'incubazione è finito, osservare la piastra di Petri in campo chiaro. DRGNs sono identificati come grandi corpo, le cellule fase di buio. Agitare la piastra Petri delicatamente per sollevare qualsiasi DRGNs aderito.
Nota: Molte cellule contaminanti si hanno fortemente aderito alla capsula di Petri, arricchendo la vostra sospensione cellulare per DRGNs.
- Trasferire la sospensione di cellule in una provetta da 15 ml. Lavare delicatamente il piatto con 4 ml di DRGN mezzi di comunicazione per raccogliere qualsiasi DRGNs residuo. Trasferire i altri 4 ml al tubo conico.
- Centrifugare per 5 min a 1200 rpm (~ 300 g).
- Aspirare il surnatante e risospendere il pellet in 500 ml di mezzi DRGN fresca.
- Calcolare il numero di DRGNs prodotto utilizzando un emocitometro. Assicurati di contare solo il DRGNs, e non altri tipi di cellule. DRGNs possono essere identificati tramite i loro corpi a grandi cellule sferiche.
- Seed 30.000-50.000 DRGNs ad ogni LN2 rivestite coprioggetto in 1 ml di DRGN media, e posto a 37 ° C di coltura tissutale incubatore a 8,5% di CO 2 durante la notte.
- La mattina seguente, eseguire un cambio completo dei media, sostituendo la DRGNmezzi di comunicazione con i media OL (meno CNTF) con una concentrazione finale di 1% Pen / Strep FuDR e 10 micron.
- Nei giorni 3 e 5, eseguire un cambio 3 / 4 dei media con i media stessi al punto 3.30.
- Giorno 7, eseguire un cambio completo dei media con i media OL (meno CNTF, Pen / Strep, FuDR).
- Il giorno di 9, il DRGNs avrebbe dovuto costituire un letto ampio neuriti, e ora sono pronti per essere co-coltura con OPC.
4. Purificazione di OPC da culture gliali miste per l'istituzione di OL-arricchito culture o OL / DRGN co-culture
- In occasione della Giornata 9 della cultura misto gliali, trasferire i flaconi di un agitatore orbitale in un 5% di CO 2 di coltura tissutale incubatore. Posizionare i contenitori sulla parte superiore del T25 fiaschi vuoti per evitare il calore generato dal agitatore orbitale, incidano negativamente sugli colture miste gliali. Lasciare le culture si stabilizzi a questo nuovo incubatore per 1 ora.
- Una volta che i palloni sono equilibrati, agitare i flaconi a 50 giri per 45 min. Lo scopo di questa scossa è quello di rimuovere tutte le cellule debolmente aderenti contaminare dal monostrato.
- Spostare le celle di un cappuccio colture di tessuti e rimuovere tutti i supporti dal fiaschi. Sostituire con 4 ml di fresca mista cultura gliali integrato con 5 mcg / ml di insulina.
- Posizionare i contenitori indietro sulla shaker, e permettono di equilibrare per circa 3 ore.
- Una volta che i palloni sono in equilibrio, li fissano in modo sicuro al agitatore orbitale, e agitare le bottiglie per circa 16 ore a 220 giri al minuto (una notte).
- La mattina dopo, se OL devono essere coltivate in assenza di DRGNs (cioè, OL-arricchito la cultura), rivestimento diversi coprioggetto sterili 12 mm con LN2 (10 mg / ml in PBS) per 1 ora. Trasferire i coprioggetti a 24-bene i piatti, lavare con PBS seguita da un lavaggio OL media. Aggiungere 1 ml di mezzi di OL in ciascun pozzetto ed equilibrare al 8,5% di CO 2.
- Equilibrare 10 centimetri piatti di coltura di tessuti al 5% di CO 2 per 30 min. Un piatto sarà richiesto per ogni 2 palloni. Questi saranno utilizzati per il differenziale adesione di arricchimento della OPC sospeso.
- Una volta che il periodo di 30 minuti di equilibrio è passato, il trasferimento ai media di palloni scossa ai piatti. Ogni piatto dovrebbe ricevere i supporti da 2 boccette, pari a circa 8 ml di sospensione cellulare per 10 piatti cm.
- Incubare i piatti al 5% di CO 2 per 30 minuti, fornendo al contempo una spinta dolce alla boa 15 min. Questo nudge aiuterà a prevenire gli OPC di aderire al piatto 10 cm.
- Una volta che l'incubazione è completa, esaminare i piatti in campo chiaro. OPC sono identificati come piccoli ammassi di cellule, di solito di 3-5 cellule, ma a volte formano grandi aggregati simile neurosfere. Molti non OL cellule lignaggio dovrebbe essere fermamente aderito alla base del piatto. Mescolare delicatamente i piatti di staccare qualsiasi OPC liberamente aderito, e trasferire la sospensione cellulare da ogni piatto in un tubo da 15 ml.
- Centrifugare a 1200 rpm (~ 300 g) per 5 min.
- Risospendere il pellet in 1 ml di media OL con una punta P1000 pipetta, seguita da risospensione con una punta P200 pipetta.
- Contare le cellule utilizzando un emocitometro.
- Per arricchito-OL culture, semi di 25.000 - 50.000 OPC ad ogni mm 12 LN2 rivestite coprioggetto in un volume finale di 1 ml mezzi OL.
- Per OL / DRGN co-culture, eseguire un supporto completo OL (meno CNTF) cambiamento sulla DRGNs dalla sezione [3], e delicatamente aggiungere 50.000 cellule dal OPC arricchito sospensione cellulare. Fare attenzione a non disturbare il letto neurite DRGN durante l'aggiunta di OPC.
- Mettere le culture in un incubatore a 37 ° C al 8,5% di CO 2, e di evitare la rimozione fino fissazione. OPC murino sono sensibili ai cambiamenti di pH, e la rimozione dal termostato altererà il pH dei media OL. Da segnalare inoltre, l'aggiunta di dH 2 O per i pozzi vuoti che circondano il colture di cellule impedisce l'evaporazione dei terreni di coltura, riducendo così al minimo le fluttuazioni nella concentrazione di soluti nei media OL. Ciò fornirà un contesto più coerente per la OPC.
5. Elaborazione di culture per microscopia di immunofluorescenza
- Fissare le culture con 100% di metanolo a -20 ° C per 10 minuti, o 3% paraformaldeide a temperatura ambiente per 15 min.
- Permeabilize coprioggetto con 0,1% Triton X-100 per 10 minuti, lavare con tampone fosfato blocco salino (PBS) e per 1 ora nel siero di capra 10%.
- Coprioggetto incubare con anticorpi primari diluiti in blocco soluzione notte a 4 ° C.
- Lavare coprioggetto 3 volte con PBS e incubare con Alexa Fluor-anticorpi secondari coniugati (Invitrogen) diluito in soluzione di blocco per 45 min.
- Contrasto con 4 ',6-diamidino-2-fenilindolo (DAPI) e lavare coprioggetto più volte con PBS.
- Monte coprioggetto in DAKO fluorescenti montaggio medio.
- Analizzare le diapositive tramite microscopia di immunofluorescenza. In questo protocollo, le diapositive sono stati analizzati sia con un fluorescenza Zeiss Axiovert 200M invertitamicroscopio o un Zeiss LSM 510 META microscopio a scansione laser confocale.
6. Tutta la proteina estrazione di cellule da OL-arricchito culture
- Rimuovere 24-culture e da incubatore e raffreddare in ghiaccio per 3 min.
- Rimuovere con attenzione i media, e aggiungere 10-20 ml di tampone di lisi (50 mM Tris-HCl, 150 mM NaCl, 0,1% SDS, sodio desossicolato 0,5%, 1% Triton X-100, con il 0,1% pepstatina, aprotinina, PMSF, leupeptina, orthovanadate di sodio) in ciascun pozzetto (un minimo di 8 pozzetti per ogni campione è suggerito).
- Raschiare pozzi con un ampio tunnel P1000 punta della pipetta, e trasferire il lisato in una provetta da centrifuga da 1,5 ml.
- Passare il lisato attraverso un mezzo a scartamento siringa da 30 a circa 15 volte, e freddo in ghiaccio per 30 min.
- Centrifugare i tubi a 14.000 giri al minuto (~ 20.000 g) per 15 minuti a 4 ° C.
- Trasferire il surnatante in provette da centrifuga nuovi, e conservare a -80 ° C.
7. SDS-PAGE analisi arricchito-OL proteina cultura
- Risolvere 30 mcg di proteina per campione nella riduzione del buffer mediante SDS-PAGE su standard 12% di poli-gel di acrilammide.
- Semi-secco gel trasferimento su membrane PVDF.
- Membrane blocco per 1 ora nel 5% latte scremato in polvere in TBST (10 mM Tris-HCl pH 8.0, 150 mM NaCl, 0.1% Tween-20).
- Incubare membrane con anticorpi primari diluiti in blocco soluzione per 1 ora.
- Lavare le membrane 3 volte con TBST per 10 minuti.
- Incubare le membrane con anticorpi secondari HRP-coniugato per 45 minuti a bloccare soluzione.
- Lavare le membrane più volte con TBST, e incubare con Amersham ECL Plus reagente rilevamento western blotting (GE Healthcare) per 5 min.
- Rileva bande proteiche con lo standard cinematografico di imaging scientifico.
8. Rappresentante dei risultati:
In questo protocollo, OPC sono espanse su un monostrato di astrociti all'interno di una cultura mista gliali. Questa cultura mista gliali è derivato da P0-P2 corteccia topo neonatale. Al giorno 1 in vitro (DIV1), la cultura contiene cellule gliali miste con morfologie diverse come si è visto al microscopio a contrasto di fase (Fig. 2a). A DIV3, un monostrato astrociti comincia a formarsi sulla base del pallone, e DIV8, OPC può essere chiaramente osservato sulla superficie monostrato. Al DIV9, la OPC proliferanti hanno raggiunto densità sufficiente per essere purificata dalla notte ad alta velocità agitazione orbitale. Una volta che il processo di purificazione è stato completato, il risultato è un OPC-arricchito popolazione di cellule. A DIV1 post purificazione, OPC hanno morfologia semplice, estendendo i processi di pochi (Figura 2b). A DIV3 purificazione dopo, le cellule hanno esteso un reticolo complesso di processi, che ricorda OL immaturi. A DIV6 purificazione messaggio, l'OL purificati hanno appiattita e proiettato volantino-come le strutture a membrana. Questo sviluppo morfologico è tipico della maturazione in vitro degli OLS.
Microscopia a immunofluorescenza indica le cellule purificate sono di OL-lignaggio (Fig. 3a). Seminato OPC inizialmente esprimere proteoglicani condroitin solfato (NG2), e si sviluppano in glicoproteina associata alla mielina (MAG) positivo OL immaturi entro tre giorni dopo la semina (Fig. 3b). A DIV6, molti OL esprimere la proteina basica della mielina (MBP), e possedere tipica morfologia maturo OL. Percentuale OL-lignaggio cellule sono state quantificate in diversi momenti per determinare la purezza della OL arricchito culture (Fig. 3c). A DIV1 purificazione post, le culture sono 50 ± 14% NG2 OPC + ve, senza ve MAG + o MBP + OL ve. Indica la purificato OL-lignaggio cellule sono in fase di precursore al momento semina, con i numeri trascurabili di OL differenziata. A DIV3, OL molti hanno differenziate in cellule MAG + ve (24 ± 5,9%), mentre alcuni conservano il fenotipo precursore, e rimangono NG2 + (13 ± 8,0%). A DIV3, una piccola percentuale di cellule MAG + ve (3,2 1,2%) sono anche esprimere MBP. A DIV6, 20 ± 5,9% del OLS sono MAG + ve mentre il 12 ± 7,3% persistere come NG2 + OPC ve. Inoltre, 21 ± 9,3% di cellule all'interno della cultura sono MBP + OL ve a questo punto del tempo. SDS-PAGE analisi mostra l'espressione graduata di 2'3'-ciclico-nucleotide 3'-fosfodiesterasi (CNP) e MBP nel periodo cultura 6 giorni, dimostrando ulteriormente la capacità di OPC nella cultura di differenziare terminali in OL maturi (Fig. 3d ). Collettivamente, questi dati definisce questo metodo come un mezzo per produrre un OL-arricchito sistema di coltura adatto per lo studio della maturazione OL da OPC.
Questo protocollo descrive anche metodi per stabilire OL / DRGN co-culture con murino sorgenti solo tessuto. Tuttavia, al fine di produrre la co-coltura, DRGNs deve prima essere coltivati solo per la produzione di una adeguata rete dei neuriti. Questi post-natale culture neuroni murini sono coltivate per 9 giorni in condizioni di scarsa mezzi siero supplementazione con 10 mM FuDR per impedire la proliferazione dei fibroblasti contaminanti e gl cellule ial. Nel corso dei 9 giorni in vitro, DRGNs isolato produrre un letto denso neurite (Fig. 4a). Questo letto è neuriti immunopositive per il neurofilamenti neuronale marcatori 200 (NF) e Tuj1 (Fig. 4b). A questo punto, OPC purificati possono essere aggiunti ai letti dei neuriti, e coltivate per altri 6 giorni di tempo per produrre mielinizzanti co-culture.
A DIV6 di OL / DRGN co-coltura, MBP molti + OL ve si possono osservare tra i + ve NF DRGN neuriti (Fig. 5a). A ben guardare, OL si evidenziano per entrare in contatto con neuriti DRGN numerose, spesso li ensheathing con un MBP + ve membrana (Fig. 5b, c).
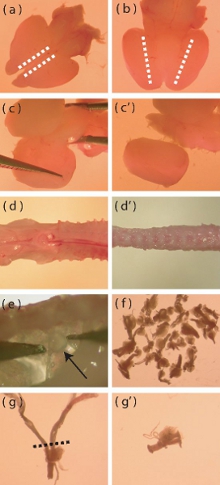
Figura 1. Microscopio immagini dissezione di aspetti particolari della corteccia del mouse neonatale e l'isolamento DRG. (A) vista dorsale di un cervello appena estratti del mouse neonatale. Le linee tratteggiate indicano l'area in cui incisioni deve essere fatto per facilitare la rimozione dello strato meningeo. (B) vista ventrale del cervello, le linee tratteggiate indicano l'area in cui la corteccia incontra il diencefalo ventrale. Profonde incisioni deve essere effettuata lungo le linee tratteggiate per aiutare l'isolamento della corteccia. (C-c ') rappresentazione visiva di come sollevare la corteccia lontano dal resto del cervello. (D) Un fresco isolato P5-P10 colonna vertebrale del mouse prima di tagliare via l'eccesso muscolare e osseo (d '). (e) Ubicazione della DRG all'interno della colonna vertebrale. (f) Il numero approssimativo di DRG che devono essere isolati da un topo. (g) Un DRG con radici lunghe che richiedono rifilatura prima della digestione enzimatica. La linea tratteggiata indica la regione in cui le radici devono essere tagliati. (G ') DRG dopo root-taglio.
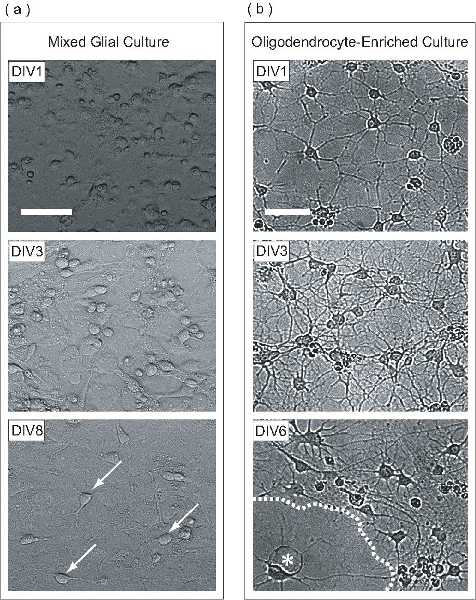
Figura 2. OPC si espandono all'interno di una coltura mista gliali, purificata, e successivamente differenziato come OL-arricchito la cultura. (A) contrasto con le immagini della fase di culture miste gliali a diversi stadi di sviluppo. A DIV1, le cellule appaiono rotonda con poche cellule appiattite. Stratificazione di cultura mista gliali inizia DIV3, dove astrociti formano un monostrato uniforme alla base del pallone, sul quale proliferano OPC. OPC molti sono visti a DIV8 (frecce) aderito alla superficie del monostrato astrociti. (B) Una volta purificata dalla cultura misto gliali, DIV1 OPC hanno esteso solo alcuni processi. A DIV3, le cellule hanno esteso molti processi, che ricorda intermedio fase OLS. A DIV6, OL appiattito (asterisco) sembrano aver prodotto fogli membranosa (linea tratteggiata). Barre di scala, a 50 micron.
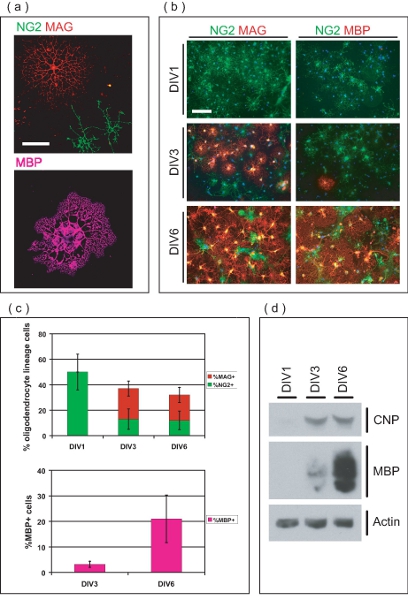
Figura 3. Caratterizzazione di OL-arricchito la cultura. (A) le immagini confocale di OL isolati a diversi stadi di sviluppo. NG2 + OPC ve hanno una morfologia semplice, mentre MAG OL + ve possedere più processi arborous. MBP + OL ve hanno esteso mielina membranose simili a fogli. Barra della scala, 50 micron. (B) purificata OL-lignaggio cellule provengono come OPC, e si differenziano in MAG + ve, MBP OL + ve oltre 6 DIV. A DIV1, tutti OPC sono NG2 + ve, mentre nessuno si MAG + ve o MBP + ve. A DIV3, MAG + ve e MBP pochi OL + ve sono ora evidenti. La maggior parte degli OLS sono MAG e MBP + ve a DIV6, con pochi rimasti NG2 + OPC ve. Barra della scala, 100 micron. (C) I valori medi ± DS della OL-lignaggio cellule per cento a diversi stadi di sviluppo oltre 6 DIV. A DIV1, tutti OL-lignaggio cellule NG2 + ve, pari al 50 ± 14% delle cellule totali all'interno della cultura. A DIV3 e DIV6, OL-lignaggio cellule rispettivamente il 36 ± 6,8% e 32 ± 8,4% di cellule totali, composto da proporzioni variabili di NG2 + ve, MAG + ve e MBP + OL ve. (D), SDS-PAGE eseguita sulle proteine derivate da arricchite OL-culture, dimostrando l'espressione graduata di OL-marcatori CNP e MBP nel periodo 6 DIV cultura.
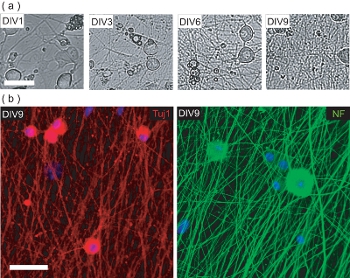
Figura 4. Caratterizzazione della cultura DRGN pre-semina OPC. (A) Fase immagini a contrasto di DRGNs nel periodo 9 DIV cultura pre-semina OPC. DRGNs provengono come di corporatura grossa cellule con processi di pochi, e producono una rete sempre più complessa dei neuriti. Barra della scala, 100 micron. (B) immagini confocale di culture DRGN fissato a DIV9 (pre-semina OPC) e colorate per neurone-specifici marcatori Tuj1 e NF200. DRGNs hanno prodotto una rete di neurite su cui OPC possono essere testa di serie per la produzione di OL / DRGN mielinizzanti co-culture. Scala bar, 50 micron.
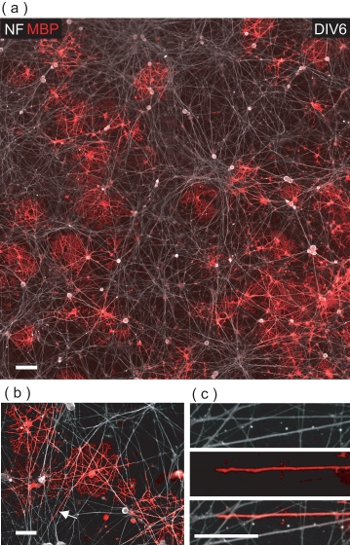
Figura 5. OL co-coltura con esito DRGNs in OL-mediata confezionamento dei neuriti DRGN con MBP + membrana ve. (A) A 4-campo immagine confocale montaggio di un OL / DRGN DIV6 co-coltura. Molti MBP + OL ve può essere visto interagire con il sottostante letto neuriti DRGN. Scala grafica, 100 micron. (B) Una visione ingrandita confocale di MBP + OL ve avvolgimento neuriti DRGN multipli. Barra della scala, 50 micron. (C) ingrandimento digitale della regione indicata in (b) quando una neurite DRGN viene avvolto con membrana OL. Scala grafica, 25 micron.
Discussione
Questo rapporto descrive un metodo per isolare OPC murini per la differenziazione nelle culture OL-arricchito o OL / DRGN co-culture. Quando colta da solo, il OPC differenziarsi in MBP + OL ve, la produzione di mielina come fogli membranosa. Quando aggiunto a DRGN letti neuriti, OL avvolgono i neuriti DRGN con MBP + membrana ve. Questo modello benefici l'indagine dei fondamenti complessi che regolano OL-mediata ensheathment assonale.
Anche se di grande valore, l'istituzione di tali culture è tecnicamente impegnativo. In particolare, gli aspetti impegnativi includono la digestione efficiente dei tessuti / dissociazione, il mantenimento del pH equilibrato terreni di coltura, e DRGN cambiamenti dei media. E 'importante considerare che la lunghezza della digestione, la quantità di tessuto essere digerito e la quantità di triturazione influenza il risultato efficacia e la fine della dissociazione dei tessuti. Non è insolito per i ricercatori esperti di ottenere basse rese cellulari dissociato da tessuti del sistema nervoso. Inoltre, OPC murino tendono ad essere sensibili alle variazioni del pH dei terreni di coltura, in particolare in ambiente alcalino. Il mantenimento di culture a 8,5% CO 2 mira a prevenire questo, dal momento che OPC sembrano tollerare condizioni migliori sul leggermente acido base. Per quanto riguarda DRGNs alimentazione, i cambiamenti dei media deve essere eseguita velocemente per non essiccare i neuroni, tuttavia, deve essere gentile come non perturbare il letto neuriti via di sviluppo. Bruschi cambiamenti dei media può rimuovere il letto neuriti dal substrato, e il risultato probabilmente nella sua completa dissociazione dalla coprioggetto.
Il merito potenzialità di questo sistema modello oscura notevolmente la sua natura tecnicamente impegnativo. Un vantaggio di questo sistema è l'uso di post-natale topi per la derivazione di coltura cellulare di eludere la necessità di sacrificare femmine riproduttrici per la raccolta dei tessuti embrionali. Un altro vantaggio è la mancanza di requisiti per i fattori di crescita (GF) per l'espansione della OPC. Misti culture gliali forniscono un ambiente che supporta la propagazione della OPC, presumibilmente a causa della presenza di astrociti derivati da fattori trofici. Altri metodi, come la derivazione via neurosfere 7,8, si basano sulle proprietà di GF mitogenica come fattore di crescita dei fibroblasti (bFGF), fattore di crescita epidermico (EGF) e delle piastrine fattore di crescita derivato dalle piastrine (PDGF) per l'espansione OPC. Allo stesso modo, usando postnatale (P5-10) per topi DRGNs evita la necessità di integrare i terreni di coltura con fattore di crescita nervosa (NGF), un fattore neurotrofico necessario per la sopravvivenza in vitro di embrioni DRGNs 9, 10. E 'di interesse per evitare l'uso di NGF poichè influenza negativamente la capacità di mielinizzanti OL quando coltivate con DRGNs 4. Evitare l'uso di GF-integrato dei media ha anche benefici economici, in quanto questi reagenti diventare costoso se utilizzato su larga scala.
Forse il vantaggio più importante di questo modello la cultura è la sua derivazione da mouse solo tessuti, fornendo così l'opportunità di derivare sia OPC e DRGNs dalla grande varietà di linee di topi transgenici. Questo permette per lo studio di entrambi e DRGN / o OPC proprietà specifiche che regolano la mielinizzazione. Questo sarà particolarmente importante per chiarire il recettore / ligando che regolano le interazioni OL-mediata mielinizzazione degli assoni. In tutto, questa tecnica è di grande valore per quanto riguarda la ricerca delle neuroscienze per le sue applicazioni verso la comprensione i segnali molecolari alla base della mielinizzazione.
Divulgazioni
Nessun conflitto di interessi dichiarati.
Riconoscimenti
Questo progetto è stato finanziato da una sovvenzione della Multiple Sclerosis Society of Canada a RKRWO è un destinatario di una borsa di studio dalla Multiple Sclerosis Society of Canada. SDR è un destinatario di Post-Doctoral Fellowships dalla Multiple Sclerosis Society of Canada e Canadian Institutes of Health Research.
Materiali
| Name | Company | Catalog Number | Comments |
| Nome prodotto | Azienda | Codice | |
| Dulbecco modificato (DMEM) | Multicell | 319-005-CL | |
| Sale di Hank soluzione equilibrata (HBSS) | Invitrogen | 14170-112 | |
| Minimo Essential Media (MEM) | GIBCO | 12360-038 | |
| Siero fetale bovino (FBS) | GIBCO | 10091-148 | |
| Penicillina-streptomicina (Pen / Strep) | GIBCO | 15140-122 | |
| GlutaMAX | Invitrogen | 35050-061 | |
| Poli-L-lisina | Sigma-Aldrich | P2636 | |
| Sieroalbumina bovina (BSA) | Sigma-Aldrich | A4503 | |
| Umano merosina purificata proteine (LN2) | Millipore | CC085 | |
| Ricombinante di ratto fattore neurotrofico ciliare (CNTF) | Peprotech | 450-50 | |
| L-tiroxina | Biochemika | 89430 | |
| Holo-transferrina | Sigma-Aldrich | T0665 | |
| B27 supplemento | GIBCO | 0080085-SA | |
| Insulina bovina | Sigma-Aldrich | I6634 | |
| 3,3 ',5-Triiodo-L-thyronine | Sigma-Aldrich | I6634 | |
| Progesterone | Sigma-Aldrich | P8783 | |
| Putrescina | Sigma-Aldrich | P7505 | |
| Sodio Selenite | Sigma-Aldrich | S5261 | |
| 5-Fluoro-2'-deossiuridina (FuDR) | Sigma-Aldrich | F0503 | |
| Papaina soluzione | Worthington | LS003126 | |
| DNaseI | ROCHE | 1010159001 | |
| L-cisteina | Sigma-Aldrich | C7352 | |
| 24-bene di coltura tissutale piatti | Cellstar | 662-160 | |
| T25-tessuto cultura fiaschi con tappo di sfiato | Corning | 430639 | |
| 10 centimetri di tessuto cultura piatti | Corning | 430167 | |
| 10 centimetri scatola di Petri | Fisher Scientific | 0875713 | |
| Collagenasi A | ROCHE | 103578 | |
| CellTrics 50 micron filtro (opzionale) | PARTEC | 04-004-2327 | |
| Proteina basica della mielina (MBP) Anticorpo | ABD Serotec | MCA409S | |
| NG2 anticorpi | Millipore | AB5320 | |
| Glicoproteina associata alla mielina (MAG) anticorpi | Millipore | MAB1567 | |
| 2 ', 3'-ciclico-nucleotide 3'-fosfodiesterasi (CNP) anticorpi | Covance | SMI-91R-100 | |
| Actina pan Ab-5 anticorpi | Fitzgerald | 10R-A106AX | |
| Neurofilamenti-200 (NF) anticorpi | Sigma-Aldrich | N4142 | |
| Tubulina beta-3 a catena (Tuj1) anticorpi | Millipore | MAB5544 | |
| Alexa Fluor 488 di capra anti-IgG di coniglio (H + L) anticorpo secondario | Invitrogen | A11008 | |
| Alexa Fluor 555 capra anti-topo IgG (H + L) anticorpo secondario | Invitrogen | A21422 | |
| Alexa Fluor 647 di capra anti-topo (IgG) (H + L) anticorpo secondario | Invitrogen | A21247 | |
| Capra anti-topo IgG (H + L)-HRP coniugato secondario | BioRad | 170-6516 | |
| Capra anti-topo IgG (H + L)-HRP coniugato secondario | Santa Cruz Biotechnology | SC-2065 | |
| 4 ',6-diamidino-2-fenilindolo (DAPI) | Sigma-Aldrich | D9542 |
Ricette dei media
OL-100X Supplemento *
| Ingrediente | Importo da aggiungere |
| DMEM | 100 ml |
| BSA | 1,02 g |
| Progesterone | 0,6 mg |
| Putrescina | 161 mg |
| Sodio Selenite | 0,05 mg |
| 3,3 ',5-Triiodo-L-thyronine | 4 mg |
* Conservare a -80 ° C in aliquote da 250 microlitri
t "> media OL| Ingrediente | Importo da aggiungere |
| DMEM | 23,75 mL |
| OL-100X Supplemento | 250 microlitri |
| Insulina bovina (da 1 mg / ml stock) | 125 microlitri |
| GlutaMAX | 250 microlitri |
| Holo-transferrina (da 33 mg / ml stock) | 37,5 microlitri |
| B27 Supplemento | 500 microlitri |
| FBS | 125 microlitri |
| CNTF (da 50 ng / mL stock) | 25 microlitri |
Tecnica mista cultura gliali (costituita in DMEM)
| Ingrediente | Concentrazione finale |
| FBS | 10% |
| Pen / strep (0,33% dal magazzino) | 33 unità / ml di penicillina e 33 mg / ml di streptomicina |
| GlutaMAX | 1% |
DRGN media (composta in DMEM)
| Ingrediente | Concentrazione finale |
| FBS | 10% |
| Pen / Strep (1% dal magazzino) | 100 unità / ml di penicillina e 100 mg / ml di streptomicina |
Digestione Soluzione Ricette:
OPC papaina soluzione (costituita nel MEM)
| Ingrediente | Concentrazione finale |
| Papaina soluzione | 1,54 mg / mL |
| L-cisteina | 360 mg / ml |
| DNaseI | 60 mg / ml |
DRG papaina soluzione (costituita in HBSS)
| Ingrediente | Concentrazione finale |
| Papaina | 1,54 mg / mL |
| L-cisteina | 360 mg / ml |
DRG Collagenasi Una soluzione (costituita in HBSS)
| Ingrediente | Concentrazione finale |
| Collagenasi A | 4 mg / mL |
Riferimenti
- Avellana-Adalid, V. Expansion of rat oligodendrocyte progenitors into proliferative "oligospheres" that retain differentiation potential. J Neurosci Res. 45, 558-570 (1996).
- McCarthy, K. D., de Vellis, J. Preparation of separate astroglial and oligodendroglial cell cultures from rat cerebral tissue. J Cell Biol. 85, 890-902 (1980).
- Barres, B. A. Cell death and control of cell survival in the oligodendrocyte lineage. Cell. 70, 31-46 (1992).
- Chan, J. R. NGF controls axonal receptivity to myelination by Schwann cells or oligodendrocytes. Neuron. 43, 183-1891 (2004).
- Camara, J. Integrin-mediated axoglial interactions initiate myelination in the central nervous system. J Cell Biol. 185, 699-712 (2009).
- Ishibashi, T. Astrocytes promote myelination in response to electrical impulses. Neuron. 49, 823-832 (2006).
- Chen, Y. Isolation and culture of rat and mouse oligodendrocyte precursor cells. Nat Protoc. 2, 1044-1051 (2007).
- Pedraza, C. E. Production, characterization, and efficient transfection of highly pure oligodendrocyte precursor cultures from mouse embryonic neural progenitors. Glia. 56, 1339-1352 (2008).
- Lewin, G. R., Ritter, A. M., Mendell, L. M. On the role of nerve growth factor in the development of myelinated nociceptors. J Neurosci. 12, 1896-1905 (1992).
- Greene, L. A. Quantitative in vitro studies on the nerve growth factor (NGF) requirement of neurons. II. Sensory neurons. Dev Biol. 58, 106-113 (1977).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon