Method Article
Вывод Обогащенный олигодендроцитов культур и олигодендроцитов / Нейрон Myelinating сотрудничества культур от Послеродовые мышей тканей
В этой статье
Резюме
В этой статье описываются методы для получения обогащенного популяции мышиные клетки-предшественники олигодендроцитов (OPC) в первичной культуре, которые отличают производить зрелые олигодендроциты (ВЛ). Кроме того, в настоящем докладе описываются методы для получения мышиных myelinating совместно культур путем посева мыши OPCs на нейритов кровать мыши задний корешок ганглиозных нейронов (DRGNs).
Аннотация
Определение молекулярного механизмов, лежащих OL развития не только решающее значение для углубления нашего знания OL биологии, но также имеет значение для понимания патогенеза демиелинизирующих заболеваний, таких как рассеянный склероз (РС). Сотовая развития обычно учился у моделей первичной культуры клеток. Первичные культуры клеток облегчает оценку данного типа клеток, обеспечивая контролируемой среде, свободной от посторонних переменных, которые присутствуют в естественных условиях. Хотя OL культур, полученных от крыс предоставили огромное количество понимание OL биологии, аналогичные усилия на создание OL культур от мышей был встречен с серьезными препятствиями. Разработка методов к культуре мышиных первичной ВЛ необходимо для того, чтобы воспользоваться доступными трансгенных линий мышей.
Различные способы для извлечения OPCs от грызунов ткани были описаны, начиная от neurosphere вывод, очистка дифференциальных адгезии и immunopurification 1-3. Хотя многие методы предлагают успеха, большинство из них требуют обширных раза культуры и / или дорогостоящего оборудования / реагентов. Чтобы обойти это, очищая OPCs из мышиной ткани с адаптацией метода первоначально описывается Маккарти и де Vellis 2 является предпочтительным. Этот метод включает физическое разделение OPCs от смешанной культуры глиальных основе коры новорожденных грызунов. В результате население очищенной OPC, которые могут быть дифференцированы в OL-обогащенного культуры. Такой подход является привлекательным из-за относительно короткий промежуток времени культура и ненужные требования факторы роста или immunopanning антител.
Изучая механизмы развития ПР в очищенной культуры является информативным, но он не обеспечивает наиболее физиологически соответствующую среду для оценки миелиновой оболочки образования. Сотрудничество культивирования ВЛ с нейронами придаст понимание молекулярной основы регулирующих OL-опосредованной миелинизации аксонов. Для многих OL / нейрона со-культурологи, задний корешок ганглиозных нейронов (DRGNs) оказались нейрона тип выбора. Они идеально подходят для совместной культуре с ВЛ-за их легкости добычи, минимальное количество загрязняющих клеток и образованием плотных кровати аксонов. Хотя исследования с использованием крысы / мыши myelinating xenocultures были опубликованы 4-6, метод получения таких OL / DRGN myelinating совместно культур от послеродовой мышиных тканей не было описано. Здесь мы приведем подробные описания методов, о том, как эффективно производить такие культуры, наряду с примерами ожидаемых результатов. Эти методы полезны для решения вопросов, связанных с развитием OL / myelinating функции, и являются полезным инструментом в области нейронауки.
протокол
Этика Заявление
Мышей, используемых в этой работе были заботу в соответствии с Канадским советом по уходу животных (CCAC) руководящих принципов. Этическое одобрение для экспериментов была получена из Университета Оттавы Animal Care Комитета по номеру протокола OGH-119.
1. Dissection - неонатальная коры мыши для OPC добычи
- Жертва P0-P2 мыши в соответствии с ведомственным руководящим принципам.
- Рассеките мозга и место в чашке Петри содержащие ледяной MEM (антибиотиков).
- Передача блюдо, чтобы вскрытие микроскопом.
- Использование скальпеля с боковыми мозг спинной вверх, сделать мелкий разрез sagittally по самым медиального края каждой коры (рис. 1а). Этот разрез должен проходить только через менингеальные слой, чтобы облегчить его удаление.
- Использование тонкой наконечником щипцы шелушиться мозговых оболочек в боковой моды. Если все сделано аккуратно, этот слой может быть удален в одной части. Во время этого шага, удаление обонятельных луковиц.
- С мозга вентральной стороной вверх, сделайте глубокий надрез сагиттальной, где кора отвечает вентральной области промежуточного мозга (рис. 1b).
- С мозг спинной стороной вверх, отдельно от коры мозга, поддев ткань в медиальной к боковым моды (рис. 1в, с '). Удалить остатки мозговых оболочек на этот шаг.
- Dice каждого кора приблизительно в 4 части и аккуратно передачи 15 мл коническую трубку, содержащую 350 мкл MEM мозга мыши пер. Держите пробирку на льду, пока все мыши были обработаны.
- Повторите шаги 1,1-1,8 для остальных мышей.
2. Диссоциация новорожденных коры и обслуживания смешанных культурах глиальных
Примечание: введение пузырьков в клеточной суспензии следует избегать во все следующие шаги.
- Добавить 15 мл коническую трубку с только что расчлененный мозги 37 ° С водяной бане в течение 3 мин.
- Передача мозги стерильной капот культуры ткани.
- Осторожно пройти кубиками коры через P1000 кончика пипетки для создания более мелкие фрагменты. Стоп пипетирования раз Есть нет мозга части достаточно большой, чтобы нарушить плавное течение суспензии через кончика пипетки.
- Добавить 75 мкл OPC папаин раствора на мозг в конической трубе. Решение OPC папаин должны быть предварительно нагревают при 37 ° С в течение 20 минут перед использованием.
- Инкубируйте в 37 ° С на водяной бане 20 мин. Примерно через каждые 2 минуты, аккуратно переверните трубку для предотвращения агрегации ткани. За это время, добавляют 5 мл смешанного глиальных питательных сред для каждого поли-L-лизин (PLL) покрытием (1 мг / мл) T25 колбу (один флакон в мозг мыши), и место в 37 ° C культуре ткани инкубаторе при 8,5% СО 2.
- Через 20 мин, возвращение ткани подвеске стерильной капот и добавить 2 мл смешанного глиальных медиакультуры в мозг трубки. Дайте настояться в течение 10 мин при комнатной температуре, чтобы инактивации решение OPC папаин.
- Алиготе ткани суспензии в 5 мл трубы пластиковые. Количество трубок должно совпадать с количеством мозгов рассеченные, в результате чего около 2,5 мл на трубе.
- Использование стерильных пламени полированное стекло пипетки Пастера осторожно растирают ткани в каждую пробирку. Растирают сначала медленно, и постепенно увеличивать скорость как части диссоциируют. Растирают примерно в 10-15 раз, однако это число может меняться в зависимости от эффективности пищеварения.
Примечание: В-растиранием приведет к плохой диссоциация ткани, в то время как чрезмерное растиранием негативно скажется на жизнеспособности клеток. Важно, чтобы не вводить пузырьков в раствор, так как это серьезно повлиять на жизнеспособность клеток.
- Как только Есть никаких видимых сгустков ткани оставшиеся в суспензии, трансфер в 50 мл коническую трубку с 4 мл смешанного глиальных медиакультуры в мозг (то есть, 4 мозги = 16 мл смешанного глиальных питательных сред).
- Аккуратно переверните 50 мл коническую трубку и повторить для оставшихся 5 мл пробирок.
- Алиготе объединенных клеточной суспензии в 15 мл конические пробирки (примерно 6,5 мл на 15 мл трубки). Число 15 мл труб должны совпадать с количеством мозгов расчленены.
- Центрифуги трубы при 1200 оборотов в минуту (~ 300 г) в течение 5 мин.
- Тщательно аспирата супернатант и добавьте 1 мл теплой смешанных глиальных СМИ культуру каждые 15 мл коническую трубку.
- Медленно ресуспендирования гранулу P1000 наконечником пипетки, соблюдая осторожность, чтобы не вводить пузыри. Добавить клеточной суспензии из каждой пробирки с предварительно уравновешенную PLL покрытием колбы T25, оказание общего объема культуральной среды до 6 мл.
- Место колбы в культуре ткани инкубаторе в течение 3-4 часов, чтобы позволить клеткам прикрепляться к субстрату PLL. Выполните полное изменение средств массовой информации с помощью пипетки из средств массовой информации, и добавить 6 мл свежего смешанного глиальных питательных сред для колб. Этот шаг снимает большую часть мусоравызванные растиранием, а также способствует культуры жизнеспособность. Если OL / DRGN совместно культур желательны, обратитесь к разделу 3 настоящего протокола.
- После 3 дней культуры, выполняют в 2 / 3 средств массовой информации изменения, удалив 4 мл средствах массовой информации, и замене 4 мл свежего смешанного глиальных медиа культуры. На данный момент, астроцитов монослоя должно быть формирование на базе колб.
- На 6-й день, совершать другие 2 / 3 средств массовой информации изменения и дополнения колбы с конечной концентрации 5 мкг / мл инсулина. На данный момент, астроцитов монослоя должны быть четко видны, на вершине которой OPCs будет пролиферирующих.
3. DRGN изоляции
Примечание: Для получения OL / DRGNs совместно культур, DRGNs должны быть установлены на следующий день после смешанной глиальных поколения культуры. Оба типа культуры выращивают самостоятельно, так и комбинированные через 9-10 дней.
- Жертва P5-P10 мыши в соответствии с ведомственным руководящим принципам.
- Извлечение позвоночника, и трансфер в чистую чашку Петри.
- Trim прочь столько мышцы и кости от позвоночника возможно (рис. 1, г, д '), поскольку это облегчит вскрытие спинной ганглий корня (ДРГ).
- Передача отделаны позвоночника к новой чашки Петри вентральной стороной вверх. Использование рассечение ножницами и начиная каудально, вырезать медиально через позвоночник в продольной моде.
- С помощью двух пар пинцетов, мягко взломать позвоночника подвергать спинного мозга.
- ДРГ можно найти снизу и сбоку от спинного мозга. Использование тонкой наконечником пинцетом, осторожно удалите ДРГ, избегая при этом повреждения ганглиев (рис. 1д).
- Передача удалены ДРГ в буфер соль ледяной Хэнка решение (HBSS, антибиотиков) в новую чашку Петри. Прозектором должна быть направлена на извлечение 40 ДРГ на мышь (рис. 1е).
- После ДРГ были извлечены, отделка ДРГ любой чрезмерно длинные корни (рис. 1 г, д '), чтобы минимизировать введения загрязняющих клеток в культуре (глиальные клетки, фибробласты).
- Передача ДРГ в 1,5 мл центрифужную пробирку, содержащую 500 мкл ледяной HBSS.
- Центрифуга при 1200 оборотов в минуту (~ 300 г) в течение 5 мин при 4 ° С до гранул ДРГ.
- Передача центрифужные пробирки для стерильных капот культуры ткани и удалить HBSS из труб.
- Добавить 500 мкл предварительно нагревается (20 мин при 37 ° С) DRG папаин решение, и инкубировать пробирки в 37 ° С на водяной бане 10 мин. Обратить труб каждые 2 мин, чтобы предотвратить ткани агрегации.
- Повторите шаг 3.10.
- Удалить решение DRG папаин и добавить 500 мкл предварительно нагревается (20 мин при 37 ° С) Коллагеназа решение. Инкубируйте в 37 ° С водяной бане в течение 10 минут, переворачивая каждые 2 мин.
- Повторите шаг 3.10.
- Удалить супернатант и добавьте 1 мл DRGN СМИ. Обратить трубки в несколько раз.
- Повторите шаг 3.10.
- Повторите шаг 3.16.
- Пальто стерильным пламенем полированного стекла с пипеткой Пастера бычьего сывороточного альбумина (БСА) с помощью пипетки раствор 0,25% BSA в HBSS в несколько раз. Покрытие раствором БСА будет препятствовать ДРГ от присоединения к стенам стеклянной пипетки.
- Измельченного в порошок ДРГ с BSA покрытием пипетки осторожно сначала, и с увеличением интенсивности раз сгустки начинают диссоциирующего. Растирают примерно в 10-15 раз, однако это число зависит от степени пищеварения, а число ДРГ в трубке.
- После диссоциации достигается, проходят суспензии через 50 мкм фильтр в стерильную чашку Петри с 7 мл DRGN СМИ. Фильтрация позволит устранить большую часть мусора из клеточной суспензии, хотя этот шаг не является критическим.
- Инкубировать чашки Петри на уровне 8,5% CO 2 примерно на 1,25 часа.
- Пальто несколько 12 мм покровные с LN2 (10 мкг / мл в PBS) в 24-луночных блюдо в течение этого времени инкубации.
- После инкубации закончен, наблюдать чашке Петри при ярком поле. DRGNs определены как большие здоровые, фаза темных клеток. Swirl чашке Петри осторожно, чтобы снять любые придерживался DRGNs.
Примечание: Многие загрязняющие клетки будут сильно привязаны к чашке Петри, обогащая тем самым ваш клеточной суспензии для DRGNs.
- Передача клеточной суспензии в 15 мл коническую трубку. Осторожно промыть посуду с 4 мл DRGN средств информации собирать любые остаточные DRGNs. Передача дополнительных 4 мл в коническую трубку.
- Центрифуга в течение 5 мин при 1200 оборотов в минуту (~ 300 г).
- Аспирируйте супернатант и ресуспендируют осадок в 500 мкл свежей среды DRGN.
- Подсчитать количество дали DRGNs использованием гемоцитометра. Будьте уверены, чтобы рассчитывать только DRGNs, а не другие типы клеток. DRGNs можно определить по их больших сферических тел клетки.
- Семенной 30,000-50,000 DRGNs каждому LN2 покрытием покровное в 1 мл DRGN средства массовой информации, и места в 37 ° C культуре ткани инкубатор на 8,5% CO 2 за одну ночь.
- Следующим утром, выполните полное изменение средств массовой информации, заменив DRGNсредах с OL СМИ (минус CNTF) с конечной концентрации 1% Pen / Strep и 10 мкМ ФУДР.
- О днях 3 и 5, выполнить изменения 3 / 4 средств массовой информации с тем же СМИ, как в шаге 3.30.
- На 7 день, выполните полное изменение сред с OL СМИ (минус CNTF, Пен / Strep, ФУДР).
- В День 9, DRGNs должны сформировали обширную кровать аксонов, и теперь готов к совместной культивировали с OPCs.
4. Очистка OPCs из смешанных глиальных культур для создания OL-обогащенной культурами или OL / DRGN совместно культур
- В День 9 из смешанных глиальные культуры, передача колб для орбитальный шейкер в 5% CO 2 культуре ткани инкубатора. Место колбы на вершине пустой колбы T25, чтобы предотвратить любое тепло, возникающее при орбитальном шейкере с отрицательно сказывается смешанных глиальных культурах. Разрешить культур, чтобы уравновесить к этому новому инкубаторе в течение 1 часа.
- После колбы имеют уравновешенный, встряхните колбы на 50 оборотов в минуту в течение 45 мин. Цель этого дрожания для удаления свободно присоединенными загрязняющих клетки монослоя.
- Перемещение ячеек на капот культуры ткани и удалить все СМИ из фляги. Заменить на 4 мл свежей смешанных глиальных питательных сред с добавлением 5 мкг / мл инсулина.
- Место колбы обратно на шейкере, и позволить, чтобы уравновесить в течение примерно 3 часов.
- После колбы уравновешенной, закрепить их надежно орбитальный шейкер, и встряхнуть колбы в течение примерно 16 часов при 220 оборотов в минуту (на ночь).
- Следующим утром, если ВЛ должны быть выращены в отсутствии DRGNs (то есть, OL-обогащенного культуры), пальто несколько стерильных 12 мм покровные с LN2 (10 мкг / мл в PBS) в течение 1 часа. Передача покровные до 24-и посуду, стирать с PBS следуют OL мыть средствами массовой информации. Добавить 1 мл OL СМИ в каждую лунку и равновесие на уровне 8,5% CO 2.
- Уравновешивать 10 см блюда культуры тканей на уровне 5% CO 2 в течение 30 мин. Один блюдо будет необходимо на каждые 2 колбы. Они будут использованы для дифференциальной адгезии обогащение приостановлено OPCs.
- После 30 минут уравновешивания период прошел, передача информации из потрясен колбы к блюдам. Каждое блюдо должно получать средства массовой информации от 2 колбы, равная примерно 8 мл клеточной суспензии на 10 см блюдо.
- Инкубируйте блюда в 5% CO 2 в течение 30 мин, обеспечивая при этом нежный толчок в 15 мин марки. Этот толчок поможет предотвратить OPCs от присоединения к 10 см блюдо.
- После инкубации завершения изучения блюд при ярком поле. OPCs определяются как небольшие пряди ячейки, как правило, из 3-5 клеток, но иногда образуют крупные агрегаты напоминающие нейросферы. Многие не-ПР клетки линии должны быть накрепко привязанным к базе пластины. Аккуратно водоворот пластин отделить любой свободно придерживаться OPCs и передачи клеточной суспензии из каждой пластины в 15 мл коническую трубку.
- Центрифуга при 1200 оборотов в минуту (~ 300 г) в течение 5 мин.
- Ресуспендируют гранул в 1 мл OL сред с P1000 пипетки, после ресуспендирования с P200 кончиком пипетки.
- Граф клеток с использованием гемоцитометра.
- Для обогащенного-ПР культур, семян 25000 - 50000 OPCs на каждые 12 мм LN2 покрытием покровное в конечном объеме 1 мл OL СМИ.
- Для OL / DRGN совместно культур, выполните полную OL СМИ (минус CNTF) изменений на DRGNs из секции [3], и осторожно добавить 50000 клеток от OPC-обогащенного клеточной суспензии. Будьте осторожны, чтобы не нарушать постельный DRGN нейритов во время добавления OPCs.
- Место культуры в 37 ° С инкубатор на 8,5% CO 2, и избежать удаления до фиксации. Мышей OPCs чувствительны к изменениям рН, и удаления из инкубатора изменит рН OL СМИ. Также следует отметить, добавление дН 2 O в пустой скважины окружающих культурах клеток предотвращает испарение культуру средств массовой информации, что позволяет минимизировать колебания концентрации растворенных веществ внутри ПР СМИ. Это обеспечит более согласованную среду для OPCs.
5. Обработка культур для микроскопии иммунофлуоресценции
- Fix культур с 100% метаноле при -20 ° С в течение 10 мин, или 3% параформальдегида при комнатной температуре в течение 15 мин.
- Permeabilize покровные с 0,1% Triton-X-100 в течение 10 мин, смойте с фосфатным буфером блок физиологический раствор (PBS) и в течение 1 часа в 10% козьего сыворотки.
- Инкубируйте покровные с первичными антителами разбавленный в блокировании решения ночи при 4 ° C.
- Вымойте покровные 3 раза PBS, и инкубировать с Alexa Fluor-сопряженных вторичными антителами (Invitrogen) разводят в блокировании решения в течение 45 мин.
- Контрастирующая с 4 ',6-diamidino-2-фенилиндола (DAPI) и промойте покровные несколько раз PBS.
- Горы в покровных DAKO флуоресцентные монтажа среды.
- Анализ слайды с помощью иммунофлюоресценции микроскопии. В этом протоколе, слайды были проанализированы либо с Zeiss Axiovert 200M перевернутой флуоресценциимикроскопа или Zeiss LSM 510 META лазерной сканирующей конфокальной микроскопии.
6. Всего добыча белки клетки от OL-обогащенного культур
- Удалить 24-луночных культуры из инкубатора и прохладной на льду в течение 3 мин.
- Осторожно удалите средства массовой информации, и добавить 10-20 мкл лизирующего буфера (50 мМ Трис-HCl, 150 мМ NaCl, 0,1% SDS, 0,5% натрия дезоксихолата, 1% Triton-X-100, с 0,1% пепстатина, апротинин, PMSF, leupeptin, ортованадата натрия) в каждую лунку (не менее 8 скважин на образец предлагается).
- Очистите скважин с использованием широким отверстием P1000 пипетки и передачи лизат в 1,5 трубки центрифуги мл.
- Pass лизат через 30 ½ калибра шприц примерно в 15 раз, и холод на льду в течение 30 мин.
- Пробирки центрифужные при 14000 оборотов в минуту (~ 20000 г) в течение 15 мин при 4 ° C.
- Передача супернатант новые трубы центрифуги, и хранить при температуре -80 ° C.
7. SDS-PAGE анализа на обогащенных-ПР культуры белка
- Решение 30 мкг белка в образце в снижении буфер SDS-PAGE на стандартных 12% поли-акриламид гели.
- Полусухой передачи гели на мембраны ПВДФ.
- Блок мембраны в течение 1 часа в 5% обезжиренного сухого молока в TBST (10 мМ Трис-HCl, рН 8,0, 150 мМ NaCl, 0,1% Твин-20).
- Инкубируйте мембран с первичными антителами разбавленный в блокировании решения в течение 1 часа.
- Вымойте мембраны 3 раза TBST течение 10 мин.
- Инкубируйте мембран с HRP-сопряженных вторичными антителами в течение 45 минут в блокировании решения.
- Вымойте мембран несколько раз TBST, и инкубировать с Amersham ECL Plus западных промокательной обнаружения реагента (GE Healthcare) в течение 5 мин.
- Обнаружение белка полосы со стандартными научный фильм изображений.
8. Представитель Результаты:
В этом протоколе OPCs будут расширены на астроциты монослоя в рамках смешанной глиальные культуры. Это смешанная глиальных культуры происходит от P0-P2 новорожденных коры мыши. На 1-й день в пробирке (div1), смешанные глиальные культуры содержит клетки с различной морфологией с точки зрения фазового контраста микроскопии (рис. 2а). На div3, астроцитов монослоя начинает формироваться на базе колбу, и в div8, OPCs можно четко наблюдать на поверхности монослоя. На DIV9, пролиферирующих OPCs достигли достаточной плотности, чтобы быть очищен ночь высокоскоростных орбитальную встряхивания. После процесса очистки была завершена, в результате OPC-обогащенного клеточной популяции. На div1 с должностями очистки, OPCs имеют простой морфологии, расширяя несколько процессов (рис. 2б). На div3 сообщение очистки, клетки расширили комплекс сети из процессов, напоминающих незрелые ВЛ. На DIV6 сообщение очистки, очищенный ВЛ имеют плоские и прогнозируемых листовки типа мембранных структур. Это морфологическое развитие характерно в пробирке созревание ВЛ.
Иммунофлуоресценции микроскопии указывает очищенные клетки в OL-линии (рис. 3а). Сеяные OPCs сначала выразить хондроитин сульфат протеогликаны (NG2), и развиваться в миелин-связанный гликопротеин (МАГ) положительные незрелых ВЛ в течение трех дней после посева (рис. 3б). На DIV6, многие ВЛ выразить основному белку миелина (ОБМ), и обладают типичным зрелым OL морфологии. Процент OL-линии клетки количественно в различные моменты времени, чтобы определить чистоту OL-обогащенной культурами (рис. 3в). На div1 сообщение очищения, культуры 50 ± 14% NG2 OPCs положительному, без каких-ве MAG + или MBP Положительный ВЛ. Это означает, очищенный OL-линии клетки находятся в стадии предшественников при посеве времени, с незначительным числом дифференцированных ВЛ. На div3, многие ВЛ дифференцировались в MAG Положительный клетках (24 ± 5,9%), а некоторые сохраняют предшественником фенотип, и остаются NG2 + (13 ± 8,0%). На div3, небольшая часть MAG Положительный клеток (3,2 1,2%), также выразив MBP. На DIV6, 20 ± 5,9% от ВЛ являются MAG Положительный то время как 12 ± 7,3% сохранится как NG2 Положительный OPCs. Кроме того, 21 ± 9,3% клеток в культуре MBP Положительный ВЛ в это время точка. SDS-PAGE анализ показывает, градуированных выражение 2'3'-циклических нуклеотидов 3'-фосфодиэстеразы (CNP) и MBP течение 6 дней культуры периода, далее демонстрируя способность OPCs в культуре неизлечимо дифференцироваться в зрелые ВЛ (рис. 3d ). В совокупности эти данные устанавливает этот метод как средство производства OL-обогащенный культурой систему, пригодную для изучения OL созревания от OPCs.
Этот протокол также описывает методы создания OL / DRGN совместного использования культур мышиных только источники ткани. Однако, для того, чтобы произвести со-культуры, DRGNs должны сначала быть культурными только, чтобы произвести достаточно разветвленная сеть аксонов. Эти послеродовой мышиной культурах нейронов выращивают в течение 9 дней в странах с низким сыворотки среде с 10 добавок ФУДР мкМ для предотвращения распространения загрязнения фибробластов и GL IAL клеток. В течение 9 дней в лабораторных условиях, изолированных DRGNs производить плотные кровать аксонов (рис. 4а). Это нейритов кровать иммунопозитивных для нейронов нейрофиламентов маркеров 200 (NF) и Tuj1 (рис. 4б). На данный момент, очищенный OPCs могут быть добавлены к нейритов кровати, и культивировали в течение еще 6 дней, чтобы произвести myelinating совместно культур.
На DIV6 О. Л. / DRGN совместно культуры, многие MBP Положительный ВЛ можно наблюдать среди NF Положительный нейритов DRGN (рис. 5а). При ближайшем рассмотрении, ВЛ являются свидетельством вступить в контакт с многочисленными нейритов DRGN, часто вкладывающийся их MBP + ве мембраны (рис. 5, б, в).
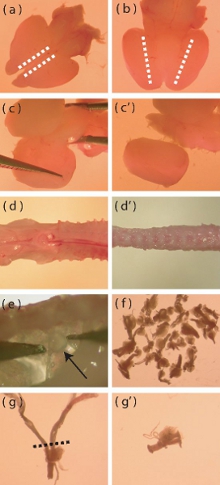
Рисунок 1. Препарирование микроскоп изображений отдельных аспектов новорожденных мышей коры и DRG изоляции. () Спинной зрения только что извлеченные неонатального мозга мыши. Пунктирные линии показывают области, где разрезы должны быть сделаны, чтобы облегчить удаление менингеальные слоя. (Б) вид снизу головного мозга, пунктирные линии показывают области, где кора отвечает вентральной промежуточного мозга. Глубокие разрезы должны быть сделаны по пунктирным линиям, чтобы помочь изоляции коры. (С-с ') визуальной информации о том, как вырвать коры от остальной части мозга. (Г) свежевыделенных P5-P10 мыши позвоночника до обрезки излишки мышц и костей (D '). (е) Расположение ДРГ в позвоночнике. (е) приблизительное количество ДРГ, которые должны быть изолированы друг от мыши. (г) DRG с длинными корнями, которые требуют обрезка до ферментативного пищеварения. Пунктирная линия указывает на область, где корни должны быть сокращены. (Д ') DRG сообщение корневой обрезки.
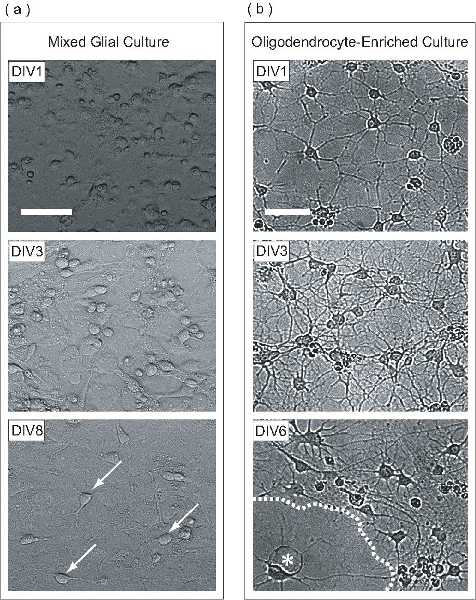
Рисунок 2. OPCs будут расширены в рамках смешанной глиальные культуры, очищают, а затем дифференцируются OL-обогащенного культуры. (А) этап контрастные изображения смешанного глиальных культурах на различных стадиях развития. На div1, клетки появляются круглые с несколькими уплощенных клеток. Стратификация смешанных глиальные культуры начинается в div3, где астроцитов образуют единую монослоя в основании колбы, на котором OPCs размножаться. Многие OPCs видны на div8 (стрелки) присоединилась к поверхности астроцитов монослоя. (Б) Как только очищенный от смешанных глиальные культуры, div1 OPCs распространили лишь несколько процессов. На div3, клетки распространились многие процессы, напоминающие промежуточной стадии ВЛ. На DIV6, сплющенные ВЛ (звездочка), похоже, производятся мембранных листов (пунктирная линия). Шкала баров, 50 мкм.
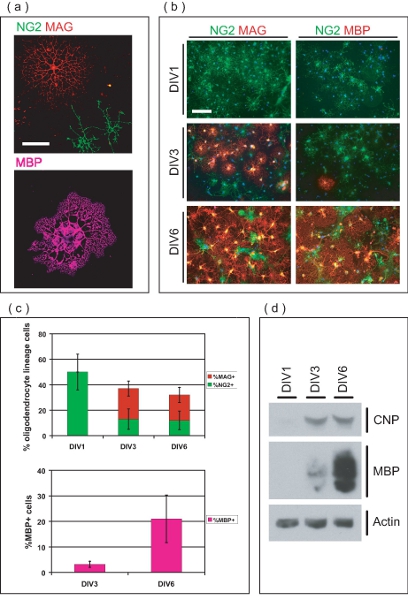
Рисунок 3. Характеристика OL-обогащенного культуры. () Конфокальной изображения изолированных ВЛ на разных стадиях развития. NG2 Положительный OPCs имеют простую морфологию, тогда как MAG ВЛ Положительный обладают несколькими arborous процессов. MBP Положительный ВЛ расширили мембранных миелин-подобных листов. Шкала бар, 50 мкм. (Б) чистый OL-линии клетки возникают как OPCs и дифференцируются в MAG + В.Е., ВЛ MBP + ве более 6 DIV. На div1, все OPCs являются NG2 Положительный, в то время ни один из них MAG положительному или MBP + ве. На div3, MAG положительные и несколько MBP ВЛ Положительный теперь очевидна. Большинство ВЛ являются MAG и MBP + ве на DIV6, с немногих оставшихся NG2 Положительный OPCs. Шкала бар, 100 мкм. (С) средние значения ± стандартное отклонение от процентов OL-линии клеток на разных стадиях развития в течение 6 DIV. На div1, все OL-линии клетки NG2 положительному, что составляет 50 ± 14% от общего числа клеток в культуре. На div3 и DIV6, OL-клетки линии соответственно составляет 36 ± 6,8% и 32 ± 8,4% от общего числа клеток, состоящий из различных пропорциях NG2 положительному, MAG положительные и MBP Положительный ВЛ. (Г) SDS-PAGE осуществляется на белка, полученного из обогащенного OL-культуры демонстрируют градуированных выражение OL-маркеры CNP и MBP более 6 период культуры DIV.
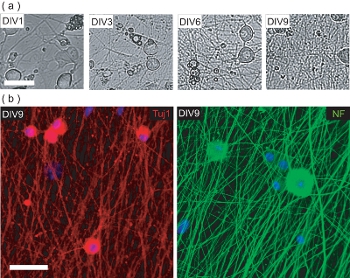
Рисунок 4. Характеристика культуры DRGN предварительно OPC посева. () Фазового контраста изображения DRGNs за 9 DIV культуры предвыборный период OPC посева. DRGNs возникают как большие здоровые клетки с несколько процессов, и производить более сложные нейритов сети. Шкала бар, 100 мкм. (Б) конфокальной образы DRGN культур зафиксирована на DIV9 (до OPC посева) и окрашивали на нейрон-специфических маркеров Tuj1 и NF200. DRGNs дали нейритов сети, на которых OPCs может быть заполнена на производство OL / DRGN myelinating совместно культур. Шкала бар, 50 мкм.
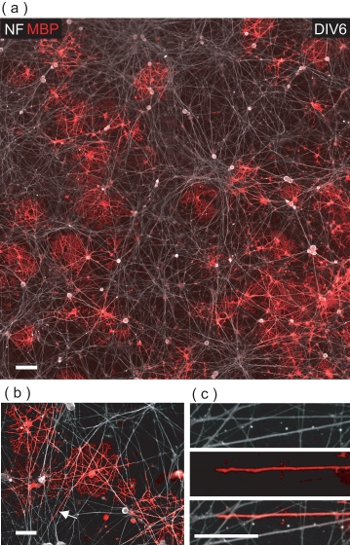
Рисунок 5. ВЛ совместно культивировали с DRGNs привести к OL-опосредованной упаковки DRGN нейритов с MBP + ве мембраны. () 4-полевой конфокальной изображение монтаж DIV6 OL / DRGN совместно культуры. Многие MBP Положительный ВЛ можно увидеть взаимодействия с основной кровати нейритов DRGN. Шкала бар, 100 мкм. (Б) увеличенное конфокальной зрения MBP Положительный ВЛ упаковки нескольких нейритов DRGN. Шкала бар, 50 мкм. (С) Цифровое увеличение региона, обозначенного в (б), где DRGN аксонов в настоящее время завернутый с О. Л. мембраны. Шкала бар, 25 мкм.
Обсуждение
В настоящем докладе описывается метод выделения мышиных OPCs для дифференциации OL-обогащенного культур или OL / DRGN совместно культур. При культивировании в одиночку, OPCs дифференцироваться в MBP Положительный ВЛ, производить миелин-подобных мембранных листов. При добавлении к DRGN нейритов кровати, ВЛ окутывать DRGN нейритов с MBP + ве мембраны. Эта модель преимущества исследование комплекса основы руководящий OL-опосредованного аксонального ensheathment.
Хотя большую ценность, создание такой культуры является технически сложным. В частности, требуя аспекты включают в себя эффективное пищеварение ткани / диссоциации, обеспечение сбалансированной рН культуральной среды, а также средств массовой информации DRGN изменения. Важно учитывать, что длина пищеварения, количество ткани переваривается и количество растиранием влияет на эффективность и конечный результат ткани диссоциации. Это не является необычным для опытных исследователей для получения низких сотовой выходы из диссоциированных нервной ткани системы. Кроме того, мышиные OPCs, как правило, чувствительны к изменению рН культуральной среды, особенно в щелочных условиях. Поддержание культур на уровне 8,5% CO 2 направлена на предотвращение этого, так как OPCs видимому, лучше терпеть слегка кислой среде над основными. Что касается кормления DRGNs, средства массовой информации изменения должны быть выполнены быстро, чтобы не пересушивает нейронов, однако, должны быть нежными, чтобы не нарушить развивающихся нейритов постели. Резкие изменения информации могут выбить нейритов кровать от субстрата, и, вероятно, привести к его полной диссоциации с покровным.
Потенциальные достоинства этой модели система значительно затмевает ее технически сложных природы. Одно из преимуществ этой системы является использование послеродовых мышей для сотовых выводе культуры, в обход необходимости жертвовать размножающихся самок собрать эмбриональной ткани. Еще одним преимуществом является отсутствие потребности в ростовых факторов (GFS) для расширения OPCs. Смешанные глиальных культурах обеспечить условия, способствующие распространению OPCs, предположительно, из-за присутствия астроцитов происхождения трофических факторов. Другие методы, такие как вывод через нейросферы 7,8, полагаться на митогенных свойства GFs, таких как основной фактор роста фибробластов (bFGF), эпидермальный фактор роста (EGF) и тромбоцитарный фактор роста (PDGF) для расширения OPC. Аналогично, используя послеродовой (С-5-10) для мышей DRGNs избегает требование пополнения питательных сред с фактор роста нервов (ФРН), нейротрофических факторов, необходимых для выживания в пробирке эмбриональных DRGNs 9, 10. Интересно, чтобы избежать использования NGF как это отрицательно влияет на myelinating мощностью ВЛ при культивировании с DRGNs 4. Отказ от использования GF-дополнены СМИ также имеет экономические преимущества, так как эти реагенты стать дорогостоящим при использовании на больших масштабах.
Возможно, наиболее важным преимуществом этой культуры модели является ее происхождение от мыши только ткани, тем самым обеспечивая возможности для получения как фотобарабанов и DRGNs из различных трансгенных линий мышей. Это дает возможность изучения как DRGN и / или OPC-определенные свойства, которые управляют миелинизации. Это будет особенно важно для выяснения рецептор / лиганд регулирующих OL-опосредованной миелинизации аксонов. В целом, этот метод имеет большое значение по отношению к неврологии исследования из-за ее приложения к пониманию молекулярных сигналов основной миелинизации.
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Этот проект был профинансирован за счет гранта от нескольких общества рассеянного склероза Канады RKRWO является получателем Студенчество из нескольких общества рассеянного склероза Канады. SDR является получателем пост-докторские стипендии от нескольких общества рассеянного склероза в Канаде и канадских институтов исследований в области здравоохранения.
Материалы
| Name | Company | Catalog Number | Comments |
| Наименование | Компания | Номер продукта | |
| Дульбеко изменения Eagle Средняя (DMEM) | Multicell | 319-005-CL | |
| Сбалансированный Соль Хэнка Решение (HBSS) | Invitrogen | 14170-112 | |
| Минимально необходимые Media (MEM) | GIBCO | 12360-038 | |
| Эмбриональной телячьей сыворотки (FBS) | GIBCO | 10091-148 | |
| Пенициллин-Стрептомицин (Pen / Strep) | GIBCO | 15140-122 | |
| GlutaMAX | Invitrogen | 35050-061 | |
| Поли-L-лизин | Sigma-Aldrich | P2636 | |
| Бычьего сывороточного альбумина (БСА) | Sigma-Aldrich | A4503 | |
| Человек merosin очищенного белка (LN2) | Millipore | CC085 | |
| Рекомбинантный крысы цилиарной нейротрофический фактор (CNTF) | PeproTech | 450-50 | |
| L-тироксин | Biochemika | 89430 | |
| Холо-трансферрина | Sigma-Aldrich | T0665 | |
| B27 дополнения | GIBCO | 0080085-SA | |
| Бычьего инсулина | Sigma-Aldrich | I6634 | |
| 3,3 ',5-трийод-L-тиронина | Sigma-Aldrich | I6634 | |
| Прогестерон | Sigma-Aldrich | P8783 | |
| Путресцин | Sigma-Aldrich | P7505 | |
| Натрия селенит | Sigma-Aldrich | S5261 | |
| 5-фтор-2'-дезоксиуридина (ФУДР) | Sigma-Aldrich | F0503 | |
| Папаин решение | Уортингтон | LS003126 | |
| DNaseI | РОШ | 1010159001 | |
| L-цистеин | Sigma-Aldrich | C7352 | |
| 24-а блюда культуре ткани | Cellstar | 662-160 | |
| T25-культуре ткани колбы с вентиляционными крышкой | Гранулирование | 430639 | |
| 10 см блюда культуре ткани | Гранулирование | 430167 | |
| 10 см Петри | Fisher Scientific | 0875713 | |
| Коллагеназа | РОШ | 103578 | |
| CellTrics 50 мкм фильтр (опция) | PARTEC | 04-004-2327 | |
| Основному белку миелина (ОБМ) антител | Абд Serotec | MCA409S | |
| NG2 антител | Millipore | AB5320 | |
| Миелин-Associated гликопротеина (МАГ) антител | Millipore | MAB1567 | |
| 2 ', 3'-циклических нуклеотидов 3'-фосфодиэстеразы (CNP) антител | Covance | SMI-91R-100 | |
| Актина кастрюлю Ab-5 антител | Фицджеральд | 10R-A106AX | |
| Нейрофиламентов-200 (NF) антител | Sigma-Aldrich | N4142 | |
| Тубулина бета-3 цепи (Tuj1) антител | Millipore | MAB5544 | |
| Alexa Fluor 488 козьего анти-IgG кролика (H + L) вторичные антитела | Invitrogen | A11008 | |
| Alexa Fluor 555 антимышиного IgG (H + L) вторичными антителами | Invitrogen | A21422 | |
| Alexa Fluor 647 козьего анти-крыса (IgG) (H + L) вторичными антителами | Invitrogen | A21247 | |
| Антимышиного IgG (H + L)-HRP сопряженных вторичными антителами | BioRad | 170-6516 | |
| Коза анти-IgG крысы (H + L)-HRP сопряженных вторичными антителами | Санта-Крус биотехнологии | SC-2065 | |
| 4 ',6-diamidino-2-фенилиндола (DAPI) | Sigma-Aldrich | D9542 |
Медиа Рецепты
OL-100X Дополнение *
| Ингредиент | Сумма, чтобы добавить |
| DMEM | 100 мл |
| BSA | 1,02 г |
| Прогестерон | 0,6 мг |
| Путресцин | 161 мг |
| Натрия селенит | 0,05 мг |
| 3,3 ',5-трийод-L-тиронина | 4 мг |
* Хранить при температуре -80 ° C в 250 мкл аликвоты
т "> OL СМИ| Ингредиент | Сумма, чтобы добавить |
| DMEM | 23,75 мл |
| 100X OL-Дополнение | 250 мкл |
| Бычьего инсулина (от 1 мг / мл складе) | 125 мкл |
| GlutaMAX | 250 мкл |
| Холо-трансферрина (с 33 мг / мл складе) | 37,5 мкл |
| Дополнение B27 | 500 мкл |
| FBS | 125 мкл |
| CNTF (от 50 нг / мкл акций) | 25 мкл |
Смешанные глиальных питательных сред (состоящая в DMEM)
| Ингредиент | Конечная концентрация |
| FBS | 10% |
| Pen / Strep (0,33% со склада) | 33 ед / мл пенициллина, 33 мкг / мл стрептомицина |
| GlutaMAX | 1% |
DRGN СМИ (составлен в DMEM)
| Ингредиент | Конечная концентрация |
| FBS | 10% |
| Pen / Strep (1% со склада) | 100 ед / мл пенициллина и 100 мкг / мл стрептомицина |
Рецепты Пищеварение Решение:
OPC папаин решение (составлен в MEM)
| Ингредиент | Конечная концентрация |
| Папаин решение | 1,54 мг / мл |
| L-цистеин | 360 мкг / мл |
| DNaseI | 60 мкг / мл |
DRG папаин решение (составлен в HBSS)
| Ингредиент | Конечная концентрация |
| Папаин | 1,54 мг / мл |
| L-цистеин | 360 мкг / мл |
DRG Коллагеназа решение (составлен в HBSS)
| Ингредиент | Конечная концентрация |
| Коллагеназа | 4 мг / мл |
Ссылки
- Avellana-Adalid, V. Expansion of rat oligodendrocyte progenitors into proliferative "oligospheres" that retain differentiation potential. J Neurosci Res. 45, 558-570 (1996).
- McCarthy, K. D., de Vellis, J. Preparation of separate astroglial and oligodendroglial cell cultures from rat cerebral tissue. J Cell Biol. 85, 890-902 (1980).
- Barres, B. A. Cell death and control of cell survival in the oligodendrocyte lineage. Cell. 70, 31-46 (1992).
- Chan, J. R. NGF controls axonal receptivity to myelination by Schwann cells or oligodendrocytes. Neuron. 43, 183-1891 (2004).
- Camara, J. Integrin-mediated axoglial interactions initiate myelination in the central nervous system. J Cell Biol. 185, 699-712 (2009).
- Ishibashi, T. Astrocytes promote myelination in response to electrical impulses. Neuron. 49, 823-832 (2006).
- Chen, Y. Isolation and culture of rat and mouse oligodendrocyte precursor cells. Nat Protoc. 2, 1044-1051 (2007).
- Pedraza, C. E. Production, characterization, and efficient transfection of highly pure oligodendrocyte precursor cultures from mouse embryonic neural progenitors. Glia. 56, 1339-1352 (2008).
- Lewin, G. R., Ritter, A. M., Mendell, L. M. On the role of nerve growth factor in the development of myelinated nociceptors. J Neurosci. 12, 1896-1905 (1992).
- Greene, L. A. Quantitative in vitro studies on the nerve growth factor (NGF) requirement of neurons. II. Sensory neurons. Dev Biol. 58, 106-113 (1977).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены