Method Article
Dérivation des cultures enrichies en oligodendrocytes et Oligodendrocyte / Neuron myélinisantes co-cultures de post-natal tissus murins
Dans cet article
Résumé
Cet article décrit les méthodes pour estimer la population enrichie des cellules précurseurs des oligodendrocytes murins (OPC) en culture primaire, qui se différencier pour produire des oligodendrocytes matures (MCO). En outre, ce rapport décrit des techniques pour produire murin myélinisantes co-cultures par semis OPC de la souris sur un lit de neurites de souris dorsale neurones ganglion de la racine (DRGNs).
Résumé
Identifier les mécanismes moléculaires qui sous-tendent le développement OL n'est pas seulement essentielle pour approfondir notre connaissance de la biologie OL, mais a également des implications pour la compréhension de la pathogenèse des maladies démyélinisantes comme la sclérose en plaques (SEP). Développement cellulaire est communément étudié avec primaires modèles de culture cellulaire. Culture de cellules primaires facilite l'évaluation d'un type cellulaire donné en fournissant un environnement contrôlé, sans les variables exogènes qui sont présentes in vivo. Bien que les cultures OL provenant de rats ont fourni une grande quantité de comprendre la biologie de LO, des efforts similaires à établir des cultures OL de souris a été rencontré d'obstacles majeurs. Développer des méthodes de culture murin LO primaire est impératif afin de profiter des lignes disponibles de souris transgéniques.
De multiples méthodes pour l'extraction des OPC à partir de tissus de rongeurs ont été décrites, allant de la dérivation Neurosphère, la purification de l'adhérence différentielle et immunopurification 1-3. Alors que de nombreuses méthodes offrent de succès, la plupart nécessitent des temps de culture extensive et / ou du matériel coûteux / réactifs. Pour contourner cela, purifiant les OPC à partir de tissus murins avec une adaptation de la méthode initialement décrite par McCarthy & de Vellis 2 est préféré. Cette méthode implique physiquement OPC séparant d'une culture mixte gliales provenant cortex des rongeurs nouveau-nés. Le résultat est une population purifiée OPC qui peuvent être différenciées en une culture de l'OL enrichi. Cette approche est attrayante en raison de ses temps de culture relativement courtes et l'exigence inutile pour les facteurs de croissance ou des anticorps immunopanning.
Tout en explorant les mécanismes du développement de LO dans une culture purifiée est informatif, il ne fournit pas l'environnement le plus physiologiquement pertinents pour évaluer la formation gaine de myéline. Co-culture avec des neurones LO donnerait un aperçu des fondements moléculaires régulant l'OL à médiation myélinisation des axones. Pour beaucoup de OL / neurone de co-culture des études, dorsale neurones ganglion de la racine (DRGNs) se sont révélés être le type de neurone de choix. Elles sont idéales pour la co-culture avec LO en raison de leur facilité d'extraction, le montant minimal de cellules contaminantes, et la formation de neurites lits denses. Alors que les études utilisant rat / souris myélinisantes xenocultures ont été publiés 4-6, une méthode pour la dérivation d'une telle OL / DRGN myélinisantes co-cultures de tissus post-natale murin n'a pas été décrite. Nous présentons ici des méthodes détaillées sur la façon de produire efficacement de telles cultures, avec des exemples de résultats escomptés. Ces méthodes sont utiles pour aborder les questions pertinentes pour le développement de LO / fonction myélinisantes, et sont des outils utiles dans le domaine des neurosciences.
Protocole
Déclaration d'éthique
Les souris utilisées dans ce travail ont été soignés selon le Conseil canadien de protection des animaux (CCPA). L'approbation éthique pour les expériences menées ont été obtenus de l'Université d'Ottawa Comité des soins des animaux sous le numéro du protocole OGH-119.
1. Dissection - le cortex de souris néonatales pour les OPC d'extraction
- Sacrifice P0-P2 souris selon les directives institutionnelles.
- Disséquer le cerveau et le placer dans une boîte de Petri contenant glacée MEM (sans antibiotique).
- Transférer le plat à un microscope à dissection.
- Avec un scalpel à la face dorsale du cerveau en place, faire une incision peu profonde le long du bord sagittalement plus interne de chaque cortex (figure 1a). Cette incision ne doit passer à travers la couche méningée, afin de faciliter son enlèvement.
- Utilisez une pince fines pointes à peler les méninges de façon latérale. S'il est effectué soigneusement, cette couche peut être enlevée en un seul morceau. Durant cette étape, retirer les bulbes olfactifs.
- Avec le cerveau ventrale côté-up, faire une incision profonde sagittale où le cortex répond la zone ventrale du diencéphale (Fig 1b).
- Avec la dorsale du cerveau secondaires, séparer le cortex du mésencéphale par indiscrets le tissu dans un médiale à la mode latéral (figure 1C, c '). Retirez tout méninges résiduel à cette étape.
- Dés chaque cortex en environ 4 morceaux et en douceur le transfert d'un tube de 15 ml conique contenant 350 pi de cerveau de souris par MEM. Maintenir le tube sur la glace jusqu'à ce que toutes les souris ont été traitées.
- Répétez les étapes 1.1 à 1.8 pour les souris restantes.
2. La dissociation du cortex néonatal et l'entretien des cultures mixtes de cellules gliales
Remarque: L'introduction de bulles dans la suspension cellulaire doit être évitée pendant toutes les étapes suivantes.
- Ajouter le tube 15 ml conique contenant le cerveau fraîchement disséqués à un bain à 37 ° C l'eau pendant 3 min.
- Transfert cerveaux pour une hotte de culture de tissus stériles.
- Doucement passent cortex dés par un embout de pipette P1000 à générer de plus petits fragments. Arrêtez de pipetage fois il n'ya pas de morceaux du cerveau suffisamment grande pour perturber la fluidité de la suspension à travers la pointe de la pipette.
- Ajouter 75 uL d'OPC papaïne solution par le cerveau dans le tube conique. La solution OPC papaïne doit être préchauffé à 37 ° C pendant 20 min avant utilisation.
- Incuber dans un bain d'eau à 37 ° C pendant 20 min. Environ toutes les 2 minutes, retourner doucement le tube pour empêcher l'agrégation des tissus. Pendant ce temps, ajoutez 5 ml de mélange des milieux de culture gliales à chaque poly-L-lysine (PLL) enduit (1 mg / ml) T25 flacon (un flacon par le cerveau de souris), et placer dans un 37 ° C de culture de tissu incubateur à 8,5% de CO 2.
- Après 20 min, retournez la suspension de tissu à la hotte stérile et ajouter 2 mL de mélange des milieux de culture gliales du cerveau par le tube. Laissez reposer pendant 10 min à température ambiante pour permettre l'inactivation de la solution de papaïne OPC.
- Aliquoter la suspension de tissu en 5 ml tubes en plastique. Le nombre de tubes doit correspondre au nombre de cerveaux disséqués, résultant en environ 2,5 ml par tube.
- En utilisant une solution stérile flamme polie pipette Pasteur en verre, délicatement triturer les tissus dans chaque tube. Triturer abord lentement et augmentez graduellement la vitesse comme des pièces dissocier. Triturer environ 10-15 fois, cependant, ce nombre peut varier en fonction de l'efficacité de la digestion.
Note: Sous-trituration va entraîner de mauvaises dissociation des tissus, tandis que plus-trituration aura un impact négatif sur la viabilité cellulaire. Il est important de ne pas introduire de bulles dans la solution, car cela va sérieusement l'impact de la viabilité cellulaire.
- Une fois il n'ya pas de touffes de tissu visibles restant dans la suspension, le transfert d'un tube conique de 50 ml contenant 4 ml de mélange des milieux de culture par gliales du cerveau (par exemple, quatre cerveaux = 16 ml mélangés milieux de culture gliales).
- Retourner doucement le tube conique de 50 ml et répéter pour les 5 autres tubes ml.
- Aliquoter la suspension de cellules regroupées dans 15 ml tubes coniques (environ 6,5 ml par tube de 15 ml). Le nombre de tubes de 15 ml doit correspondre au nombre de cerveaux disséqués.
- Centrifuger les tubes à 1200 rpm (~ 300 g) pendant 5 min.
- Soigneusement aspirer le surnageant et ajouter 1 ml d'eau tiède mélangée milieux de culture gliales dans chaque tube de 15 ml conique.
- Lentement Reprendre le culot avec une pointe de pipette P1000, en faisant attention à ne pas introduire de bulles. Ajouter la suspension de cellules de chaque tube à une pré-équilibrée PLL enduits T25 ballon, rendant le volume total du milieu de culture à 6 ml.
- Placer les flacons dans un incubateur de culture tissulaire pendant 3-4 heures pour permettre aux cellules d'attacher au substrat PLL. Effectuer un changement complet des médias par pipetage dans les médias, et en ajoutant 6 mL de milieu de culture frais mélangés gliales dans les flacons. Cette étape supprime une grande partie des débriscausés par la trituration, et favorise la viabilité de la culture. Si l'OL / DRGN co-cultures sont souhaitées, se reporter à la section 3 du présent protocole.
- Après 3 jours de culture, effectuer un changement de 2 / 3 des médias en supprimant 4 ml de médias, et les remplacer par 4 ml de milieu de culture frais mélangés gliales. À ce stade, une monocouche d'astrocytes devrait se former sur la base des flacons.
- Au jour 6, effectuez un autre support 2 / 3 du changement et de compléter les flacons avec une concentration finale de 5 pg / ml d'insuline. À ce stade, une monocouche d'astrocytes doit être clairement visible, sur le sommet de laquelle les OPC sera prolifèrent.
3. L'isolement DRGN
Remarque: Pour produire OL / DRGNs co-cultures, DRGNs devrait être établi le jour après génération culture mixte gliales. Les deux types de culture sont cultivés de manière indépendante, et combinées après 9-10 jours.
- Sacrifice P5-P10 souris selon les directives institutionnelles.
- Extrait de la colonne vertébrale, et le transfert à une boîte de Petri propre.
- Coupez le muscle et l'os bien de la colonne vertébrale que possible (figure 1D, d '), car cela facilitera la dissection des ganglions de la racine dorsale (DRG).
- Transfert de la colonne vertébrale parés à une nouvelle boîte de Petri ventrale côté-up. Avec des ciseaux de dissection et de départ caudalement, couper à travers la médiane de la colonne vertébrale de façon longitudinale.
- L'utilisation de deux paires de pinces, soulever doucement ouverte de la colonne vertébrale afin d'exposer la moelle épinière.
- DRG peut être trouvé en dessous et latérales de la moelle épinière. En utilisant des pinces fines pointes, retirer délicatement les DRG, tout en évitant d'endommager les ganglions (fig. 1e).
- Transférer la DRG enlevée pour solution glacée de Hank saline tamponnée (HBSS, sans antibiotique) dans un nouveau plat de Pétri. Le dissecteur devrait avoir pour objectif d'extraire 40 DRG par souris (figure 1f).
- Une fois que le DRG ont été extraits, taillez les racines de toute DRG excessivement longue (Fig. 1g, g ') pour minimiser l'introduction de cellules contaminantes dans la culture (cellules gliales, les fibroblastes).
- Transférer la DRG un tube à centrifuger de 1,5 ml contenant 500 ul de HBSS glacée.
- Centrifuger à 1200 rpm (~ 300 g) pendant 5 min à 4 ° C pour culotter les DRG.
- Transférer les tubes de centrifugeuse pour une hotte de culture de tissus stériles et retirer le HBSS des tubes.
- Ajouter 500 ul de pré-chauffé (20 min à 37 ° C) DRG papaïne solution, et incuber les tubes dans un bain d'eau à 37 ° C pendant 10 min. Inverser les tubes toutes les 2 min pour empêcher l'agrégation des tissus.
- Répétez l'étape 3.10.
- Retirer la solution la papaïne DRG et ajouter 500 ul de pré-chauffé (20 min à 37 ° C) Une solution collagénase. Incuber dans un bain d'eau à 37 ° C pendant 10 min, en inversant toutes les 2 min.
- Répétez l'étape 3.10.
- Enlever le surnageant et ajouter 1 mL de DRGN médias. Inverser le tube plusieurs fois.
- Répétez l'étape 3.10.
- Répétez l'étape 3.16.
- Manteau stérile flamme polie pipette Pasteur en verre avec l'albumine sérique bovine (BSA) par pipetage une solution de BSA à 0,25% dans HBSS plusieurs fois. Le revêtement avec une solution de BSA permettra d'éviter les DRG d'adhérer aux parois de la pipette en verre.
- Triturer les DRG avec la pipette BSA enduits d'abord doucement, et avec une intensité croissante fois des bouquets commencent dissocier. Triturer environ 10-15 fois, cependant ce nombre dépend du degré de digestion, et le nombre de DRG par tube.
- Une fois que la dissociation est atteint, passer la suspension à travers un filtre de 50 microns dans une boîte de Pétri stérile contenant 7 ml de DRGN médias. Filtration permettra d'éliminer une grande partie des débris de la suspension cellulaire, bien que cette étape n'est pas critique.
- Incuber les boîtes de Pétri à 8,5% de CO 2 d'environ 1,25 heures.
- Manteau de plusieurs lamelles de 12 mm avec LN2 (10 ug / ml dans le PBS) dans un plat de 24 puits pendant ce temps d'incubation.
- Une fois l'incubation est terminée, observez la boîte de Pétri sous champ lumineux. DRGNs sont identifiés comme grand corps, cellules en phase sombre. Swirl la boîte de Pétri doucement pour lever toute DRGNs respectées.
Note: Plusieurs cellules contaminantes aura fortement adhéré à la boîte de Pétri, enrichissant ainsi la suspension de votre cellulaire pour DRGNs.
- Transférer la suspension cellulaire dans un tube de 15 ml conique. Rincer délicatement le plat avec 4 ml de DRGN médias de recueillir toute DRGNs résiduelle. Transférer le supplément de 4 ml dans le tube conique.
- Centrifuger pendant 5 min à 1200 rpm (~ 300 g).
- Aspirer le surnageant et resuspendre le culot dans 500 uL de médias DRGN frais.
- Calculer le nombre de DRGNs donné en utilisant un hématimètre. Soyez sûr de ne compter que les DRGNs, et d'autres types de cellules non. DRGNs peuvent être identifiés par leurs grands corps cellulaires sphériques.
- Graine 30.000-50.000 DRGNs à chaque lamelle LN2 enduits dans 1 ml de DRGN médias, et placer dans un 37 ° C de culture de tissu incubateur à 8,5% de CO 2 pendant la nuit.
- Le lendemain matin, effectuer un changement complet des médias en remplaçant le DRGNdes médias avec les médias OL (moins CNTF) avec une concentration finale de 1% Pen / Strep et 10 FUDR uM.
- Aux jours 3 et 5, effectuer un changement de 3 / 4 des médias avec les médias comme à l'étape 3.30.
- Le Jour 7, effectuez un changement complet des médias avec les médias OL (moins CNTF, Pen / Strep, FUDR).
- Le jour de 9, le DRGNs devrait avoir formé un lit neurites étendue, et sont maintenant prêts à être co-cultivées avec des OPC.
4. Purification des OPC de cultures mixtes de cellules gliales pour la création d'OL-cultures enrichies ou OL / DRGN co-cultures
- Le jour 9 de la culture mixte gliales, le transfert des flacons d'un agitateur orbital dans un 5% de CO 2 de culture de tissu incubateur. Placer les flacons au-dessus du vide, des flacons T25 pour éviter toute chaleur générée par l'agitateur orbital de porter atteinte aux cultures mixtes gliales. Autoriser les cultures de s'équilibrer à ce nouvel incubateur pendant 1 heure.
- Une fois les flacons ont équilibré, secouer les flacons à 50 rpm pendant 45 min. Le but de cette secousse est d'enlever toutes les cellules faiblement adhérentes contaminant de la monocouche.
- Déplacer des cellules d'une hotte de culture de tissus et de supprimer tous les médias à partir des flacons. Remplacez-le par 4 ml de milieu de culture frais mélangés gliales complété avec 5 pg / mL d'insuline.
- Placer les flacons en arrière sur le vibreur, et permettre à s'équilibrer pendant environ 3 heures.
- Une fois les flacons sont équilibrées, les fixer solidement à l'agitateur orbital, et secouer les flacons pour environ 16 heures à 220 rpm (la nuit).
- Le lendemain matin, si MCO sont à être cultivées en l'absence de DRGNs (ie, l'OL enrichi la culture), le manteau de plusieurs lamelles stériles 12 mm avec LN2 (10 ug / ml dans PBS) pendant 1 heure. Transférer les lamelles de 24 puits, laver avec du PBS suivi par un lavage OL médias. Ajouter 1 mL de milieu de LO dans chaque puits et équilibrer à 8,5% de CO 2.
- Equilibrer boîtes de 10 cm de culture de tissu à 5% de CO 2 pendant 30 min. Un plat sera nécessaire pour tous les 2 flacons. Ils seront utilisés pour le différentiel d'adhérence d'enrichissement de l'OPC en suspension.
- Une fois la période de 30 minutes d'équilibration est passée, le transfert des médias à partir des flacons secoué pour la vaisselle. Chaque plat doit recevoir des supports de 2 flacons, égalant environ 8 ml de suspension cellulaire par 10 cm de plat.
- Incuber les boîtes à 5% de CO 2 pendant 30 min, tout en offrant un petit coup de pouce à la marque de 15 min. Ce coup de pouce permettra d'éviter les OPC d'adhérer à l'antenne de 10 cm.
- Une fois l'incubation est terminée, examinez les plats sous champ lumineux. Les OPC sont identifiés comme des bouquets de cellules petites, généralement de 3-5 cellules, mais parfois la forme de grands agrégats ressemblant neurosphères. De nombreuses cellules lignée non-OL devrait être fermement adhéré à la base de la plaque. Mélanger délicatement les plaques pour détacher les OPC vaguement collé, et le transfert de la suspension cellulaire de chaque plaque dans un tube de 15 ml conique.
- Centrifuger à 1200 rpm (~ 300 g) pendant 5 min.
- Reprendre le culot dans 1 ml de médias OL avec une pointe P1000 pipette, puis remise en suspension avec une pointe P200 pipette.
- Compter les cellules en utilisant un hématimètre.
- Pour enrichi-OL cultures, semences 25000 - 50000 OPC à chaque 12 mm revêtu de LN2 lamelle dans un volume final de 1 ml médias LO.
- Pour LO / DRGN co-cultures, effectuer un média complète OL (moins CNTF) changement sur le DRGNs de la section [3], et ajouter doucement 50.000 cellules de la suspension cellulaire enrichie OPC. Prenez soin de ne pas perturber le lit neurites DRGN lors de l'ajout d'OPC.
- Placez les cultures dans un incubateur à 37 ° C à 8,5% de CO 2, et éviter d'enlever jusqu'à la fixation. OPC murins sont sensibles aux changements de pH, et la suppression de l'incubateur va modifier le pH de la presse de LO. A noter également, l'ajout de dH 2 O pour les puits vides entourant les cultures cellulaires permettra d'éviter l'évaporation des milieux de culture, minimisant ainsi les fluctuations de la concentration de solutés dans les médias LO. Cela fournira un environnement plus cohérent pour l'OPC.
5. Traitement des cultures pour la microscopie d'immunofluorescence
- Fixer les cultures avec du méthanol 100% à -20 ° C pendant 10 min, ou le paraformaldéhyde 3% à température ambiante pendant 15 min.
- Perméabiliser lamelles avec 0,1% de Triton-X-100 pendant 10 min, laver avec du tampon phosphate de bloc salin (PBS) et pendant 1 heure dans du sérum de chèvre 10%.
- Incuber lamelles avec des anticorps primaire dilué dans une solution de blocage nuit à 4 ° C.
- Lavez lamelles 3 fois avec PBS, et incuber avec Alexa Fluor-anticorps secondaires conjugués (Invitrogen) dilué dans une solution de blocage pendant 45 min.
- Contre avec 4 ',6-diamidino-2-phénylindole (DAPI) et laver plusieurs fois avec des lamelles de PBS.
- Mont lamelles de DAKO fluorescentes milieu de montage.
- Analyser diapositives par microscopie d'immunofluorescence. Dans ce protocole, les diapositives ont été analysés soit avec un Zeiss Axiovert 200M inversé à fluorescencemicroscope ou un laser Zeiss LSM 510 META microscope confocal à balayage.
6. Whole extraction des protéines cellulaires de l'OL cultures enrichies
- Retirer de 24 puits des cultures de pépinière et laisser refroidir sur glace pendant 3 min.
- Retirez délicatement les médias, et d'ajouter de 10 à 20 uL de tampon de lyse (50 mM Tris-HCl, NaCl 150 mM, SDS 0,1%, désoxycholate de sodium à 0,5%, 1% de Triton-X-100, avec pepstatine 0,1%, l'aprotinine, PMSF, leupeptine, orthovanadate de sodium) dans chaque puits (Un minimum de 8 puits par échantillon est suggéré).
- Grattez les puits en utilisant un large trou P1000 pointe de la pipette et transférer le lysat dans un tube à centrifuger de 1,5 ml.
- Passer le lysat à travers un 30 ½ calibre seringue environ 15 fois, et laisser refroidir sur glace pendant 30 min.
- Centrifuger les tubes à 14000 rpm (~ 20 000 g) pendant 15 min à 4 ° C.
- Transférer le surnageant dans des tubes à centrifuger de nouvelles, et conserver à -80 ° C.
7. Analyse SDS-PAGE de protéines enrichi la culture-OL
- Résoudre 30 ug de protéine par échantillon dans la réduction de tampon par SDS-PAGE sur la norme de 12% de poly-acrylamide des gels.
- Les gels de transfert semi-sec sur des membranes de PVDF.
- Membranes bloc pendant 1 heure dans 5% poudre de lait écrémé dans TBST (10 mM Tris-HCl pH 8,0, NaCl 150 mM, 0,1% Tween-20).
- Incuber membranes avec des anticorps primaire dilué dans une solution de blocage pendant 1 heure.
- Laver 3 fois avec les membranes TBST pendant 10 min.
- Incuber les membranes avec HRP-anticorps secondaires conjugués pendant 45 min dans une solution de blocage.
- Laver les membranes à plusieurs reprises avec du TBST, et incuber avec Amersham ECL Plus réactif de détection ouest blot (GE Healthcare) pendant 5 min.
- Détecter bandes de protéines avec un film standard d'imagerie scientifique.
8. Les résultats représentatifs:
Dans ce protocole, les OPC sont étendus sur une monocouche d'astrocytes dans une culture mixte gliales. Cette culture mixte gliales est dérivé de P0-P2 du cortex de souris néonatales. Au jour 1 in vitro (DIV1), la culture mixte contient des cellules gliales avec des morphologies différentes comme on le voit par microscopie à contraste de phase (figure 2a). Au DIV3, une monocouche d'astrocytes commence à se former sur la base du flacon, et à DIV8, les OPC peuvent être clairement observées à la surface monocouche. Au DIV9, les OPC prolifèrent ont encore atteint une densité suffisante pour être purifiée par la nuit à haute vitesse d'agitation orbitale. Une fois le processus de purification a été achevée, le résultat est une population de cellules OPC-enrichi. Au DIV1 post purification, les OPC ont une morphologie simple, étendant quelques processus (figure 2b). Au DIV3 de purification de poste, les cellules ont étendu un maillage complexe de processus, rappelant LO immatures. Au DIV6 de purification de poste, l'OL purifiée ont aplati et projetés dépliant-comme des structures membranaires. Ce développement morphologique est typique de la maturation in vitro des LO.
Immunofluorescence indique les cellules purifiées sont de OL-lignage (figure 3a). Ensemencée OPC d'abord exprimer la chondroïtine sulfate protéoglycanes (NG2), et se développer en myéline associated glycoprotein (MAG) positif LO immatures dans les trois jours après le semis (figure 3B). Au DIV6, beaucoup LO exprimer la protéine de myéline de base (MBP), et possèdent la morphologie typique de maturité LO. Pour cent OL lignée cellules ont été quantifiées à des moments différents pour déterminer la pureté des cultures OL-enrichi (figure 3C). Au DIV1 de purification de poste, les cultures sont de 50 ± 14% NG2 OPC + ve, sans avons MAG + ou MBP + LO VE. Ceci indique l'OL purifiée lignée cellules sont dans le stade précurseur au moment des semis, avec un nombre négligeable de LO différenciées. Au DIV3, LO nombreuses se sont différenciées en cellules MAG + ve (24 ± 5,9%) alors que certains conservent le phénotype de précurseur, et restent NG2 + (13 ± 8,0%). Au DIV3, une petite proportion de cellules MAG + ve (3,2 1,2%) sont également exprimer MBP. Au DIV6, 20 ± 5,9% de LO sont MAG + ve, tandis que 12 ± 7,3% persistent comme NG2 + OPC ve. En outre, 21 ± 9,3% de cellules dans la culture sont MBP + LO avez à ce point du temps. Analyse SDS-PAGE montre l'expression graduée de 2'3'-cyclique nucléotide 3'-phosphodiestérase (CNP) et le MBP au cours de la période de culture 6 jours, démontrant la capacité des OPC en culture pour se différencier en terminale LO matures (figure 3D ). Collectivement, ces données établit cette méthode comme un moyen de produire un système de culture de l'OL enrichi adapté à l'étude de la maturation de l'OL OPC.
Ce protocole décrit également des méthodes pour établir OL / DRGN co-cultures utilisant des sources de tissu murin seule. Toutefois, afin de produire la co-culture, DRGNs doit d'abord être cultivées seules à produire un réseau neuritique adéquate. Ces cultures post-natal des neurones murins sont cultivés pendant 9 jours en basse milieux sans sérum avec 10 supplémentation FUDR uM pour empêcher la prolifération des fibroblastes contamine et GL cellules ial. Au cours des 9 jours in vitro, DRGNs isolés produisent un lit neurites dense (figure 4a). Ce lit est neurites immunopositives pour les neurofilaments neuronale marqueurs 200 (NF) et Tuj1 (figure 4b). À ce stade, les OPC purifié peut être ajouté à la neurite lits, et cultivées pendant 6 jours supplémentaires pour produire myélinisantes co-cultures.
Au DIV6 de l'OL / DRGN co-culture, de nombreux MBP + LO VE peut être observée chez les neurites NF DRGN + ve (Fig. 5a). Un examen plus approfondi, LO sont mises en évidence pour prendre contact avec de nombreux neurites DRGN, souvent engainantes avec un MBP + ve la membrane (figure 5b, c).
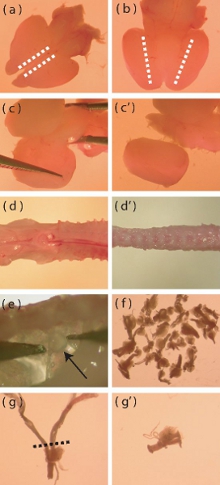
Figure 1. Images de microscopie Dissection des aspects particuliers de la souris néonatales cortex et l'isolement DRG. (A) Vue dorsale d'un cerveau de souris nouveau-né fraîchement extrait. Les lignes pointillées indiquent la zone où les incisions doivent être faites pour faciliter l'enlèvement de la couche méningée. (B) Vue ventrale du cerveau, les lignes pointillées indiquent l'endroit où le cortex répond le diencéphale ventral. Incisions profondes doivent être faites le long des pointillés pour faciliter l'isolement des corticales. (C-c ') représentation visuelle de la manière de fouiller le cortex écart du reste du cerveau. (D) Un fraîchement isolées P5-P10 colonne vertébrale de souris avant découpe loin muscle en excès et en os (d '). (e) Emplacement des DRG dans la colonne vertébrale. (f) Le nombre approximatif de DRG qui devraient être isolés les uns des souris. (g) Un DRG aux longues racines qui nécessitent coupe avant la digestion enzymatique. La ligne pointillée indique la région où les racines doivent être coupées. (G ') DRG après-racine rognage.
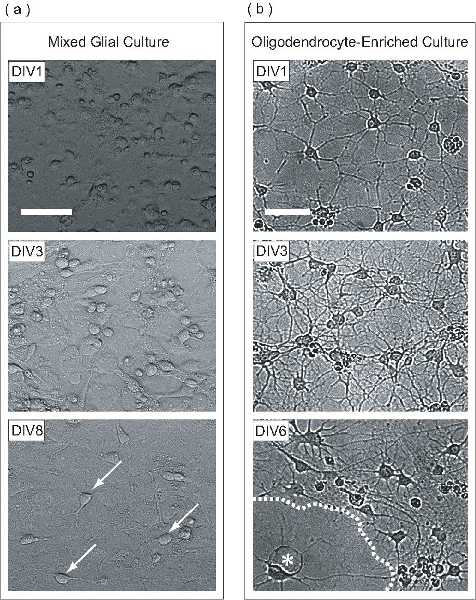
Figure 2. Les OPC sont développées au sein d'une culture mixte gliales, purifié, et par la suite comme une culture différenciée OL-enrichi. (A) des images à contraste de phase du mélange des cultures gliales à différents stades de développement. Au DIV1, les cellules apparaissent ronde avec quelques cellules aplaties. La stratification de la culture gliales mélangées commence à DIV3, où les astrocytes forment une monocouche uniforme à la base du flacon, sur laquelle les OPC prolifèrent. Beaucoup OPC sont vus à DIV8 (flèches) ont adhéré à la surface de la monocouche d'astrocytes. (B) Une fois purifiée à partir de la culture mixte gliales, DIV1 OPC ont étendu quelques procédés. Au DIV3, les cellules ont prolongé de nombreux processus, rappelant étape intermédiaire LO. Au DIV6, LO aplati (astérisque) semblent avoir produit des feuilles membraneuses (ligne pointillée). Barres d'échelle, 50 um.
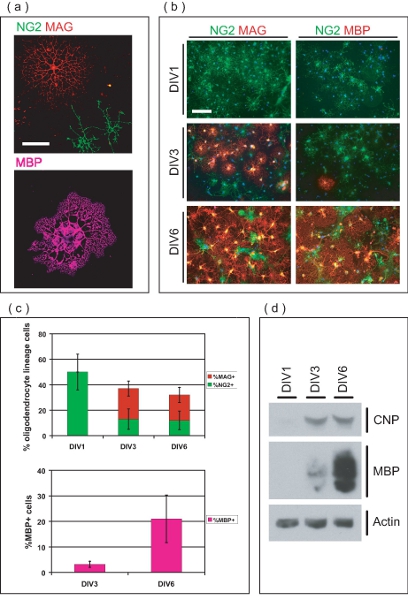
Figure 3. Caractérisation de l'OL enrichi la culture. (A) des images confocale de LO isolés à différents stades de développement. NG2 + OPC avons ont une morphologie simple, alors que les LO MAG + ve possèdent de multiples processus arborous. MBP + LO avons avons étendu membraneuse myéline comme des feuilles. La barre d'échelle, 50 um. (B) purifiée OL lignée cellules proviennent que OPC, et se différencient en MAG + ve LO MBP, + ve plus de 6 DIV. Au DIV1, tous les OPC sont NG2 + ve, alors qu'aucun MAG sont séro + ou MBP + ve. Au DIV3, MAG + LO VE et MBP quelques + ve sont maintenant évidents. La majorité des MCO sont MAG et le MBP + ve au DIV6, avec NG2 reste quelques + OPC ve. La barre d'échelle, 100 um. (C) Les valeurs moyennes ± écart type de l'OL pour cent lignée des cellules à différents stades de développement de plus de 6 DIV. Au DIV1, toutes les cellules LO-lignée sont NG2 + ve, représentant 50 ± 14% du nombre total de cellules dans la culture. Au DIV3 et DIV6, l'OL lignée cellules représentent respectivement 36 ± 6,8% et 32 ± 8,4% du nombre total de cellules, comprenant des proportions variables de NG2 + ve, MAG + ve et le MBP + LO VE. (D) de SDS-PAGE effectué sur les protéines dérivées de cultures enrichies OL-démontrant l'expression gradué de OL-marqueurs CNP et MBP sur la période 6 DIV culture.
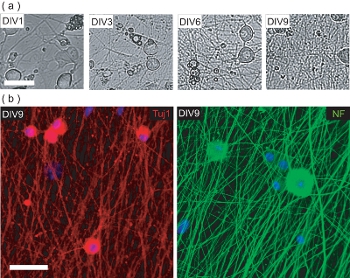
Figure 4. Caractérisation de la culture pré-OPC DRGN ensemencement. (A) La phase des images à contraste de DRGNs sur la période 9 DIV culture pré-Commissariat des semis. DRGNs proviennent que de grande taille des cellules avec quelques processus, et de produire un réseau neuritique plus en plus complexes. La barre d'échelle, 100 um. (B) les images confocale des cultures DRGN fixé à DIV9 (pré-semis OPC) et colorées pour des marqueurs spécifiques des neurones Tuj1 et NF200. DRGNs ont produit un réseau neuritique sur laquelle les OPC peuvent être ensemencés pour produire OL / DRGN myélinisantes co-cultures. La barre d'échelle, 50 um.
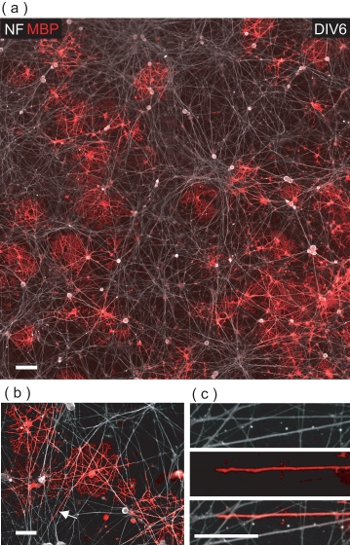
Figure 5. LO co-cultivées avec un résultat DRGNs dans OL-médiatisée d'emballage de neurites DRGN avec MBP + membrane ve. (A) Une image 4-champ confocale montage d'une DIV6 OL / DRGN co-culture. Beaucoup MBP + LO avez peut être vu en interaction avec le lit DRGN neurites sous-jacent. La barre d'échelle, 100 um. (B) Une vue agrandie confocale de MBP + LO avez emballage neurites DRGN multiples. La barre d'échelle, 50 um. (C) l'agrandissement numérique de la région notée en (b) où une neurite DRGN est enveloppée d'une membrane de LO. La barre d'échelle, 25 um.
Discussion
Ce rapport décrit une méthode pour isoler les OPC murin de différenciation dans les cultures OL-enrichi ou OL / DRGN co-cultures. Lorsqu'elle est cultivée seule, l'OPC se différencier en MBP + LO VE, produisant de la myéline comme des feuilles membraneuses. Lorsqu'il est ajouté à DRGN lits neurites, LO enveloppent les neurites DRGN avec MBP + membrane ve. Ce modèle profite à l'enquête sur les fondements complexes qui régissent l'OL à médiation ensheathment axonale.
Tout d'une grande valeur, l'établissement de ces cultures est techniquement difficile. En particulier, les aspects exigeants incluent la digestion des tissus efficace / dissociation, l'entretien de la culture médiatique au pH équilibré, et DRGN changements médias. Il est important de considérer que la durée de la digestion, la quantité de tissu étant digérée et le montant de la trituration affecte le résultat d'efficacité et à la fin de la dissociation des tissus. Il n'est pas inhabituel pour les chercheurs expérimentés d'obtenir de faibles rendements cellulaires des tissus du système nerveux dissociés. En outre, les OPC murins ont tendance à être sensibles aux changements dans le pH du milieu de culture, en particulier dans des conditions alcalines. L'entretien des cultures, à 8,5% de CO 2 vise à empêcher cela, puisque les OPC semblent mieux tolérer des conditions légèrement acides au cours de base. En ce qui concerne DRGNs alimentation, les changements de supports doivent être effectués rapidement pour ne pas dessécher les neurones, cependant, doit être doux pour ne pas perturber le lit de neurites en développement. Changements brusques des médias peuvent déloger le lit neurites du substrat, et le résultat probable dans sa dissociation complète de la lamelle.
Le mérite potentiel de ce système modèle éclipse fortement son caractère techniquement exigeante. Un avantage de ce système est l'utilisation de la post-natale des souris pour la dérivation de la culture cellulaire, en contournant la nécessité de sacrifier les femelles reproductrices de récolter des tissus embryonnaires. Un autre avantage est l'absence d'obligation pour les facteurs de croissance (GFS) pour l'expansion de l'OPC. Mixte cultures gliales fournir un environnement qui favorise la propagation des OPC, vraisemblablement en raison de la présence de facteurs trophiques astrocyte dérivées. D'autres méthodes, telles que la dérivation via neurosphères 7,8, reposent sur les propriétés mitogéniques de GFS tels que le facteur de croissance fibroblastique basique (bFGF), facteur de croissance épidermique (EGF) et le facteur de croissance dérivé des plaquettes (PDGF) pour l'expansion du CPVP. De même, en utilisant le développement postnatal (P5-10) pour les souris DRGNs évite l'obligation de compléter les milieux de culture avec un facteur de croissance nerveuse (NGF), un facteur neurotrophique requis pour le taux de survie in vitro des embryons DRGNs 9, 10. Il est intéressant d'éviter d'utiliser le NGF car elle influence négativement la capacité de myélinisation des LO lorsqu'elles sont cultivées avec des DRGNs 4. Éviter l'utilisation du GF-complété des médias a aussi des avantages économiques, comme ces réactifs devenir coûteux s'il est utilisé à grande échelle.
Peut-être l'avantage le plus important de ce modèle est sa culture de dérivation de la souris uniquement les tissus, offrant ainsi la possibilité de tirer à la fois les OPC et les DRGNs de la grande variété de lignées de souris transgéniques. Cela permet pour l'étude de deux DRGN et / ou OPC propriétés spécifiques qui régissent la myélinisation. Cela sera particulièrement important pour l'élucidation des interactions récepteur / ligand régulation OL-médiée myélinisation des axones. En tout, cette technique est d'une grande valeur en ce qui concerne la recherche en neurosciences en raison de ses applications vers la compréhension des signaux moléculaires qui sous-tendent la myélinisation.
Déclarations de divulgation
Aucun conflit d'intérêt déclaré.
Remerciements
Ce projet a été financé par une subvention de la Société canadienne de la sclérose d'RKRWO est récipiendaire d'une bourse d'études de la Société canadienne de la sclérose. DTS est un récipiendaire de bourses postdoctorales de la Multiple Sclerosis Society of Canada et les Instituts de recherche en santé.
matériels
| Name | Company | Catalog Number | Comments |
| Nom du produit | Société | Numéro de produit | |
| Eagle modifié par Dulbecco (DMEM) | Multicell | 319 à 005-CL | |
| Hank Balanced Salt Solution (HBSS) | Invitrogen | 14170-112 | |
| Minimum Essential Media (MEM) | GIBCO | 12360-038 | |
| Sérum fœtal bovin (FBS) | GIBCO | 10091-148 | |
| Pénicilline-streptomycine (Pen / Strep) | GIBCO | 15140-122 | |
| Glutamax | Invitrogen | 35050-061 | |
| Poly-L-lysine | Sigma-Aldrich | P2636 | |
| Albumine sérique bovine (BSA) | Sigma-Aldrich | A4503 | |
| Homme mérosine protéine purifiée (LN2) | Millipore | CC085 | |
| Recombinante du facteur neurotrophique rat ciliaire (CNTF) | PeproTech | 450-50 | |
| L-thyroxine | Biochemika | 89430 | |
| Holo-transferrine | Sigma-Aldrich | T0665 | |
| B27 complément | GIBCO | 0080085-SA | |
| L'insuline bovine | Sigma-Aldrich | I6634 | |
| 3,3 ',5-triiodo-L-thyronine | Sigma-Aldrich | I6634 | |
| La progestérone | Sigma-Aldrich | P8783 | |
| Putrescine | Sigma-Aldrich | P7505 | |
| Sélénite de sodium | Sigma-Aldrich | S5261 | |
| 5-fluoro-2'-désoxyuridine (FUDR) | Sigma-Aldrich | F0503 | |
| Solution de papaïne | Worthington | LS003126 | |
| DNaseI | ROCHE | 1010159001 | |
| L-cystéine | Sigma-Aldrich | C7352 | |
| 24 puits de culture tissulaire | Cellstar | 662-160 | |
| Flacons de culture de tissu T25 avec capuchon de l'évent | Corning | 430639 | |
| Boîtes de 10 cm de culture de tissu | Corning | 430167 | |
| 10 cm de Petri | Fisher Scientific | 0875713 | |
| Une collagénase | ROCHE | 103578 | |
| CellTrics 50 um (optionnel) de filtre | PARTEC | 04-004-2327 | |
| La myéline protéine basique (MBP) Anticorps | AbD Serotec | MCA409S | |
| NG2 d'anticorps | Millipore | AB5320 | |
| La myéline-associated glycoprotein (MAG) antibody | Millipore | MAB1567 | |
| 2 ', 3'-cyclique nucléotide 3'-phosphodiestérase (CNP) antibody | Covance | SMI-91R-100 | |
| L'actine pan Ab-5 anticorps | Fitzgerald | 10R-A106AX | |
| Neurofilament-200 (NF) antibody | Sigma-Aldrich | N4142 | |
| Bêta-tubuline trois chaînes (Tuj1) antibody | Millipore | MAB5544 | |
| Alexa Fluor 488 chèvre anti-lapin IgG (H + L) anticorps secondaire | Invitrogen | A11008 | |
| Alexa Fluor 555 chèvre anti-souris IgG (H + L) anticorps secondaire | Invitrogen | A21422 | |
| Alexa Fluor 647 chèvre anti-rat (IgG) (H + L) anticorps secondaire | Invitrogen | A21247 | |
| Chèvre anti-souris IgG (H + L)-HRP anticorps secondaire conjugué | BioRad | 170-6516 | |
| Chèvre anti-rat IgG (H + L)-HRP anticorps secondaire conjugué | Santa Cruz Biotechnology | SC-2065 | |
| 4 ',6-diamidino-2-phénylindole (DAPI) | Sigma-Aldrich | D9542 |
Recettes des médias
OL-100X * Supplément
| Ingrédient | Montant à ajouter |
| DMEM | 100 ml |
| BSA | 1,02 g |
| La progestérone | 0,6 mg |
| Putrescine | 161 mg |
| Sélénite de sodium | 0,05 mg |
| 3,3 ',5-triiodo-L-thyronine | 4 mg |
* Store à -80 ° C dans 250 aliquotes
t "> Médias OL| Ingrédient | Montant à ajouter |
| DMEM | 23,75 mL |
| OL-100X Supplément | 250 uL |
| L'insuline bovine (de 1 mg / mL de stock) | 125 ul |
| Glutamax | 250 uL |
| Holo-transferrine (de 33 mg / mL de stock) | 37,5 uL |
| B27 Supplément | 500 ul |
| FBS | 125 ul |
| CNTF (de 50 ng / uL stock) | 25 uL |
Mixte des milieux de culture gliales (composé de DMEM)
| Ingrédient | La concentration finale |
| FBS | 10% |
| Pen / Strep (0,33% du stock) | 33 unités / ml de pénicilline et 33 pg / ml de streptomycine |
| Glutamax | 1% |
DRGN médias (constitué de DMEM)
| Ingrédient | La concentration finale |
| FBS | 10% |
| Pen / Strep (1% du stock) | 100 unités / ml de pénicilline et 100 pg / ml de streptomycine |
Recettes solution de digestion:
OPC papaïne solution (composé de MEM)
| Ingrédient | La concentration finale |
| Solution de papaïne | 1,54 mg / mL |
| L-cystéine | 360 pg / ml |
| DNaseI | 60 pg / mL |
DRG papaïne solution (composé de HBSS)
| Ingrédient | La concentration finale |
| La papaïne | 1,54 mg / mL |
| L-cystéine | 360 pg / ml |
DRG collagénase Une solution (composé de HBSS)
| Ingrédient | La concentration finale |
| Une collagénase | 4 mg / ml |
Références
- Avellana-Adalid, V. Expansion of rat oligodendrocyte progenitors into proliferative "oligospheres" that retain differentiation potential. J Neurosci Res. 45, 558-570 (1996).
- McCarthy, K. D., de Vellis, J. Preparation of separate astroglial and oligodendroglial cell cultures from rat cerebral tissue. J Cell Biol. 85, 890-902 (1980).
- Barres, B. A. Cell death and control of cell survival in the oligodendrocyte lineage. Cell. 70, 31-46 (1992).
- Chan, J. R. NGF controls axonal receptivity to myelination by Schwann cells or oligodendrocytes. Neuron. 43, 183-1891 (2004).
- Camara, J. Integrin-mediated axoglial interactions initiate myelination in the central nervous system. J Cell Biol. 185, 699-712 (2009).
- Ishibashi, T. Astrocytes promote myelination in response to electrical impulses. Neuron. 49, 823-832 (2006).
- Chen, Y. Isolation and culture of rat and mouse oligodendrocyte precursor cells. Nat Protoc. 2, 1044-1051 (2007).
- Pedraza, C. E. Production, characterization, and efficient transfection of highly pure oligodendrocyte precursor cultures from mouse embryonic neural progenitors. Glia. 56, 1339-1352 (2008).
- Lewin, G. R., Ritter, A. M., Mendell, L. M. On the role of nerve growth factor in the development of myelinated nociceptors. J Neurosci. 12, 1896-1905 (1992).
- Greene, L. A. Quantitative in vitro studies on the nerve growth factor (NGF) requirement of neurons. II. Sensory neurons. Dev Biol. 58, 106-113 (1977).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon