Method Article
Derivação de Enriquecido Culturas oligodendroglial e Neuron / oligodendroglial Myelinating Co-culturas de tecidos pós-natais murino
Neste Artigo
Resumo
Este artigo descreve métodos para derivar populações enriquecidas de células precursoras de oligodendrócitos murino (OPCs) em cultura primária, que se diferenciam para produzir oligodendrócitos maduros (MQO). Além disso, este relatório descreve as técnicas para produzir murino myelinating co-culturas semeando OPCs do mouse sobre uma cama de neurite do mouse neurônios do gânglio da raiz dorsal (DRGNs).
Resumo
Identificar os mecanismos moleculares subjacentes ao desenvolvimento OL não é apenas fundamental para ampliar nosso conhecimento da biologia OL, mas também tem implicações para a compreensão da patogênese de doenças desmielinizantes, como esclerose múltipla (MS). Desenvolvimento celular é comumente estudada com modelos de cultura primária da célula. Cultura de células primárias facilita a avaliação de um tipo de célula dada por fornecer um ambiente controlado, livre das variáveis externas que estão presentes in vivo. Enquanto culturas OL derivados de ratos têm proporcionado uma grande quantidade de insights sobre a biologia OL, esforços semelhantes ao estabelecimento de culturas OL de camundongos, foi recebido com grandes obstáculos. Desenvolvimento de métodos para a cultura murino OLS primário é imperativa, a fim de aproveitar as linhas disponíveis camundongo transgênico.
Vários métodos para a extração de OPCs a partir de tecido de roedores têm sido descritos, variando de derivação neurosphere, purificação de adesão diferencial e immunopurification 1-3. Embora muitos métodos oferecer maior sucesso, requerem tempos de cultivo extensivo e / ou equipamentos de alto custo / reagentes. Para contornar isso, purificando OPCs do tecido murino com uma adaptação do método originalmente descrito por McCarthy & de Vellis 2 é o preferido. Este método envolve fisicamente OPCs separação de uma cultura mista glial derivado de córtices roedores neonatal. O resultado é uma população purificada OPC que podem ser diferenciados em uma cultura OL-enriquecido. Esta abordagem é atraente devido ao seu tempo relativamente curto a cultura ea exigência desnecessária para fatores de crescimento ou anticorpos immunopanning.
Enquanto explora os mecanismos de desenvolvimento OL em uma cultura purificada é informativo, não proporcionar o ambiente mais fisiologicamente relevantes para a avaliação de mielina formação da bainha. Co-cultura de MQO com os neurônios emprestaria visão sobre as bases moleculares que regulam OL-mediada mielinização dos axônios. Para muitos OL / neurônio co-cultura estudos, os neurônios do gânglio da raiz dorsal (DRGNs) provaram ser o tipo de neurônio de escolha. Eles são ideais para co-cultura com MQO, devido à sua facilidade de extração, quantidade mínima de células contaminantes, e formação de camas neurite denso. Enquanto estudos usando ratos / mouse myelinating xenocultures foram publicados 4-6, um método para a derivação de tais OL / DRGN myelinating co-culturas de pós-natal do tecido murino não tem sido descrita. Aqui apresentamos métodos detalhados sobre a forma de produzir tais culturas, juntamente com exemplos de resultados esperados. Estes métodos são úteis para tratar de questões relevantes para o desenvolvimento OL / função myelinating, e são ferramentas úteis no campo da neurociência.
Protocolo
Declaração de ética
Os ratos utilizados neste trabalho foram tratados de acordo com o Conselho Canadense on Animal Care (CCAC) orientações. Aprovação ética para experimentos realizados foi obtida a partir da Universidade de Ottawa Animal Care Comissão sob o protocolo número OGH-119.
1. Dissecção - córtex do rato neonatal para OPC extração
- Sacrifício P0-P2 rato acordo com as diretrizes institucionais.
- Dissecar o cérebro e coloque em um prato de Petri contendo gelada MEM (sem antibiótico).
- Transferir o prato a um microscópio de dissecação.
- Usando um bisturi com o lado dorsal do cérebro para cima, fazer uma incisão sagital rasas ao longo da borda mais medial de cada córtex (Fig. 1a). Esta incisão só deve passar através da camada meníngea, a fim de facilitar a sua remoção.
- Use uma pinça bem cotado para descolar as meninges de forma lateral. Se feito com cuidado, esta camada pode ser removido em uma única peça. Durante esta etapa, retire os bulbos olfativos.
- Com o cérebro ventral voltada para cima, faça uma incisão profunda sagital, onde o córtex atende a região ventral do diencéfalo (Fig 1b).
- Com o cérebro dorsal lateral-up, separe os córtices do mesencéfalo erguendo o tecido em um medial à moda lateral (Fig. 1c, c '). Remova qualquer meninges residual nesta etapa.
- Dice cada córtex em aproximadamente 4 pedaços e delicadamente transferência para um tubo cônico de 15 mL contendo 350 mL de MEM cérebro do rato por. Manter o tubo em gelo até que todos os ratos foram processadas.
- Repita os passos de 1,1-1,8 por ratos restantes.
2. Dissociação dos córtices neonatal e manutenção de culturas mistas glial
Nota: A introdução de bolhas na suspensão de células devem ser evitados durante todas as etapas seguintes.
- Adicione o tubo cônico contendo 15 mL dos cérebros recém-dissecado para um banho de água 37 ° C por 3 min.
- Transferência de cérebros para um capuz estéreis de cultura de tecidos.
- Suavemente passar córtices picado por uma ponteira P1000 para gerar fragmentos menores. Parar pipetagem uma vez que não há peças cérebro grande o suficiente para atrapalhar um bom fluxo de suspensão através da ponta da pipeta.
- Adicionar 75 mL de solução de papaína por OPC cérebro para dentro do tubo cônico. O OPC solução papaína deve ser pré-aquecido a 37 ° C por 20 min antes do uso.
- Incubar em banho-maria a 37 ° C por 20 min. Aproximadamente a cada 2 minutos, inverter o tubo para evitar a agregação do tecido. Durante este tempo, adicionar 5 mL de meio de cultura mista glial a cada poli-L-lisina (PLL) revestido (1 mg / mL) T25 frasco (um frasco por cérebro de rato), e coloque em um 37 ° C de cultura de tecidos na incubadora 8,5% CO 2.
- Após 20 min, o retorno a suspensão de tecido para a capa estéril e adicionar 2 mL de meio de cultura mista glial por cérebro para o tubo. Deixe descansar por 10 min em temperatura ambiente para permitir que a inativação da solução de papaína OPC.
- Suspensão da alíquota do tecido em 5 mL de tubos de plástico. O número de tubos devem corresponder ao número de cérebros dissecados, resultando em aproximadamente 2,5 mL por tubo.
- Usando um estéril chama-polida de vidro Pasteur pipeta, gentilmente triturar o tecido em cada tubo. Triturar lentamente no início, e gradualmente aumentar a velocidade como peças de dissociar. Triturar cerca de 10-15 vezes, no entanto este número pode variar de acordo com a eficácia da digestão.
Nota: De acordo com trituração, resultará em má dissociação do tecido, enquanto que mais de trituração, terá um impacto negativo na viabilidade celular. É importante não introduzir bolhas na solução, pois isso irá afetar seriamente a viabilidade celular.
- Uma vez que não existem pedaços de tecidos remanescentes visíveis na suspensão, a transferência para um tubo cônico de 50 mL contendo 4 mL de meio de cultura mista glial por cérebro (ou seja, 4 = 16 mL cérebros mista glial meios de cultura).
- Inverta delicadamente o tubo cônico de 50 mL e repetir para os restantes 5 tubos mL.
- Alíquota da suspensão de células agrupadas em 15 mL tubos cônicos (aproximadamente 6,5 mL por tubo de 15 mL). O número de tubos de 15 mL deve corresponder ao número de cérebros dissecados.
- Centrifugar os tubos a 1200 rpm (~ 300 g) por 5 min.
- Aspirar cuidadosamente o sobrenadante e adicionar 1 mL de meio de cultura morna misturado glial a cada tubo 15 mL cônico.
- Lentamente, ressuspender o sedimento com uma pipeta P1000, tomando cuidado para não introduzir bolhas. Adicione a suspensão celular de cada tubo para uma pré-equilibradas PLL revestido T25 frasco, tornando o volume total dos meios de cultura a 6 mL.
- Colocar o balão em uma incubadora de cultura de tecidos por 3-4 horas para permitir que as células para anexar ao substrato PLL. Realizar uma mudança completa de mídia por pipetagem a mídia, ea adição de 6 mL de meio de cultura fresco misturado glial para os frascos. Essa etapa remove muitos dos fragmentoscausada pela trituração, e promove a viabilidade da cultura. Se OL / DRGN co-culturas são desejadas, consulte a Seção 3 do presente protocolo.
- Após 3 dias de cultura, realizar uma alteração de 2 / 3 de mídia através da remoção de 4 mL de mídia, e substituindo com 4 mL de meio de cultura fresco misturado glial. Neste ponto, uma monocamada astrócitos devem estar se formando sobre a base dos frascos.
- No dia 6, realizar outra mídia 03/02 mudança e complementar os frascos com uma concentração final de 5 de insulina mcg / mL. Neste ponto, uma monocamada astrócitos devem ser claramente visível, no topo do qual OPCs será proliferando.
3. Isolamento DRGN
Nota: Para produzir OL / DRGNs co-culturas, DRGNs deve ser estabelecido o dia após geração cultura mista glial. Ambos os tipos de cultura são cultivadas de forma independente, e combinado após 90-10 dias.
- Sacrifício P5-P10 rato acordo com as diretrizes institucionais.
- Extrato da coluna vertebral, e transferir para um prato de Petri limpa.
- Apare tanto músculo e osso da espinha possível (Fig. 1d, d '), pois isso irá facilitar a dissecção dos gânglios da raiz dorsal (DRGs).
- Transferência da espinha cortado para uma placa de Petri nova ventral lateral-up. Com uma tesoura de dissecção e começando caudalmente, corte medial através da coluna vertebral de forma longitudinal.
- Usando dois pares de fórceps, gentilmente forçar a abertura da coluna vertebral para expor a medula espinhal.
- DRGs pode ser encontrada abaixo e lateral para a medula espinhal. Usando uma pinça fina com ponta, remova cuidadosamente a DRGs, evitando danos para os gânglios (Fig. 1e).
- Transferir os DRGs removido para solução gelada de Hank sal tamponado (HBSS, sem antibiótico) em uma placa de Petri novo. O dissector devem procurar extrair 40 DRGs por mouse (Fig. 1f).
- Uma vez que o DRGs foram extraídos, aparar as DRGs de qualquer raízes excessivamente longo (Fig. 1g, g ') para minimizar a introdução de células contaminantes na cultura (células gliais, fibroblastos).
- Transferir os DRGs a um tubo de centrífuga de 1,5 mL contendo 500 mL de HBSS gelado.
- Centrifugar a 1200 rpm (~ 300 g) por 5 min a 4 ° C para agregar as DRGs.
- Transferir os tubos de centrífuga de um capuz estéreis de cultura de tecidos e remover o HBSS dos tubos.
- Adicionar 500 mL de pré-aquecido (20 min a 37 ° C) DRG solução papaína, e incubar os tubos em banho-maria a 37 ° C por 10 min. Inverter os tubos cada 2 min para evitar a agregação do tecido.
- Repita o passo 3.10.
- Remover a solução papaína DRG e adicionar 500 mL de pré-aquecido (20 min a 37 ° C) Uma solução de colagenase. Incubar em banho-maria a 37 ° C por 10 min, invertendo a cada min 2.
- Repita o passo 3.10.
- Remover o sobrenadante e adicionar 1 mL de DRGN mídia. Inverter várias vezes tubo.
- Repita o passo 3.10.
- Repita o passo 3.16.
- Um casaco estéril chama-polido vidro Pasteur pipeta com albumina de soro bovino (BSA), pipetando uma solução de BSA 0,25% em HBSS várias vezes. O revestimento com solução BSA impedirá a DRGs de aderir às paredes da pipeta de vidro.
- Triturar os DRGs com a pipeta BSA revestido suavemente no início, e com intensidade crescente, uma vez clumps começar a dissociar. Triturar cerca de 10-15 vezes, no entanto este número é dependente do grau de digestão, eo número de DRGs por tubo.
- Uma vez que a dissociação é alcançado, passar a suspensão através de um filtro de 50 mm em uma placa de Petri estéreis, contendo 7 mL de DRGN mídia. Filtração vai eliminar grande parte dos detritos da suspensão de células, embora este passo não é crítica.
- Incubar a placa de Petri de 8,5% de CO 2 para cerca de 1,25 horas.
- Brasão várias lamelas 12 mm com LN2 (10 mcg / mL em PBS) em um prato de 24 bem durante este tempo de incubação.
- Uma vez que a incubação terminar, observe a placa de Petri em campo brilhante. DRGNs são identificados como grandes bodied, fase de celas escuras. Agitar o prato Petri delicadamente para levantar qualquer DRGNs aderido.
Nota: Muitas células contaminando terá fortemente aderidas à placa de Petri, enriquecendo a sua suspensão de células para DRGNs.
- Transferir a suspensão de célula para um tubo cônico de 15 mL. Lave o prato com 4 mL de DRGN mídia para recolher qualquer DRGNs residual. Transferir a 4 mL adicional para o tubo cônico.
- Centrifugar por 5 min a 1200 rpm (~ 300 g).
- Aspirar o sobrenadante e ressuspender o sedimento em 500 mL de mídia DRGN fresco.
- Calcule o número de DRGNs rendeu utilizando um hemocitômetro. Certifique-se de apenas contar o DRGNs, e outros tipos de células não. DRGNs podem ser identificadas por seus grandes corpos celulares esférica.
- Semente 30.000-50.000 DRGNs a cada lamela LN2 revestido em 1 mL de DRGN mídia, e colocar em um 37 ° C de cultura de tecidos incubadora a 8,5% de CO 2 durante a noite.
- Na manhã seguinte, faça uma mudança completa de mídia, substituindo o dragãomeios de comunicação com a mídia OL (menos CNTF) com uma concentração final de 1% Pen / Strep e 10 FuDR mM.
- Nos dias 3 e 5, executar um 04/03 mudança de mídia com a mesma mídia como na Etapa 3,30.
- No dia 7, executar uma mudança completa de mídia com a mídia OL (menos CNTF, Pen / Strep, FuDR).
- No dia 9, o DRGNs deveria ter formado uma cama neurite extensa, e está agora pronto para ser co-cultivados com OPCs.
4. Purificação de OPCs de culturas mistas glial para o estabelecimento de OL enriquecido culturas ou OL / DRGN co-culturas
- No dia 9 de cultura mista glial, a transferência dos frascos a um agitador orbital em um 5% CO 2 de cultura de tecidos incubadora. Colocar o balão em cima do vazio T25 frascos para evitar que o calor gerado a partir do agitador orbital prejudiquem as culturas mista glial. Permitir que as culturas para equilibrar a esta nova incubadora por 1 hora.
- Uma vez que os frascos têm equilibrada, agite o frasco a 50 rpm por 45 min. O objetivo deste agitar é remover todas as células frouxamente aderente contaminação da monocamada.
- Mover células para uma capa de cultura de tecidos e remover todos os meios de comunicação dos frascos. Substituir com 4 mL de meio de cultura fresco misturado glial suplementado com 5 mg / mL de insulina.
- Colocar o balão de volta para o shaker, e deixar estabilizar durante cerca de três horas.
- Uma vez que os frascos são equilibradas, fixá-las de forma segura para o agitador orbital, e agitar os frascos por cerca de 16 horas a 220 rpm (overnight).
- Na manhã seguinte, se MQO devem ser cultivadas na ausência de DRGNs (ie, OL enriquecido cultura), casaco várias estéril lamínulas 12 mm com LN2 (10 mcg / mL em PBS) por 1 hora. Transferir as lamelas de 24 poços pratos, lavar com PBS seguido por uma lavagem de mídia OL. Adicionar 1 mL de mídia OL a cada poço e se equilibram em 8,5% CO 2.
- Equilibrar 10 centímetros placas de cultura de tecidos em 5% CO 2 por 30 min. Um prato será necessário para cada 2 frascos. Estes serão usados para o enriquecimento de adesão diferencial do OPCs suspenso.
- Uma vez que o período de 30 min de equilíbrio passou, transferir a mídia dos frascos agitados para os pratos. Cada prato deve receber media de 2 frascos, equivalente a aproximadamente 8 mL de suspensão celular por 10 prato cm.
- Incubar os pratos em 5% CO 2 por 30 min, ao fornecer um pequeno empurrão na marca de 15 min. Este nudge irá ajudar a evitar OPCs de aderir ao prato de 10 cm.
- Uma vez que a incubação é completa, examine os pratos em campo brilhante. OPCs são identificadas como aglomerados de células pequenas, tipicamente de 3-5 células, mas às vezes formam grandes agregados lembrando neurospheres. Muitas células não-OL linhagem deve ser firmemente aderido à base do prato. Agite suavemente as placas para separar qualquer OPCs frouxamente aderidas, e transferir a suspensão de células de cada placa em um tubo cônico de 15 mL.
- Centrifugar a 1200 rpm (~ 300 g) por 5 min.
- Ressuspender o sedimento em 1 mL de mídia OL com uma ponteira P1000, seguido por ressuspensão com uma ponteira P200.
- Contar as células usando um hemocitômetro.
- Para enriquecer-OL culturas, sementes 25.000 - 50.000 OPCs a cada 12 milímetros lamela LN2 revestido em um volume final de 1 mL de mídia OL.
- Para OL / DRGN co-culturas, realizar uma mídia completa OL (menos CNTF) mudança no DRGNs da seção [3], e delicadamente adicione 50.000 células da suspensão de células OPC-enriquecido. Tome cuidado para não perturbar a cama neurite DRGN durante a adição de OPCs.
- Coloque as culturas em uma incubadora de 37 ° C em 8,5% de CO 2, e evitar a remoção até a fixação. OPCs murinos são sensíveis às mudanças no pH, e remoção da incubadora irá alterar o pH dos meios de comunicação OL. Também digno de nota, a adição de dH 2 O aos poços vazios em torno da cultura de células irá evitar a evaporação do meio de cultura, minimizando assim as flutuações no solutos concentrações na mídia OL. Isto proporcionará um ambiente mais consistente para o OPCs.
5. Processamento de culturas para a microscopia de imunofluorescência
- Fix culturas com metanol 100% a -20 ° C por 10 min, ou paraformaldeído a 3% em temperatura ambiente por 15 min.
- Permeabilizar lamínulas com 0,1% Triton-X-100 por 10 min, lave com bloco de tampão fosfato (PBS) e por uma hora no soro de cabra 10%.
- Lamínulas incube com anticorpos primários diluídos em solução de bloqueio durante a noite a 4 ° C.
- Lavar lamínulas 3 vezes com PBS e incubar com anticorpos conjugados Alexa-fluor secundário (Invitrogen) diluída em solução de bloqueio por 45 min.
- Contracoloração com 4 ',6-diamidino-2-phenylindole (DAPI) e lave várias vezes com lamínulas PBS.
- Monte lamínulas em DAKO fluorescentes meio de montagem.
- Analisar slides através de microscopia de imunofluorescência. Neste protocolo, as lâminas foram analisadas com qualquer um Axiovert Zeiss de fluorescência 200M invertidamicroscópio ou um Zeiss LSM 510 META laser de varredura do microscópio confocal.
6. Extração de proteínas de células íntegras de OL enriquecido culturas
- Remover 24 bem culturas de incubadora e fresco no gelo por 3 min.
- Remova cuidadosamente mídia, e adicione 10-20 mL de tampão de lise (50 mM Tris-HCl, 150 mM NaCl, 0,1% SDS, desoxicolato de sódio 0,5%, 1% Triton-X-100, com pepstatin 0,1%, a aprotinina, PMSF, leupeptin, ortovanadato de sódio) para cada poço (Um mínimo de oito poços por amostra é sugerido).
- Raspe poços usando um grande furo ponteira P1000, e transferir o lisado a um tubo de centrífuga de 1,5 mL.
- Passe o lisado através de uma seringa de 30 ½ calibre cerca de 15 vezes, e frio no gelo por 30 min.
- Centrifugar a 14.000 rpm tubos (~ 20.000 g) por 15 min a 4 ° C.
- Transfira o sobrenadante para novos tubos de centrífuga, e armazenar a -80 ° C.
7. SDS-PAGE análise sobre enriqueceu-OL proteína cultura
- Resolve 30 mg de proteína por amostra na redução de buffer por SDS-PAGE no padrão de 12% de acrilamida-poly géis.
- Semi-seco géis transferência para membranas PVDF.
- Membranas de bloco para uma hora em 5% leite em pó desnatado em TBST (10 mM Tris-HCl pH 8,0, 150 mM NaCl, 0,1% Tween-20).
- Incubar membranas com anticorpos primários diluídos em solução de bloqueio por 1 hora.
- Lavar 3 vezes com membranas TBST por 10 min.
- Incubar a membrana com HRP-conjugado anticorpos secundários por 45 min em solução de bloqueio.
- Lavar várias vezes com membranas TBST, e incubar com Amersham ECL Plus reagente de detecção western blotting (GE Healthcare) por 5 min.
- Detectar bandas de proteínas com filme de imagem padrão científico.
8. Resultados representativos:
Neste protocolo, OPCs são expandidas em uma monocamada astrócitos dentro de uma cultura mista glial. Esta cultura mista glial é derivado de P0-P2 córtex do rato neonatal. No dia 1 in vitro (div1), a cultura mista glial contém células com morfologias diferentes como pode ser visto por microscopia de contraste de fase (Fig. 2a). No Div3, uma monocamada astrócitos começa a se formar na base do frasco, e ao DIV8, OPCs podem ser claramente observados na superfície monocamada. No DIV9, o OPCs proliferando atingiram densidade suficiente para ser purificada pela agitação em alta velocidade durante a noite orbital. Uma vez que o processo de purificação foi concluída, o resultado é uma população de células OPC-enriquecido. No div1 pós-purificação, OPCs têm morfologia simples, estendendo-se alguns processos (Fig. 2b). No Div3 purificação post, as células têm estendido uma malha complexa de processos, uma reminiscência de OLS imaturo. No DIV6 purificação post, o OLS purificada têm achatada e projetada folheto-como estruturas de membrana. Este desenvolvimento morfológico é típico da maturação in vitro de OLS.
Microscopia de imunofluorescência indica as células purificadas são de OL-linhagem (Fig. 3). Semeado OPCs inicialmente expressam sulfato de condroitina proteoglicanos (NG2), e se desenvolvem em mielina associados glicoproteína (MAG) positivo OLS imaturos dentro de três dias após a semeadura (Fig. 3b). No DIV6, muitos OLS expressam a proteína básica de mielina (MBP), e possuem a morfologia típica madura OL. Por cento OL-linhagem de células foram quantificadas em momentos diferentes para determinar a pureza das culturas OL-enriquecido (Fig. 3c). No div1 purificação post, as culturas são 50 ± 14% NG2 OPCs ve +, sem ve + MAG ou MBP + OLS ve. Isso indica que o OL-purificada linhagem de células estão em fase de precursor na época de semeadura, com números insignificantes de OLS diferenciadas. No Div3, OLS muitos diferenciados em células MAG + ve (24 ± 5,9%), enquanto alguns mantêm o fenótipo precursor, e permanecem NG2 + (13 ± 8,0%). No Div3, uma pequena proporção de células MAG + ve (3,2% 1.2) são também expressando MBP. No DIV6, 20 ± 5,9% do OLS são MAG + ve enquanto 12 ± 7,3% persistem como NG2 + OPCs ve. Além disso, 21 ± 9,3% de células dentro da cultura são MBP + OLS ve neste momento do tempo. SDS-PAGE análise mostra a expressão classificados de 2'3'-cíclica de nucleotídeo 3'-fosfodiesterase (CNP) e PAM durante o período de seis dias de cultura, demonstrando a capacidade de OPCs em cultura para se diferenciar em terminais OLS maduros (Fig. 3d ). Coletivamente, estes dados estabelece este método como um meio de produzir um sistema de cultura OL enriquecido adequado para o estudo da maturação de OPCs OL.
Este protocolo também descreve métodos para estabelecer OL / DRGN co-culturas que utilizam fontes de murino apenas o tecido. No entanto, a fim de produzir a co-cultura, DRGNs primeiro deve ser cultivado sozinho para produzir uma rede de neurite adequada. Estes pós-natal culturas de neurônios de camundongos são cultivadas por 9 dias em baixa media de soro com 10 mM FuDR suplementação para evitar a proliferação de fibroblastos e contaminando gl células ial. Ao longo de nove dias in vitro, DRGNs isolados produzem uma cama de neurite densa (Fig. 4). Esta cama é neurite imunopositivas para o neurofilamento marcadores neuronais 200 (NF) e Tuj1 (Fig. 4b). Neste ponto, OPCs purificada pode ser adicionado à cama neurite, e cultivadas por um período adicional de seis dias para produzir myelinating co-culturas.
No DIV6 de OL / DRGN co-cultura, MBP muitos + ve OLS pode ser observado entre as neurites NF + ve DRGN (Fig. 5). Após um exame mais detalhado, OLS são evidenciados para fazer contato com neurites DRGN numerosos, muitas vezes ensheathing-los com um MBP + ve membrana (Fig. 5b, c).
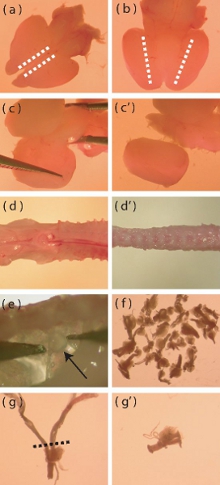
Figura 1. Dissecção imagens de microscópio de aspectos específicos do córtex do rato neonatal e isolamento DRG. (A) Vista dorsal de um cérebro de camundongo recém-extraídos neonatal. As linhas pontilhadas indicam a área onde as incisões devem ser feitas para facilitar a remoção da camada meníngea. (B) vista ventral do cérebro, linhas pontilhadas indicam a área onde o córtex encontra o diencéfalo ventral. Incisões profundas devem ser feitas ao longo das linhas pontilhadas para ajudar no isolamento do córtex. (C-c ') representação visual de como erguer o córtex longe do restante do cérebro. (D) Um recém-isoladas P5-P10 espinha do rato antes de aparar afastado muscular em excesso e osso (d '). (e) Localização de DRGs dentro da coluna vertebral. (f) O número aproximado de DRGs que deve ser isolado de um mouse. (g) A DRG com raízes longas que exigem corte antes da digestão enzimática. A linha pontilhada indica a região onde as raízes devem ser aparadas. (G ') DRG pós-raiz de corte.
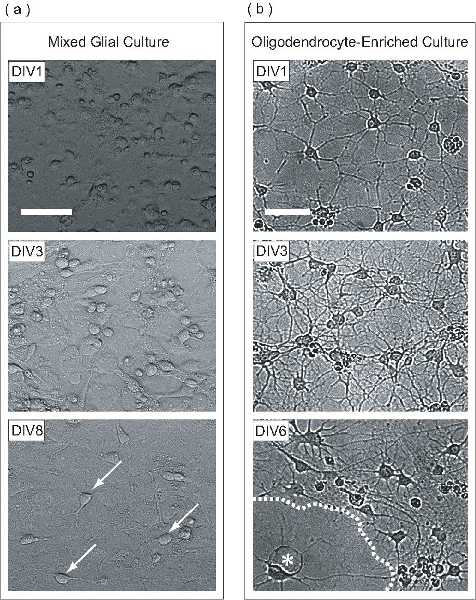
Figura 2. OPCs são expandidas dentro de uma cultura mista glial, purificada e, posteriormente, como uma cultura diferenciada OL-enriquecido. (A) Fase imagens de contraste de culturas mista glial em diferentes estágios de desenvolvimento. No div1, as células aparecem rodada com poucas células achatadas. Estratificação da cultura mista glial começa em Div3, onde astrócitos formam uma monocamada uniforme na base do frasco, sobre a qual OPCs proliferar. OPCs muitos são vistos em DIV8 (setas) aderidos à superfície da monocamada de astrócitos. (B) Uma vez purificada a partir da cultura mista glial, div1 OPCs ter estendido apenas alguns processos. No Div3, as células têm estendido muitos processos, uma reminiscência de estágio intermediário OLS. No DIV6, OLS achatada (asterisco) parecem ter produzido folhas membranosas (linha pontilhada). Barras de escala, 50 mm.
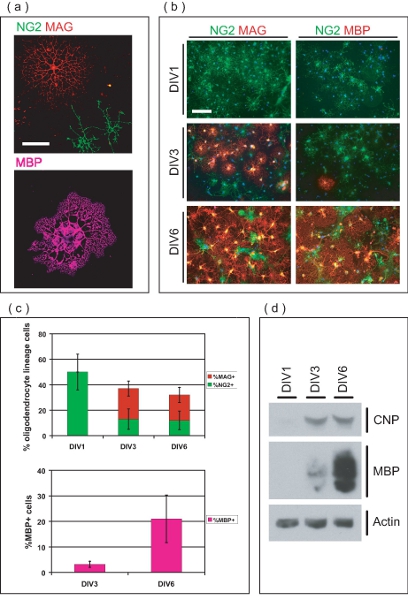
Figura 3. Caracterização de OL enriquecido cultura. (A) imagens Confocal de OLS isoladas em diferentes estágios de desenvolvimento. NG2 + OPCs ve ter morfologia simples, enquanto OLS + ve MAG possuem vários processos arborizada. MBP + OLS ve ter estendido membranosa mielina como folhas. Barra de escala, 50 mm. (B) OL-purificada linhagem de células originam como OPCs e diferenciar em MAG + ve, MBP OLS + ve mais de 6 DIV. No div1, todos são OPCs NG2 + ve, enquanto nenhum é MAG ve + ou MBP + ve. No Div3, MAG + ve e MBP poucos OLS + ve são agora evidentes. A maioria dos MQO são MAG e MBP ve + na DIV6, com poucos remanescentes NG2 + OPCs ve. Barra de escala, 100 mm. (C) Os valores médios ± DP do percentual OL-linhagem de células em diferentes estágios de desenvolvimento mais de 6 DIV. No div1, todas as células OL-linhagem são NG2 + ve de contabilidade, por 50 ± 14% do total de células na cultura. No Div3 e DIV6, OL-linhagem de células, respectivamente responsáveis por 36 ± 6,8% e 32 ± 8,4% do total de células, que consiste em proporções variáveis de NG2 + ve, MAG + ve e MBP + OLS ve. (D) SDS-PAGE realizadas em proteínas derivadas de enriquecimento OL-culturas demonstrando a expressão classificados de OL-marcadores CNP e MBP durante o período de 6 a cultura DIV.
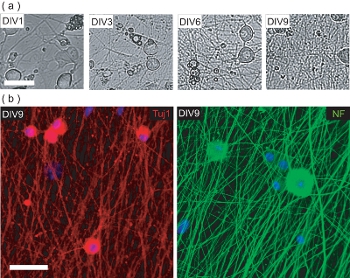
Figura 4. Caracterização da semeadura da cultura DRGN pré-OPC. (A) Fase imagens de contraste de DRGNs durante o período de 9 a cultura DIV pré-OPC semeadura. DRGNs originam como de grande porte células com poucos processos, e produzir uma rede de neurite cada vez mais complexas. Barra de escala, 100 mm. (B) imagens Confocal de culturas DRGN fixado em DIV9 (pré-semeadura OPC) e coradas para neurônio-específica e marcadores Tuj1 NF200. DRGNs produziram uma rede de neuritos em que OPCs podem ser semeados para produzir OL / DRGN myelinating co-culturas. Barra de escala, 50 mm.
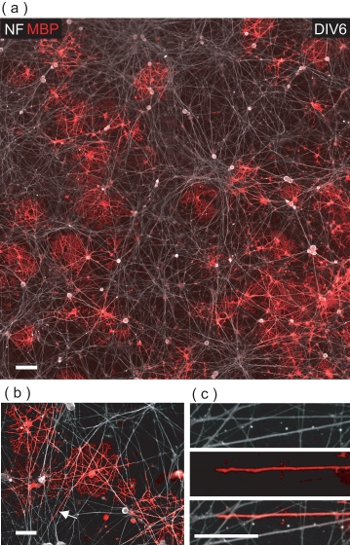
Figura 5. OLS co-cultivados com DRGNs resultar em OL-mediada ao acondicionamento de neurites DRGN com MBP + membrana ve. (A) Uma imagem de campo de 4-confocal montagem de um DIV6 OL / DRGN co-cultura. MBP muitos + ve MQO podem ser vistos interagindo com a cama subjacente neurite DRGN. Barra de escala, 100 mm. (B) Uma visão ampliada confocal de MBP + OLS ve embrulho DRGN neurites múltiplas. Barra de escala, 50 mm. (C) ampliação Digital da região denotada em (b) onde uma neurite DRGN está sendo enrolado com membrana OL. Barra de escala, 25 mm.
Discussão
Este relatório descreve um método para isolar OPCs murino para a diferenciação em culturas OL-enriquecido ou OL / DRGN co-culturas. Quando cultivadas por si só, o OPCs diferenciar em MBP + ve OLS, produzindo mielina como folhas membranosas. Quando adicionado ao DRGN camas neurite, OLS envolver o neurites DRGN com MBP + membrana ve. Este modelo beneficia a investigação dos fundamentos complexos que regem OL-mediada ensheathment axonal.
Embora de grande valor, o estabelecimento de tais culturas é um desafio técnico. Em particular, os aspectos exigentes incluem a digestão do tecido eficiente / dissociação, manutenção de pH equilibrado meios de cultura, e as mudanças DRGN mídia. É importante considerar que o comprimento da digestão, a quantidade de tecido a ser digerida e da quantidade de trituração afeta o resultado final da eficácia e da dissociação do tecido. Não é incomum para investigadores experientes para obter baixos rendimentos a partir de celulares dissociados tecidos do sistema nervoso. Além disso, OPCs murino tendem a ser sensíveis às mudanças no pH do meio de cultura, especialmente sob condições alcalinas. A manutenção de culturas em 8,5% CO 2 visa evitar isso, desde OPCs parecem tolerar melhor as condições mais básicas ligeiramente ácido. Com relação ao DRGNs alimentação, alterações de mídia deve ser realizada rapidamente para não desidratar os neurônios, no entanto, deve ser suave para não perturbar a cama neurite em desenvolvimento. Mudanças bruscas de mídia pode desalojar a cama neurite do substrato, e que resultam em sua dissociação completa da lamela.
O mérito potencial deste sistema modelo muito ofusca sua natureza tecnicamente exigente. Uma vantagem deste sistema é a utilização de ratos pós-natal para derivação de cultura de células, evitando a necessidade de sacrifício fêmeas reprodutoras para a colheita de tecido embrionário. Outra vantagem é a falta de exigência de fatores de crescimento (GFs) para a expansão da OPCs. Mistas culturas gliais proporcionar um ambiente que suporta a propagação de OPCs, provavelmente devido à presença de fatores de astrócitos derivados trófica. Outros métodos, como a derivação via neurospheres 7,8, invocar as propriedades mitogênica da FG, como fator básico de crescimento de fibroblastos (bFGF), fator de crescimento epidérmico (EGF) e das plaquetas fator de crescimento derivado (PDGF) para expansão da OPC. Da mesma forma, usando pós-natal (P5-10) para ratos DRGNs evita a necessidade de complementar os meios de cultura com fator de crescimento neural (NGF), um fator neurotrófico necessários para a sobrevivência in vitro de embriões DRGNs 9, 10. É de interesse para evitar o uso de NGF, uma vez que influencia negativamente a capacidade myelinating de OLS quando cultivadas com DRGNs 4. Evitando o uso de GF-suplementado mídia também tem benefícios econômicos, uma vez que estes reagentes tornar-se caro quando usado em larga escala.
Talvez o benefício mais importante deste modelo de cultura é sua derivação do rato-somente tecidos, proporcionando assim as oportunidades para derivar tanto OPCs e DRGNs da grande variedade de linhas de ratinhos transgénicos. Isto permite o estudo de ambos e DRGN / ou OPC propriedades específicas que regem a mielinização. Isto será especialmente importante para a elucidação das interações receptor / ligante regulação OL-mediada mielinização dos axônios. Ao todo, esta técnica é de grande valor com relação à pesquisa em neurociência, devido à suas aplicações para a compreensão dos sinais moleculares subjacentes mielinização.
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Este projeto foi financiado por uma doação da Sociedade de Esclerose Múltipla do Canadá para RKRWO é um receptor de um Studentship da Sociedade de Esclerose Múltipla do Canadá. SDR é um receptor de Bolsas de Pós-Doutorado da Sociedade de Esclerose Múltipla do Canadá e Canadian Institutes of Health Research.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do produto | Companhia | Número de produtos | |
| Modificado Dulbecco Eagle Medium (DMEM) | Multicélulas | 319-005-CL | |
| Solução salina balanceada de Hank (HBSS) | Invitrogen | 14170-112 | |
| Mínimo Essential Media (MEM) | GIBCO | 12360-038 | |
| De soro fetal bovino (FBS) | GIBCO | 10091-148 | |
| Penicilina-estreptomicina (Pen / Strep) | GIBCO | 15140-122 | |
| Glutamax | Invitrogen | 35050-061 | |
| Poli-l-lisina | Sigma-Aldrich | P2636 | |
| Albumina de soro bovino (BSA) | Sigma-Aldrich | A4503 | |
| Humana merosina proteína purificada (LN2) | Millipore | CC085 | |
| Recombinante rato fator neurotrófico ciliar (CNTF) | PeproTech | 450-50 | |
| L-tiroxina | Biochemika | 89430 | |
| Holo-transferrina | Sigma-Aldrich | T0665 | |
| B27 suplemento | GIBCO | 0080085-SA | |
| Insulina bovina | Sigma-Aldrich | I6634 | |
| 3,3 ',5-Triiodo-L-thyronine | Sigma-Aldrich | I6634 | |
| Progesterona | Sigma-Aldrich | P8783 | |
| Putrescina | Sigma-Aldrich | P7505 | |
| Selenito de sódio | Sigma-Aldrich | S5261 | |
| 5-fluoro-2'-deoxiuridina (FuDR) | Sigma-Aldrich | F0503 | |
| Solução de papaína | Worthington | LS003126 | |
| DNaseI | ROCHE | 1010159001 | |
| L-cisteína | Sigma-Aldrich | C7352 | |
| 24 pratos bem a cultura de tecidos | Cellstar | 662-160 | |
| Frascos T25 tecido-cultura com tampa da abertura | Corning | 430639 | |
| 10 centímetros cultura pratos tecido | Corning | 430167 | |
| 10 centímetros placa de Petri | Fisher Scientific | 0875713 | |
| A colagenase | ROCHE | 103578 | |
| CellTrics 50 mm filtro (opcional) | PARTEC | 04-004-2327 | |
| Mielina Básico Protein (MBP) Antibody | AbD Serotec | MCA409S | |
| NG2 anticorpos | Millipore | AB5320 | |
| Mielina Associated Glicoproteína anticorpos (MAG) | Millipore | MAB1567 | |
| 2 ', 3'-cíclico-fosfodiesterase nucleotídeo 3'-anticorpos (CNP) | Covance | SMI-91R-100 | |
| Actina pan-5 Ab de anticorpos | Fitzgerald | 10R-A106AX | |
| Neurofilamento-200 de anticorpo (NF) | Sigma-Aldrich | N4142 | |
| Beta-3 tubulina cadeia (Tuj1) de anticorpos | Millipore | MAB5544 | |
| Alexa Fluor 488 cabra anti-IgG de coelho (H + L) anticorpo secundário | Invitrogen | A11008 | |
| Alexa Fluor 555 cabra anti-camundongo IgG (H + L) anticorpo secundário | Invitrogen | A21422 | |
| Alexa Fluor 647 cabra anti-rato (IgG) (H + L) anticorpo secundário | Invitrogen | A21247 | |
| Cabra anti-camundongo IgG (H + L)-HRP conjugado anticorpo secundário | BioRad | 170-6516 | |
| Cabra anti-IgG de rato (H + L)-HRP conjugados de anticorpos secundários | Santa Cruz Biotechnology | SC-2065 | |
| 4 ',6-diamidino-2-phenylindole (DAPI) | Sigma-Aldrich | D9542 |
Receitas da mídia
OL-100X Suplemento *
| Ingrediente | Quantidade para adicionar |
| DMEM | 100 mL |
| BSA | 1,02 g |
| Progesterona | 0,6 mg |
| Putrescina | 161 mg |
| Selenito de sódio | 0,05 mg |
| 3,3 ',5-Triiodo-L-thyronine | 4 mg |
* Conservar a -80 ° C em 250 mL alíquotas
t "> mídias OL| Ingrediente | Quantidade para adicionar |
| DMEM | 23,75 mL |
| Suplemento OL-100X | 250 L |
| Insulina bovina (de um estoque mg / mL) | 125 mL |
| Glutamax | 250 L |
| Holo-transferrina (de 33 ações mg / mL) | 37,5 mL |
| B27 Suplemento | 500 mL |
| FBS | 125 mL |
| CNTF (de 50 ações ng / mL) | 25 mL |
Mista glial meios de cultura (confeccionados em DMEM)
| Ingrediente | Concentração final |
| FBS | 10% |
| Pen / Strep (0,33% do estoque) | 33 unidades / ml de penicilina e estreptomicina 33 mg / mL |
| Glutamax | 1% |
DRGN media (confeccionados em DMEM)
| Ingrediente | Concentração final |
| FBS | 10% |
| Pen / Strep (1% do estoque) | 100 unidades / ml de penicilina e estreptomicina 100 mg / mL |
Solução Receitas digestão:
OPC papaína solução (composta em MEM)
| Ingrediente | Concentração final |
| Solução de papaína | 1,54 mg / mL |
| L-cisteína | 360 mcg / mL |
| DNaseI | 60 mcg / mL |
DRG papaína solução (composta em HBSS)
| Ingrediente | Concentração final |
| Papaína | 1,54 mg / mL |
| L-cisteína | 360 mcg / mL |
DRG colagenase solução A (confeccionados em HBSS)
| Ingrediente | Concentração final |
| A colagenase | 4 mg / mL |
Referências
- Avellana-Adalid, V. Expansion of rat oligodendrocyte progenitors into proliferative "oligospheres" that retain differentiation potential. J Neurosci Res. 45, 558-570 (1996).
- McCarthy, K. D., de Vellis, J. Preparation of separate astroglial and oligodendroglial cell cultures from rat cerebral tissue. J Cell Biol. 85, 890-902 (1980).
- Barres, B. A. Cell death and control of cell survival in the oligodendrocyte lineage. Cell. 70, 31-46 (1992).
- Chan, J. R. NGF controls axonal receptivity to myelination by Schwann cells or oligodendrocytes. Neuron. 43, 183-1891 (2004).
- Camara, J. Integrin-mediated axoglial interactions initiate myelination in the central nervous system. J Cell Biol. 185, 699-712 (2009).
- Ishibashi, T. Astrocytes promote myelination in response to electrical impulses. Neuron. 49, 823-832 (2006).
- Chen, Y. Isolation and culture of rat and mouse oligodendrocyte precursor cells. Nat Protoc. 2, 1044-1051 (2007).
- Pedraza, C. E. Production, characterization, and efficient transfection of highly pure oligodendrocyte precursor cultures from mouse embryonic neural progenitors. Glia. 56, 1339-1352 (2008).
- Lewin, G. R., Ritter, A. M., Mendell, L. M. On the role of nerve growth factor in the development of myelinated nociceptors. J Neurosci. 12, 1896-1905 (1992).
- Greene, L. A. Quantitative in vitro studies on the nerve growth factor (NGF) requirement of neurons. II. Sensory neurons. Dev Biol. 58, 106-113 (1977).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados