Method Article
포스트 - 나탈 Murine 조직의 공동 문화를 Myelinating 풍부한 Oligodendrocyte 문화와 Oligodendrocyte / 신경 세포의 유도
요약
이 문서는 성숙 oligodendrocytes (OLs)를 생산하는 차별화 기본 문화에 murine oligodendrocyte 전구체 세포 (OPCs)의 풍부한 인구를 유도하는 방법을 설명합니다. 또한,이 보고서는 생산 기술에 대해 설명합니다 murine 마우스 등의 루트 신경절의 뉴런 (DRGNs)의 neurite 침대에 마우스 OPCs을 심는 공동 문화 myelinating.
초록
OL 개발을 기본 분자 메커니즘을 파악하면 OL 생물학 우리의 지식을 발전에만 중요한 것이 아니라, 또한 여러 경화증 (MS)와 같은 demyelinating 질병의 pathogenesis을 이해하는 데 의미가 있습니다. 세포 개발은 일반적으로 기본 세포 배양 모델 공부입니다. 기본 세포 배양은 생체내에 존재하는 외부 변수의 자유로운 제어 환경을 제공하여 주어진 세포 유형의 평가를 용이하게합니다. 쥐에서 파생된 OL 문화가 OL 생물학에 대한 통찰력의 방대한 양의를 제공하는 동안 마우스의 OL 문화를 확립에 유사한 노력은 주요 장애물을 만났되었습니다. 문화 murine 기본 OLs하는 방법을 개발하는 것은 가능한 유전자 변형 마우스 라인을 활용하기 위해 필수적입니다.
설치류 조직에서 OPCs의 추출을위한 여러 방법 neurosphere의 유도, 차동 부착 정화와 1-3 immunopurification 이르기까지, 설명되었습니다. 많은 방법이 성공을 제공하는 동안, 대부분의 광범위한 문화 시간 및 / 또는 비용이 많이 드는 장비 / 시약을 필요로합니다. 이것을 회피하려면, 원래 맥카시 & 데 Vellis 2 설명한 방법의 적응과 murine 조직에서 OPCs을 정화하는 것이 좋습니다. 이 방법은 신생아 쥐 cortices에서 파생된 혼합 glial 문화 물리적으로 분리 OPCs을 포함한다. 그 결과 OL - 풍부한 문화로 차별화된 수있는 정화 OPC 인구입니다. 이러한 접근 방식으로 인해 자사의 비교적 짧은 문화 시간과 성장 요인이나 immunopanning 항체에 대한 불필요한 요구에 호소합니다.
정화 문화 OL 개발의 메커니즘을 탐구하는 것이 유익하는 동안, 그것은 myelin의 쉬스 형성을 평가하기위한 가장 생리학 관련성이 높은 환경을 제공하지 않습니다. 뉴런과 함께 공동 culturing의 OLs은 axons의 OL - 중재 myelination 규제 분자 토대에 대한 통찰력을 빌려 것입니다. 신경 세포 공동 문화 연구 / OL 많은 경우, 지느러미 루트 신경절의 뉴런 (DRGNs)은 선택의 신경 세포 유형적일 수있다. 그들은 추출, 오염 세포의 최소한, 그리고 짙은 neurite 침대 형성 그들의 용이성으로 인해 OLs 공동 문화에 이상적입니다. xenocultures를 myelinating 쥐를 / 마우스를 사용하는 연구가 출판되었습니다 동안 4-6는 그러한 파생하는 방법은 DRGN / OL 포스트 나탈 murine 조직의 공동 문화를 myelinating 것은 설명되지 않았습니다. 우리가 효과적으로 예상 결과의 예제와 함께, 이러한 문화를 생산하는 방법에 대한 자세한 방법을 제시한다. 이러한 방법은 OL 개발 / myelinating 함수에 관련된 질문을 해결하는 데 유용하고, 유용한 도구는 신경 과학 분야에 있습니다.
프로토콜
윤리 정책
이 작품에 사용된 생쥐 애니멀 케어에 캐나다 협의회 (CCAC) 지침에 따라 치료를 받았다. 진행 실험 윤리 승인 프로토콜 번호 OGH - 119 이하 오타와 애니멀 케어위원회의 대학에서 얻은 것입니다.
1. 해부 - OPC 추출을위한 신생아 마우스 피질
- 기관 지침에 따라 P0 - P2 마우스를 희생.
- 얼음처럼 차가운 멤을 (항생제 무료)가 포함된 배양 접시에있는 두뇌와 장소를 해부하다.
- 해부 현미경으로 요리를 전송합니다.
- 최대 두뇌 등의 사이드와 메스를 사용하여 각 피질 (그림 1A)의 가장 내측 가장자리 sagittally 얕은 절개합니다. 이것은 절개는 자사의 제거를 촉진하기 위해 meningeal 계층을 통과해야합니다.
- 래터럴 방식으로 meninges에서 껍질을 잘 밀고 집게를 사용하십시오. 신중하게 할 경우,이 계층은 한 조각으로 제거할 수 있습니다. 이 단계 동안 후각 전구를 제거합니다.
- 뇌 복부 측면 접속으로 피질이 diencephalon의 복부 영역 (그림의 1B) '요건을 충족하고 깊은 화살 절개합니다.
- 사이드 최대 두뇌 지느러미와 측면 패션 (그림 1C, C ')에 중간에 조직을 캐고하여 midbrain에서 cortices를 구분한다. 이 단계에서 잔여 meninges를 제거합니다.
- 약 4 조각으로 각 피질을 주사위 부드럽게 멤 당 마우스 두뇌의 350 μL를 포함한 15 ML 원뿔 관을 전송할 수 있습니다. 모든 마우스가 처리 때까지 얼음 튜브 보관하십시오.
- 반복 남은 쥐를위한 1.1-1.8 단계를 반복합니다.
2. 혼합 glial 문화 신생아 cortices 및 유지 보수의 해리
참고 : 세포 현탁액에 거품의 도입은 다음 모든 단계 동안 피해야한다.
- 3 분 37 ° C의 물 목욕으로 신선한 해부 두뇌를 포함한 15 ML 원뿔 관을 추가합니다.
- 무균 조직 배양 후드에 머리를 전송합니다.
- 부드럽게 작은 조각을 생성하는 P1000 피펫 팁을 통해 절단 cortices을 전달합니다. 더 뇌 조각이 피펫 팁을 통해 현탁액의 원활한 흐름을 방해하기 위해 충분히 큰 없습니다 번 pipetting 중지합니다.
- 원뿔 관에 뇌의 당 OPC papain 솔루션의 75 μL를 추가합니다. OPC papain 솔루션은 37 미리 예열해야 ° 전에 20 분에 대해 C는 사용할 수 있습니다.
- 20 분 37 ° C의 물을 욕조에 품어. 약 매 2 분 거리에 있으며, 부드럽게 조직 집계를 방지하기 위해 튜브를 반전. 이 시간 동안 37 ° C 조직 문화 인큐베이터의 각 폴리 - L - 라이신 (PLL) 코팅 (1 MG / ML) T25 플라스크 (마우스 뇌의 당 하나의 플라스크), 장소에서하는 혼합 glial 문화 미디어의 5 ML을 추가 8.5 % 2 CO.
- 20 분 후, 멸균 후드에 조직 정지를 반환하고 튜브에 두뇌 당 혼합 glial 문화 미디어 2 ML를 추가합니다. OPC papain 솔루션의 불활 성화 수 있도록 실내 온도 10 분 앉아 보자.
- 5 ML 플라스틱 튜브로 나누어지는 조직 현탁액. 튜브의 개수는 튜브 당 약 2.5 ML의 결과, 해부하는 두뇌의 수를 일치해야합니다.
- 멸균 화염 - 광택 유리 파스퇴르 피펫을 사용하여 부드럽게 각 튜브의 조직을 씹다. 처음에는 천천히 씹다, 그리고 조각 떼어 놓다로 점차적으로 속도를 향상시킬 수 있습니다. 약 10-15 시간을 씹다,하지만이 번호는 소화의 효능에 따라 달라질 수 있습니다.
참고 : 이상 - 가루약은 부정적인 세포 생존 능력에 영향 반면, 아래 - 가루약은 조직의 가난한 분리가 발생합니다. 이것은 심각하게 세포 생존에 영향을하므로, 솔루션에 거품을 소개하지 않는 것이 중요합니다.
- 일단 정지에 남아 눈에 띄는 조직 대단히 짧은 시간이 없습니다, 뇌 당 혼합 glial 문화 미디어 4 ML (즉, 4 뇌는 = 16 ML 혼합 glial 문화 미디어)이있는 50 ML 원뿔 관을 전송할 수 있습니다.
- 부드럽게 나머지 5 ML 튜브에 대한 50 ML 원뿔 관과 반복 반전.
- 15 ML 원뿔 튜브 (15 ML 튜브 약 6.5 ML)로 나누어지는 풀링 세포 현탁액을. 15 ML 튜브의 숫자를 해부 두뇌의 수를 일치해야합니다.
- 5 분 1,200 RPM (~ 300g)에서 튜브를 원심 분리기.
- 조심스럽게 뜨는을 대기음 각 15 ML 원뿔 관에 따뜻한 혼합 glial 문화 미디어 1 ML를 추가합니다.
- 천천히 거품을 소개하지 않도록주의하고, P1000 피펫 팁으로 펠렛을 resuspend. 6 ML하는 문화 미디어의 전체 볼륨을 렌더링, 각 튜브의 사전 equilibrated PLL - 코팅 T25 플라스크에 세포 현탁액을 추가합니다.
- 세포 PLL 기판에 연결하도록 3~4시간위한 조직 문화 인큐베이터에서 flasks를 놓습니다. 미디어를 pipetting하고 flasks 신선한 혼합 glial 문화 미디어 6 ML를 추가하여 전체 미디어 변화를 수행합니다. 이 단계는 많은 파편을 제거분쇄에 의한, 그리고 문화 생존을 촉진합니다. 공동 문화 DRGN / OL가 원하는 경우,이 프로토콜의 섹션 3 참조하십시오.
- 문화 3 일 후에, 미디어 4 ML을 제거하고, 신선한 혼합 glial 문화 미디어 4 ML로 대체하여 삼분의이 매체 변경을 수행합니다. 이 시점에서, astrocyte monolayer은 flasks의 기초를 형성해야합니다.
- 주 6 일, 다른 삼분의이 미디어는 5 μg / ML 인슐린의 최종 농도로 flasks을 변경하고 보완 수행합니다. 이 시점에서, astrocyte monolayer는 OPCs가 proliferating 수있는 위에, 명확하게 표시해야합니다.
3. DRGN 절연
참고 : 공동 문화 DRGNs / OL, DRGNs가 혼합 glial 문화 세대 다음날 설립되어야 생산합니다. 두 문화 유형이 독립적으로 성장, 그리고 9-10일 후 결합됩니다.
- 기관 지침에 따라 희생 P5 - P10은 마우스.
- 척추를 추출하고, 깨끗한 페트리 접시에 전송할 수 있습니다.
- 이것은 지느러미 루트 신경 (DRGs)의 절개를 용이하므로, 가능한 한 척추 (그림의 1D, D ')에서 많은 근육과 뼈가 떨어져 낸다.
- 새로운 배양 접시 복부 측면 최대 손질 척추를 전송합니다. 해부 가위를 사용 caudally 시작 세로 패션에 척추를 통해 medially 했네요.
- 포셉 두 쌍을 사용하면, 부드럽게 척수를 노출하기 위해 척추를 엽니다 캐내다.
- DRGs은 아래 발견과 척수에 래터럴 수 있습니다. 신경 (그림 1E)에 손상을 피하면서 멋진 밀고 집게를 사용하여 부드럽게 DRGs를 제거합니다.
- 새로운 배양 접시에 얼음 차가운 행크의 버퍼 소금 용액 (HBSS, 항생제 무료)을 제거 DRGs을 전송합니다. 해부학자 마우스 40 DRGs (그림 1 층)을 추출하는 것을 목표로한다.
- DRGs 압축되었습니다되면, 문화에 오염 전지의 소개 (glial 세포, 섬유아 세포)를 최소화하기 위해 모든 지나치게 긴 뿌리 (그림 1g, G ')의 DRGs 좀 잘라.
- 얼음 차가운 HBSS 500 μL를 포함하는 1.5 ML의 원심 관에 DRGs를 전송합니다.
- 4 5 분 1,200 RPM (~ 300g) · 펠릿 DRGs에 C에서 원심 분리기.
- 무균 조직 문화 후드에 원심 튜브를 전송하고 튜브에서 HBSS를 제거합니다.
- 사전 예열 500 μL에 추가 (37 20 분 ° C) DRG papain 솔루션, 10 분 37 ° C의 물을 욕조에서 튜브를 품어. 튜브에게 조직 집계를 방지하기 위해 매 2 분 반전.
- 3.10 단계를 반복합니다.
- DRG의 papain 솔루션을 제거하고 Collagenase 솔루션 미리 예열 (37 ° C에서 20 분) 500 μL를 추가합니다. 10 분, 반전 매 2 분 37 ° C의 물을 욕조에 품어.
- 3.10 단계를 반복합니다.
- 뜨는 제거하고 DRGN 미디어 1 ML를 추가합니다. 튜브 여러 번 반전.
- 3.10 단계를 반복합니다.
- 3.16 단계를 반복합니다.
- 코트 HBSS 여러 번에 0.25 %의 BSA의 솔루션을 pipetting하여 (BSA) 소 혈청 알부민과 살균 불꽃 - 광택 유리 파스퇴르 피펫. BSA 솔루션 코팅 유리 피펫의 성벽을 지키는에서 DRGs을 방지할 수 있습니다.
- 처음에는 부드럽게 BSA - 코팅 피펫으로 DRGs를 씹다, 그리고 강도 증가와 함께 대단히 짧은 시간 dissociating를 시작 한 번. 약 10-15 시간을 씹다 그러나이 수치는 소화의 정도에 따라, 그리고 튜브 당 DRGs의 번호입니다.
- 일단 분리가 달성이다 DRGN 미디어 7 ML를 포함하는 멸균 페트리 접시에 필터 50 μm의를 통해 현탁액을 전달합니다. 이 단계는 중요하지 않습니다 있지만 여과는 많은 세포 현탁액에서 파편을 제거합니다.
- 약 1.25 시간 동안 8.5 % CO 2에서 페트리 접시를 품어.
- 이 배양 시간 동안 24 - 잘 접시에 LN2 (PBS에서 10 μg / ML)로 코팅 여러 12mm의 coverslips.
- 배양이 완료되면, 명시야 아래의 페트리 접시를 관찰합니다. DRGNs는 대형 바디, 위상 어두운 세포로 구분됩니다. 어떤 준수 DRGNs 올려 부드럽게 소용돌이 페트리 접시.
참고 : 많은 오염 세포가 강력하게함으로써 DRGNs에 대한 세포 현탁액을 풍요로운, 페트리 접시을 준수해야합니다.
- 15 ML 원뿔 튜브에 세포 현탁액을 전송합니다. 부드럽게 잔여 DRGNs를 수집하는 DRGN 미디어 4 ML로 요리를 씻어. 원뿔 관에 추가 4 ML을 전송합니다.
- 1,200 RPM (~ 300g)에 5 분 원심 분리기.
- 뜨는을 대기음 신선한 DRGN 미디어 500 μL의 펠렛을 resuspend.
- hemocytometer를 사용하여 굴복 DRGNs의 개수를 계산합니다. 오직 DRGNs 및 기타 아니라 세포 유형을 포함해야합니다. DRGNs들은 큰 구형 세포 기관에 의해 확인할 수 있습니다.
- 하룻밤 8.5 %의 CO 2 각 LN2 - 코팅 DRGN 미디어 1 ML에 coverslip, 그리고 37 ° C 조직 문화의 인큐베이터에서 장소에 종자 30,000-50,000 DRGNs합니다.
- 다음날 아침, DRGN을 대체하여 전체 미디어 변경을 수행1 %의 펜 / Strep와 10 μm의의 FuDR의 최종 농도와 OL 미디어 (마이너스 CNTF)와 미디어.
- 일 3 5 단계 3.30에서와 같은 미디어 4분의 3 미디어 변경을 수행합니다.
- 주 7 일, OL 미디어 (마이너스 CNTF, 펜 / Strep, FuDR)로 전체 미디어 변경을 수행합니다.
- 일 9, DRGNs는 광범위한 neurite 침대를 결성, 지금 OPCs 공동 교양 될 준비가되어 있어야합니다.
4. OL - 풍부한 문화 또는 DRGN / OL 공동 문화의 설립을위한 혼합 glial 문화 OPCs의 정화
- 혼합 glial 문화의 날 9 일, 5 % CO 2 조직 문화 인큐베이터의 궤도 쉐이크로 flasks을 전송하기만하면됩니다. 부정 혼합 glial 문화에 영향을 미치는에서 궤도 쉐이크에서 발생하는 열을 방지하기 위해 비어 T25 flasks 위에 flasks 놓으십시오. 문화가 1 시간이 새로운 인큐베이터에 평형 수 있습니다.
- flasks가 equilibrated되면 45 분 50 RPM에서 flasks를 흔들. 이 흔들의 목적은 monolayer에서 어떤 느슨하게 자기편 오염 세포를 제거하는 것입니다.
- 조직 문화 후드로 세포를 이동하고 flasks에서 모든 미디어를 제거합니다. 5 μg / ML의 인슐린과 함께 보충 신선한 혼합 glial 문화 미디어 4 ML로 바꿉니다.
- 다시 흔드는에 flasks를 삽입하고, 약 3 시간 동안 평형 수 있습니다.
- flasks가 equilibrated되면, 궤도 쉐이크 안전하게 그들을 체결하고, 220 RPM (야간)에서 약 16시간에 대한 flasks를 흔들.
- 다음날 아침, OLs는 DRGNs이없는 (즉, OL - 풍부한 문화), LN2 (PBS에서 10 μg / ML) 1 시간 동안 함께 코트 여러 살균 12mm의 coverslips 재배해야하는 경우. 24 잘 요리 coverslips을 전송, OL 미디어 세척 다음 PBS로 세척. 각 잘하는 OL 미디어 1 ML을 추가하고 8.5 %의 CO 2 평형.
- 5 % 10cm 조직 문화 요리 평형은 30 분 2 CO. 한 접시는 매 2 flasks 필요합니다. 이들은 정지 OPCs의 차동 부착 농축에 사용됩니다.
- 30 분 평균 기간이 경과되면, 요리에 떨면서 flasks에서 미디어를 전송합니다. 각 접시 10cm 요리 당 세포 현탁액의 약 8 ML과 동등, 2 flasks에서 미디어를 받으실 수 있습니다.
- 15 분 마크에서 부드러운 찔러 제공하면서 5 % 30 분 CO 2에서 요리를 품다. 이 찔러는 10cm 접시에 준수에서 OPCs을 방지하는 데 도움이됩니다.
- 배양이 완료되면, 명시야에서 요리를 검사합니다. OPCs는 일반적으로 3-5 세포의 작은 세포 대단히 짧은 시간 같은 식별하지만 때로 neurospheres를 닮은 큰 집계를 형성하고 있습니다. 많은 비 OL 혈통 세포는 단단히 접시의 기본을 준수해야합니다. 부드럽게 소용돌이 접시는 느슨하게 붙어 OPCs를 분리하고, 15 ML 원뿔 관에 각각의 접시에서 세포 현탁액을 전송할 수 있습니다.
- 5 분 1,200 RPM (~ 300g)에 원심 분리기.
- P200 피펫 팁로 resuspension 다음 P1000 피펫 팁과 OL 미디어 1 ML에서 펠렛을 Resuspend.
- hemocytometer를 사용하여 셀을 계산합니다.
- 에 대한 강화 - OL 문화, 종자 25000 - 1 ML OL 미디어의 최종 볼륨에있는 각 12mm LN2 - 코팅 coverslip에 50,000 OPCs.
- 공동 문화 DRGN / OL, 섹션에서 DRGNs에 전체 OL 미디어 (마이너스 CNTF) 변경을 수행을 위해 [3], 그리고 부드럽게 OPC - 농축 세포 현탁액에서 50,000 세포를 추가합니다. OPCs를 추가하는 동안 DRGN의 neurite 침대를 중단하지 않도록 조심해.
- 이곳은 8.5 % CO 2에서 37 ° C 배양기에서 문화, 그리고 고정 때까지 제거하지 마십시오. Murine OPCs가 산도의 변화와 보육의 제거로 구분하면 OL 미디어의 산도를 변경합니다. 또한 참고의 세포 문화를 둘러싼 빈 우물에 DH 2 O의 또한 따라서 OL 미디어 내의 농도의 solutes의 변동을 최소화, 문화 미디어의 증발을 방지할 수 있습니다. 이것은 OPCs에 대한보다 일관된 환경을 제공합니다.
5. immunofluorescence 현미경을위한 문화의 처리
- 15 분 상온에서 10 분, 또는 3 % paraformaldehyde를위한 -20 ° C에서 100 % 메탄올과 문화를 수정.
- 0.1 % 10 분 트리톤 - X - 100 coverslips을 Permeabilize, 10 % 염소 혈청에서 1 시간 인산염 버퍼 호수 (PBS)와 블록 씻으십시오.
- 4 박 솔루션을 차단에 희석 일차 항체와 함께 품어 coverslips ° C.
- PBS로 coverslips에게 3 번 씻고, 45 분 솔루션을 차단에 희석 알렉사 - 플루어 복합 이차 항체 (Invitrogen)에 품어.
- 4 ', 6 diamidino - 2 - phenylindole (DAPI)와 Counterstain하고 PBS로 coverslips 여러 번 씻는다.
- DAKO 형광의 마운트 coverslips이 매체를 장착.
- immunofluorescence 현미경을 통해 슬라이드를 분석할 수 있습니다. 이 프로토콜에서는 슬라이드는 자이스 혈구 Axiovert 200M 거꾸로 형광도 함께 분석했다현미경이나 공촛점 현미경 자이스 혈구 LSM 510 META 레이저.
6. OL - 농축 문화에서 전체 세포 단백질 추출
- 3 분위한 얼음 인큐베이터 및 냉각의 24 잘 문화를 제거합니다.
- 조심스럽게 미디어를 제거하고 용해 버퍼의 10-20 μL (0.1 % pepstatin과 함께 50 MM 트리스 - HCL, 150 MM NaCl, 0.1 % SDS, 0.5 %의 나트륨 deoxycholate, 1 % 트리톤 - X - 100, aprotinin, PMSF을 추가 각 자에게 류펩틴, 나트륨 orthovanadate) (샘플 당 8 웰스의 최소 권장합니다.)
- 넓은 구멍 P1000 피펫 팁을 사용하여 우물을 다쳤고, 그리고 1.5 ML의 원심 관에 lysate를 전송합니다.
- 30 ½ - 게이지 주사기를 통해 약 15 시간, 30 분 얼음에 진정을 lysate를 전달합니다.
- 4 15 분 ° C. 위해 14,000 RPM (~ 20,000g)에서 튜브를 원심 분리기
- -80에서 새로운 원심 분리기 튜브 및 저장 뜨는 전송 ° C.
7. 강화 - OL 문화 단백질을 SDS - PAGE 분석
- 표준 12% 폴리 아크릴 아미드의 - 젤에 대한 SDS - PAGE에 의해 버퍼를 줄일 샘플 당 단백질 30 μg를 해결합니다.
- PVDF의 점막에 세미 드라이 전송 젤.
- 5 % 1 시간 블록 점막 (10 MM 트리스 - HCL 산도 8.0, 150 MM NaCl, 0.1 % 트윈 - 20) TBST에서 분유를 우유.
- 1 시간 동안 솔루션을 차단에 희석 일차 항체와 세포막을 품어.
- 10 분 TBST로 세포막에게 3 번 씻으십시오.
- 솔루션을 차단 45 분 HRP - 복합 차 항체와 세포막을 품어.
- TBST로 세포막 여러 번 씻어, 5 분 애머스햄 ECL 플러스 서쪽 모래 바닥 검출 시약 (GE 헬스케어)와 부화.
- 표준 과학 이미징 필름으로 단백질 밴드를 감지합니다.
8. 대표 결과 :
이 프로토콜에서는 OPCs는 혼합 glial 문화 이내 astrocyte monolayer에 확장됩니다. 이 혼합 glial 문화 P0 - P2 신생아 마우스 피질에서 파생됩니다. 관내 (DIV1)에 일 1, 혼합 glial 문화 위상 콘트라스트 현미경 (그림 2A)에서 볼 수 등 다양한 morphologies과 세포가 포함되어 있습니다. DIV3에서 astrocyte monolayer은 술병의 바닥에있는 양식을 시작하고, DIV8에서 OPCs는 명확하게 monolayer 표면에 볼 수 있습니다. DIV9에서 proliferating OPCs는 하룻밤 사이에 고속 궤도 흔들어에 의해 정화하는 충분한 밀도에 도달했습니다. 정화 프로세스가 완료되면, 결과는 OPC - 풍부한 세포 인구입니다. DIV1 - 게시 정화에서 OPCs는 몇 가지 프로세스 (그림 2B)를 확장, 간단한 형태 있습니다. DIV3 게시물 정화에서, 세포이지나 OLs 연상 프로세스의 복잡한 meshwork을 확장합니다. DIV6 게시물 정화에서 정화 OLs은 평평하고 멤브레인 구조 전단지와 같은 예상했습니다. 이 형태학의 개발 OLs의 체외의 성숙에의 전형이다.
Immunofluorescence 현미경은 정화 세포 OL - 혈통 (그림 3A)의 것을 나타냅니다. 시드 처음 콘드로이틴 황산 표현 proteoglycan (NG2)을 OPCs, 3 일 포스트 시딩 (그림 3B) 이내 myelin - 연결된 당단백질 (잡지) 긍정적인 미숙 OLs으로 개발할 수 있습니다. DIV6에서 많은 OLs 표현 myelin 기본 단백질 (MBP), 그리고 가진 전형적인 성숙 OL 형태. 퍼센트 OL - 혈통 전지는 OL - 풍부한 문화 (그림 3C)의 순도를 결정하는 다른 시간 지점에서 계량했다. DIV1 게시물 정화에서 문화 50아르 ± 14% NG2 + 곳을 OPCs는, 아니 마그 +했거나 MBP + 곳을 OLs와 함께. 이것은 정화 OL - 혈통 세포가 차별 OLs 무시할 수 숫자, 시딩 시간에 전구체 단계에 있음을 나타냅니다. 일부는 전구체 표현형을 유지하고, NG2 유지하면서 DIV3에서 많은 OLs는 마그 +했습니다 세포 (24 ± 5.9 %)에 차별이 + (13 ± 8.0 %). DIV3에서 마그 +했습니다 세포 (3.2 1.2 %)의 작은 비율도 MBP을 표현하고 있습니다. DIV6에서 OLs의 20 ± 5.9 %입니다 마그 + 12 ± 7.3 %가 NG2 + 곳을 OPCs로 유지했습니다 동안. 또한, 문화 내의 세포 21 ± 9.3 %는 MBP 아르 +이 시점에서 올린 OLs. SDS - PAGE 분석 추가 말기 (그림 3D 성숙 OLs로 차별화하는 문화에 OPCs의 능력을 보여주 2'3' - 순환 - 염기 3' - phosphodiesterase (CNP)과 6 일 문화 기간 동안 MBP의 등급 표현을 보여줍니다 ). 총체적으로,이 데이터는 OPCs에서 OL 성숙 연구에 적합한 OL - 풍부한 문화 시스템을 생산의 수단으로이 방법을 설정합니다.
이 프로토콜은 또한 murine 전용 티슈 소스를 사용하여 DRGN / OL 공동 문화를 확립하는 방법을 설명합니다. 그러나, 공동 문화를 생산하기 위해, DRGNs 먼저 적절한 neurite 네트워크를 만들어 혼자 교양해야합니다. 이 포스트 나탈 murine 신경 세포 배양은 오염 섬유아 세포와 GL의 확산을 방지하기 위해 10 μm의의 FuDR의 보완과 함께 낮은 혈청 미디어 9 일 동안 재배 원점 세포. 체외 9 일 과정 동안 고립 DRGNs는 고밀도 neurite 침대 (그림 4A)를 생산하고 있습니다. 이 neurite 침대의 연결 마커의 neurofilament 200 (NF)와 Tuj1 (그림 4B)에 immunopositive입니다. 이 시점에서, 정화 OPCs는 neurite 침대에 추가될 수 있으며, 공동 문화를 myelinating 생산 추가 6 일간 교양.
공동 문화 DRGN / OL 많은 MBP가 + 곳을 OLs이 NF +했습니다 DRGN의 neurites (그림의 5A) 사이에서 볼 수 있습니다의 DIV6에서. 가까이 검사시 OLs 종종 MBP +했습니다 막 (그림의 5B, C) 그들을 ensheathing 수많은 DRGN의 neurites 접촉하도록 입증하고 있습니다.
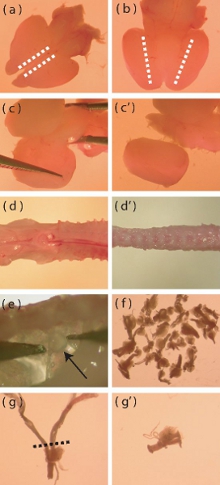
그림 1. 신생아 마우스 대뇌 피질 및 DRG 절연의 특정 부분의 해부 현미경 이미지. 갓 추출된 신생아 마우스 두뇌의 (A) 도설 볼 수 있습니다. 점선은 incisions이 meningeal 레이어의 제거를 촉진하기되어야합니다 지역을 나타냅니다. (B) 두뇌의 복부보기가, 점선은 피질이 복부 diencephalon을 충족 영역을 나타냅니다. 딥 incisions는 cortices의 절연을 지원하기 위해 점선을 따라하셔야합니다. (C - C ') 두뇌의 나머지 부분으로부터 멀리 피질 프라이하는 방법을 시각 묘사. (D) 신선한 절연 P5 - P10 마우스 척추 멀리 초과 근육과 뼈 (D ')를 트리밍하기 전에. 척추 칼럼 내에서 DRGs의 (E) 위치. (F) 1 마우스에서 격리해야 DRGs의 대략적인 수입니다. (G) DRG 필요로 긴 뿌리 효소 소화하기 전에 트리밍. 점선은 뿌리가 줄어들해야하는 지역을 나타냅니다. (G ') 이후 루트 - 트리밍을 DRG.
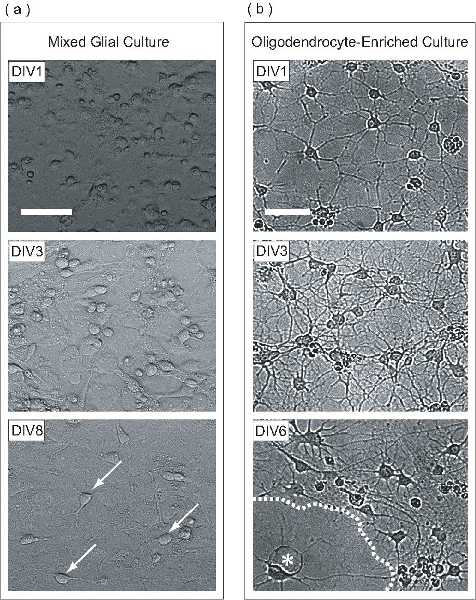
그림 2. OPCs는 혼합 glial 문화 이내 확장 정화하고, 이후 OL - 풍부한 문화로 구별됩니다. 개발의 다른 단계에 혼합 glial 문화 (A) 위상 콘트라스트 이미지를 표시합니다. DIV1에서 전지는 몇 평평 세포와 원형 나타납니다. 혼합 glial 문화의 충화는 astrocytes가 OPCs가 세포 분열 따위에 의해 번식하는시 술병의 바닥에 균일 monolayer를 형성 DIV3에서 시작됩니다. 많은 OPCs가 astrocyte monolayer의 표면을 준수 DIV8 (화살표)에서 볼 수 있습니다. (B) 일단 혼합 glial 문화 정화, DIV1 OPCs는 몇 가지 프로세스를 확장합니다. DIV3에서, 세포는 중간 단계 OLs 연상케 많은 프로세스를 확장합니다. DIV6에서 평평 OLs (별표) (점선) 막의 시트를 생산하도록 나타납니다. 스케일 바, 50 μm의.
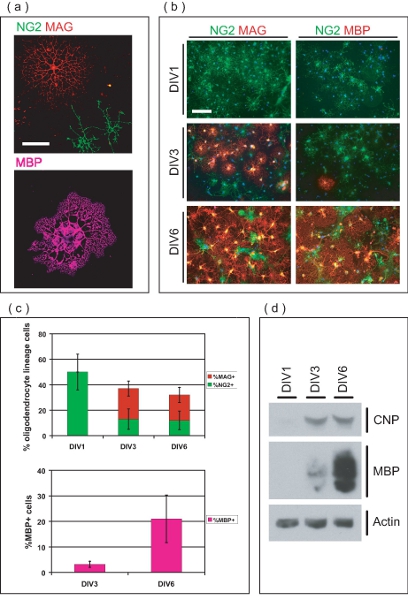
그림 3. OL - 농축 문화의 특성화. 개발의 다른 단계에 격리 OLs의 (A) 공촛점 이미지. NG2 + 마그 + 곳을 OLs 여러 arborous 프로세스를 가진 반면에 올린 OPCs는 간단한 형태 있습니다. MBP + 곳을 OLs는 막의 myelin 같은 시트를 확장. 스케일 바, 50 μm의가. (B) 정화 OL - 혈통 전지 OPCs으로 유래 및 6 DIV여 마그 + 적, MBP + 곳을 OLs로 구분. 아무도 잡지 +했거나 MBP + 적없는 동안 DIV1에서 모든 OPCs는, NG2 + 적 있습니다. DIV3에서, 매기 +했습니다 그리고 몇 MBP + 곳을 OLs 지금은 분명합니다. OLs의 대부분은 몇 가지 남아 NG2 + 곳을 OPCs와 DIV6에서 잡지와 MBP + 적 있습니다. 스케일 바, 100 μm의가. (C) 값 ± SD 6 DIV를 통해 개발의 다른 단계에있는 퍼센트 OL - 혈통 세포를 의미합니다. DIV1에서 모든 OL - 혈통 전지는 50 NG2 + 적, 회계 ± 문화 내의 전체 세포의 14 %입니다. DIV3 및 DIV6에서 OL - 혈통 전지 36 각각의 계정 ± 6.8 % 및 32 ± 총 세포의 8.4 %, NG2의 비율을 변화 구성된 + 적, 매기는 + 적과 MBP + 올린 OLs. (D) SDS - PAGE는 수행 6 DIV 문화 기간 동안 OL - 마커 CNP 및 MBP의 등급 표현을 보여주는 풍부한 OL - 문화권에서 파생된 단백질에.
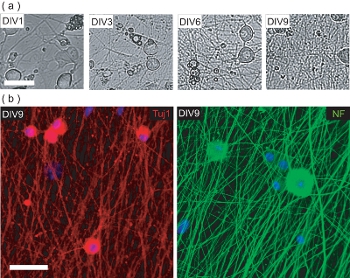
그림 4. DRGN 문화 사전 OPC의 시딩의 특성화. (A) 사전 OPC의 시딩 9 DIV 문화 기간 동안 단계 DRGNs의 콘트라스트 이미지를. DRGNs는 몇 가지 프로세스와 대형 바디 세포로 보낸, 그리고 점점 더 복잡해지는 neurite 네트워크를 생산하고 있습니다. 스케일 바, 100 μm의. (B) DIV9 (사전 OPC 시딩)에 고정하고 신경 세포 특정 마커 Tuj1 및 NF200에 대한 스테인드 DRGN 문화의 공촛점 이미지. DRGNs는 OPCs가 DRGN / OL 공동 문화 myelinating 생산에 씨앗을 수있는시 neurite 네트워크를 생산했습니다. 스케일 바, 50 μm의.
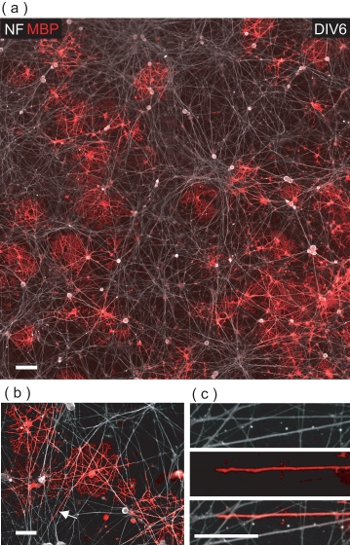
그림 5. OLs MBP와 DRGN neurites +했습니다 막의 OL - 중재 포장의 DRGNs 결과와 함께 공동 교양. (A) DIV6 DRGN / OL 공동 문화의 몽타주 4 필드 공촛점 이미지. 대부분의 MBP는 + 곳을 OLs은 기본 DRGN의 neurite 침대와 상호 작용을 볼 수 있습니다. 스케일 바, 100 μm의. MBP의 (B) 확대보기 공촛점 + 여러 DRGN의 neurites을 포장 곳을 OLs. 스케일 바, 50 μm의가. (C) 지역의 디지털 확대는 (B) DRGN neurite이 OL 막으로 싸여되고 어디에 표시됨. 스케일 바, 25 μm의.
토론
이 보고서는 OL - 풍부한 문화 또는 DRGN / OL 공동 문화의 차별 화를위한 murine OPCs를 분리하는 방법을 설명합니다. 혼자 교양 경우, OPCs은 MBP로 차별화 + 곳을 OLs을 막의 시트 myelin 같은 생산. neurite 침대 DRGN에 추가하면, OLs은 MBP로 DRGN의 neurites을 싸다 +하신 막합니다. 이 모델은 OL - 중재 axonal ensheathment를 지배하는 복잡한 토대의 조사를 장점.
큰 가치가 있지만, 그러한 문화의 설립은 기술적 도전이다. 특히, 까다로운 측면 효율적인 조직 소화 / 분리, 균형 문화 미디어 산도의 유지 보수 및 DRGN 미디어 변경 사항을 포함합니다. 소화의 길이가, 조직의 금액은 소화 및 분쇄의 금액은 조직 분리의 효능과 최종 결과에 영향을 받고 있다고 의심하는 것이 중요합니다. 그것은 dissociated 신경계 조직에서 낮은 세포 수율을 얻는 경험 연구원 드문되지 않습니다. 또한, murine OPCs 특히 알칼리성 조건, 문화 미디어의 산도 변화에 민감한 경향이 있습니다. 8.5 %의 CO 2에 문화의 유지 보수 OPCs 더 기본 이상의 약산성 조건을 내버려 표시 있기 때문에, 이것을 방지하는 것을 목표로하고있다. 수유 DRGNs와 관련, 미디어 변경은 뉴런을 마르다하지 최대한 빨리 수행되어야하지만, 개발 neurite 침대를 중단하지로 부드럽게해야합니다. 돌발 미디어 변경은 기판에서 neurite 침대와 coverslip로부터 완전한 분리의 가능성이 결과를 이동시키다 수 있습니다.
이 모델 시스템의 잠재적인 장점은 크게는 기술적으로 까다로운 성격을 overshadows. 이 시스템의 장점 중 하나는 배아 조직을 수확하기 위해 번식 여자를 희생의 필요성을 우회, 세포 배양 유래에 대한 사후 산후 마우스를 사용하는 것입니다. 또 다른 장점은 OPCs의 확장에 대한 성장 요인에 대한 요구의 부족 (GFS)입니다. 혼합 glial 문화 astrocyte - 파생 영양 요인의 존재로 인해 아마도 OPCs의 전파를 지원하는 환경을 제공합니다. 이러한 neurospheres 7,8를 통해 유도와 같은 다른 방법은, 이러한 기본적인 fibroblast의 성장 인자 (bFGF), 표피 성장 인자 (EGF)와 OPC 확장에 대한 혈소판 - 유래 성장 인자 (PDGF)로 GFS의 mitogenic 속성에 의존하고 있습니다. 마찬가지로, 출생 후의 (P5 - 10) DRGNs 위해 마우스를 사용하면 신경 성장 인자 (NGF), 배아 DRGNs 9, 10의 체외 생존에 필요한 neurotrophic 요인과 문화 미디어를 보완의 요구 사항을 방지합니다. 그것은 DRGNs 4 교양 때 부정 OLs의 myelinating 용량에 영향을 미친다으로 NGF를 사용하지 않도록 관심을 것입니다. 의 사용 피하 GF를 보충 대규모 사용할 때 이러한 시약은 비용이 증가함에 따라 미디어 또한, 경제적 이점을하고 있습니다.
아마이 문화 모델의 가장 중요한 이점은 따라서 유전자 변형 마우스 라인의 다양한에서 OPCs 및 DRGNs 모두를 파생하는 기회를 제공, 마우스 전용 티슈로부터 파생됩니다. 이것은 모두 DRGN 및 / 또는 myelination에 적용 OPC 특정 속성의 연구 있습니다. 이것은 axons의 OL - 중재 myelination 규제 수용체 / 리간드 상호 작용을 elucidating 특히 중요한 것입니다. 모두에서는,이 기술은 myelination를 기본 분자 신호를 이해하는 방향으로 애플 리케이션에 의한 신경 과학 연구에 관해 훌륭한 가치입니다.
공개
관심 없음 충돌 선언하지 않습니다.
감사의 말
이 프로젝트는 캐나다의 여러 경화증 협회에서 RKRWO을 부여하여 투자했던 것은 캐나다의 여러 경화증 협회에서 학생이기의받는 사람입니다. SDR 건강 연구의 캐나다 캐나다 연구소의 다중 경화증 사회에서 포스트 박사 장학금을받는 사람입니다.
자료
| Name | Company | Catalog Number | Comments |
| 제품 이름 | 회사 | 제품 번호 | |
| Dulbecco의 수정 이글 중간 (DMEM) | Multicell | 319-005 - CL | |
| 행크의 밸런스드 소금 솔루션 (HBSS) | Invitrogen | 14170-112 | |
| 최소 필수 미디어 (멤) | GIBCO | 12360-038 | |
| 태아 소 혈청 (FBS) | GIBCO | 10091-148 | |
| 페니실린 - 스트렙토 마이신 (펜 / Strep) | GIBCO | 15140-122 | |
| GlutaMAX | Invitrogen | 35050-061 | |
| 폴리 - L - 리신 | 시그마 - 알드리치 | P2636 | |
| 소 혈청 알부민 (BSA) | 시그마 - 알드리치 | A4503 | |
| 인간 merosin 정화 단백질 (LN2) | Millipore | CC085 | |
| 재조합 쥐 ciliary neurotrophic 요인 (CNTF) | PeproTech | 450-50 | |
| L - 티록신 | Biochemika | 89,430 | |
| 홀로그램 트랜스페린 | 시그마 - 알드리치 | T0665 | |
| B27 보충 | GIBCO | 0080085 - SA | |
| 보빈 인슐린 | 시그마 - 알드리치 | I6634 | |
| 3,3 ',5 - Triiodo - L - thyronine | 시그마 - 알드리치 | I6634 | |
| Progesterone | 시그마 - 알드리치 | P8783 | |
| Putrescine | 시그마 - 알드리치 | P7505 | |
| 나트륨 Selenite | 시그마 - 알드리치 | S5261 | |
| 5 - 플루오로 - 2' - deoxyuridine (FuDR) | 시그마 - 알드리치 | F0503 | |
| Papain 솔루션 | 워싱턴 | LS003126 | |
| DNaseI | ROCHE | 1010159001 | |
| L - 시스테인 | 시그마 - 알드리치 | C7352 | |
| 24 잘 조직 문화 요리 | Cellstar | 662-160 | |
| 환기 캡과 T25 - 조직 문화 flasks | 코닝 | 430639 | |
| 10cm 조직 문화 요리 | 코닝 | 430167 | |
| 10cm 페트리 접시 | 피셔 사이 언티픽 | 0,875,713 | |
| Collagenase | ROCHE | 103578 | |
| CellTrics 50 μm의 필터 (옵션) | PARTEC | 04-004-2327 | |
| Myelin 기본 단백질 (MBP) 항체 | AbD Serotec | MCA409S | |
| NG2 항체 | Millipore | AB5320 | |
| Myelin - 관련 당단백질 (마그) 항체 | Millipore | MAB1567 | |
| 2 ', 3' - 순환 - 염기 3' - phosphodiesterase (CNP) 항체 | Covance | SMI - 91R - 100 | |
| 굴지 팬 AB - 5 항체 | 피츠제럴드 | 10R - A106AX | |
| Neurofilament - 200 (NF) 항체 | 시그마 - 알드리치 | N4142 | |
| Tubulin 베타 - 3 체인 (Tuj1) 항체 | Millipore | MAB5544 | |
| 알렉사 플루어 488 염소 안티 - 토끼 IgG (H + L) 이차 항체 | Invitrogen | A11008 | |
| 알렉사 플루어 555 염소 안티 - 마우스 IgG (H + L) 이차 항체 | Invitrogen | A21422 | |
| 알렉사 플루어 647 염소 안티 쥐 (IgG) (H + L) 이차 항체 | Invitrogen | A21247 | |
| 염소 항 마우스 IgG (H + L) - HRP 복합 이차 항체 | BioRad | 170-6516 | |
| 염소 안티 쥐 IgG (H + L) - HRP 복합 이차 항체 | 산타크루즈 생명 공학 | SC - 2065 | |
| 4 ', 6 diamidino - 2 - phenylindole (DAPI) | 시그마 - 알드리치 | D9542 |
미디어 요리법
100X OL - 보충 *
| 성분 | 추가 금액 |
| DMEM | 100 ML |
| BSA | 1.02 g |
| Progesterone | 0.6 MG |
| Putrescine | 161 MG |
| 나트륨 Selenite | 0.05 MG |
| 3,3 ',5 - Triiodo - L - thyronine | 4 MG |
-80시 * 보관 ° C 250 μL aliquots에
t "> OL 미디어| 성분 | 추가 금액 |
| DMEM | 23.75 ML |
| 100X OL - 보충 | 250 μL |
| 보빈 인슐린 (1 MG / ML 주식에서) | 125 μL |
| GlutaMAX | 250 μL |
| 홀로그램 트랜스페린 (33 MG / ML 주식에서) | 37.5 μL |
| B27 보충 | 500 μL |
| FBS | 125 μL |
| CNTF (50 μL / NG 주식에서) | 25 μL |
혼합 glial 문화 미디어 (DMEM에서 만든)
| 성분 | 최종 농도 |
| FBS | 10% |
| 펜 / Strep (재고의 0.33 %) | 33 단위 / ML 페니실린 33 μg / ML 스트렙토 마이신 |
| GlutaMAX | 1퍼센트 |
DRGN 미디어 (DMEM에서 만든)
| 성분 | 최종 농도 |
| FBS | 10% |
| 펜 / Strep (재고의 1 %) | 100 단위 / ML 페니실린과 100 μg / ML 스트렙토 마이신 |
소화 솔루션 요리법 :
OPC papain 솔루션 (멤에서 만든)
| 성분 | 최종 농도 |
| Papain 솔루션 | 1.54 MG / ML |
| L - 시스테인 | 360 μg / ML |
| DNaseI | 60 μg / ML |
DRG papain 용액 (HBSS에서 만든)
| 성분 | 최종 농도 |
| Papain | 1.54 MG / ML |
| L - 시스테인 | 360 μg / ML |
DRG Collagenase 용액 (HBSS에서 만든)
| 성분 | 최종 농도 |
| Collagenase | 4 MG / ML |
참고문헌
- Avellana-Adalid, V. Expansion of rat oligodendrocyte progenitors into proliferative "oligospheres" that retain differentiation potential. J Neurosci Res. 45, 558-570 (1996).
- McCarthy, K. D., de Vellis, J. Preparation of separate astroglial and oligodendroglial cell cultures from rat cerebral tissue. J Cell Biol. 85, 890-902 (1980).
- Barres, B. A. Cell death and control of cell survival in the oligodendrocyte lineage. Cell. 70, 31-46 (1992).
- Chan, J. R. NGF controls axonal receptivity to myelination by Schwann cells or oligodendrocytes. Neuron. 43, 183-1891 (2004).
- Camara, J. Integrin-mediated axoglial interactions initiate myelination in the central nervous system. J Cell Biol. 185, 699-712 (2009).
- Ishibashi, T. Astrocytes promote myelination in response to electrical impulses. Neuron. 49, 823-832 (2006).
- Chen, Y. Isolation and culture of rat and mouse oligodendrocyte precursor cells. Nat Protoc. 2, 1044-1051 (2007).
- Pedraza, C. E. Production, characterization, and efficient transfection of highly pure oligodendrocyte precursor cultures from mouse embryonic neural progenitors. Glia. 56, 1339-1352 (2008).
- Lewin, G. R., Ritter, A. M., Mendell, L. M. On the role of nerve growth factor in the development of myelinated nociceptors. J Neurosci. 12, 1896-1905 (1992).
- Greene, L. A. Quantitative in vitro studies on the nerve growth factor (NGF) requirement of neurons. II. Sensory neurons. Dev Biol. 58, 106-113 (1977).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유