Method Article
Visualización mejorada de metástasis pulmonares en la Resolución sola célula en ratones por Combinada
En este artículo
Resumen
El nuevo protocolo reportados en el presente estudio permite la detección selectiva de metástasis pulmonares en la celda de resolución única en ratones por combinada In situ Perfusión pulmonar y la tinción de fijación y X-Gal de LacZ-Etiquetados células tumorales.
Resumen
La metástasis es la principal causa de muerte en la mayoría de tipos de cáncer y, en consecuencia un enfoque principal en la investigación del cáncer. Sin embargo, la detección de micrometástasis por las imágenes radiológicas y el éxito en su erradicación terapéutico siguen siendo limitados.
Mientras que los modelos animales han demostrado ser herramientas invaluables para la investigación del cáncer 1, el monitoreo / visualización de micrometástasis sigue siendo un reto y evaluación inexacta de la diseminación metastásica en estudios preclínicos potencialmente conduce a resultados decepcionantes en ensayos clínicos 2. Por consiguiente, existe un gran interés en el perfeccionamiento de los métodos para permitir finalmente la detección reproducible y fiable de las metástasis hasta el nivel de células individuales en el tejido normal. El objetivo principal es por lo tanto en las técnicas, que permiten la detección de células tumorales in vivo, como micro-tomografía computarizada (micro-CT), tomografía por emisión de positrones (PET), bioluminiscencia o imágenes de fluorescencia <sup> 3,4. Actualmente estamos optimizando estas técnicas para monitorización in vivo de crecimiento de tumores primarios y metástasis en modelos diferentes de osteosarcoma. Algunas de estas técnicas también se pueden utilizar para el análisis ex vivo de metástasis a los métodos clásicos como qPCR 5, 6 FACS o diferentes tipos de tinción histológica. Como punto de referencia, se han establecido en el presente estudio de la transfección o transducción estable de células tumorales con el gen lacZ que codifica la enzima bacteriana β-galactosidasa que metaboliza el sustrato cromogénico 5-bromo-4-cloro-3-indolil-beta-D -galactopiranósido (X-Gal) con un tinte de índigo azul insoluble 7 y permite altamente sensible y selectiva tinción histoquímica azul de las células tumorales in vivo ex ratón tejido hasta el nivel de célula única, como se muestra aquí. Se trata de una herramienta de bajo costo y no al equipo de obra, que permite la validación precisa de metástasis en 8 estudios que evalúan un nuevoterapias ticancer 9-11. Un factor limitante de X-gal tinción es el bajo contraste con, por ejemplo relacionados con la sangre, así tinción roja de los tejidos vascularizados. En tejido pulmonar este problema puede ser resuelto por perfusión pulmonar in-situ, una técnica que se ha establecido recientemente por Borsig et al. 12 que perfundieron los pulmones de los ratones bajo anestesia para borrar de la sangre y para fijar e incrustarlos en-situ, en virtud inflación a través de la tráquea. Este método evita también el colapso del pulmón y por lo tanto mantiene la morfología funcional de los alvéolos pulmonares, lo que mejora la calidad del tejido para el análisis histológico. En el presente estudio, se describe un nuevo protocolo, que se aprovecha de una combinación de X-gal tinción de lacZ células tumorales que expresan e in-situ la perfusión y la fijación del tejido pulmonar. Este protocolo permite refinado de alta sensibilidad de detección de células metastásicas individuales en el pulmón y nos ha permitido, en un estudio reciente para detect "latentes" micrometástasis pulmonares en un modelo de ratón 13, que se describió originalmente para ser no metastásico 14.
Protocolo
1. In-situ de perfusión pulmonar y fijación
- Anestesiar a ratones por inyección ip de ~ 150 l de solución salina tamponada con fosfato (PBS) que contenía 112,5 mg / kg (peso corporal) de ketamina, xilazina 16,5 mg / kg, y 15 mg / kg de acepromazina (o por otro que contiene anestesia asesinos apropiadas dolor).
- Cuando los reflejos del ratón ya no se observan, fijarlo a la mesa de operaciones de back-abajo y humedecer la piel con un 70% de etanol a la mancha de los pelos hacia abajo.
- Abra la piel del abdomen hasta el cuello y tirar de ella hacia los lados o eliminarlo.
- Abra el peritoneo y el tórax de un tamaño amplio. Prevenir ruptura de los vasos grandes (por ejemplo, la vena yugular) para evitar la reducción de la eficiencia de la perfusión posterior.
- Cortar el caudalis vena cava por debajo del hígado.
- Use una jeringa de 20 ml equipado con un 21G - 24G aguja para inyectar despacio 10-15 ml de PBS en el ventrículo derecho del corazón batiendo hasta que el pulmón es completamente blanco yel corazón deja de latir (asistolia).
- Pellizque de los vasos sanguíneos por encima del hígado y el diafragma con una pinza vascular.
- Usar una jeringa de 10 ml equipado con un 21G - 24G aguja para inyectar ~ 2 ml de 3% de paraformaldehído (PFA) en PBS en el ventrículo derecho.
- Descubre la tráquea fuera del tórax. Usar la misma jeringa para inyectar ~ 3 ml de 3% de PFA en PBS craneal (fuera de tórax) en la tráquea hasta que el pulmón se infla. Inmediatamente después de la retirada de la aguja, pellizcar el caudal tráquea de la punción con una pinza vascular y esperar 10 minutos para permitir la fijación.
- Transecto los vasos sanguíneos por encima de la pinza vascular, quitar la abrazadera y inyectar ~ 2 ml de PBS en el ventrículo derecho a eliminar el exceso de PFA.
- Perforar las partes más bajas de todos los lóbulos pulmonares con una aguja, retirar la abrazadera vascular de la tráquea y se inyectan 3-5 ml de una solución de PolyFreeze medio de inclusión / PBS 1:1 en la tráquea caudal de la primera punción hasta que el PFA en la pulmónlóbulos se sustituye por la solución.
- Eliminar el pulmón cuidadosamente tirando del corazón con un fórceps y por transección ligamentos de tejido conectivo, vasos sanguíneos y la tráquea. Mantener el corazón conectado a los pulmones.
- Dependiendo de la forma de proceder con el análisis del tejido pulmonar continuar con los protocolos descritos en las secciones 2 o 3. Si usted quiere hacer ambos análisis, extraer un lóbulo pulmonar y siga el procedimiento descrito en el punto 3. Procesar los lóbulos restantes conectados al corazón como se describe en 2.
2. Visualización de lacZ-etiquetados células tumorales metastásicas en los lóbulos de pulmón completo
- Coloque el pulmón en un vaso de plástico con tapa de cierre hermético y fijarla con 2% de formaldehído en PBS a temperatura ambiente durante 30-60 min.
- Elimine la solución de fijación y lavar a fondo 3 veces con PBS.
- Añadir al menos 10 ml recién preparada de 5-bromo-4-cloro-3-indolil-β-D-galactósido (X-Gal) solución de tinción (X-Gal solución madre de [40 mg / ml enDimetilformamida] 1:40 diluido en solución de tinción Basic, pH 7,1 (Tabla 1); proteger de la luz).
- Poner un trozo de gasa en la parte superior del pulmón natación para mantenerlo completamente en la solución y colocar la tapa sólo débilmente en el bote para permitir el intercambio de aire.
- Incubar a 37 ° C durante 3-5 h protegida de la luz.
- Retire X-Gal solución, se lava una vez con PBS para eliminar los residuos de X-Gal solución (opcional) y añadir un 4% PFA.
3. Visualización de lacZ-etiquetados células tumorales metastásicas en pulmón criosecciones
- Prefill una incrustación de etiquetado molde a 1/3 con medio sin diluir incrustación PolyFreeze. Ponga el lóbulo pulmonar en la parte superior y se llenan de medio de inclusión hasta el lóbulo está completamente cubierto. Trate de evitar burbujas.
- Incubar los pulmones incrustados a 4 º C durante 20 min.
- Luego congelar los pulmones incrustados lentamente en una mezcla de hielo seco y isopentano y almacenar a -80 ° C.
- Cortar 7-10 micras criosecciones en un criostato y montarlos en portaobjetos de microscopio SuperFrostPlus.
- Incubar las secciones inmediatamente con solución de tinción X-Gal a 37 ° C durante 24 horas en una cámara humidificada.
- Enjuagar los portaobjetos en PBS 2 veces durante 5 min y, a continuación brevemente en agua destilada.
- Contra-tinción con rojo nuclear rápido durante 10-30 segundos, enjuague en agua destilada y montar las diapositivas con Immu-Mount.
4. Los resultados representativos
Asai et al. Publicado en el artículo original en el modelo de Dunn-derivado LM8 ratón OS que los tumores sc primarios derivados de las células parentales Dunn, diferentes de los derivados de la altamente metastásico LM8 línea celular sub, no forman espontáneamente metástasis pulmonares detectables en syngeneic ratones C3H 14. Con las técnicas aquí reportados, se volvió a investigar la formación de metástasis en los modelos de ratón Dunn/LM8 OS. Nos aprovechamos de estable-lacZ transduced Dunn y celular LM8s y de un protocolo de perfusión pulmonar in-situ y fijación en ratones. Imágenes representativas de los pulmones perfundidos y no perfundido-de ratones por vía subcutánea inyectados con lacZ-transducidas y no transducidas de control Dunn y células LM8 se muestra en la figura 1. En los ratones inyectados con células de control Dunn, metástasis macroscópicas y microscópicas se mantuvo indetectable en los pulmones no perfundido y perfundido (Figura 1A, i-iv). Pero, curiosamente, en ratones inyectados con células Dunn-lacZ, X-gal tinción reveló azul micrometastásica focos de células individuales o de pequeños grupos de células (<0,1 mm) en la superficie de la no perfundidos pulmones (Figura 1A, vi). En- perfusión in situ y la fijación de los pulmones mejora aún más la capacidad de detección de micrometástasis Dunn-lacZ (Figura 1A, viii). Sin embargo, a consecuencia macroscópica focos no se observó (Figura 1A, V, VII).
En los ratones inyectados con células de control LM8, translúcido, apenas detectable macrometastatic focos mayor que 0,1 mm de diámetro fueron reconocidas en no perfundidos pulmones (Figura 1B, i). Perfusión del pulmón (Figura 1B, iii) no mejora la detección de los focos. Sin embargo, en ratones inyectados con células LM8-lacZ múltiples X-Gal manchado azul macro-(Figura 1B, v) y micrometástasis (Figura 1B, vi) se detectaron en la superficie de la no perfundidos órganos. Además, la perfusión de los pulmones mejora aún más la detectabilidad de macro-y micro-metástasis (Figura 1B, vii - viii). Por consiguiente, los micro-y macrometástasis se hizo visible a una densidad mayor y un número mayor, principalmente debido a la translucidez del tejido perfundido en el que los focos debajo de la superficie del órgano se convirtió también visible.
Una hora adicionalanálisis istological utilizando criosecciones de tejido pulmonar confirmó la detectabilidad mejorada de metástasis pulmonares en los ratones inyectados con lacZ-transducidas Dunn y células LM8. En los ratones con tumores primarios derivados de Dunn-lacZ o células LM8-lacZ, a diferencia de en los ratones con tumores primarios de las células de control respectivos, micrometástasis o células incluso solo focos fueron reconocidos en secciones de pulmón (Figura 2). Además, macrometástasis eran también más claramente visible en los ratones inyectados con células LM8-lacZ que en los animales inyectados con el control LM8 células (Figura 2C, D).
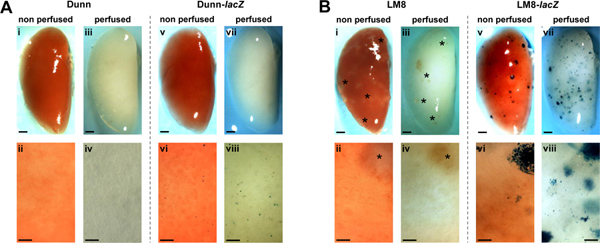
Figura 1. Detección de metástasis espontáneas de no transducidas (i-iv) y lacZ-transducidas (v-viii) Dunn (A) y LM8 (B) en las células no perfundido (i, ii, v, vi) y perfundido (iii, iv, vii, viii) los pulmones en ratones C3H. Metástasis en representante de X-Gal-staINED pulmones enteros (v, vii en A y B) y los respectivos primeros planos (VI, VIII en A y B) aparecen en azul. Macrometastatic focos (> 0,1 mm) en los órganos de ratones inyectados con los no etiquetados LM8 células (i-iv en B) se indican con asteriscos. Las áreas que se muestran en los primeros planos son representativos de los pulmones enteros. Las barras de escala indican 1 mm en las imágenes de todo el pulmón y 0,1 mm en los primeros planos. Haga clic aquí para ampliar la cifra .
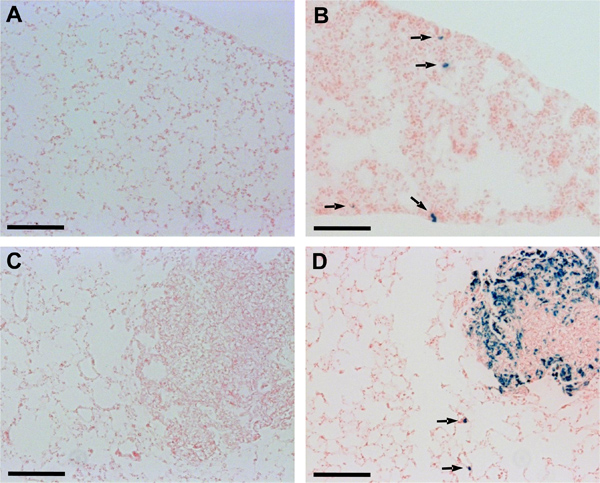
Figura 2. Detección de Dunn y LM8 micrometástasis en criosecciones de pulmón. Las secciones de tejido embebido octubre de pulmón se incubaron en solución de X-Gal tinción a 37 ° C durante 24 horas en una cámara húmeda y luego se contratiñeron con rojo nuclear rápido. Las flechas apuntan a micrometastásica focos reconocida en secciones de pulmón de ratones inyectados con Dunn-lacZ (B) o LM8-lacZ células (D). Micrometastases se mantuvo indetectable en secciones de pulmón de ratones inyectados con no transducidas Dunn (A) o LM8 células (C). Las barras de escala indican 0,1 mm.
Discusión
Los resultados presentados aquí en el modelo de ratón Dunn/LM8 OS demostrar el poder del método recién establecido que combina la tinción X-Gal de lacZ-etiquetados células tumorales con la perfusión in situ / fijación de tejido pulmonar. Esta combinación de las dos técnicas permite la detección de alta sensibilidad de las lesiones micrometastásicas a nivel de células individuales y también mejora la visualización de macrometástasis sobre la superficie del pulmón (Figura 1), así como en secciones de pulmón (Figura 2). Mientras que la tinción con X-Gal permite también la detección de (micro) metástasis en otros órganos, la perfusión in situ / fijación mejora la detectabilidad de los focos metastásicos en otros tejidos de los pulmones sólo ligeramente por el color natural de la sangre y de los tejidos relacionada de estos 13 órganos. Incluso si la perfusión se dirige a otro órgano, por ejemplo, el hígado, la eliminación de la sangre sería sólo parcialmente mejorar la apuesta contrasteween X-Gal tinción y el color natural del órgano. Sin embargo, el método es aplicable a cualquier tipo de lacZ-etiquetados células tumorales, dramáticamente mejorar la detectabilidad de las metástasis de pulmón hasta el nivel de una sola célula latentes micrometástasis y permite una cuantificación sencilla y fiable de macro y micrometástasis. Una limitación de este método y todas las otras técnicas que se basan en los genes indicadores, que incluyen proteínas de luciferasa y fluorescentes, es la estabilidad de la expresión del transgén. Como se muestra en la Figura 2d, no todas las células del tumor dentro de los focos macrometastatic se tiñen de azul, lo que indica una falta de actividad de beta-galactosidasa. Esto podría estar relacionado con la necrosis, pero es más probable debido a la pérdida de la expresión del transgen. Hemos observado que el Dunn y células LM8 son muy eficaces en la regulación a la baja de lacZ y otros transgenes, incluso bajo selección continua para la expresión. Por lo tanto, conmutada en estudios recientes para el murino K12y K7M2 y los HOS humanos 143B, y SAOS-2 líneas celulares de osteosarcoma, todos los cuales mantienen estable la expresión de lacZ in vitro así como in vivo hasta el 100% en el tiempo.
Una vez estable-lacZ expresión está garantizada, esta técnica se puede aplicar en estudios con manipuladas gen de las células tumorales, por ejemplo, para investigar mecánicamente el proceso de colonización del tejido 13, así como para el desarrollo y la prueba de nuevas terapias destinadas a la erradicación de las lesiones metastásicas 15 , 16. Además, puede servir como punto de referencia para la mejora de las actuales técnicas de imagen radiológicas, como el PET, CT (micro) y la resonancia magnética, que se utiliza para la detección precoz de las lesiones metastásicas. En un estudio reciente de PET (sin publicar) con diferentes trazadores se verificó en el pulmón in vivo detectó metástasis in vivo posteriormente ex con el protocolo descrito. En un estudio en curso con un nuevo animal pequeño micro-CT (SkyScan) estamos tan lejos abLe para detectar metástasis pulmonares in vivo a un tamaño de 0,5 mm y ex vivo a 0,3 mm, pero apuntamos a una resolución de 0,1 mm. Curiosamente, este es el límite de tamaño que establecerse para distinguir los macro-de micrometástasis con el método combinado de perfusión in situ y tinción con X-Gal. Esto subraya de nuevo la sensibilidad y la utilidad de esta técnica fácil y rentable.
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Los autores desean agradecer al Dr. Lubor Borsig (Instituto de Fisiología de la Universidad de Zurich) por sus consejos sobre la técnica de perfusión pulmonar. Este trabajo fue apoyado por becas de la Krebsliga del Cantón de Zurich, el L. Walter y Johanna Wolf Foundation, Zurich, la Fundación Lydia Hochstrasser, Zurich, la Swiss National Science Foundation, SNF, Suiza, el Balgrist Schweizerischer Verein, y la Universidad de Zurich.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | Comentarios |
| Narketan10 (ketamina) | Vétoquinol AG | 100 mg / ml de solución | |
| Xylazin (xilazina) | Streuli Pharma AG | 20 mg / ml de solución | |
| Prequilan (acepromacina) | Fatro SpA | 10 mg / ml de solución | |
| Bulldog Tipo Serrefine clamp vascular | Herramientas Artes Ciencias | 18051-35 | mm curvada, 35 |
| Taza de plástico con tapa | Semadeni | 2988 | 25 tazas ml con tapa |
| 5-Bromo-4-cloro-3-indolil-β-D-galactósido (X-gal); polvo | Axxora | ALX-582-002-G005 | se disuelven en N, N-di-metilformamida a 40 mg / ml, tienda protegido de la luz a -20 º C |
| Solución de tinción de base, se equilibró a pH 7,1, almacenado protegido de la luz a 4 º C durante max. 1 mes | hecho a sí mismo | 100 ml / l 10xPBS, 1,64 g / L K3Fe (CN) 6, 2,1 g / L K4Fe (CN) 6, 2 ml / L MgCl2 1 M, 2 ml / L 10% NP40, 1 ml / L 10% Sodio-desoxicolato | |
| PolyFreeze medio de inclusión | Polysciences; suizo distribuidor: Brunschwig | 19636-1 | |
| Incrustación de molde | Polysciences | 18646A-1 | |
| Criostato Leica CM1850 | Leica Microsystems | ||
| SuperFrost diapositivas | Menzel | J1800AMNZ | |
| Nuclear-Fast Red - solución de sulfato de aluminio | División Chroma Waldeck GmbH & Co KG distributor: Medite | 84-0241-00 | |
| Immu-Mount | Thermo Electron, distribuidor suizo: Histocom | 9990412 |
Tabla 1. Reactivos y Equipos.
Referencias
- Frese, K. K., Tuveson, D. A. Maximizing mouse cancer models. Nature. 7, 645-658 (2007).
- Coussens, L. M., Fingleton, B., Matrisian, L. M. Matrix metalloproteinase inhibitors and cancer: trials and tribulations. Science (New York, N.Y.). 295, 2387-2392 (2002).
- Fass, L. Imaging and cancer: a review. Mol Oncol. 2, 115-152 (2008).
- Puaux, A. L. A comparison of imaging techniques to monitor tumor growth and cancer progression in living animals. Int. J. Mol. Imaging. 2011, 321538 (2011).
- Malek, A., Catapano, C. V., Czubayko, F., Aigner, A. A sensitive polymerase chain reaction-based method for detection and quantification of metastasis in human xenograft mouse models. Clinical & experimental metastasis. 27, 261-271 (2010).
- Schmidt, C. M. Characterization of spontaneous metastasis in an aggressive breast carcinoma model using flow cytometry. Clinical & experimental metastasis. 17, 537-544 (1999).
- Horwitz, J. P. Substrates for Cytochemical Demonstration of Enzyme Activity. I. Some Substituted 3-Indolyl-Beta-D-Glycopyranosides. J. Med. Chem. 7, 574-575 (1964).
- Kruger, A., Schirrmacher, V., Khokha, R. The bacterial lacZ gene: an important tool for metastasis research and evaluation of new cancer therapies. Cancer metastasis reviews. 17, 285-294 (1998).
- Arlt, M. Increase in gelatinase-specificity of matrix metalloproteinase inhibitors correlates with antimetastatic efficacy in a T-cell lymphoma model. Cancer research. 62, 5543-5550 (2002).
- Arlt, M. J. Efficient inhibition of intra-peritoneal tumor growth and dissemination of human ovarian carcinoma cells in nude mice by anti-L1-cell adhesion molecule monoclonal antibody treatment. Cancer research. 66, 936-943 (2006).
- Banke, I. J. Effective inhibition of experimental metastasis and prolongation of survival in mice by a potent factor Xa-specific synthetic serine protease inhibitor with weak anticoagulant activity. Thrombosis and haemostasis. 94, 1084-1093 (2005).
- Borsig, L. Heparin and cancer revisited: mechanistic connections involving platelets, P-selectin, carcinoma mucins, and tumor metastasis. Proceedings of the National Academy of Sciences of the United States of America. 98, 3352-3357 (2001).
- Arlt, M. J. LacZ transgene expression in the subcutaneous Dunn/LM8 osteosarcoma mouse model allows for the identification of micrometastasis. J. Orthop. Res. 29, 938-946 (2011).
- Asai, T. Establishment and characterization of a murine osteosarcoma cell line (LM8) with high metastatic potential to the lung. International journal of cancer. 76, 418-422 (1998).
- Arlt, M. J. The antineoplastic antibiotic taurolidine promotes lung and liver metastasis in two syngeneic osteosarcoma mouse models and exhibits severe liver toxicity. International journal of cancer. , (2011).
- Steinmann, P. Antimetastatic activity of honokiol in osteosarcoma. Cancer. , (2011).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados