Method Article
Una migliore visualizzazione delle metastasi polmonari a risoluzione singola cella in Mouse di combinata
In questo articolo
Riepilogo
Il nuovo protocollo riportato nel presente studio permette la rilevazione selettiva delle metastasi polmonari con una risoluzione singola cellula nei topi combinata In-situ Perfusione polmonare e la fissazione e colorazione X-Gal di LacZ-Tagged cellule tumorali.
Abstract
Metastasi è la principale causa di morte nella maggior parte dei tipi di cancro e di conseguenza un obiettivo principale nella ricerca sul cancro. Tuttavia, il rilevamento di micrometastasi di immagini radiologica e il successo nella loro eradicazione terapeutico rimangono limitate.
Mentre modelli animali hanno dimostrato di essere strumenti preziosi per la ricerca sul cancro 1, il controllo / visualizzazione di micrometastasi rimane una sfida e una valutazione imprecisa di diffusione metastatica in studi preclinici porta potenzialmente a risultati deludenti negli studi clinici 2. Di conseguenza, vi è un grande interesse per affinare i metodi per consentire finalmente rilevamento riproducibile e affidabile di metastasi al livello di singola cellula nel tessuto normale. L'obiettivo principale è quindi sulle tecniche, che consentono l'individuazione delle cellule tumorali in vivo, come la micro-tomografia computerizzata (micro-CT), la tomografia ad emissione di positroni (PET), bioluminescenza o imaging di fluorescenza <sup> 3,4. Attualmente stiamo ottimizzando queste tecniche per il monitoraggio in vivo della crescita tumorale primario e metastasi in modelli diversi osteosarcoma. Alcune di queste tecniche può essere utilizzato anche per l'analisi ex vivo di metastasi accanto metodi classici come qPCR 5, 6 o FACS diversi tipi di colorazione istologica. Come valore di riferimento, abbiamo stabilito nel presente studio la trasfezione stabile o trasduzione di cellule tumorali con il gene lacZ codifica l'enzima batterico β-galattosidasi che metabolizza il substrato cromogeno 5-bromo-4-cloro-3-indolil-beta-D -galattopiranoside (X-Gal) in un colorante blu insolubile indaco 7 e permette altamente sensibile e selettivo colorazione istochimica blu di cellule tumorali in vivo ex tessuti mouse per livello di singola cellula, come qui mostrato. Questo è uno strumento a basso costo e non attrezzature ad alta intensità, che consente la validazione precisa di metastasi 8 in studi di valutazione di un nuovoterapie ticancer 9-11. Un fattore limitante di X-gal colorazione è il basso contrasto, ad esempio, consanguinei colorazione rosso di ben tessuti vascolarizzati. In tessuto polmonare questo problema può essere risolto in situ perfusione polmonare, una tecnica che è stata recentemente istituita dal Borsig et al. Perfusi 12 anni che i polmoni di topi in anestesia per eliminarli dal sangue e per fissare e incorporarli in situ sotto inflazione attraverso la trachea. Questo metodo impedisce anche il collasso del polmone e mantiene quindi la morfologia funzionale alveoli polmonari, che migliora la qualità del tessuto per l'analisi istologica. Nel presente studio, si descrive un nuovo protocollo, che sfrutta una combinazione di X-gal colorazione lacZ cellule tumorali che esprimono e in-situ perfusione e fissazione del tessuto polmonare. Questo protocollo permette raffinato alta sensibilità di rilevazione di singole cellule metastatiche nel polmone e permesso in un recente studio di detect "dormienti" micrometastasi polmonari in un modello murino 13, che è stato originariamente descritto di essere non-metastatico 14.
Protocollo
1. In-situ perfusione polmonare e fissaggio
- Anestetizzare topi mediante iniezione ip di ~ 150 microlitri soluzione salina tamponata con fosfato (PBS) contenente 112,5 mg / kg (di peso corporeo) ketamina, 16,5 mg / kg xilazina, e 15 mg / kg acepromazina (o da un altro anestesia contenente antidolorifici adeguati).
- Quando riflessi del mouse non sono più rispettate, fissarlo sul tavolo operatorio indietro verso il basso e bagnare il pelo con il 70% di etanolo lisci i capelli giù.
- Aprire la pelle dall'addome fino al collo e tirare ai lati o rimuoverlo.
- Aprire il peritoneo e il torace ad una dimensione ampia. Evitare rotture di vasi grandi (ad esempio il jugularis vena) per evitare una perdita di efficienza perfusione successivo.
- Tagliare il caudalis vena cava sotto il fegato.
- Utilizzare una siringa da 20 ml dotato di un 21G - ago 24G per iniettare lentamente 10-15 ml PBS nel ventricolo destro del cuore battere fino al polmone è completamente bianco eil cuore smette di battere (asistolia).
- Afferrare i vasi sanguigni di cui sopra il fegato e il diaframma con una pinza vascolare.
- Utilizzare una siringa da 10 ml dotato di un 21G - ago 24G per iniettare ~ 2 ml del 3% paraformaldeide (PFA) in PBS nel ventricolo destro.
- Scoprire la trachea all'esterno del torace. Utilizzare la stessa siringa per iniettare ~ 3 ml del 3% in PBS PFA craniale (fuori del torace) nella trachea fino ai polmoni è gonfiato. Immediatamente dopo la rimozione dell'ago, pizzichi via caudale trachea della puntura con una pinza vascolare e attendere per 10 minuti per consentire fissaggio.
- Transect i vasi sanguigni di sopra della pinza vascolare, rimuovere la fascetta e iniettare ~ 2 ml PBS nel ventricolo destro per rimuovere l'eccesso PFA.
- Forare le parti inferiori di tutti i lobi polmonari con un ago, rimuovere la pinza vascolare alla trachea e iniettare 3-5 ml di una soluzione di PolyFreeze incorporamento medio / PBS 01:01 nella trachea caudale della puntura prima fino alla PFA nella polmonelobi è sostituita dalla soluzione.
- Rimuovere il polmone tirandola il cuore con una pinza e da sezionare legamenti del tessuto connettivo, vasi sanguigni e la trachea. Mantenere il cuore collegato ai polmoni.
- A seconda di come procedere con l'analisi del tessuto polmonare continuare con i protocolli descritti nelle sezioni 2 o 3. Se si vuole fare entrambe le analisi, rimuovere un lobo polmonare e procedere come descritto al punto 3. Trattare i lobi rimanenti collegati al cuore, come descritto al punto 2.
2. Visualizzazione di lacZ-etichetta cellule metastatiche del tumore in lobi polmonari Intere
- Posizionare il polmone in una tazza di plastica con coperchio di chiusura a tenuta e fissarla con 2% di formaldeide in PBS a temperatura ambiente per 30-60 min.
- Rimuovere la soluzione di fissaggio e lavare accuratamente 3 volte con PBS.
- Aggiungere almeno 10 ml preparata 5-Bromo-4-cloro-3-indolil-β-D-galattoside (X-Gal) soluzione colorante (X-Gal soluzione stock [40 mg / ml inDimetilformammide] 01:40 diluito in soluzione di base di colorazione, pH 7.1 (Tabella 1), al riparo dalla luce).
- Mettere un pezzo di garza in cima al polmone nuoto di mantenere completamente nella soluzione e posizionare il coperchio solo vagamente sulla pentola per consentire lo scambio di aria.
- Incubare a 37 ° C per 3-5 ore al riparo dalla luce.
- Rimuovere X-Gal soluzione, lavare una volta con PBS per rimuovere i residui di X-Gal soluzione (opzionale) e aggiungere 4% PFA.
3. Visualizzazione di lacZ-etichetta cellule metastatiche del tumore nel polmone criosezioni
- Prefill uno stampo incorporamento etichettati per 1/3 con media non diluito inclusione PolyFreeze. Mettere il lobo polmonare in alto e riempire con l'incorporamento medio fino a che il lobo è completamente coperto. Cercate di evitare le bolle.
- Incubare i polmoni incorporati a 4 ° C per 20 min.
- Poi congelare i polmoni incorporati lentamente in una miscela di ghiaccio secco e isopentano e conservare a -80 ° C.
- Tagliare 7-10 micron criosezioni su un criostato e montarle su vetrini da microscopio SuperFrostPlus.
- Incubare le sezioni immediatamente con X-Gal soluzione di colorazione a 37 ° C per 24 ore in una camera umidificata.
- Sciacquare i vetrini in PBS 2 volte per 5 min e poi brevemente in acqua distillata.
- Counter-macchia con rosso nucleare veloce per 10-30 sec, sciacquare in acqua distillata e montare i vetrini con Immu-Mount.
4. Risultati rappresentativi
Asai et al. Riportato nell'articolo originale sul Dunn-derivato topo modello LM8 OS che i tumori sc primarie derivate dalle cellule parentali Dunn, diversi da quelli derivati dal altamente metastatico LM8 linea cellulare sub, non formano spontaneamente metastasi polmonari rilevabili in singenici topi C3H 14. Con le tecniche qui riportate, abbiamo inchiesta la formazione di metastasi in modelli murini Dunn/LM8 OS. Abbiamo approfittato di stabile lacZ-trasdotte Dunn e LM8 cellulares e di un protocollo di in-situ perfusione polmonare e fissaggio in topi. Immagini rappresentative di polmoni perfusi e non perfuso di topi iniettati sottocute con lacZ-trasdotte e non trasdotte controllo Dunn e LM8 cellule sono mostrati in Figura 1. Nei topi iniettati con cellule di controllo Dunn, metastasi macroscopiche e microscopiche rimasta non rilevabile nei polmoni non perfusi e perfuso (Figura 1A, I-IV). Ma, interessante, in topi iniettati con cellule Dunn-lacZ, X-gal colorazione blu rivelato micrometastatica foci di cellule singole o piccoli ammassi cellulari (<0,1 mm) sulla superficie del non-perfusi polmoni (Figura 1A, vi). In- perfusione situ e la fissazione dei polmoni ulteriormente migliorato la rilevabilità di Dunn-lacZ micrometastasi (Figura 1A, viii). Tuttavia, per conseguenza macroscopica foci non è stato osservato (Figura 1A, V, VII).
Nei topi iniettati con cellule di controllo LM8, traslucidi, appena rilevabile macrometastatic focolai più grandi di 0,1 mm di diametro sono stati rilevati a non perfusi polmoni (Figura 1B, i). Perfusione del polmone (Figura 1B, iii) non ha migliorato la rilevazione dei fuochi. Tuttavia, in topi iniettati con LM8-lacZ celle multiple X-Gal macchiato macro-blu (Figura 1B, v) e micrometastasi (Figura 1B, vi) sono stati rilevati sulla superficie del non-perfusi organi. Inoltre, la perfusione dei polmoni ulteriormente migliorato l'individuazione delle macro e micrometastasi (Figura 1B, vii - viii). Di conseguenza, micro e macrometastasi divenne visibile una densità maggiore e un numero maggiore, principalmente a causa della traslucenza del tessuto perfuso in cui foci sotto la superficie dell'organo divenne anche visibile.
Un ulteriore hanalisi utilizzando criosezioni istologico di tessuto polmonare confermato la rilevabilità miglioramento delle metastasi polmonari nei topi iniettati con lacZ-trasdotte Dunn e LM8 cellule. Nei topi con tumori primari derivati da Dunn-lacZ o LM8-lacZ cellule, a differenza di topi con tumori primari delle cellule di controllo, rispettivi micrometastasi o addirittura singola cella foci erano riconosciuti in sezioni polmonari (Figura 2). Inoltre, macrometastasi erano anche più chiaramente visibile in topi iniettati con LM8-lacZ cellule che negli animali iniettati con il controllo LM8 cellule (Figura 2C, D).
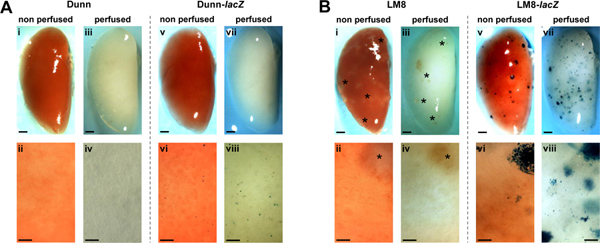
Figura 1. Rilevamento di metastasi spontanee di non trasdotte (I-IV) e lacZ-trasdotte (v-viii) Dunn (A) e LM8 (B) in cellule non-perfuso (I, II, V, VI) e perfuso (III, IV, VII, VIII) polmoni nei topi C3H. Metastasi a rappresentante X-Gal-staINED polmoni interi (V, VII in A e B) e rispettivi primi piani (VI, VIII in A e B) appaiono blu. Macrometastatic foci (> 0,1 mm) negli organi dei topi iniettati con i tag LM8 cellule (i-iv in B) sono indicati da un asterisco. Le aree indicate nei primi piani sono rappresentativi per i polmoni interi. Barre di scala indicano 1 mm di immagini di polmoni interi e 0,1 mm di primi piani. Clicca qui per ingrandire la figura .
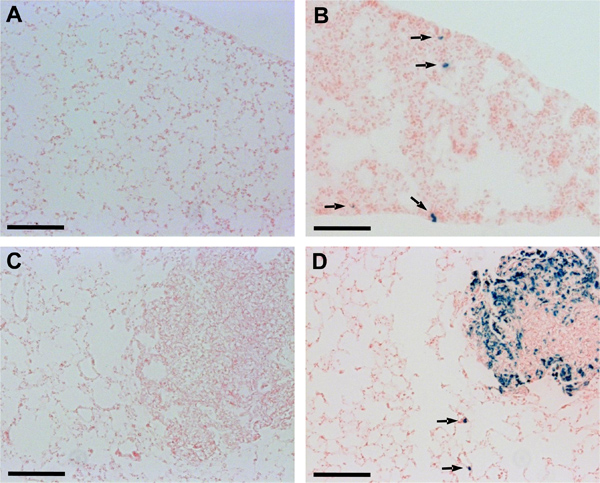
Figura 2. Rilevamento di Dunn e LM8 micrometastasi in criosezioni polmonari. Sezioni di tessuto polmonare ottobre incorporato state incubate in X-Gal soluzione di colorazione a 37 ° C per 24 ore in una camera umidificata e poi colorate con rosso nucleare fast. Frecce indicano micrometastatica foci riconosciuto in sezioni polmonari di topi iniettati con Dunn-lacZ (B) o LM8-lacZ cellule (D). Micrometastases rimasta non rilevabile in sezioni polmonari di topi iniettati con non trasdotte Dunn (A) o LM8 cellule (C). Barre di scala indicano 0,1 mm.
Discussione
I risultati qui presentati nel modello di topo Dunn/LM8 OS dimostrare la potenza del metodo appena stabilito che combina l'X-Gal colorazione lacZ-etichetta cellule tumorali con l'in-situ perfusione / fissaggio del tessuto polmonare. Questa combinazione delle due tecniche permette la rilevazione elevata sensibilità di lesioni micrometastatica fino a livello di singola cellula e migliora anche la visualizzazione macrometastasi sulla superficie polmonare (Figura 1) e in sezioni polmonari (Figura 2). Mentre l'X-Gal colorazione permette inoltre la rilevazione di (micro) metastasi in altri organi, in-situ perfusione / fissazione migliora la rilevabilità di foci metastatici in tessuti diversi dal polmone solo leggermente a causa del colore naturale sangue e tessuti correlati di questi organi 13. Anche se la perfusione è diretta ad un altro organo, ad esempio il fegato, la rimozione del sangue potrebbe migliorare solo parzialmente dal contrastoween X-Gal colorazione e il colore naturale dell'organo. Tuttavia, il metodo è applicabile a qualsiasi tipo di etichetta lacZ-cellule tumorali, migliorare notevolmente la rilevabilità di metastasi polmonari fino al livello di dormienti monocellulari micrometastasi e consente una quantificazione semplice e affidabile di macro e micrometastasi. Un limite di questo metodo e tutte le altre tecniche che si basano su geni reporter luciferasi, comprese le proteine fluorescenti, e la stabilità del transgene. Come mostrato in figura 2d, non tutte le cellule tumorali all'interno foci macrometastatic sono di colore blu, che indica una mancanza di beta-galattosidasi. Questo potrebbe essere correlato a necrosi, ma è più probabilmente dovuta ad una perdita di espressione del transgene. Abbiamo osservato che il Dunn e LM8 cellule sono molto efficaci nel down-regulation di lacZ e transgeni altri anche in continua selezione per l'espressione. Abbiamo quindi commutata in studi recenti per l'murine K12e K7M2 e gli umani HOS, 143B e SaOS-2 linee cellulari di osteosarcoma, tutte mantenute stabili lacZ espressione in vitro e in vivo fino al 100% nel tempo.
Una volta stabile lacZ-espressione è garantita, questa tecnica può essere applicata in studi con gene-manipolati cellule tumorali, per esempio per investigare meccanicamente il processo di colonizzazione tessuto 13 e per lo sviluppo e la sperimentazione di nuove terapie obiettivo di eradicazione delle lesioni metastatiche 15 , 16. Inoltre, può servire come punto di riferimento per il miglioramento delle attuali tecniche di imaging radiologici, come la PET, (micro) TC e RM, utilizzati per la diagnosi precoce delle lesioni metastatiche. In uno studio PET recente (inedito) con traccianti diversi abbiamo verificato in vivo polmone rilevato metastasi ex vivo successivamente con il protocollo descritto. In uno studio in corso con un nuovo animale piccolo micro-CT (SkyScan) siamo così lontani abper rilevare le metastasi polmonari in vivo fino ad una dimensione di 0,5 mm ed ex vivo fino a 0,3 mm, ma relative ad una risoluzione di 0,1 mm. Curiosamente, questo è il limite che abbiamo impostato per distinguere macro-di micrometastasi con il metodo combinato di perfusione in situ e X-Gal colorazione. Questo sottolinea ancora una volta la sensibilità e l'utilità di questa tecnica semplice e conveniente.
Divulgazioni
Nessun conflitto di interessi dichiarati.
Riconoscimenti
Gli autori desiderano ringraziare il Dr. Lubor Borsig (Istituto di Fisiologia, Università di Zurigo) per i suoi consigli sulla tecnica della perfusione polmonare. Questo lavoro è stato sostenuto dalle concessioni dal Krebsliga del Cantone di Zurigo, la L. Walter e Johanna Wolf Foundation, Zurigo, il Lydia Hochstrasser Foundation, Zurigo, il Fondo nazionale svizzero, SNF, Svizzera, Schweizerischer Verein Balgrist, e l'Università di Zurigo.
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reagente | Azienda | Numero di catalogo | Commenti |
| Narketan10 (ketamina) | Vétoquinol AG | 100 mg / ml soluzione | |
| Xylazin (xilazina) | Streuli Pharma AG | 20 mg / ml soluzione | |
| Prequilan (acepromazina) | Fatro SpA | 10 mg / ml soluzione | |
| Bulldog Tipo Serrefine pinza vascolare | Strumenti Scienza Belle | 18051-35 | curvo, mm 35 |
| Tazza di plastica con coperchio | Semadeni | 2988 | 25 tazze ml con coperchio |
| 5-Bromo-4-cloro-3-indolil-β-D-galattoside (X-Gal); polvere | Axxora | ALX-582-002-G005 | sciogliere in N, N-di-metilformammide a 40 mg / ml, negozio protetto dalla luce a -20 ° C |
| Colorazione soluzione basica, equilibrata a pH 7,1, memorizzato protetto dalla luce a 4 ° C per max. 1 mese | fatto da sé | 100 ml / L 10xPBS, 1,64 g / L K3Fe (CN) 6, 2,1 g / L K4Fe (CN) 6, 2 ml / L 1M MgCl2, 2 ml / L 10% NP40, 1 ml / L 10% di sodio desossicolato- | |
| PolyFreeze Embedding Media | Polysciences; Distributore svizzero: Brunschwig | 19636-1 | |
| Incorporamento stampo | Polysciences | 18646A-1 | |
| Leica CM1850 criostato | Leica Microsystems | ||
| SuperFrost diapositive | Menzel | J1800AMNZ | |
| Nucleare-Fast Red - soluzione di solfato di alluminio | Divisione Chroma Waldeck GmbH & Co KG distributor: Medite | 84-0241-00 | |
| Immu-Mount | Thermo Electron, distributore svizzero: Histocom | 9990412 |
Tabella 1. Reagenti e materiale.
Riferimenti
- Frese, K. K., Tuveson, D. A. Maximizing mouse cancer models. Nature. 7, 645-658 (2007).
- Coussens, L. M., Fingleton, B., Matrisian, L. M. Matrix metalloproteinase inhibitors and cancer: trials and tribulations. Science (New York, N.Y.). 295, 2387-2392 (2002).
- Fass, L. Imaging and cancer: a review. Mol Oncol. 2, 115-152 (2008).
- Puaux, A. L. A comparison of imaging techniques to monitor tumor growth and cancer progression in living animals. Int. J. Mol. Imaging. 2011, 321538 (2011).
- Malek, A., Catapano, C. V., Czubayko, F., Aigner, A. A sensitive polymerase chain reaction-based method for detection and quantification of metastasis in human xenograft mouse models. Clinical & experimental metastasis. 27, 261-271 (2010).
- Schmidt, C. M. Characterization of spontaneous metastasis in an aggressive breast carcinoma model using flow cytometry. Clinical & experimental metastasis. 17, 537-544 (1999).
- Horwitz, J. P. Substrates for Cytochemical Demonstration of Enzyme Activity. I. Some Substituted 3-Indolyl-Beta-D-Glycopyranosides. J. Med. Chem. 7, 574-575 (1964).
- Kruger, A., Schirrmacher, V., Khokha, R. The bacterial lacZ gene: an important tool for metastasis research and evaluation of new cancer therapies. Cancer metastasis reviews. 17, 285-294 (1998).
- Arlt, M. Increase in gelatinase-specificity of matrix metalloproteinase inhibitors correlates with antimetastatic efficacy in a T-cell lymphoma model. Cancer research. 62, 5543-5550 (2002).
- Arlt, M. J. Efficient inhibition of intra-peritoneal tumor growth and dissemination of human ovarian carcinoma cells in nude mice by anti-L1-cell adhesion molecule monoclonal antibody treatment. Cancer research. 66, 936-943 (2006).
- Banke, I. J. Effective inhibition of experimental metastasis and prolongation of survival in mice by a potent factor Xa-specific synthetic serine protease inhibitor with weak anticoagulant activity. Thrombosis and haemostasis. 94, 1084-1093 (2005).
- Borsig, L. Heparin and cancer revisited: mechanistic connections involving platelets, P-selectin, carcinoma mucins, and tumor metastasis. Proceedings of the National Academy of Sciences of the United States of America. 98, 3352-3357 (2001).
- Arlt, M. J. LacZ transgene expression in the subcutaneous Dunn/LM8 osteosarcoma mouse model allows for the identification of micrometastasis. J. Orthop. Res. 29, 938-946 (2011).
- Asai, T. Establishment and characterization of a murine osteosarcoma cell line (LM8) with high metastatic potential to the lung. International journal of cancer. 76, 418-422 (1998).
- Arlt, M. J. The antineoplastic antibiotic taurolidine promotes lung and liver metastasis in two syngeneic osteosarcoma mouse models and exhibits severe liver toxicity. International journal of cancer. , (2011).
- Steinmann, P. Antimetastatic activity of honokiol in osteosarcoma. Cancer. , (2011).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon