Method Article
組み合わせによるマウスのシングルセル解像度で肺転移の可視化の向上
要約
本研究で報告された新たなプロトコルが組み合わせによるマウスの単一細胞の解像度で肺転移の選択的検出を可能にのin-situ肺血流との固定とX-Gal染色 lacZをタグ付きの腫瘍細胞。
要約
転移は、がんの種類やがん研究の結果として、主な焦点の大半の死亡の主な原因である。しかし、放射線イメージングおよびそれらの治療根絶の成功により、微小転移の検出が制限されたままです。
動物モデルでは、がん研究のための貴重なツールが1であることが証明されているが、微小転移のモニタリング/可視化は、潜在的に臨床試験2で残念な結果につながる前臨床試験で転移拡散の挑戦と不正確な評価のままです。その結果、最終的にダウンして正常組織における単一細胞レベルへの転移の再現性と信頼性の高い検出を可能にするための方法を洗練することに大きな関心がある。主な焦点は、したがって、マイクロコンピューター断層撮影(マイクロCT)、陽電子放射断層撮影(PET)、生物発光や蛍光イメージングのようなin vivoでの腫瘍細胞の検出を可能にする技術は、オンになっている<> 3,4(商標)。我々は現在、別の骨肉腫モデルにおける原発腫瘍の増殖や転移の in vivoモニタリングのために、これらの技術を最適化している。これらの技術のいくつかは、定量PCR 5、6、FACSまたは組織学的染色の異なるタイプのような古典的な方法の横に転移の ex vivo での解析に使用することができます。ベンチマークとして、我々は発色基質5 -ブロモ-4 -クロロ-3 -インドリル-β-Dを代謝する細菌酵素β-ガラクトシダーゼをコードするlacZ遺伝子と本研究では、腫瘍細胞の安定なトランスフェクションまたは形質導入を確立している不溶性の藍色染料7〜-ガラクトピラノシド(X-Gal)を、ここに示すように、単一細胞レベルにマウス組織を ex vivoでの腫瘍細胞の高感度かつ選択的な組織化学ブルー染色をダウンできます。これは、新規性を評価する研究で転移8の正確な検証を可能にする機器を集中的に低コストではないツールですticancer療法9-11。 X-gal染色の制限要因はよく血管化組織の血液関連赤い染色をEGに低いコントラストである。肺組織では、この問題はその場での肺血流、最近ベルジッヒら 12血液からそれらをクリアすると下にその場でこれを修正して埋め込 むことが麻酔下のマウスの肺を灌流することによって確立された手法によって解決することができます気管を通じてインフレ。この方法はまた、肺の崩壊を防ぎ、それによって組織学的分析のために組織の品質を向上させる機能的な肺胞の形態を維持しています。そこで、本研究では 、lacZ 発現腫瘍細胞と肺組織のin-situ灌流および固定のX-gal染色の組み合わせを活用して新しいプロトコルを記述します。この洗練されたプロトコルは、肺内の単一の転移細胞の高感度検出を可能にし、A〜Dの最近の研究で私たちを有効にもともと14非転移性であることが記載されたマウスモデル13に"休止状態"肺の微小転移をetect。
プロトコル
1 のIn-situ肺血および固定
- 112.5 mg / kgの(体重)ケタミン、16.5 mg / kgのキシラジン、および15 mg / kgのアセプロマジン(または適切な鎮痛剤を含む他の麻酔による)を含む緩衝化生理食塩水(PBS)〜150μlのリン酸塩の腹腔内注射によりマウスを麻酔。
- マウスの反射神経は、もはや観察されていない場合、バックダウン手術台の上にそれを修正し、なでつける毛に70%エタノールで毛皮を濡らす。
- 首に腹部から皮膚を開き、両側に引っ張ったり、それを削除します。
- 腹膜と十分な大きさに胸を開きます。その後の灌流の効率低下を避けるために大きな血管(静脈の脈など )の破裂を防ぐ。
- 肝臓の下に下大静脈尾側をカットします。
- 肺は完全に白であるとまでは鼓動する心臓の右心室にゆっくりと10〜15ミリリットルのPBSを注入するために24G針 - 21Gを搭載した20ミリリットルの注射器を使用し心臓が(心静止)暴行を停止します。
- 血管クランプで肝臓と横隔膜上の血管をピンチオフ。
- 右心室にPBS中の3%パラホルムアルデヒド〜2ミリリットル(PFA)を注入する注射針24G - 21Gを搭載した10 mlの注射器を使用しています。
- 胸郭の外気管を発見。肺が膨張するまで気管に頭蓋のPBS中の3%PFA(胸郭の外側)の約3ミリリットルを注入するために、同じ注射器を使用しています。直ちに針を除去した後、血管クランプで穿刺の気管尾をピンチオフと固定を可能にするために10分間待ちます。
- 血管クランプ上記血管を横断し、クランプを取り外し、過剰PFAを削除するには右心室に〜2mlのPBSを注入します。
- 穿刺針を持つすべての肺葉の下の部分は、気管に血管クランプを取り外して、中のPFAまで初回穿刺の気管尾に培地/ PBSで1:1を埋め込むPolyFreezeのソリューションの3〜5 mlを注入する肺ローブは、ソリューションに置き換えられます。
- 鉗子で心を引いて、結合組織の靭帯、血管や気管をtransectingによって注意深く肺を取り外します。肺に接続されている心を保つ。
- 肺組織分析の進め方に応じてセクション2または3に概説プロトコルに進みます。あなたは両方の分析を行いたい場合は、1つの肺葉を削除して、3で説明したように進みます。 2で説明したように心臓に接続、残りの葉を処理します。
2。全体肺葉における lacZ-タグ転移性腫瘍細胞の可視化
- タイトな開閉蓋のプラスチックカップに肺を置き、30〜60分間、室温でPBS中2%ホルムアルデヒドで固定します。
- 固定液を取り除き、PBSで十分に3回洗浄します。
- 新たに5 - ブロモ-4 - クロロ-3 - インドリル-β-D-ガラクトシド(X-Gal)を染色液(X-galストック溶液[40 mg / mlで製造された少なくとも10ミリリットルを追加ジメチルホルムアミド] 1時40分基本的な染色液で希釈し、pHは7.1( 表1)、光から保護する)。
- 溶液中で完全にそれを維持し、空気の交換を可能にするために鍋でのみゆるく蓋を置くスイミング肺の上にガーゼを入れてください。
- 光から保護して3から5時間37℃でインキュベートする。
- X-gal溶液を取り除き、残留X-gal溶液(オプション)を削除し、4%PFAを追加するには、PBSで一回すすいでください。
3。肺凍結切片における lacZ-タグ転移性腫瘍細胞の可視化
- 原液PolyFreeze埋め込み培地で1月3日にプレフィルラベルの付いた埋め込み型。上に肺葉を入れて、葉が完全に覆われるまで、メディアを埋め込んでいっぱい。気泡がないように配慮してください。
- 20分間、4℃で埋め込まれた肺をインキュベートする。
- その後-80℃でゆっくりとドライアイスとイソペンタンと店舗の混合物中に埋め込ま肺を凍結
- 7から10μmの凍結をカットクライオスタットのセクションとSuperFrostPlus顕微鏡スライド上にマウントします。
- 加湿チャンバー内で24時間37℃でのX-Gal染色液で直ちにセクションをインキュベートする。
- 蒸留水で簡単にその後5分間のために2回、PBSでスライドを洗浄します。
- 10から30秒のための核ファーストレッドで対比染色、蒸留水ですすぎ、免疫マウントにスライドをマウントします。
4。代表的な結果
浅井ら高転移LM8サブ細胞株由来のものとは異なる親のダン細胞由来の皮下原発腫瘍が、自発的に検出可能な肺転移を形成しないことをダン由来LM8 OSのマウスモデルの元の記事で報告同系のC3Hマウス14。ここで報告技術により、我々はDunn/LM8マウスのOSモデルにおける転移の形成を再調査。我々は安定したlacZの形質ダンとLM8細胞を利用しましたsおよびマウスでのin-situ肺血流および固定のためのプロトコル。 lacZを形質導入し、非形質制御ダンとLM8細胞は図1に示されている皮下注射したマウスの灌流および非灌流肺の代表画像。制御ダン細胞を注射したマウスでは、肉眼的および顕微鏡的転移は非灌流灌流した肺( 図1A、I-IV)で検出不可能であった。しかし、興味深いことに、ダン-lacZの細胞を注射したマウスでは、X-gal染色は非灌流肺( 図1A、vi)の表面上の単一細胞や小さな細胞クラスター(<0.1 mm)の青微小転移病巣を明らかにした。 イン肺の in situ灌流および固定がさらにダン-lacZを微小転移( 図1A、ⅷ)の検出を改善しました。しかし、巨視的巣に伸長( 図1A、V、VII)は観察されなかった。
直径0.1mm以上LM8細胞、半透明の、かろうじて検出macrometastatic巣大きなコントロールを注射したマウスでは、非肺灌流した( 図1B、i)で認識された。肺の灌流( 図1B、iii) は病巣の検出を改善しなかった。しかし、マウスで複数のLM8-lacZの細胞を注入しX-Galを青く染色マクロ( 図1B、v)と微小転移( 図1Bは、vi)が非灌流した臓器の表面に検出された。また、肺の血流はさらにマクロおよび微小転移( - VIII 図1B、vii)の検出能を向上させました。その結果、マイクロおよびmacrometastasesは主として臓器表面の下に巣も見えるようになっている組織灌流さの半透明に、より高い密度とより多くの目に見えるようになった。
追加のH肺組織の凍結切片を用いた分析は 、lacZ istological形質ダンとLM8細胞を注射したマウスの肺転移の検出能の改善を確認した。ダン-lacZまたはLM8-lacZを細胞に由来する原発腫瘍を持つマウスでは、それぞれのコントロール細胞、微小転移あるいは単一細胞病巣の原発腫瘍を持つマウスと異なり肺切片( 図2)に認識された。また、macrometastasesも制御LM8細胞( 図2C、D)を注射した動物に比べLM8-lacZを細胞を注射したマウスで、よりはっきりと見えた。
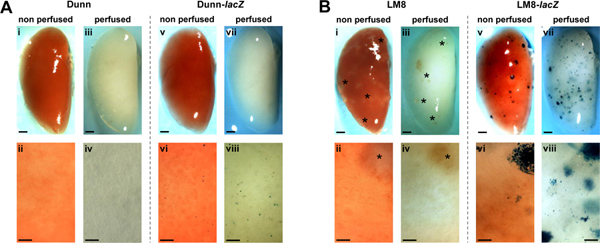
図 (I、II、V、VI)が非灌流灌流し、非形質導入(I〜IV) および lacZ形質導入(V-VIII)ダン()とLM8(B)細胞の自発的な転移の1。検出C3Hマウスにおいて(III、IV、VII、VIII)肺。代表のX-Gal-STAへの転移ined全体の肺(v、およびBのvii)及びそれぞれのクローズアップ(VI、VIIIでAおよびB)を青色で表示されます。非タグ付けLM8細胞(BにおけるI-IV)を注射したマウスの臓器内Macrometastatic病巣が(> 0.1ミリメートル)は、アスタリスクによって示されます。クローズアップに示す領域が全体の肺のための代表的なものである。スケールバーは全体の肺の画像で1ミリメートルとクローズアップさ0.1mmを示す。 拡大図を表示するには、ここをクリックしてください 。
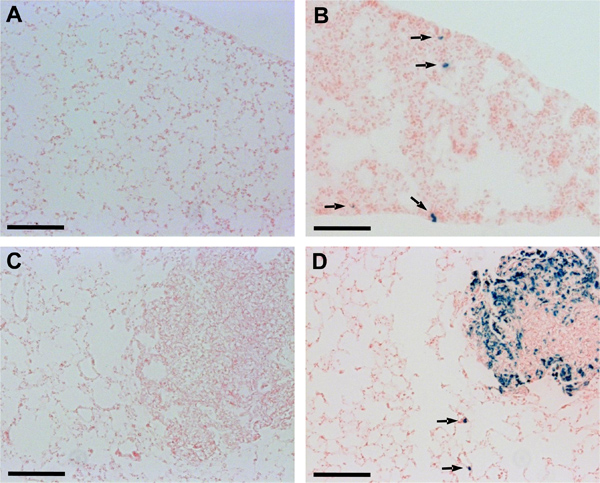
図2:ダンと肺凍結切片における微小転移の検出LM8。 10月組み込み肺組織の切片を加湿チャンバー内で24時間37℃でのX-Gal染色液中でインキュベートした後、核ファーストレッドで対比染色した。矢印はダン-lacZを(B)またはLM8-lacZの細胞(D)を注射したマウスの肺切片において認識微小転移巣を指す。 Micrometastasesは非形質ダン(A)またはLM8セル(C)を注射したマウスの肺切片では検出できなかった。スケールバーは0.1mmを示す。
ディスカッション
Dunn/LM8マウスOSモデルでここに示された結果は、肺組織のin-situ灌流/固定でのlacZ-タグ腫瘍細胞のX-gal染色を組み合わせて新たに確立された方法の力を発揮。 2つの技術のこの組み合わせは、単一細胞レベルに微小転移病変の高感度検出を停止でき、また、肺の表面( 図1)と同様の肺切片における( 図2)macrometastasesの可視化を向上させます。 X-gal染色も自然なので、血液と組織関連の色の他の臓器のin-situ灌流/固定で(マイクロ)転移の検出がわずかに肺以外の組織における転移巣の検出能を向上させることができますがこれらの器官13。灌流が別の臓器に向けられている場合であっても、肝臓を例えば 、血液の除去は部分的にしかコントラストベットを改善するであろう〜だと思うX-gal染色や臓器の自然な色。しかし、この方法はlacZをタグ付きの腫瘍細胞の任意のタイプに適用され、飛躍的に休眠中の単一セルの微小転移のレベルに肺転移の検出能を向上させ、ダウンマクロおよび微小転移の簡単で信頼性の高い定量が可能になります。この方法の限界及びルシフェラーゼおよび蛍光タンパク質を含むレポーター遺伝子に基づいている他のすべての技術は、導入遺伝子の発現の安定性である。 図2dに示すように、macrometastatic病巣内の全ての腫瘍細胞は、β-ガラクトシダーゼ活性の不足を示す青色に染色されています。これは、壊死に関連するかもしれないが、それは可能性が高く、導入遺伝子発現の損失によるものである。私たちは、ダンとLM8細胞が発現させるためであっても連続的な選択の下lacZおよび他の導入遺伝子のダウンレギュレーションに非常に有効であることを観察した。そこで我々は、マウスK12に最近の研究で切り替えとK7M2と人間HOS、143BとSAOS-2骨肉腫細胞株、in vitroでのすべての維持安定lacZ発現ならびに生体内では、最大時間をかけて100%に。
lacZの発現が保証されて安定したら、この技術は、機構的に転移性病変の根絶15を目指して新たな治療法の開発およびテストを行うためだけでなく、組織の植民地化13のプロセスを調査するために例えば、遺伝子操作された腫瘍細胞を用いた研究で適用することができます、16。さらに、転移性病変の早期検出のために使用される、例えば、PET、(マイクロ)、CTやMRIなどの現在の放射線イメージング技術、改善のためのベンチマークとして機能することができます。異なるトレーサーとの最近のPET研究(未発表)では、我々 は 、in vivoで検出された肺で記述されたプロトコルで、その後、ex vivoで転移が確認された。新しい小動物マイクロCTとの継続的な研究では(SkyScan)我々はこれまでにABですleは0.5ミリメートルとex vivoでダウンして0.3 mmまでのサイズにインビボで肺転移をダウン検出するが、我々は0.1ミリメートルの分解能を目指しています。興味深いことに、これは我々がマクロからのin-situ灌流およびX-gal染色を組み合わせた方法で微小転移を区別するために設定されたサイズ制限があります。これは、再びこの簡単かつ費用対効果の高い技術の感度と有用性を強調している。
開示事項
特別な利害関係は宣言されません。
謝辞
著者らは、肺血流のテクニックで彼の忠告博士Luborベルジッヒ(生理学研究所、チューリッヒ大学)に感謝したいと思います。この作品は、カントンチューリッヒのKrebsliga、ウォルターL.とヨハンナウルフ財団、チューリッヒ、リディアHochstrasser財団、チューリッヒ、スイス国立科学財団、SNF、スイス、Schweizerischer法令に基づく連合組織体Balgrist、大学からの補助金によって支えられてチューリッヒの。
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名称 | 会社 | カタログ番号 | 注釈 |
| Narketan10(ケタミン) | VétoquinolAG | 100 mg / mlの溶液を | |
| Xylazin(キシラジン) | StreuliファーマAG | 20 mg / mlの溶液を | |
| Prequilan(アセプロマジン) | Fatro SpAの | 10 mg / mlの溶液を | |
| ブルドッグのタイプは、血管クランプを止血小鉗子 | ファイン科学ツール | 18051から35 | 湾曲した、35ミリメートル |
| 蓋付きのプラスチックカップ | Semadeni | 2988 | 蓋つきの25ミリリットルのコップ |
| 5 - ブロモ-4 - クロロ-3 - インドリル-β-D-ガラクトシド(X-Gal)を、粉末 | Axxora | ALX-582-002-G005 | 店舗-20℃で光保護、N-ジ-メチルホルムアミドに40 mg / mlで、Nに溶解 |
| maxの光保護4℃で保存されてpHが7.1に平衡化の基本的な染色液、、。 1ヶ月 | 自分で作った | 100ミリリットル/ L 10xPBS、1.64 g / LのK3Fe(CN)6、2.1 g / LのK4Fe(CN)6、2ミリリットル/ L 1MのMgCl2、2ミリリットル/ L 10%NP40、1ミリリットル/ Lの10%のナトリウムデオキシコール酸 | |
| PolyFreezeの埋め込みミディアム | Polysciences社、スイスの代理店:Brunschwig | 19636から1 | |
| 埋め込み型 | ポリサイエンス | 18646A-1 | |
| ライカCM1850UVクライオスタット | ライカマイクロシステムズ | ||
| SuperFrostスライド | メンツェル | J1800AMNZ | |
| 核ファストレッド - 硫酸アルミニウム溶液 | 課クロマヴァルデック社&CO KG DISTributor:Medite | 84-0241-00 | |
| 免疫マウント | サーモエレクトロンは、スイスの代理店:Histocom | 9990412 |
表1試薬および器具。
参考文献
- Frese, K. K., Tuveson, D. A. Maximizing mouse cancer models. Nature. 7, 645-658 (2007).
- Coussens, L. M., Fingleton, B., Matrisian, L. M. Matrix metalloproteinase inhibitors and cancer: trials and tribulations. Science (New York, N.Y.). 295, 2387-2392 (2002).
- Fass, L. Imaging and cancer: a review. Mol Oncol. 2, 115-152 (2008).
- Puaux, A. L. A comparison of imaging techniques to monitor tumor growth and cancer progression in living animals. Int. J. Mol. Imaging. 2011, 321538 (2011).
- Malek, A., Catapano, C. V., Czubayko, F., Aigner, A. A sensitive polymerase chain reaction-based method for detection and quantification of metastasis in human xenograft mouse models. Clinical & experimental metastasis. 27, 261-271 (2010).
- Schmidt, C. M. Characterization of spontaneous metastasis in an aggressive breast carcinoma model using flow cytometry. Clinical & experimental metastasis. 17, 537-544 (1999).
- Horwitz, J. P. Substrates for Cytochemical Demonstration of Enzyme Activity. I. Some Substituted 3-Indolyl-Beta-D-Glycopyranosides. J. Med. Chem. 7, 574-575 (1964).
- Kruger, A., Schirrmacher, V., Khokha, R. The bacterial lacZ gene: an important tool for metastasis research and evaluation of new cancer therapies. Cancer metastasis reviews. 17, 285-294 (1998).
- Arlt, M. Increase in gelatinase-specificity of matrix metalloproteinase inhibitors correlates with antimetastatic efficacy in a T-cell lymphoma model. Cancer research. 62, 5543-5550 (2002).
- Arlt, M. J. Efficient inhibition of intra-peritoneal tumor growth and dissemination of human ovarian carcinoma cells in nude mice by anti-L1-cell adhesion molecule monoclonal antibody treatment. Cancer research. 66, 936-943 (2006).
- Banke, I. J. Effective inhibition of experimental metastasis and prolongation of survival in mice by a potent factor Xa-specific synthetic serine protease inhibitor with weak anticoagulant activity. Thrombosis and haemostasis. 94, 1084-1093 (2005).
- Borsig, L. Heparin and cancer revisited: mechanistic connections involving platelets, P-selectin, carcinoma mucins, and tumor metastasis. Proceedings of the National Academy of Sciences of the United States of America. 98, 3352-3357 (2001).
- Arlt, M. J. LacZ transgene expression in the subcutaneous Dunn/LM8 osteosarcoma mouse model allows for the identification of micrometastasis. J. Orthop. Res. 29, 938-946 (2011).
- Asai, T. Establishment and characterization of a murine osteosarcoma cell line (LM8) with high metastatic potential to the lung. International journal of cancer. 76, 418-422 (1998).
- Arlt, M. J. The antineoplastic antibiotic taurolidine promotes lung and liver metastasis in two syngeneic osteosarcoma mouse models and exhibits severe liver toxicity. International journal of cancer. , (2011).
- Steinmann, P. Antimetastatic activity of honokiol in osteosarcoma. Cancer. , (2011).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved