Method Article
Visualização melhorada de metástases pulmonares em Resolução única célula em Ratos por Combinado
Neste Artigo
Resumo
O protocolo romance relatado no presente estudo permite a detecção seletiva de metástases pulmonares em resolução única célula em camundongos combinado In-situ Perfusão pulmonar e fixação e coloração com X-Gal de LacZ Marcado com células tumorais.
Resumo
Metástase é a principal causa de morte na maioria dos tipos de câncer e, consequentemente, um foco principal na pesquisa do câncer. No entanto, a detecção de micrometástases de imagiologia radiológica e o sucesso na sua erradicação terapêutico permanecer limitado.
Enquanto modelos animais provaram ser ferramentas valiosas para a pesquisa do câncer 1, o monitoramento / visualização de micrometástases continua a ser um desafio e avaliação imprecisa de metástase em estudos pré-clínicos potencialmente leva a resultados desapontadores em ensaios clínicos 2. Consequentemente, existe um grande interesse em refinar os métodos para finalmente permitir a detecção reprodutível e fiável de metástases para baixo para o nível de célula única em tecido normal. O foco principal é, por conseguinte, sobre técnicas que permitem a detecção de células tumorais in vivo, como a micro-tomografia computorizada (micro-CT), tomografia de emissão de positrões (PET), a bioluminescência ou imagens de fluorescência <sup> 3,4. Estamos actualmente a optimização destas técnicas para a monitorização in vivo do crescimento do tumor primário e as metástases em modelos de osteosarcoma diferentes. Algumas destas técnicas podem também ser usados para análise ex vivo de metástase lado métodos clássicos como qPCR 5, 6 ou FACS diferentes tipos de coloração histológica. Como um padrão de referência, estabelecemos no presente estudo a transfecção ou transdução estável de células tumorais com o gene lacZ que codifica a enzima bacteriana β-galactosidase que metaboliza o substrato cromogénico 5-bromo-4-cloro-3-indolil-beta-D -galactopiranosido (X-Gal) com um corante azul índigo insolúvel 7 e permite que altamente sensível e selectivo coloração histoquímica azul de células tumorais em tecido de rato ex vivo até ao nível da célula individual, como mostrado aqui. Esta é uma ferramenta de baixo custo e não equipamento intensivo, o que permite a validação preciso da metástase 8 em estudos de avaliação de um novoterapias ticancer 9-11. Um fator limitante de X-gal de coloração é o baixo contraste, por exemplo, relacionadas com o sangue de coloração vermelho tecidos bem vascularizada. No tecido pulmonar, este problema pode ser resolvido por perfusão in situ de pulmão, uma técnica que foi recentemente estabelecido pela Borsig et al. Perfundidos 12 que os pulmões dos ratos, sob anestesia para eliminá-las do sangue, e para fixar e inserir-los in situ sob inflação através da traquéia. Este método evita também o colapso do pulmão e, assim, mantém a morfologia funcional alvéolos pulmonares, o que melhora a qualidade do tecido para análise histológica. No presente estudo, nós descrevemos um novo protocolo, que tira vantagem de uma combinação de X-gal de coloração lacZ células tumorais que expressam e in-situ de perfusão e de fixação do tecido pulmonar. Este protocolo permite refinado de alta sensibilidade de detecção de simples células metastáticas no pulmão e permitiu-nos em um estudo recente para detect "adormecidas" micrometástases pulmonares em um modelo de rato 13, que foi originalmente descrito como sendo não-metastáticos 14.
Protocolo
1. Perfusão Pulmonar In situ e Fixação
- Anestesiar ratos por injecção ip de 150 ul ~ fosfato salino tamponado (PBS) contendo 112,5 mg / kg (peso corporal) de cetamina, xilazina 16,5 mg / kg e 15 mg / kg de acepromazina (ou por um outro anestésico contendo analgésicos adequados).
- Quando os reflexos do mouse já não são observadas, corrigi-lo na mesa de operação de volta para baixo e molhar a pele com etanol 70% para os cabelos lisos para baixo.
- Abrir a pele do abdómen até ao pescoço e puxá-la para os lados ou removê-lo.
- Abra o peritônio eo tórax de um amplo tamanho. Impedir rupturas de grandes vasos (por exemplo, a veia jugular) para evitar a redução da eficiência da perfusão subsequente.
- Cortar a veia cava caudal abaixo do fígado.
- Usar uma seringa de 20 ml equipado com um 21G - agulha 24G para injectar lentamente 10-15 ml de PBS para dentro do ventrículo direito do coração a bater até que o pulmão é completamente branco eo coração pára de bater (assistolia).
- Beliscar fora dos vasos sanguíneos acima do fígado e do diafragma, com uma pinça vascular.
- Use uma seringa de 10 ml equipado com um 21G - agulha 24G para injectar ~ 2 ml de paraformaldeído a 3% (PFA) em PBS para o ventrículo direito.
- Descobrir a traqueia fora do tórax. Usar a mesma seringa para injectar ~ 3 ml de 3% de PFA em PBS cranial (do lado de fora do tórax) na traqueia até o pulmão é insuflado. Imediatamente após a remoção da agulha, belisque da cauda traqueia de punção com uma pinça vascular e aguardar durante 10 minutos para permitir a fixação.
- Transecão os vasos sanguíneos acima do grampo vascular, remover o grampo e injectar ~ 2 ml de PBS para o ventrículo direito para remover o excesso de PFA.
- Punção as partes inferiores de todos os lobos pulmonares com uma agulha, retirar a pinça vascular na traqueia e injectar 3-5 ml de uma solução de PolyFreeze incorporação médio / PBS 1:1 para o caudal da traqueia da primeira punção até o PFA no pulmãolóbulos é substituída pela solução.
- Retire cuidadosamente o pulmão puxando o coração com uma pinça e atravessa em ligamentos do tecido conjuntivo, vasos sanguíneos e da traquéia. Manter o coração ligado para os pulmões.
- Dependendo de como proceder com a análise do tecido pulmonar continuar com os protocolos descritos nas secções 2 ou 3. Se você quer fazer ambas as análises, remover um lobo do pulmão e proceder conforme descrito em 3. Processar os restantes lóbulos ligados ao coração, tal como descrito no ponto 2.
2. Visualização de lacZ-marcadas células tumorais metastáticas em lobos pulmonares inteiras
- Coloque o pulmão num copo de plástico com tampa de fecho estanque e fixá-lo com formaldeído a 2% em PBS à temperatura ambiente durante 30-60 min.
- Remover solução fixadora e lavam cuidadosamente 3 vezes com PBS.
- Adicionar pelo menos 10 ml preparada de fresco de 5-bromo-4-cloro-3-indolil-β-D-galactósido (X-Gal), a coloração da solução (solução stock X-Gal [40 mg / ml emDimetilformamida] 01:40 diluído em solução de coloração básico, pH 7,1 (Tabela 1), proteger da luz).
- Colocar um pedaço de gaze na parte superior do pulmão de natação para mantê-la completamente na solução e colocar a tampa apenas frouxamente sobre o pote para permitir a troca de ar.
- Incubar a 37 ° C durante 3-5 hr protegido da luz.
- Remover X-Gal solução, lavar uma vez com PBS para remover a solução de X-Gal residual (opcional) e adicionar PFA a 4%.
3. Visualização de lacZ-tagged células tumorais metastáticas em criocortes Pulmonares
- Prefill um molde de encaixe marcado a 1/3 com meio não diluído PolyFreeze incorporação. Coloque o lobo em cima e encher-se com a incorporação médio até que o lobo está completamente coberto. Tente evitar bolhas.
- Incubar os pulmões incorporados a 4 ° C durante 20 min.
- Em seguida, congelar os pulmões incorporados lentamente em uma mistura de gelo seco e isopentano e armazenar a -80 ° C.
- Corte 7-10 mM crioseções em um criostato e montá-los em lâminas de microscópio SuperFrostPlus.
- Incubar as secções imediatamente com X-Gal solução de coloração a 37 ° C durante 24 horas numa câmara húmida.
- Enxaguar as lâminas em PBS 2 vezes durante 5 min e, em seguida, brevemente em água destilada.
- Counter-mancha de vermelho rápido nuclear por 10-30 segundos, lavar em água destilada e montar as lâminas com Carac-Monte.
4. Resultados representativos
Asai et al. Relatada no artigo original sobre o derivado Dunn-modelo de rato LM8 OS que os tumores sc primárias derivadas das células parentais de Dunn, diferentes dos derivados da linha de células altamente metastáticas LM8 sub, não formam espontaneamente metástases pulmonares em detectáveis ratinhos C3H singénicos 14. Com as técnicas aqui relatadas, que de novo inquérito a formação de metástases nas Dunn/LM8 modelos do rato do SO. Nós aproveitou estável lacZ transduzidas Dunn e LM8 celulars e de um protocolo para a in-situ de perfusão pulmonar e fixação em ratinhos. Imagens representativas de pulmões perfundidos e não perfundido de ratos injectados subcutaneamente com lacZ-transduzidas e não transduzidas de controlo Dunn e LM8 células são mostradas na Figura 1. Nos ratinhos injectados com células de controlo Dunn, metástases macroscópicas e microscópicas permaneceu indetectável no pulmão não-perfundidos e perfundido (Figura 1A, i-iv). Mas, curiosamente, em ratinhos injectados com células de Dunn-lacZ, X-gal revelou coloração azul micrometastático focos de células individuais ou grupos de células pequenas (<0,1 mm), na superfície do não-perfundidos pulmões (Figura 1A, vi). In- perfusão in situ e fixação dos pulmões melhorou a detecção de micrometástases Dunn-lacZ (Figura 1A, viii). No entanto, a excrescência focos macroscópico não foi observado (Figura 1A, v, vii).
Nos ratinhos injectados com células de controlo LM8, translúcidas, dificilmente detectável macrometastatic focos maiores do que 0,1 mm de diâmetro foram reconhecidos em não-perfundidos pulmões (Figura 1B, i). Perfusão do pulmão (Figura 1B, iii) não melhorou a detecção de focos. No entanto, em ratinhos injectados com LM8-lacZ várias células X-Gal azul manchado macro-(Figura 1B, v) e micrometástases (Figura 1B, vi) foram detectados na superfície do não-perfundidos órgãos. Além disso, a perfusão dos pulmões melhorou a detectabilidade de macro-e micrometástases (Figura 1B, vii - viii). Consequentemente, as micro-e macrometástases tornou visível a uma densidade mais elevada e um número maior, principalmente devido à transparência do tecido perfundido de focos em que por baixo da superfície de órgãos tornou-se também visível.
Um h adicionalanálise istological usando criocortes de tecido pulmonar confirmou a detectabilidade melhorada de metástases pulmonares em ratinhos injectados com lacZ-transduzidas Dunn e LM8 células. Nos ratinhos com tumores primários derivados de Dunn-lacZ ou LM8-lacZ células, ao contrário dos camundongos com tumores primários das células de controlo respectivos, micrometástases ou mesmo única célula focos foram reconhecidos em secções de pulmão (Figura 2). Além disso, também foram macrometástases mais claramente visíveis em ratinhos injectados com células LM8-lacZ do que em animais injectados com o controlo LM8 células (Figura 2C e D).
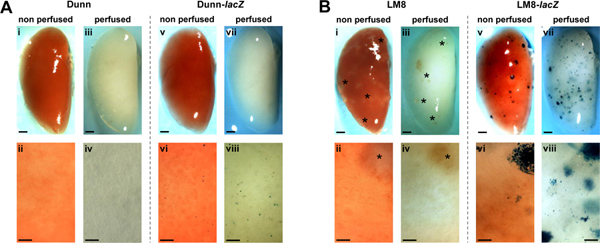
Figura 1. Detecção de metástases espontâneas de não transduzidas (i-iv) e lacZ transduzidas (v-viii) Dunn (A) e LM8 (B) células não perfundido (i, ii, v, vi) e perfundida (iii, iv, vii, viii) nos pulmões de ratinhos C3H. Metástases em representante X-Gal-staINED pulmões inteiros (V, VII, em A e B) e respectivo close-ups (VI, VIII em A e B) aparecem em azul. Macrometastatic focos (> 0,1 mm) nos órgãos de ratos injetados com os não-etiquetados LM8 células (i-iv em B) são indicados por asteriscos. Áreas mostradas em close-ups são representativos para os pulmões inteiros. Barras de escala indicam um milímetro em imagens de pulmões inteiros e 0,1 mm de close-ups. Clique aqui para ver maior figura .
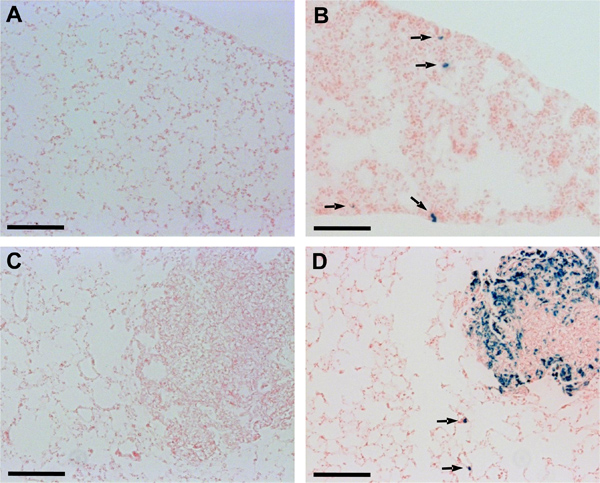
Figura 2. Detecção de Dunn e LM8 micrometástases em criocortes de pulmão. Secções de tecido de pulmão outubro embedded foram incubadas em X-Gal solução de coloração a 37 ° C durante 24 horas numa câmara húmida e, em seguida, contrastadas com vermelho nuclear rápido. As setas apontam para os focos micrometastático reconhecido em secções de pulmão de ratos injectados com Dunn-lacZ (B), ou células LM8-lacZ (D). Micrometastases permaneceu indetectável em secções de pulmão de ratos injectados com não transduzidas Dunn (A) ou LM8 células (C). Barras de escala indicam 0,1 mm.
Discussão
Os resultados aqui apresentados no modelo Dunn/LM8 OS rato demonstram o poder do método recentemente estabelecido que combina a coloração com X-Gal-lacZ de células tumorais marcadas com a perfusão in situ / fixação do tecido pulmonar. Esta combinação das duas técnicas permite uma detecção de alta sensibilidade de lesões micrometastáticas para baixo para o nível da célula individual e também melhora a visualização das macrometástases sobre a superfície do pulmão (Figura 1), bem como nas secções de pulmão (Figura 2). Embora a coloração com X-Gal permite também a detecção de (micro) metástases em outros órgãos, in-situ de perfusão / fixação melhora a detecção de focos metastáticos nos tecidos do pulmão que não sejam apenas ligeiramente por causa da cor natural do sangue e do tecido relacionada desses 13 órgãos. Mesmo se a perfusão é dirigida a um outro órgão, por exemplo, o fígado, a remoção do sangue só parcialmente melhorar a aposta contrasteween coloração com X-Gal e a cor natural do órgão. No entanto, o método é aplicável a qualquer tipo de lacZ-tagged células tumorais, irá melhorar drasticamente a detectabilidade de metástase pulmonar até ao nível de uma única célula dormente micrometástases e permite uma quantificação fácil e fiável de macro e micrometástases. Uma limitação deste método e todas as outras técnicas que são baseados em genes repórter, incluindo as proteínas de luciferase e de fluorescência, é a estabilidade da expressão do transgene. Como se mostra na Figura 2d, nem todas as células tumorais dentro do macrometastatic focos estão manchadas azul, indicando uma ausência de actividade de beta-galactosidase. Isso pode ser devido a necrose, mas é mais provavelmente devido a uma perda da expressão do transgene. Observou-se que a Dunn e LM8 células são muito eficazes na regulação negativa de lacZ e outros transgenes mesmo sob selecção contínua para a expressão. Nós, portanto, ligado em estudos recentes para o K12 murinoe K7M2 e os humanos HOS, 143B e SAOS-2 linhas de células de osteosarcoma, as quais todas mantidas expressão de lacZ estável in vitro, bem como in vivo, até 100% ao longo do tempo.
Uma vez que a expressão de lacZ-estável é garantido, esta técnica pode ser aplicada em estudos com genes manipulados células tumorais, por exemplo, para investigar mecanicamente o processo de colonização do tecido 13, assim como para o desenvolvimento e teste de novas terapias visando a erradicação das lesões metastáticas 15 , 16. Além disso, pode servir como uma referência para a melhoria das atuais técnicas de imagem radiológica, tais como PET, (micro) TC e RM, usados para a detecção precoce de lesões metastáticas. Em um estudo recente de PET (não publicado) com marcadores diferentes verificou-se a no pulmão detectado vivo metástases in vivo subsequentemente ex com o protocolo descrito. Em um estudo em curso com um novo animal pequeno micro-CT (SkyScan) estamos tão longe able para detectar metástases pulmonares in vivo para um tamanho de 0,5 mm para baixo e ex vivo a 0,3 mm, mas pretende-se uma resolução de 0,1 mm. Interessantemente, isto é o limite de tamanho, que definimos distinguir macro-de micrometástases com o método combinado de perfusão in situ e a coloração X-Gal. Esta sublinha uma vez mais a sensibilidade ea utilidade desta técnica fácil e de baixo custo.
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Os autores gostariam de agradecer ao Dr. Lubor Borsig (Instituto de Fisiologia da Universidade de Zurique) para o seu conselho sobre a técnica de perfusão pulmonar. Este trabalho foi financiado por subvenções dos Krebsliga da Zurich Kanton, o L. Walter e Wolf Johanna Foundation, Zurique, a Lydia Hochstrasser Foundation, Zurique, o Swiss National Science Foundation, SNF, Suíça, Schweizerischer Verein Balgrist, e da Universidade de Zurique.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Número de catálogo | Comentários |
| Narketan10 (ketamina) | Vétoquinol AG | 100 mg / ml solução | |
| Xilazina (xilazina) | Streuli Pharma AG | 20 mg / ml solução | |
| Prequilan (acepromazina) | FATRO SpA | 10 mg / ml solução | |
| Bulldog Tipo Serrefine grampo vascular | Belas Science Tools | 18051-35 | mm, curvo 35 |
| Copo de plástico com tampa | Semadeni | 2988 | 25 ml com tampas de copos |
| 5-Bromo-4-cloro-3-indolil-β-D-galactósido (X-Gal); pó | Axxora | ALX-582-002-G005 | dissolver em N, N-di-metilformamida e 40 mg / ml, loja de luz-protegido à temperatura de -20 ° C |
| Solução corante básico, equilibrada a pH 7,1, armazenadas light-protegida, a 4 ° C para max. 1 mês | por si mesmo | 100 ml / L 10xPBS, 1,64 g / L K3Fe (CN) 6, 2,1 g / L K4Fe (CN) 6, 2 mL / L 1 M de MgCl2, 2 ml / L 10% de NP40, 1 ml / L de sódio a 10%-Desoxicolato | |
| Meio de incorporação PolyFreeze | Polysciences; distribuidor suíço: Brunschwig | 19.636-1 | |
| Incorporação molde | Polysciences | 18646A-1 | |
| Leica CM1850 criostato | Leica Microsystems | ||
| Lâminas SuperFrost | Menzel | J1800AMNZ | |
| Nuclear Fast-Vermelho - solução de sulfato de alumínio | Divisão Chroma Waldeck GmbH & Co KG distributor: Medite | 84-0241-00 | |
| Carac-Monte | Thermo Electron, distribuidor suíço: Histocom | 9990412 |
Tabela 1. Reagentes e Equipamentos.
Referências
- Frese, K. K., Tuveson, D. A. Maximizing mouse cancer models. Nature. 7, 645-658 (2007).
- Coussens, L. M., Fingleton, B., Matrisian, L. M. Matrix metalloproteinase inhibitors and cancer: trials and tribulations. Science (New York, N.Y.). 295, 2387-2392 (2002).
- Fass, L. Imaging and cancer: a review. Mol Oncol. 2, 115-152 (2008).
- Puaux, A. L. A comparison of imaging techniques to monitor tumor growth and cancer progression in living animals. Int. J. Mol. Imaging. 2011, 321538 (2011).
- Malek, A., Catapano, C. V., Czubayko, F., Aigner, A. A sensitive polymerase chain reaction-based method for detection and quantification of metastasis in human xenograft mouse models. Clinical & experimental metastasis. 27, 261-271 (2010).
- Schmidt, C. M. Characterization of spontaneous metastasis in an aggressive breast carcinoma model using flow cytometry. Clinical & experimental metastasis. 17, 537-544 (1999).
- Horwitz, J. P. Substrates for Cytochemical Demonstration of Enzyme Activity. I. Some Substituted 3-Indolyl-Beta-D-Glycopyranosides. J. Med. Chem. 7, 574-575 (1964).
- Kruger, A., Schirrmacher, V., Khokha, R. The bacterial lacZ gene: an important tool for metastasis research and evaluation of new cancer therapies. Cancer metastasis reviews. 17, 285-294 (1998).
- Arlt, M. Increase in gelatinase-specificity of matrix metalloproteinase inhibitors correlates with antimetastatic efficacy in a T-cell lymphoma model. Cancer research. 62, 5543-5550 (2002).
- Arlt, M. J. Efficient inhibition of intra-peritoneal tumor growth and dissemination of human ovarian carcinoma cells in nude mice by anti-L1-cell adhesion molecule monoclonal antibody treatment. Cancer research. 66, 936-943 (2006).
- Banke, I. J. Effective inhibition of experimental metastasis and prolongation of survival in mice by a potent factor Xa-specific synthetic serine protease inhibitor with weak anticoagulant activity. Thrombosis and haemostasis. 94, 1084-1093 (2005).
- Borsig, L. Heparin and cancer revisited: mechanistic connections involving platelets, P-selectin, carcinoma mucins, and tumor metastasis. Proceedings of the National Academy of Sciences of the United States of America. 98, 3352-3357 (2001).
- Arlt, M. J. LacZ transgene expression in the subcutaneous Dunn/LM8 osteosarcoma mouse model allows for the identification of micrometastasis. J. Orthop. Res. 29, 938-946 (2011).
- Asai, T. Establishment and characterization of a murine osteosarcoma cell line (LM8) with high metastatic potential to the lung. International journal of cancer. 76, 418-422 (1998).
- Arlt, M. J. The antineoplastic antibiotic taurolidine promotes lung and liver metastasis in two syngeneic osteosarcoma mouse models and exhibits severe liver toxicity. International journal of cancer. , (2011).
- Steinmann, P. Antimetastatic activity of honokiol in osteosarcoma. Cancer. , (2011).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados