Method Article
Улучшена визуализация метастазов в легких на одной резолюции сотовый у мышей, комбинированные
В этой статье
Резюме
Роман протокол сообщили в настоящем исследовании, позволяет избирательно обнаружения метастазов в легких в одной резолюции клетки у мышей, комбинированные На месте Перфузии легкого и фиксации и X-Gal окрашивание LacZ С метками опухолевых клеток.
Аннотация
Metastasis is the main cause of death in the majority of cancer types and consequently a main focus in cancer research. However, the detection of micrometastases by radiologic imaging and the success in their therapeutic eradication remain limited.
While animal models have proven to be invaluable tools for cancer research1, the monitoring/visualization of micrometastases remains a challenge and inaccurate evaluation of metastatic spread in preclinical studies potentially leads to disappointing results in clinical trials2. Consequently, there is great interest in refining the methods to finally allow reproducible and reliable detection of metastases down to the single cell level in normal tissue. The main focus therefore is on techniques, which allow the detection of tumor cells in vivo, like micro-computer tomography (micro-CT), positron emission tomography (PET), bioluminescence or fluorescence imaging3,4. We are currently optimizing these techniques for in vivo monitoring of primary tumor growth and metastasis in different osteosarcoma models. Some of these techniques can also be used for ex vivo analysis of metastasis beside classical methods like qPCR5, FACS6 or different types of histological staining. As a benchmark, we have established in the present study the stable transfection or transduction of tumor cells with the lacZ gene encoding the bacterial enzyme β-galactosidase that metabolizes the chromogenic substrate 5-bromo-4-chloro-3-indolyl-beta-D-galactopyranoside (X-Gal) to an insoluble indigo blue dye7 and allows highly sensitive and selective histochemical blue staining of tumor cells in mouse tissue ex vivo down to the single cell level as shown here. This is a low-cost and not equipment-intensive tool, which allows precise validation of metastasis8 in studies assessing new anticancer therapies9-11. A limiting factor of X-gal staining is the low contrast to e.g. blood-related red staining of well vascularized tissues. In lung tissue this problem can be solved by in-situ lung perfusion, a technique that was recently established by Borsig et al.12 who perfused the lungs of mice under anesthesia to clear them from blood and to fix and embed them in-situ under inflation through the trachea. This method prevents also the collapse of the lung and thereby maintains the morphology of functional lung alveoli, which improves the quality of the tissue for histological analysis. In the present study, we describe a new protocol, which takes advantage of a combination of X-gal staining of lacZ-expressing tumor cells and in-situ perfusion and fixation of lung tissue. This refined protocol allows high-sensitivity detection of single metastatic cells in the lung and enabled us in a recent study to detect "dormant" lung micrometastases in a mouse model13, which was originally described to be non-metastatic14.
протокол
1. В месте перфузии легкого и фиксация
- Anesthetize мышей IP-инъекции ~ 150 мкл фосфатным буферным раствором (PBS), содержащего 112,5 мг / кг (масса тела) кетамин, 16,5 мг / кг ксилазина и 15 мг / кг Ацепромазин (или другой анестезии, содержащие соответствующие болеутоляющие средства).
- Когда рефлексы у мышей больше не наблюдается, зафиксировать его на операционный стол обратно вниз и влажный мех с 70% этанола, чтобы пятно волосы вниз.
- Откройте кожу от живота до шеи и потяните ее в сторону или удалить его.
- Откройте брюшины и грудной клетки с достаточным размером. Предотвращение разрывов крупных сосудов (например, jugularis пола), чтобы избежать снижения эффективности последующей перфузии.
- Вырезать полой вены caudalis под печенью.
- Используйте 20 мл шприц оснащен 21G - 24G иглу вводят медленно 10-15 мл PBS в правый желудочек бьющегося сердца, пока легкие полностью белый исердце перестает биться (асистолия).
- Повышение от кровеносных сосудов на печени и диафрагмы с сосудистым зажимом.
- Используйте в 10 мл шприц оснащен 21G - 24G иглу вводят ~ 2 мл 3% параформальдегидом (PFA) в PBS в правый желудочек.
- Раскройте трахею снаружи грудной клетки. Используйте тот же шприц для введения ~ 3 мл 3% PFA в PBS черепа (за пределами грудной клетки) в трахею до легкого завышены. Сразу же после удаления игл, отщипывать трахеи хвостового из прокола с сосудистым зажимом и ждать 10 минут, чтобы позволить фиксации.
- Разрез кровеносных сосудов выше сосудистый зажим, снимите зажим и вводят ~ 2 мл PBS в правый желудочек, чтобы удалить излишки PFA.
- Прокол нижней части всех долей легких с помощью иглы, удалить сосудистый зажим на трахею и вводить 3-5 мл раствора PolyFreeze вложения средне / PBS 1:01 в трахею хвостового первого прокола до PFA в легкоедолей заменяется решением.
- Снимите легких, осторожно потянув сердце с щипцами и пересекающих соединительной ткани связок, кровеносных сосудов и трахеи. Держите сердце связан с легкими.
- В зависимости от того, как приступить к анализу легочной ткани продолжить протоколы, описанные в разделах 2 и 3. Если вы хотите сделать и анализы, удалить одно легкое доли и действуйте, как описано в возрасте до 3. Процесс оставшихся долей подключен к сердцу, как описано в разделе 2.
2. Визуализация LacZ с метками метастатических опухолевых клеток в целых долей легких
- Поместите легких в пластиковой чашке с плотной крышкой закрытия и исправить ее с 2% формальдегида в PBS при комнатной температуре в течение 30-60 мин.
- Удалить фиксации решения и тщательно промойте 3 раза с PBS.
- Добавить по крайней мере, 10 мл свежеприготовленного 5-бром-4-хлор-3-индолил-β-D-галактозид (X-Gal) окрашивание раствора (X-Gal раствора [40 мг / мл вДиметилформамид] 1:40 разводят в Основной красящий раствор, рН 7,1 (табл. 1); защиты от света).
- Положите кусок марли в верхней части бассейна легкие, чтобы держать его полностью в растворе и положите крышку лишь в общих чертах на горшок, позволяющие осуществлять обмен воздуха.
- Инкубировать при 37 ° С в течение 3-5 часов в защищенном от света.
- Удалить X-Gal раствора, промойте один раз PBS для удаления остаточных X-Gal решение (по желанию) и добавить 4% PFA.
3. Визуализация LacZ с метками метастатических опухолевых клеток в легких Cryosections
- Prefill помечены вложения форму на 1/3 неразбавленным среднего вложения PolyFreeze. Положить доля легкого сверху и залейте вложения среде до лопасть полностью покрыта. Постарайтесь предотвратить пузыри.
- Инкубируйте встроенных легких при 4 ° С в течение 20 мин.
- Тогда заморозить встроенных легких медленно в смеси сухого льда и изопентана и хранить при температуре -80 ° C.
- Вырезать 7-10 мкм криоразделах, посвященных криостата и смонтировать их на SuperFrostPlus слайды микроскопом.
- Инкубируйте разделов сразу с X-Gal окрашивание раствора при 37 ° С в течение 24 ч во влажной камере.
- Промыть слайдов в PBS 2 раза в течение 5 мин, а затем кратко в дистиллированной воде.
- Counter-пятно с ядерными быстрым красным в течение 10-30 секунд, промыть в дистиллированной воде и смонтировать слайды с иммуно-горе.
4. Представитель Результаты
Асаи и соавт. Сообщили в оригинальной статье на Dunn-производные LM8 мышиной модели ОС, которая SC первичных опухолей, полученных от родительской клетки Данн, отличаются от тех, происходит от высокой метастатической LM8 к югу клеточной линии, не самопроизвольно образуют обнаружены метастазы в легких сингенных C3H мышей 14. С Здесь сообщил методы, мы переследованию образованию метастазов в Dunn/LM8 мышиных моделях ОС. Мы воспользовались стабильной LacZ-трансдуцированных Данн и LM8 клеткиы и протокол на месте перфузии легкого и фиксации у мышей. Представитель изображений перфузии и не перфузии легких мышей подкожно с LacZ-трансдуцированных и не трансдуцированных управления Данн и LM8 клетки показано на рисунке 1. В мышей, которым вводили контрольные клетки Данн, макроскопические и микроскопические метастазы остались обнаружить в не-перфузии и перфузии легких (рис. 1А, I-IV). Но, что интересно, в мышей, которым вводили Dunn-LacZ клеток, X-Gal окрашивание выявило синие микрометастазов очагов отдельных клеток или небольших скоплений клеток (<0,1 мм) на поверхность без перфузии легких (рис. 1А, VI). В месте перфузии и фиксации легких дальнейшее совершенствование выявляемости Dunn-LacZ микрометастазов (рис. 1А, VIII). Тем не менее, результат для макроскопических очагов не наблюдается (рис. 1А, V, VII).
В мышей, которым вводили управления LM8 клетки, полупрозрачные, едва уловимым macrometastatic очагов более 0,1 мм в диаметре, были признаны в не-перфузии легких (рис. 1б, г). Перфузии легкого (рис. 1б, в) не улучшает обнаружение очагов. Тем не менее, в мышей, которым вводили LM8-LacZ клеток нескольких X-Gal окрашен в голубой цвет макро-(рис. 1Б, В) и микрометастазов (рис. 1б, VI) были обнаружены на поверхности, не перфузии органов. Кроме того, перфузии легких улучшена выявляемость макро-и микрометастазов (рис. 1б, VII - VIII). Следовательно, микро-и macrometastases стал видимым при более высокой плотностью и большим числом, в основном за счет полупрозрачности перфузии тканей, в которых очаги под поверхностью орган также стал видимым.
Дополнительные чistological анализа с использованием cryosections легочной ткани подтвердили улучшенные возможности обнаружения метастазов в легких у мышей вводили LacZ-трансдуцированных Данн и LM8 клеток. У мышей с первичными опухолями, полученные из Dunn-LacZ или LM8-LacZ клеток, в отличие от мышей с первичными опухолями соответствующих контрольных клеток, микрометастазов или даже одной клетки очаги были признаны в легких секций (рис. 2). Кроме того, macrometastases также были более четко видны в мышей, которым вводили LM8-LacZ клеток, чем у животных, которым вводили управления LM8 клетки (рис. 2, D).
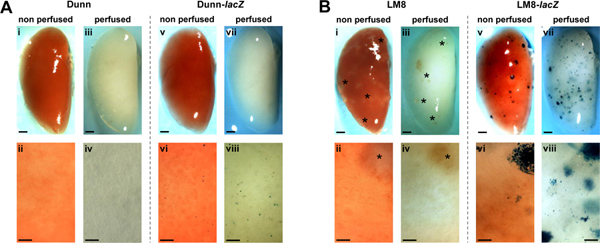
Рисунок 1. Обнаружение спонтанных метастазов, не трансдуцированных (I-IV) и LacZ-трансдуцированных (V-VIII), Данн (А) и LM8 (B) клеток в не-перфузии (I, II, V, VI) и перфузии (III, IV, VII, VIII), легкие в C3H мышей. Метастазы в представительных X-Gal-станцииINED целом легких (V, VII в А и B) и соответствующие крупным планом (VI, VIII в А и B) голубого цвета. Macrometastatic очагов (> 0,1 мм) в органах мышей, которым вводили, не отмеченных LM8 клеток (I-IV в B), обозначены звездочками. Районы показано в крупных планов являются репрезентативными для всей легких. Масштаб полоски указывают на 1 мм в образах целом легких и 0,1 мм крупным планом. Нажмите, чтобы увеличить показатель .
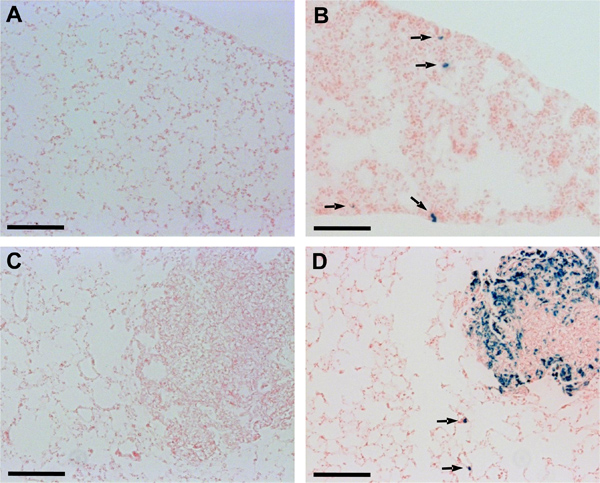
Рисунок 2. Обнаружение Данн и LM8 микрометастазов в легких cryosections. Разделы октября легочной ткани встроенный инкубировали в X-Gal красящий раствор при 37 ° С в течение 24 ч во влажной камере, а затем контрастно с ядерным быстрый красного цвета. Стрелки указывают на микрометастазов очагов признается в легких участков мышей, которым вводили Dunn-LacZ (B) или LM8-LacZ клеток (D). Micrometastases осталось обнаружить в легких участков мышей, которым вводили не-трансдуцированных Данн (A) или LM8 клеток (C). Масштаб полоски указывают на 0,1 мм.
Обсуждение
Здесь представлены результаты в Dunn/LM8 модель мыши OS продемонстрировать силу вновь созданный метод, который сочетает в себе X-Gal окрашивание LacZ с метками опухолевых клеток на месте перфузии / фиксации легочной ткани. Эта комбинация этих двух методов позволяет с высокой чувствительностью обнаружения микрометастазов поражения до одного уровня клеток, а также улучшает визуализацию macrometastases на поверхности легких (рис. 1), а также в легких секций (рис. 2). В то время как X-Gal окрашивание также позволяет обнаруживать (микро) метастазов в других органах, на месте перфузии / фиксации повышает выявляемость метастатических очагов в тканях, кроме легких незначительно из-за естественной крови и тканях связанных цвет этих органов 13. Даже если перфузии направлено на другого органа, например печени, удаление кровь лишь частично улучшить контрастность ставкуWeen X-Gal окрашивание и естественный цвет органа. Тем не менее, метод применим к любому типу LacZ с метками опухолевых клеток, значительно улучшить выявляемость легких метастазы до уровня спящих одноклеточных микрометастазов и позволяет легко и надежно количественного макро-и микрометастазов. Ограничение этого метода и все другие методы, основанные на репортера генов, в том числе люциферазы и флуоресцентные белки, является стабильность экспрессии трансгенов. Как показано на рисунке 2-й, не все опухолевые клетки в macrometastatic очаги окрашен в голубой цвет, что указывает на отсутствие бета-галактозидазы. Это может быть связано с некрозом, но это, скорее всего, в связи с потерей экспрессии трансгенов. Мы заметили, что Данн и LM8 клетки очень эффективны в понижающей регуляции LacZ и другие трансгены даже при непрерывной селекции для самовыражения. Поэтому мы переключается в недавних исследованиях с мышиным K12и K7M2 и человеческого HOS, 143В и Saos-2 линии остеосаркомы клетки, которые все поддерживали устойчивые выражения LacZ в пробирке, а также в естественных условиях до 100% в течение долгого времени.
После стабилизации LacZ-выражения гарантируется, этот метод может быть применен в исследованиях генов манипулировать опухолевых клеток, например, для механистически исследовать процесс колонизации тканей 13, а также для разработки и тестирования новых методов лечения, направленных на искоренение метастатических поражений 15 , 16. Кроме того, она может служить в качестве ориентира для совершенствования текущих методов визуализации радиологических, таких как ПЭТ, (микро) КТ и МРТ, используемых для раннего выявления метастазов. В недавнем исследовании ПЭТ (неопубликованные) с различными индикаторов мы убедились в естественных условиях обнаружены метастазы в легких впоследствии бывший естественных условиях с описанным протоколом. В продолжающемся исследовании с новым мелких животных микро-CT (SkyScan) мы так далеко ABле для выявления метастазов в легких в естественных условиях до размера 0,5 мм и экс естественных условиях до 0,3 мм, но мы нацелены на разрешение 0,1 мм. Интересно, что это предельный размер, что мы устанавливаем отличить от макро-микрометастазов с комбинированным методом на месте перфузии и X-Gal окрашивание. Это вновь подчеркивает чувствительность и полезность этой простой и экономически эффективной техники.
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Авторы хотели бы поблагодарить д-ра Lubor Borsig (Институт физиологии Цюрихского университета) за его советы по технике перфузии легких. Эта работа была поддержана грантами от Krebsliga в кантоне Цюрих, Walter L. и Йоханна Wolf Foundation, Цюрих, Лидия Хохштрассер фонда, Цюриха, Швейцарский национальный научный фонд, ОЯТ, Швейцарии, Schweizerischer Verein Балгрист, и университет Цюрих.
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер в каталоге | Комментарии |
| Narketan10 (кетамин) | Vetoquinol AG | 100 мг / мл | |
| Xylazin (ксилазина) | Штрели Pharma AG | 20 мг / мл | |
| Prequilan (Ацепромазин) | Fatro SpA | 10 мг / мл | |
| Бульдог Тип сосудистый зажим сосудистый зажим | Средства изобразительных наук | 18051-35 | изогнутые, 35 мм |
| Пластиковая чашка с крышкой | Семадени | 2988 | 25 мл чашки с крышками |
| 5-бром-4-хлор-3-индолил-β-D-галактозид (X-Gal); порошок | Axxora | ALX-582-002-G005 | растворяют в N, N-ди-метилформамида до 40 мг / мл, магазин защищенном от света при температуре -20 ° C |
| Основной красящий раствор, сравняться с рН 7,1, хранятся защищенном от света при температуре 4 ° С в течение макс. 1 месяц | самодельный | 100 мл / л 10xPBS, 1,64 г / л K3Fe (CN) 6, 2,1 г / л K4Fe (CN) 6, 2 мл / л 1М MgCl2, 2 мл / л 10% NP40, 1 мл / л 10% Натрий-Deoxycholate | |
| Средний PolyFreeze внедрения | Polysciences; швейцарские дистрибьютор: Brunschwig | 19636-1 | |
| Вложение формы | Polysciences | 18646A-1 | |
| Leica CM1850 криостата | Leica Microsystems | ||
| SuperFrost слайды | Менцель | J1800AMNZ | |
| Ядерные-Fast Red - алюминиевый раствор сульфата | Отдел Chroma Waldeck GmbH & Co KG расстояниеributor: Medite | 84-0241-00 | |
| IMMU-Mount | Thermo Electron, швейцарский дистрибьютор: Histocom | 9990412 |
Таблица 1. Реагентов и оборудования.
Ссылки
- Frese, K. K., Tuveson, D. A. Maximizing mouse cancer models. Nature. 7, 645-658 (2007).
- Coussens, L. M., Fingleton, B., Matrisian, L. M. Matrix metalloproteinase inhibitors and cancer: trials and tribulations. Science (New York, N.Y.). 295, 2387-2392 (2002).
- Fass, L. Imaging and cancer: a review. Mol Oncol. 2, 115-152 (2008).
- Puaux, A. L. A comparison of imaging techniques to monitor tumor growth and cancer progression in living animals. Int. J. Mol. Imaging. 2011, 321538 (2011).
- Malek, A., Catapano, C. V., Czubayko, F., Aigner, A. A sensitive polymerase chain reaction-based method for detection and quantification of metastasis in human xenograft mouse models. Clinical & experimental metastasis. 27, 261-271 (2010).
- Schmidt, C. M. Characterization of spontaneous metastasis in an aggressive breast carcinoma model using flow cytometry. Clinical & experimental metastasis. 17, 537-544 (1999).
- Horwitz, J. P. Substrates for Cytochemical Demonstration of Enzyme Activity. I. Some Substituted 3-Indolyl-Beta-D-Glycopyranosides. J. Med. Chem. 7, 574-575 (1964).
- Kruger, A., Schirrmacher, V., Khokha, R. The bacterial lacZ gene: an important tool for metastasis research and evaluation of new cancer therapies. Cancer metastasis reviews. 17, 285-294 (1998).
- Arlt, M. Increase in gelatinase-specificity of matrix metalloproteinase inhibitors correlates with antimetastatic efficacy in a T-cell lymphoma model. Cancer research. 62, 5543-5550 (2002).
- Arlt, M. J. Efficient inhibition of intra-peritoneal tumor growth and dissemination of human ovarian carcinoma cells in nude mice by anti-L1-cell adhesion molecule monoclonal antibody treatment. Cancer research. 66, 936-943 (2006).
- Banke, I. J. Effective inhibition of experimental metastasis and prolongation of survival in mice by a potent factor Xa-specific synthetic serine protease inhibitor with weak anticoagulant activity. Thrombosis and haemostasis. 94, 1084-1093 (2005).
- Borsig, L. Heparin and cancer revisited: mechanistic connections involving platelets, P-selectin, carcinoma mucins, and tumor metastasis. Proceedings of the National Academy of Sciences of the United States of America. 98, 3352-3357 (2001).
- Arlt, M. J. LacZ transgene expression in the subcutaneous Dunn/LM8 osteosarcoma mouse model allows for the identification of micrometastasis. J. Orthop. Res. 29, 938-946 (2011).
- Asai, T. Establishment and characterization of a murine osteosarcoma cell line (LM8) with high metastatic potential to the lung. International journal of cancer. 76, 418-422 (1998).
- Arlt, M. J. The antineoplastic antibiotic taurolidine promotes lung and liver metastasis in two syngeneic osteosarcoma mouse models and exhibits severe liver toxicity. International journal of cancer. , (2011).
- Steinmann, P. Antimetastatic activity of honokiol in osteosarcoma. Cancer. , (2011).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены