Method Article
Lavado broncoalveolar (BAL) de Investigación; obtención de rendimiento adecuado de la muestra
En este artículo
Resumen
Se describe una técnica de investigación para la fibrobroncoscopia y el lavado broncoalveolar mediante succión baja presión. La técnica se utiliza para cosechar células inmunes de las superficies broncoalveolar de pulmón. Se utiliza anestesia local y sedación consciente leve (midazolam). Los sujetos toleran bien el procedimiento y experimentan efectos secundarios mínimos.
Resumen
Se describe una técnica de investigación para la fibrobroncoscopia con lavado broncoalveolar (BAL) utilizando la succión de mano manual para eliminar las células no adherentes y fluido del revestimiento del pulmón de la superficie de la mucosa. En entornos de investigación, BAL permite el muestreo de innata (macrófagos de pulmón), las respuestas celulares (B-y células T), y humoral (inmunoglobulina) en el pulmón.
BAL está aceptado internacionalmente con fines de investigación y desde 1999 la técnica se ha realizado en> 1.000 sujetos en el Reino Unido y Malawi por nuestro grupo.
Nuestra técnica utiliza una succión suave de mano de fluido instilado; este está diseñado para maximizar el volumen BAL volvió y aplicar fuerza de corte mínima en el epitelio ciliado con el fin de preservar la estructura y función de las células dentro del fluido BAL y para preservar la viabilidad para facilitar el crecimiento de células en cultivo ex vivo. Por tanto, la técnica de investigación utiliza un mayor volumen inslavaje (típicamente en el orden de 200 ml) y se emplea de succión manual para reducir el daño celular.
Los pacientes reciben anestesia local, ofrecen sedación consciente (midazolam), y toleran el procedimiento bien con efectos secundarios mínimos. Información sujeta verbal y escrito, mejora la tolerancia y el consentimiento informado por escrito es obligatorio. Seguridad de la asignatura es de suma importancia. Los sujetos son cuidadosamente seleccionados con criterios de inclusión y exclusión claros.
Este protocolo incluye una descripción de los riesgos potenciales y las medidas adoptadas para mitigarlos, una lista de contraindicaciones, pre-y los controles posteriores al procedimiento, así como las técnicas de broncoscopia y de laboratorio precisos.
Introducción
Fondo
La fibrobroncoscopia fue desarrollado para la práctica clínica, sino que es ampliamente utilizado tanto en el diagnóstico y terapéutica 1,2. El lavado broncoalveolar (BAL) elimina las células no adherentes y de pulmón fluido de recubrimiento de la superficie de la mucosa; biopsia se utiliza para muestrear tejidos de la mucosa y de la submucosa. En entornos de investigación, BAL permite respuestas de muestreo de innata (macrófagos pulmonares 3-5), celular (-B y las células T 6), y humorales (inmunoglobulina 7) en el pulmón.
BAL está internacionalmente aceptado para fines de investigación 8 y desde 1999 la técnica se ha realizado en> 1.000 sujetos en el Reino Unido y Malawi por nuestro grupo. Utilizamos esta técnica en el estudio de la respuesta inmune innata, celulares y humorales al antígeno de neumococo incluidos experimental carro humana neumocócica 9,17, biomasa humo 5, VIH y vacunación, y Stu tratamiento complementariomuere en la recuperación de una neumonía. Nuestra técnica utiliza una succión suave de mano de fluido instilado; este está diseñado para maximizar el volumen BAL devuelto y aplicar fuerza de corte mínima en el epitelio ciliado con el fin de preservar la estructura y función de las células dentro del fluido BAL.
En un contexto de investigación BAL utiliza una técnica diferente de la practicada por los médicos de atención respiratoria e intensivas (a menudo denominado lavado bronquial, lavados, lavado, o BAL) que aspiran a obtener un beneficio diagnóstico o terapéutico. La técnica de investigación está diseñado para cosechar las células y preservar la viabilidad para facilitar el crecimiento de células en cultivo ex vivo. Por estas razones, la técnica de investigación utiliza un mayor volumen instilado (típicamente en el orden de 200 ml) y se emplea de succión manual para reducir el daño celular. Los pacientes reciben anestesia local, ofrecen sedación consciente (midazolam), y toleran el procedimiento bien con efectos secundarios mínimos. Subjetivo verbal y escritainformación t mejora la tolerancia y el consentimiento informado por escrito es obligatorio 1.
Meta
El objetivo general es que el procedimiento debe ser seguro y efectivo. Los sujetos no deben experimentar ninguna alteración fisiológica y los operadores deben recoger sistemáticamente superiores a 100 ml de BAL de los sujetos. Después del procedimiento, los sujetos deberían experimentar efectos secundarios mínimos.
Seguridad
Seguridad de la asignatura es de suma importancia. Los sujetos son cuidadosamente seleccionados con criterios de inclusión y exclusión claros. Este protocolo incluye una descripción de los riesgos potenciales y las medidas adoptadas para mitigarlos.
Las contraindicaciones de la broncoscopia investigación pueden expresarse como absoluta o relativa, y están incluidos en el protocolo de estudio como criterios de exclusión y de inclusión. Nuestros temas están seleccionados para garantizar la plena salud.
Las contraindicaciones absolutasincluir columna inestable de cuello uterino, la hipoxia no responde, la angina de pecho inestable, diátesis hemorrágica, y arritmia cardíaca maligna.
Las contraindicaciones relativas, incluso las condiciones asociadas con el aumento de las tasas de complicaciones, incluyen:
General: poco cooperativa sujeto 1, cualquier problema significativo de medicina general por ejemplo, la epilepsia, la anterior broncoscopia mal tolerado, conocido reacciones adversas a la lidocaína o midazolam, el embarazo, la mala nutrición.
Respiratoria: hipoxia [saturaciones (SATs) en el aire <94%], hipercapnia, asma inestable 1, la función respiratoria deteriorada significativamente 1 (FEV 1 <1 L), la hipertensión pulmonar.
Cardiovascular: uremia, dentro de las 6 semanas de infarto de miocardio 1, obstrucción de la vena cava superior.
Otros: inmunosupresión (nuestro grupo realiza regularmente este procedimientomiento en sujetos VIH positivos).
Vea la Tabla 1 - Los riesgos asociados con BAL para la investigación.
Protocolo
1. Los sujetos son recibidos a su llegada por la Enfermera de Investigación Respiratoria
- El tema ha estado ayunando durante> 4 horas para alimentos sólidos y 2 h para líquidos claros 1.
- El procedimiento se realiza como un caso de día con los controles pre y post-procedimiento adecuado (según la política del hospital estándar).
- El sujeto lleva una bata de hospital.
- Se inserta una pequeña cánula de calibre (lo ideal es en la mano izquierda) y se mantiene in situ hasta el final del período de recuperación después del procedimiento 1.
- Se toman observaciones previos al procedimiento (presión arterial, frecuencia cardíaca, saturación de oxígeno [SATS]).
- El sujeto se transfiere a la suite de la broncoscopia.
2. El sujeto está preparada para el procedimiento en la suite por una Investigación Clínico Respiratorio Con experiencia en broncoscopia
- Los equipos de inspección se adjunta incluyendo; 3 derivaciones ECG, oxímetro de pulso 1,10 y esfigmomanómetro. AnesthetNo se necesita apoyo ic incluyendo el consentimiento informado por escrito.
- El oxígeno se puede suministrar a través de una cánula nasal con hasta 4 L / min, para lograr SAT> 90% 1.
- El operador comprueba el broncoscopio, esto incluye asegurarse de succión efectiva mediante la aspiración de solución salina normal estéril.
- La anestesia tópica con lidocaína se consigue en los pasajes nasales (utilizando Instillagel 1) y la mucosa oral (utilizando xilocaína)
- Si la sedación es apropiada y solicitado por el sujeto, el midazolam se administra por vía intravenosa 1. Un agente de inversión apropiado (flumazenil) está disponible inmediatamente.
- El equipo de reanimación debe estar disponible 1,10.
3. El broncoscopio es insertado y posicionado
- La intubación es por lo general a través de la nariz. Si esto no es posible debido a pólipos nasales, cornetes inflamados, o cualquier molestia entonces el sujeto es intubado a través de la boca (un protector bucal se utiliza para prevenirdaños en el alcance o los dientes del sujeto).
- La anestesia tópica en la laringe se completa utilizando 4% de lidocaína, por lo general se utiliza un total de 4-6 ml. Comúnmente esto causa la tos en la instilación.
- Se pasan las cuerdas vocales, y otros que utilizan la anestesia de la mucosa de 2 ml de lidocaína al 2% en la carina, en la división del lóbulo inferior derecho (RLL) y lóbulo medio derecho (RML) y en la entrada RML.
- El broncoscopio se coloca dentro de la RML, idealmente en el segmento medial, en una posición en la que es suficiente para estar en una posición segura distal pero no demasiado distal de modo que la vía respiratoria se derrumba cuando se aplica succión ("prueba de Wink 'utilizando el botón de aspiración ).
- Una buena posición es indicada durante la prueba guiño mediante un broncoscopio que se puede mantener totalmente en posición por el broncoscopista y una vía aérea que no lo hace totalmente cierran inmediatamente una succión suave.
4. El BAL se realiza
- Cuatro 60 ml jeringas son prelleno con solución salina normal calentada - 60 ml, 50 ml, 50 ml, y 40 ml en jeringas sucesivas. Cuando el sujeto y broncoscopista están listos la primera jeringa de solución salina se instila por el asistente broncoscopia mientras broncoscopista mantiene la posición en la RML.
- Succión suave mano se lleva a cabo a continuación por el asistente utilizando el mismo puerto y 50 ml jeringa.
- Este procedimiento se repite entonces una 3x aún más, con un volumen máximo de 200 ml utilizados en nuestra técnica específica.
- El BAL líquido recuperado se expulsa suavemente en recipientes etiquetados que ya se encuentren en la fusión del hielo. Los recipientes de vidrio pueden ser presiliconized el fin de inhibir la unión de células y maximizar el rendimiento celular.
- El fluido BAL aparece nebuloso contra la luz con las burbujas de jabón de superficie formadas por tensioactivos.
- El broncoscopio se retira lentamente plenamente.
- El BAL líquido se transporta sin demora en hielo para su procesamiento inmediato.
5. Asunto Recuperación
- El sujeto se recupera para 2-4 horas por la enfermera de la investigación respiratoria en una sala.
- Durante este tiempo se les permite descansar y sólo comer y beber> 60 min 1 después del procedimiento (cuando su deglución es evaluado como seguro), con el fin de reducir el riesgo de aspiración.
- Observaciones posteriores al procedimiento son controlados y registrados. Un examen clínico se produce antes de la descarga.
- El sujeto se informó predescarga acerca de los efectos secundarios comunes (fiebre, dolor de pecho submamaria derecha leve, dolor de garganta) y se le dio un número de contacto en caso de efectos secundarios significativos se producen 1.
- El sujeto se dio seguimiento en 1-5 días después del procedimiento con un contacto clínico. Esto puede ser o bien por teléfono o en persona.
6. Las células se aíslan en el laboratorio - Realizar el deshielo, cuando sea posible
- El volumen de líquido de BAL se registra y se filtró a través de una doble capa de gasa estéril hisopopara quitar los tapones de moco en, tubos de 50 ml centrífuga estériles preenfriados.
- Las células se sedimentaron por centrifugación a 500 xg a 4 ° C durante 5-10 minutos y se lavaron por agitación en 50 ml de frío de solución salina normal. Centrifugación se repite una vez.
- Las células se resuspenden en medio de cultivo (RPMI-1640 + suero bovino fetal al 10% + 2 mM de L-glutamina + penicilina [40 UI / ml], estreptomicina [75 UI / ml], y la anfotericina B [0,5 UI / ml]) y recuento diferencial realizado usando un volumen igual de azul de tripano y un hemocitómetro.
- La suspensión celular se normaliza a la densidad requerida (usamos 1 x 10 6 células / ml), introducidos con la pipeta en placas de cultivo tisular adecuada y se incuban a 37 ° C durante 3 horas para permitir la adherencia de macrófagos. 1 ml de esta suspensión celular por pocillo es apropiado para placas de cultivo de 24 pocillos.
- Para el trabajo de linfocitos, después de 3 horas de incubación, el medio de cultivo se pipeta suavemente hacia arriba y hacia abajo de 3 aumentos, y se recoge. Este medio contiene linfocitosy los macrófagos no adherentes y se pueden utilizar para evaluar la función de linfocitos, sino que también se puede utilizar en etapas de purificación, por ejemplo con perlas magnéticas CD14 para eliminar los macrófagos.
- Para el trabajo de los macrófagos, después de 3 h de incubación, el medio se retira cuidadosamente con un mínimo de pipeteo y se reemplaza con medio fresco, caliente sin antibióticos (RPMI 1640 + 10% de suero bovino fetal + 2 mM de L-glutamina). Los macrófagos son adherentes a la placa de cultivo de tejidos (véase la Figura 1).
Resultados
Los buenos resultados clínicos son un volumen BAL de más de 100 ml y un sujeto que ha experimentado a lo sumo, una leve molestia (ver Tabla 1). Esto requiere de un sujeto relajado y cooperativo. El médico debe estar seguro, completamente preparado (Materiales), y la comprensión hacia el voluntariado.
Variabilidad inter e intra-sujetos en el rendimiento celular (incluyendo recuento diferencial) se ha descrito. Diferencial de células de sujetos sanos son típicamente> 90% de macrófagos con un pequeño número de neutrófilos (<2%) y linfocitos (5-10%). BAL células se centrifugaron sobre portaobjetos de microscopio se pueden teñir con un tinte nuclear diferencial para obtener esta información (Figura 1). En la Figura 1, las células de BAL han sido fijadas y teñidas usando tinción Hemacolor de acuerdo con las instrucciones del fabricante. Al menos 300 células se deben contar para obtener resultados fiables de los macrófagos,neutrófilos y linfocitos; 500 células para tipos de células raras.
| Peligro | Riesgo | Reducido en este protocolo a través de: |
| Efecto de la broncoscopia y BAL 1, 14 | ||
| Molestias leves | <25% 14, # | Analgesia y sedación adecuada. Enfoque Confiado y atento al tema. |
| Epistaxis | <1% # | Presión leve por sólo intubación nasal. Si el malestar tema o menor apertura de diafragma - intubación oral en su lugar. |
| Hemorragia endobronquial (hemoptisis) | <0,1% * 15 | No biopsias tomadas. El control cuidadoso durante la broncoscopia - evitando la mucosa respiratoria. |
| Nausea, vómitos y aspiración neumonía | <0,02% 14, # | Ayuno para el alimento sólido> 4 horas antes del procedimiento 1. Anestesia tópica adecuada. Posición semisentada durante el procedimiento. Una cuidadosa observación post-procedimiento. |
| Fiebre | 0,01 para 14 - 1% #, 16 | Se relaciona con la inflamación, y puede minimizarse mediante la recolección máxima de BAL. Lóbulo individual BAL solamente. # |
| Nariz dolorida / garganta y ronquera | <25% 14, # | Anestesia tópica adecuada de la nariz, la garganta y la laringe (minimizando la tos). |
| Infección | <0,1% de VIH negativo, 1% en VIH positivo 14, # | Procedimiento de lavado broncoscopio estándar 1. Lóbulo individual BAL solamente. # El reconocimiento precoz de la infección: examen clínico dentro de 1 hora unad contacto clínico en 1-5 días después de la broncoscopia. |
| Dolor en el pecho / tos | <0,2% 14, # | Lóbulo individual BAL solamente. Colección Maximal BAL. # |
| Efectos de las drogas: la lidocaína, midazolam | ||
| Arritmia | Muy raras * | Máximo de 5 mg / kg 14 lidocaína utilizada. Al calor de solución salina normal inculcado. # La oximetría de pulso (SATs> 90% con la administración de suplementos de oxígeno), la monitorización cardiaca durante todo el procedimiento. Antagonista de las benzodiazepinas (flumazenil) disponible de inmediato. |
| Desorientación / agitación | <0,1% † # | |
| Depresión respiratoria Cardio | Muy raras * | |
* No experiencia de nuestro grupo en más de 1.500 procedimientos de investigación.
† idiosyncratic en lugar de la reacción dependiente de la dosis.
# La experiencia de nuestro grupo en más de 1.500 procedimientos de investigación.
Tabla 1. Los riesgos asociados con BAL para la investigación. Esto incluye el peligro o riesgo y cómo esto se reduce mediante el uso de la técnica descrita. Efectos de la broncoscopia / BAL y también los efectos de alguna droga medicinales utilizadas están incluidos.
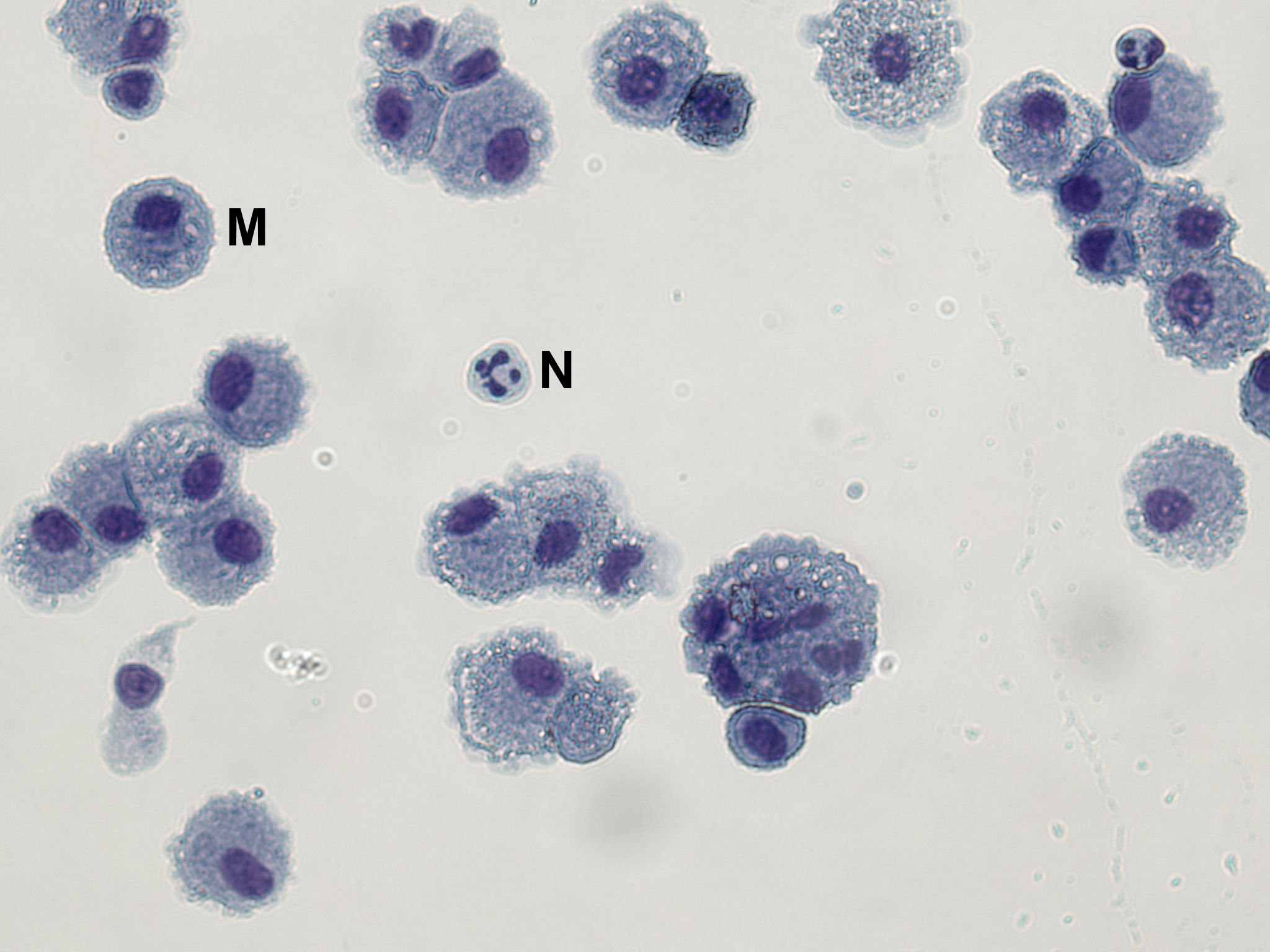
Figura 1. Un portaobjetos de microscopio Mostrando BAL macrófagos y neutrófilos ocasionales. BAL células se han corregido en metanol y se tiñeron con rojo Hemacolor (eosina Y) y azul (azur B).
Discusión
Con el fin de lograr buenos resultados los siguientes son útiles:
- Bueno Anesthetisation en la base de la lengua y la orofaringe posterior. Esto es importante, ya que mejora la tolerancia de procedimiento del sujeto y la comodidad general.
- Cualquiera de una pediátrica (diámetro exterior 3.4-3.6 mm) o broncoscopio adulto (4.8 a 5.9 mm de diámetro exterior) se pueden utilizar.
- Si hay cualquier incomodidad durante la intubación nasal, se prefiere intubación oral. En general la intubación nasal es ya sea una técnica sencilla o debe ser abandonada.
- Después de la instilación inicial de lidocaína a la orofaringe, el sujeto puede preferir el broncoscopio para ser retirado a la espera de la aparición de la anestesia, especialmente si el broncoscopio se inserta por vía oral.
- Asegúrese de por lo menos 10 x 10 ml jeringas están precargadas con sólo 2-4 ml de lidocaína. El aire debe ser dejado en las jeringas que permiten una mejor prestación de la anestesia directamente sobre los cables y muco endobronquialsa.
- Desde la tos durante el procedimiento reduce significativamente BAL rendimiento; utilizando solución salina caliente y tener buenas anestesia de la mucosa son importantes para reducir esto.
- Las jeringas de 50 ml deben ser precargadas con solución salina calentada. Es común para los primeros 50 ml de solución salina normal para producir inculcado entre 10-20 ml debido a la pérdida del espacio muerto y el resto se ejecuta en las vías aéreas terminales. Otras partes alícuotas de devolver una cantidad mayor proporción de fluido.
- El operador siempre debe comprobar el broncoscopio antes de la intubación, incluida la garantía de succión efectiva mediante la aspiración de solución salina normal estéril. Pérdida de succión puede ocurrir comúnmente debido a la formación de cocas en el tubo o fugas alrededor de las conexiones con el broncoscopio o dispositivo de succión.
- Durante la aspiración manual, idealmente la vía aérea no debería colapsar. Si succión colapsa de forma recurrente de las vías respiratorias, los rendimientos BAL se reducen a un mecanismo de válvula, y la inflamación y el sangrado local es más probable: esto a su vez hace que las vías respiratorias mmineral irritable y tos más probable. Por lo tanto, La elección de la rama subsegmental RML más apropiado y el uso de bajas presiones de succión son a la vez importantes.
- Cuando el aire se aspira constantemente vuelva a comprobar la conexión de la jeringa para el broncoscopio y también la posición del broncoscopio en la vía aérea distal. Si se trata de un problema recurrente, post-procedimiento asegúrese de que no hay agujeros en el propio broncoscopio.
- BAL de los fumadores a menudo es más oscuro debido a la presencia de partículas intracelulares. Los fumadores pueden tolerar la broncoscopia menos bien, y tienen aumento de la tos.
- El preferible rendimiento de volumen BAL es> 100 ml. Se obtuvo un rendimiento de> 150 ml es excelente. No hemos tenido ningún rendimiento> 170 ml. No existe una relación lineal entre el rendimiento celular y el rendimiento de volumen BAL.
- Los rendimientos de <100 ml son, en nuestra experiencia, más probabilidades de dar lugar a efectos secundarios tales como tos, dolor en el pecho y fiebre. Aconsejamos que los sujetos con rendimientos de <100 ml Sea recoVered en la posición de lateral izquierdo, esto puede ayudar al drenaje de cualquier líquido pulmonar restante.
- Contacto clínico debe hacerse con el sujeto dentro de 1-5 días para asegurar sin efectos secundarios.
- Sedación midazolam se utiliza para el <50% de los sujetos en el Reino Unido y <5% en Malawi. El midazolam no parece mejorar directamente la tolerabilidad, algunos operadores consideran que la sedación a veces puede ser contraproducente en el mantenimiento de un diálogo coherente (y tranquilizador) con el tema.
- En nuestra experiencia, hay una curva de aprendizaje significativa con esta técnica. Por ejemplo la coordinación entre el médico y la enfermera toma tiempo y los rendimientos son a menudo más bajos al comienzo del proceso de aprendizaje.
- En sujetos VIH positivos, utilizamos los antibióticos de manera profiláctica prebronchoscopy.
Divulgaciones
Andrea M. Collins está financiado por la Fundación Bill y Melinda Gates, y no hay posibles conflictos de intereses. Ella ha recibido fondos de Merck (MSD) y GSK para asistir a conferencias y honorarios por conferencias. 50 LBA de investigación realizaron de forma independiente.
Jamie Rylance está financiado por el Wellcome Trust, y no tiene ningún conflicto de intereses. Ha recibido ningún otro fondo. 70 LBA de investigación realizaron de forma independiente.
Daniel G. Wootton está financiado por una beca de doctorado NIHR, y no tiene ningún conflicto de intereses. 40 LBA de investigación realizaron de forma independiente.
Angela D. Wright no tiene potenciales conflictos de intereses. Asistido con más de 100 LBA investigación.
Adam KA Wright no tiene potenciales conflictos de intereses. Él ha procesado más de 50 muestras de BAL.
Duncan G. Fullerton No tiene potenciales conflictos de intereses. 100 LBA de investigación realizaron de forma independiente.
Stephen B. Gordon no tiene potenciales conflictos de intereses. Él ha recibido fondos de Merck (MSD) y Novartis para asistir a conferencias. 400 LBA de investigación realizaron de forma independiente.
Agradecimientos
¡Gracias a Elena Mitsi (asistente de investigación) y la Hermana Carole Hancock (enfermera de Investigación) y personal del teatro por su contribución a la filmación, y para David Shaw (enfermera de la investigación) por su apoyo con nuestros broncoscopias investigación. Gracias también a nuestra voluntaria Rebecca Dunphy por permitir este procedimiento para ser filmado.
Materiales
| Name | Company | Catalog Number | Comments |
Fiberoptic bronchoscope, light, and suction source | unspecified | ||
| Surgical gown, sterile gloves | unspecified | ||
| Sphygnomanometer | unspecified | For continuous patient monitoring | |
| Pulse oximeter | unspecified | For continuous patient monitoring | |
3-lead ECG monitor | unspecified | For continuous patient monitoring | |
Nasal oxygen delivery 2-4 L/min | unspecified | ||
| Lidocaine 10% spray (Xylocaine) | AstraZeneca | For topical anesthesia | |
| Lidocaine hydrochloride 2% | unspecified | For topical anesthesia | |
| Lidocaine gel (Instillagel) | Farco-Pharma, Germany | Alternative products available from other suppliers | |
Normal saline, sterile, 200 ml | unspecified | Warm to 30 °C | |
10 ml taper-end syringe (x10) | unspecified | For administration of lidocaine | |
Intravenous cannula 18 G | unspecified | For administration of midazolam | |
| Midazolam | unspecified | For sedation | |
| Flumazenil | unspecified | Reversal of benzodiazepine sedation (emergency use only) | |
60 ml taper-end syringes (x4) | unspecified | For normal saline injection and BAL fluid withdrawal. May require connector to attach to the injection port of the bronchoscope. | |
| Sterile gauze swab | Vernaid, UK | Alternative products available from other suppliers | |
| Sterile container for BAL fluid | See text and comments | Siliconized glass bottles reduce macrophage adherence. Alternatively, 50 ml centrifuge tubes may be used (total capacity 200 ml) | |
| Sigmacote | Sigma, UK | SL2 | Only if siliconised glass bottles used. NB: Harmful and flammable. If used, follow precautions detailed in manufacturer’s MSDS |
| Centrifuge | unspecified | At least 4 x 50 ml tube capacity. Refrigeration to 4 °C preferred. | |
| Shandon Cytospin centrifuge | Thermo Scientific, UK | For differential count only | |
| RPMI 1640 medium with L-glutamine | Sigma, UK | R8758 | Alternative products available from other suppliers |
| Fetal bovine serum | Sigma, UK | F6178 | Alternative products available from other suppliers |
| Penicillin-Streptomycin | Sigma, UK | P4333 | Alternative products available from other suppliers |
| Amphotericin B | Sigma, UK | A2942 | Alternative products available from other suppliers |
| Tissue culture plates | Greiner Bio-One, UK | 662160 | Alternative products available from other suppliers |
| Glass microscope slides | unspecified | For differential count only | |
| Shandon cytofunnel | Thermo Scientific, UK | A78710003 | For differential count only |
| Shandon cytoclip | Thermo Scientific, UK | 59910052 | For differential count only |
| Hemacolor staining set (fixative, red and blue reagents) | Merck, Germany | 111661 | Use according to manufacturer’s instructions |
Referencias
- BTS, The British Thoracic Society Bronchoscopy Guideline Committee - A sub-Committee of the Standards of Care Committee of the British Thoracic Society. Thorax. 56 (Suppl I), 1-21 (2001).
- . Technical recommendations and guidelines for bronchoalveolar lavage (BAL) report of the European Society for Pneumology Task Group. Eur. Respir. , 561-585 (1989).
- Gordon, S. B., Irving, G. R., Lawson, R. A., Lee, M. E., Read, R. C. Intracellular trafficking and killing of Streptococcus pneumoniae by human alveolar macrophages are influenced by opsonins. Infect. Immun. 68, 2286-2293 (2000).
- Gordon, S. B., et al. Pulmonary immunoglobulin responses to Streptococcus pneumoniae are altered but not reduced in human immunodeficiency virus-infected Malawian adults. J. Infect. Dis. 188, 666-670 (2003).
- Fullerton, D. G., et al. Domestic smoke exposure is associated with alveolar macrophage particulate load. Trop. Med. Int. Health. 14, 349-354 (2009).
- Jambo, K. C., et al. Bronchoalveolar CD4+ T cell responses to respiratory antigens are impaired in HIV-infected adults. Thorax. 66, 375-382 (2011).
- Eagan, R., et al. Lung fluid immunoglobulin from HIV-infected subjects has impaired opsonic function against pneumococci. Clin. Infect. Dis. 44, 1632-1638 (2007).
- Rose, A. S., Knox, K. S. Bronchoalveolar lavage as a research tool. Sem. Respir. Crit. Care Med. 28, 561-573 (2007).
- Wright, A. K. A., et al. Human Nasal Challenge with Streptococcus pneumoniae is Immunising in the Absence of Carriage. PLoS Pathog. , (2012).
- Bolliger, C. T., et al. ERS/ATS statement on interventional pulmonology European Respiratory Society/American Thoracic Society. Eur. Respir. J. 19, 356-373 (2002).
- Ettensohn, D. B., Jankowski, M. J., Duncan, P. G., Lalor, P. A. Bronchoalveolar lavage in the normal volunteer subject. I. Technical aspects and intersubject variability. Chest. 94, 275-280 (1988).
- Ettensohn, D. B., Jankowski, M. J., Redondo, A. A., Duncan, P. G. Bronchoalveolar lavage in the normal volunteer subject. 2. Safety and results of repeated BAL, and use in the assessment of intrasubject variability. Chest. 94, 281-285 (1988).
- De Brauwer, E. I., Jacobs, J. A., Nieman, F., Bruggeman, C. A., Drent, M. Bronchoalveolar lavage fluid differential cell count. How many cells should be counted. Anal. Quant. Cytol. Histol. 24, 337-341 (2002).
- Mtunthama, N., et al. Malawians permit research bronchoscopy due to perceived need for healthcare. J. Med. Ethics. 34, 303-307 (2008).
- Pereira, W., Kovnat, D. M., Snider, G. L. A prospective cooperative study of complications following flexible fiberoptic bronchoscopy. Chest. 73, 813-816 (1978).
- Huang, Y. C., Bassett, M. A., Levin, D., Montilla, T., Ghio, A. J. Acute phase reaction in healthy volunteers after bronchoscopy with lavage. Chest. 129, 1565-1569 (2006).
- Gritzfeld, J. F., et al. Experimental Human Pneumococcal Carriage. J. Vis. Exp. (72), (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados