Method Article
Lavaggio broncoalveolare (BAL) di ricerca; ottenere un'adeguata Yield Esempio
In questo articolo
Riepilogo
Descriviamo una tecnica di ricerca per la broncoscopia a fibre ottiche e di lavaggio broncoalveolare con l'aspirazione a bassa pressione. La tecnica è utilizzata per raccogliere cellule immunitarie dalle superfici bronco polmonare. Viene utilizzato anestesia locale e sedazione cosciente lieve (midazolam). Soggetti tollerano gli effetti collaterali minimi procedura di bene e di esperienza.
Abstract
Descriviamo una tecnica di ricerca per la broncoscopia a fibre ottiche con lavaggio broncoalveolare (BAL) con mano il manuale di aspirazione possedute al fine di rimuovere le cellule non aderenti e liquido rivestimento del polmone dalla superficie della mucosa. In ambienti ricerca, BAL permette di campionamento di innata (macrofagi polmoni), cellulari (cellule T B e) e umorali (immunoglobulina) risposte all'interno del polmonare.
BAL è accettata a livello internazionale per scopi di ricerca e dal 1999 la tecnica è stata eseguita in> 1.000 soggetti nel Regno Unito e in Malawi dal nostro gruppo.
La nostra tecnica utilizza aspirazione portatile delicato da fluido instillato, questo è stato progettato per massimizzare il volume BAL restituito e applicare una forza minima al taglio su epiteli ciliati al fine di preservare la struttura e la funzione delle cellule all'interno del BAL e preservare la vitalità di facilitare la crescita di cellule in coltura ex vivo. La tecnica di ricerca utilizza pertanto un più ampio volume di insstillato (tipicamente dell'ordine di 200 ml) e impiega aspirazione manuale per ridurre il danno cellulare.
I pazienti sono date anestesia locale, offerto sedazione cosciente (midazolam), e tollerano la procedura bene con effetti collaterali minimi. Informazioni soggette verbale e scritta migliora la tolleranza e il consenso informato scritto è obbligatoria. Sicurezza del soggetto è fondamentale. I soggetti vengono accuratamente selezionati con chiari criteri di inclusione ed esclusione.
Questo protocollo include una descrizione dei rischi potenziali e le misure adottate per mitigare loro, un elenco di controindicazioni, pre e verifiche post-procedura, nonché precise tecniche di broncoscopia e di laboratorio.
Introduzione
Sfondo
Broncoscopia a fibre ottiche è stato sviluppato per la pratica clinica, è ampiamente utilizzato sia diagnostico che terapeutico 1,2. Il lavaggio broncoalveolare (BAL) rimuove le cellule non aderenti e del polmone rivestimento liquido dalla superficie della mucosa, la biopsia viene usato per campionare mucosa e sottomucosa tessuti. In ambienti di ricerca, BAL permette di campionamento di innata (macrofagi polmonari 3-5), cellulare (B e le cellule T 6), e umorali (immunoglobuline 7) risposte all'interno del polmone.
BAL è accettata a livello internazionale per la ricerca 8 e dal 1999 la tecnica è stata eseguita in> 1.000 soggetti nel Regno Unito e in Malawi dal nostro gruppo. Usiamo questa tecnica negli studi di risposte immunitarie innate, cellulari e umorali all'antigene pneumococco inclusi sperimentale trasporto umano pneumococcica 9,17, biomassa fumo 5, HIV e la vaccinazione, e stu trattamento adiuvantemuore in recupero da polmonite. La nostra tecnica utilizza aspirazione a mano gentile di liquido instillato, questo è stato progettato per massimizzare il volume BAL restituiti e applicare una forza minima di taglio sulla epiteli ciliato al fine di preservare la struttura e la funzione delle cellule all'interno del fluido BAL.
In un contesto di ricerca BAL utilizza una tecnica diversa da quella praticata da medici di assistenza respiratoria e intensiva (lavare spesso definita bronchiale, lavaggi, di lavaggio, o BAL), che mirano a ottenere benefici diagnostico o terapeutico. La tecnica di ricerca è destinato a raccogliere le cellule e preservare la vitalità di facilitare la crescita delle cellule in coltura ex vivo. Per questi motivi la tecnica di ricerca utilizza un instillate volume più grande (tipicamente dell'ordine di 200 ml) e impiega aspirazione manuale per ridurre il danno cellulare. I pazienti sono date anestesia locale, offerto sedazione cosciente (midazolam), e tollerano la procedura bene con effetti collaterali minimi. Soggettivi verbale e scrittainformazioni t migliora la tolleranza e il consenso informato scritto è obbligatoria 1.
Scopo
L'obiettivo generale è che la procedura dovrebbe essere sicuro ed efficace. I soggetti non dovrebbero incontrare alcun disturbo fisiologico e gli operatori devono costantemente raccogliere in eccesso di 100 ml di BAL di soggetti. Dopo la procedura, i soggetti dovrebbero verificarsi effetti collaterali minimi.
Sicurezza
Sicurezza del soggetto è fondamentale. I soggetti vengono accuratamente selezionati con chiari criteri di inclusione ed esclusione. Questo protocollo include una descrizione dei rischi potenziali e le misure adottate per mitigarli.
Controindicazioni alla broncoscopia ricerca possono essere espressi come assoluto o relativo, e sono inclusi nel nostro protocollo di studio come criteri di esclusione e di inclusione. I nostri soggetti sono tutti selezionati per garantire piena salute.
Controindicazioni assoluteincludere rachide cervicale instabile, ipossia non risponde, angina instabile, diatesi emorragica e maligna aritmia cardiaca.
Le controindicazioni relative, comprese quelle condizioni associate con l'aumento del tasso di complicanze, comprendono:
Generale: mal cooperativa soggetto 1, alcun significativo problema di salute generale ad esempio l'epilessia, precedente broncoscopia mal tollerata, noto reazioni avverse ai lidocaina o midazolam, gravidanza, cattiva alimentazione.
Respiratorio: ipossia [saturazioni (CST), in onda <94%], ipercapnia, asma instabile 1, la funzione respiratoria significativa compromissione 1 (FEV1 <1 L), ipertensione polmonare.
Cardiovascolare: uremia, entro 6 settimane di infarto del miocardio 1, superior ostruzione della vena cava.
Altro: immunosoppressione (il nostro gruppo si esibisce regolarmente questa proceduradura in soggetti HIV positivi).
Vedi Tabella 1 - Rischi connessi con BAL per la ricerca.
Protocollo
1. I soggetti sono accolti all'arrivo dal Nurse Research respiratoria
- L'argomento è stato a digiuno per> 4 ore per il cibo solido e 2 ore per liquidi chiari 1.
- La procedura viene eseguita come un caso al giorno con gli opportuni controlli pre-e post-procedura (come da politica ospedaliera standard).
- Il soggetto indossa un camice.
- Una piccola cannula calibro viene inserito (idealmente in mano sinistra) e rimane in situ fino al termine del periodo di recupero post-procedura 1.
- Osservazioni Preprocedure sono prese (pressione arteriosa, frequenza cardiaca, saturazione dell'ossigeno [SATs]).
- Il soggetto viene trasferito alla suite broncoscopia.
2. Il soggetto è preparato per la Procedura nella Suite da una ricerca Clinico respiratoria Esperto in broncoscopia
- Apparecchiature di monitoraggio è fissato tra cui: 3 derivazioni, pulsossimetro 1,10 e sfigmomanometro. AnesteticiSupporto ic non è necessario compreso il consenso informato scritto.
- L'ossigeno può essere distribuito mediante cannula nasale fino a 4 L / min, per ottenere SATs> 90% 1.
- L'operatore controlla il broncoscopio, questo include la garanzia di aspirazione efficace aspirando soluzione fisiologica sterile.
- Anestesia topica con lidocaina è raggiunto nei passaggi nasali (utilizzando Instillagel 1) e la mucosa orale (usando xylocaina)
- Se la sedazione è appropriato e richiesto dal soggetto, midazolam per via endovenosa è somministrato 1. Un agente di inversione del caso (flumazenil) è immediatamente disponibile.
- Attrezzature per la rianimazione devono essere prontamente disponibili 1,10.
3. Il broncoscopio è inserita e posizionata
- Intubazione è di solito tramite il naso. Se questo non è possibile a causa di polipi nasali, turbinati infiammate, o qualsiasi disagio allora il soggetto è intubato attraverso la bocca (un paradenti è usato per preveniredanneggiare la portata o denti del soggetto).
- Anestesia topica alla laringe viene completata usando 4% lidocaina, di solito viene utilizzato un totale di 4-6 ml. Comunemente questo provoca tosse su instillazione.
- Le corde vocali sono passati, ed ulteriori anestesia delle mucose con 2 ml di lidocaina al 2% alla carena, alla divisione del lobo inferiore destro (RLL) e del lobo medio destro (RML) e all'ingresso RML.
- Il broncoscopio è posizionato all'interno della RML, idealmente nel segmento mediale, in una posizione in cui è sufficiente essere in una posizione sicura distale ma non troppo distale in modo che il collasso delle vie aeree quando si aspira ('test Wink' utilizzando il pulsante aspirazione ).
- Buon posizionamento è indicato durante la prova wink da un broncoscopio che può essere completamente mantenuta in posizione dal broncoscopista e una via aerea che non fa chiudere completamente immediatamente aspirazione delicata.
4. Il BAL viene eseguito
- Quattro 60 ml siringhe preriempito con soluzione salina riscaldata - 60 ml, 50 ml, 50 ml e 40 ml in siringhe successive. Quando il soggetto e broncoscopista sono pronti prima siringa di soluzione salina viene instillata dall'assistente broncoscopia mentre il broncoscopista mantiene la posizione nella RML.
- Aspirazione mano delicata viene quindi eseguita l'assistente utilizzando la stessa porta e 50 ml siringa.
- Questa procedura viene poi ripetuta un ulteriore 3x, con un volume massimo di 200 ml utilizzati nella nostra tecnica specifica.
- Il fluido BAL recuperato viene espulso delicatamente in contenitori etichettati già svoltasi il ghiaccio in fusione. Contenitori di vetro possono essere presiliconized per inibire l'adesione cellulare e massimizzare il rendimento cella.
- Il fluido BAL appare nebuloso contro la luce con superficie le bolle di sapone formati da tensioattivi.
- Il broncoscopio sta lentamente completamente ritirata.
- Il BAL viene trasportato immediatamente in ghiaccio per l'elaborazione immediata.
5. Oggetto Recovery
- Il soggetto viene recuperato per 2-4 ore dalla nutrice di ricerca respiratorio in un reparto.
- Durante questo periodo essi sono autorizzati a riposare e poi solo mangiare e bere> 60 min 1 dopo la procedura (quando la loro rondine è valutato come sicuro), al fine di ridurre il rischio di aspirazione.
- Osservazioni post procedurali sono monitorati e registrati. Un esame clinico si verifica prima della dimissione.
- Il soggetto è informato pre-dimissione circa gli effetti collaterali più comuni (febbre, mite destra sottomammario dolore al petto, mal di gola) e dato un numero da contattare in caso di significativi effetti collaterali si verificano 1.
- Il soggetto è un follow-up a 1-5 giorni post-procedura con un contatto clinico. Questo può essere sia per telefono o di persona.
6. Le cellule sono isolati in laboratorio - Eseguire su Melting Ice Dove Possibile
- Il volume di fluido BAL è registrato e filtrato attraverso un doppio strato di garza sterile tamponeper rimuovere i tappi di muco in prechilled, sterili provette da 50 ml centrifuga.
- Le cellule vengono pellettizzate per centrifugazione a 500 xg a 4 ° C per 5-10 minuti e lavate vortex in 50 ml di soluzione fisiologica fredda. La centrifugazione viene ripetuto una volta.
- Le cellule sono risospese in terreno di coltura (RPMI-1640 + siero bovino fetale al 10% + 2 mM L-glutammina + penicillina [40 UI / ml], streptomicina [75 UI / ml], e amfotericina B [0,5 UI / ml]) e conteggio differenziale effettuato con un volume uguale di trypan blu e un emocitometro.
- La sospensione cellulare è normalizzata alla densità richiesta (usiamo 1 x 10 6 cellule / ml), introdotto pipettando nella opportune piastre di coltura tissutale, e incubate a 37 ° C per 3 ore per consentire macrofagi aderenza. 1 ml di questa sospensione di cellule per pozzetto è appropriato per piastre di coltura da 24 pozzetti.
- Per il lavoro linfociti, dopo 3 ore di incubazione, il mezzo di coltura viene delicatamente pipettati su e giù 3x, e raccolto. Questo mezzo contiene linfocitie macrofagi non aderenti e può essere utilizzato per valutare la funzione dei linfociti, ma può essere utilizzato anche in fasi di purificazione ad esempio con CD14 biglie magnetiche per rimuovere i macrofagi.
- Per lavoro macrofagi, dopo 3 h di incubazione, il mezzo viene accuratamente rimosso con pipettaggio minimo e sostituito con fresco, medio caldo senza antibiotici (RPMI 1640 + 10% siero fetale bovino + 2 mM L-glutammina). I macrofagi sono aderenti alla piastra di coltura tissutale (vedi Figura 1).
Risultati
Buoni risultati clinici sono un volume BAL con oltre 100 ml e un soggetto che ha sperimentato al massimo, disagio minore (vedere Tabella 1). Ciò richiede un soggetto rilassato e cooperativo. Il medico deve essere sicuro, pienamente preparati (Materiali), e comprensione verso il volontario.
Variabilità inter-e intra-soggetto della resa cellulare (compresa la conta differenziale) è stato descritto. Conta delle cellule differenziali di soggetti sani sono in genere> 90% macrofagi con un piccolo numero di neutrofili (<2%) e linfociti (5-10%). Cellule BAL centrifugati su vetrini da microscopio possono essere colorati con una macchia nucleare differenziale per ottenere queste informazioni (Figura 1). In Figura 1, le cellule BAL sono state fissate e colorate con Hemacolor colorazione secondo le istruzioni del produttore. Almeno 300 celle devono essere contati per ottenere risultati affidabili per i macrofagi,neutrofili e linfociti; 500 cellule per i tipi di cellule più rari.
| Pericolo | Rischio | Ridotto in questo protocollo da: |
| Effetto della broncoscopia e BAL 1, 14 | ||
| Lieve disagio | <25% 14 # | Analgesia e sedazione adeguata. Approccio fiducioso e attento al soggetto. |
| Epistassi | <1% # | Leggera pressione solo per intubazione nasale. Se il soggetto fastidio o un diaframma più chiuso - intubazione orale invece. |
| Emorragia endobronchiale (emottisi) | <0,1% * 15 | Nessun biopsie prese. Attento controllo durante la broncoscopia - evitando mucosa respiratoria. |
| Nausea, vomito e polmonite da aspirazione | <0,02% 14, # | Il digiuno per cibo solido> 4 ore preprocedure 1. Adeguata anestesia topica. Posizione semiseduta durante la procedura. Un'attenta osservazione post-procedura. |
| Febbre | 0.01 14-1% # 16 | Si riferisce a infiammazione, e può minimizzato raccolta massima di BAL. Lobo singolo BAL solo. # |
| Naso Mal / di gola e raucedine | <25% 14 # | Adeguate anestesia topica del naso, della gola e della laringe (minimizzando tosse). |
| Infezione | <0,1% in HIV negativo, 1% in pazienti HIV positivi 14 # | Procedura broncoscopio lavaggio standard 1. Lobo singolo BAL solo. # Il riconoscimento precoce di infezione: esame clinico entro 1 ora did contatto clinica 1-5 giorni dopo la broncoscopia. |
| Dolore toracico / tosse | <0,2% 14, # | Lobo solo single BAL. Raccolta massima BAL. # |
| Effetti dei farmaci: lidocaina, midazolam | ||
| Aritmia | Molto raro * | Massimo di 5 mg / kg 14 lidocaina utilizzati. Riscaldato soluzione fisiologica instillato. # Pulsossimetria (satelliti> 90% con la supplementazione di ossigeno), il monitoraggio cardiaco tutta procedura. Benzodiazepine antagonista (flumazenil) immediatamente disponibile. |
| Disorientamento / agitazione | <0,1% † # | |
| Depressione respiratoria Cardio | Molto raro * | |
* Non sperimentato nel nostro gruppo in oltre 1.500 procedure di ricerca.
† idiosyncratic anziché reazione dose-dipendente.
# Esperienza del nostro gruppo in oltre 1.500 procedure di ricerca.
Tabella 1. Rischi connessi con BAL per la ricerca. Questo include pericolo o del rischio e come questo viene ridotto usando la tecnica descritta. Effetti della broncoscopia / BAL e anche gli effetti di tutte le droghe medicinali utilizzati sono inclusi.
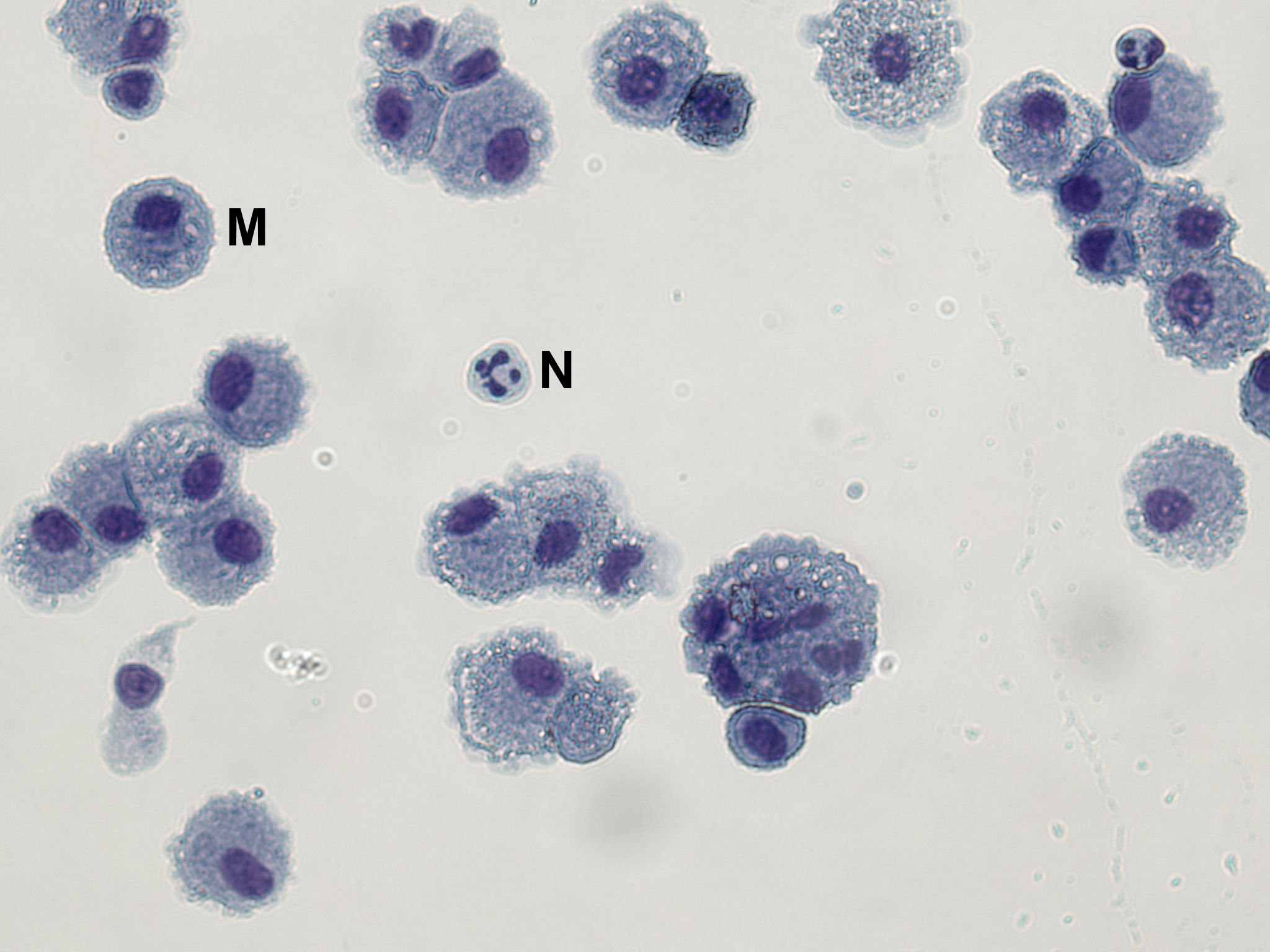
Figura 1. Un vetrino da microscopio Mostro BAL macrofagi e neutrofili occasionale. Cellule BAL sono stati fissati in metanolo e colorate con Hemacolor rosso (eosina Y) e blu (azzurro B).
Discussione
Per ottenere buoni risultati i seguenti sono utili:
- Buona anesthetisation alla base della lingua e posteriore dell'orofaringe. Questo è importante perché migliora la tolleranza procedurale del soggetto e comfort complessivo.
- O una pediatrico (diametro esterno 3,4-3,6 mm) o broncoscopio adulto (diametro esterno 4,8-5,9 mm) possono essere utilizzati.
- Se c'è qualche disagio durante l'intubazione nasale, intubazione orale è preferito. In generale, intubazione nasale o è una tecnica semplice, o dovrebbe essere abbandonato.
- Dopo instillazione iniziale di lidocaina all'orofaringe, il soggetto può preferire broncoscopio ritirata in attesa dell'inizio dell'anestesia, soprattutto se il broncoscopio viene inserito per via orale.
- Garantire almeno 10 x 10 ml siringhe sono precompilati con solo 2-4 ml di lidocaina. L'aria deve essere lasciato nelle siringhe che consentano un migliore consegna delle dell'anestesia direttamente su corde e muco endobronchialesa.
- Poiché tosse durante la procedura riduce significativamente BAL rendimento; utilizzando una soluzione salina riscaldata e con buone anestesia mucose sono importanti per ridurre questo.
- I 50 ml siringhe devono essere pre-riempite con soluzione salina riscaldata. E 'comune per i primi 50 ml di soluzione salina normale instillato cedere tra 10-20 ml causa della perdita spazio morto e la restante esecuzione nelle vie aeree terminali. Ulteriori aliquote restituiscono una percentuale maggiore di fluido.
- L'operatore deve sempre controllare il broncoscopio prima di intubazione, compresa la garanzia di aspirazione efficace aspirando soluzione fisiologica sterile. Perdita di aspirazione può comunemente verificarsi a causa di attorcigliamento del tubo o perdite attorno alle connessioni con il broncoscopio o dispositivo di aspirazione.
- Durante l'aspirazione manuale, idealmente le vie aeree non deve crollare. Se l'aspirazione crolla ricorrentemente le vie aeree, ritorna BAL ridurre al meccanismo a valvola, e infiammazione locale e sanguinamento è più probabile: questo a sua volta rende le vie aeree mminerale irritabile e tosse più probabile. La scelta del più appropriato ramo subsegmentali RML e con basse pressioni di aspirazione sono quindi entrambi importanti.
- Quando l'aria viene aspirata costantemente verificare nuovamente la connessione della siringa al broncoscopio e anche la posizione del broncoscopio nelle vie aeree distale. Se questo è un problema ricorrente, post-procedura assicurarsi che non ci siano buchi nel broncoscopio stessa.
- BAL dai fumatori è spesso più scuro a causa della presenza di particelle intracellulari. I fumatori possono tollerare la broncoscopia meno bene, e hanno aumento della tosse.
- La resa del volume BAL preferibile è> 100 ml. Una resa di> 150 ml è eccellente. Non abbiamo avuto alcun rendimenti> 170 ml. Non esiste una relazione lineare tra il rendimento delle cellule e BAL resa volume.
- I rendimenti di <100 ml sono, nella nostra esperienza, più propensi a portare a effetti collaterali quali tosse, dolore toracico e febbre. Si consiglia che i soggetti con rese di <100 ml essere recoVered in posizione laterale sinistra, puo aiutare il drenaggio di qualsiasi fluido polmone residuo.
- Contatto clinico dovrebbe essere effettuato con il soggetto entro 1-5 giorni per garantire l'assenza di effetti collaterali.
- Midazolam sedazione viene utilizzato per <50% dei soggetti nel Regno Unito e <5% in Malawi. Midazolam non sembra direttamente migliorare la tollerabilità, alcuni operatori ritengono che la sedazione a volte può essere controproducente nel mantenere un dialogo coerente (e rassicurante) con il soggetto.
- Nella nostra esperienza, c'è una curva di apprendimento significativo con questa tecnica. Per esempio il coordinamento tra medico e infermiere richiede tempo e rendimenti sono spesso inferiori all'inizio del processo di apprendimento.
- Nei soggetti HIV positivi, usiamo gli antibiotici a scopo profilattico prebronchoscopy.
Divulgazioni
Andrea M. Collins è finanziato dalla Bill e Melinda Gates Foundation, e nessun potenziale conflitto di interessi. Ha ricevuto fondi dalla Merck (MSD) e GSK per partecipare a conferenze e le tasse universitarie. 50 Bals di ricerca svolte in modo indipendente.
Jamie Rylance è finanziato dal Wellcome Trust, e non ha alcun conflitto di interessi. Egli non ha ricevuto altri fondi. 70 Bals di ricerca svolte in modo indipendente.
Daniel G. Wootton è finanziato da un NIHR PhD Fellowship, e non ha conflitti di interesse. 40 Bals di ricerca svolte in modo indipendente.
Angela D. Wright non ha alcun potenziale conflitto di interessi. Assist con oltre 100 Bals ricerca.
Adam KA Wright non ha alcun potenziale conflitto di interessi. Ha elaborato oltre 50 campioni di BAL.
Duncan G. Fullerton Non ha alcun potenziale conflitto di interessi. 100 Bals di ricerca svolte in modo indipendente.
Stephen B. Gordon non ha alcun potenziale conflitto di interessi. Ha ricevuto fondi dalla Merck (MSD) e Novartis per partecipare a conferenze. 400 Bals di ricerca svolte in modo indipendente.
Riconoscimenti
Grazie a Elena Mitsi (Assistente di ricerca) e suor Carole Hancock (infermiere Research) e personale del teatro per il loro contributo alla ripresa, e David Shaw (infermiere ricerca) per il suo supporto con i nostri broncoscopie di ricerca. Grazie anche al nostro volontario Rebecca Dunphy per consentire a questa procedura per essere girato.
Materiali
| Name | Company | Catalog Number | Comments |
Fiberoptic bronchoscope, light, and suction source | unspecified | ||
| Surgical gown, sterile gloves | unspecified | ||
| Sphygnomanometer | unspecified | For continuous patient monitoring | |
| Pulse oximeter | unspecified | For continuous patient monitoring | |
3-lead ECG monitor | unspecified | For continuous patient monitoring | |
Nasal oxygen delivery 2-4 L/min | unspecified | ||
| Lidocaine 10% spray (Xylocaine) | AstraZeneca | For topical anesthesia | |
| Lidocaine hydrochloride 2% | unspecified | For topical anesthesia | |
| Lidocaine gel (Instillagel) | Farco-Pharma, Germany | Alternative products available from other suppliers | |
Normal saline, sterile, 200 ml | unspecified | Warm to 30 °C | |
10 ml taper-end syringe (x10) | unspecified | For administration of lidocaine | |
Intravenous cannula 18 G | unspecified | For administration of midazolam | |
| Midazolam | unspecified | For sedation | |
| Flumazenil | unspecified | Reversal of benzodiazepine sedation (emergency use only) | |
60 ml taper-end syringes (x4) | unspecified | For normal saline injection and BAL fluid withdrawal. May require connector to attach to the injection port of the bronchoscope. | |
| Sterile gauze swab | Vernaid, UK | Alternative products available from other suppliers | |
| Sterile container for BAL fluid | See text and comments | Siliconized glass bottles reduce macrophage adherence. Alternatively, 50 ml centrifuge tubes may be used (total capacity 200 ml) | |
| Sigmacote | Sigma, UK | SL2 | Only if siliconised glass bottles used. NB: Harmful and flammable. If used, follow precautions detailed in manufacturer’s MSDS |
| Centrifuge | unspecified | At least 4 x 50 ml tube capacity. Refrigeration to 4 °C preferred. | |
| Shandon Cytospin centrifuge | Thermo Scientific, UK | For differential count only | |
| RPMI 1640 medium with L-glutamine | Sigma, UK | R8758 | Alternative products available from other suppliers |
| Fetal bovine serum | Sigma, UK | F6178 | Alternative products available from other suppliers |
| Penicillin-Streptomycin | Sigma, UK | P4333 | Alternative products available from other suppliers |
| Amphotericin B | Sigma, UK | A2942 | Alternative products available from other suppliers |
| Tissue culture plates | Greiner Bio-One, UK | 662160 | Alternative products available from other suppliers |
| Glass microscope slides | unspecified | For differential count only | |
| Shandon cytofunnel | Thermo Scientific, UK | A78710003 | For differential count only |
| Shandon cytoclip | Thermo Scientific, UK | 59910052 | For differential count only |
| Hemacolor staining set (fixative, red and blue reagents) | Merck, Germany | 111661 | Use according to manufacturer’s instructions |
Riferimenti
- BTS, The British Thoracic Society Bronchoscopy Guideline Committee - A sub-Committee of the Standards of Care Committee of the British Thoracic Society. Thorax. 56 (Suppl I), 1-21 (2001).
- Technical recommendations and guidelines for bronchoalveolar lavage (BAL) report of the European Society for Pneumology Task Group. Eur. Respir. , 561-585 (1989).
- Gordon, S. B., Irving, G. R., Lawson, R. A., Lee, M. E., Read, R. C. Intracellular trafficking and killing of Streptococcus pneumoniae by human alveolar macrophages are influenced by opsonins. Infect. Immun. 68, 2286-2293 (2000).
- Gordon, S. B., et al. Pulmonary immunoglobulin responses to Streptococcus pneumoniae are altered but not reduced in human immunodeficiency virus-infected Malawian adults. J. Infect. Dis. 188, 666-670 (2003).
- Fullerton, D. G., et al. Domestic smoke exposure is associated with alveolar macrophage particulate load. Trop. Med. Int. Health. 14, 349-354 (2009).
- Jambo, K. C., et al. Bronchoalveolar CD4+ T cell responses to respiratory antigens are impaired in HIV-infected adults. Thorax. 66, 375-382 (2011).
- Eagan, R., et al. Lung fluid immunoglobulin from HIV-infected subjects has impaired opsonic function against pneumococci. Clin. Infect. Dis. 44, 1632-1638 (2007).
- Rose, A. S., Knox, K. S. Bronchoalveolar lavage as a research tool. Sem. Respir. Crit. Care Med. 28, 561-573 (2007).
- Wright, A. K. A., et al. Human Nasal Challenge with Streptococcus pneumoniae is Immunising in the Absence of Carriage. PLoS Pathog. , (2012).
- Bolliger, C. T., et al. ERS/ATS statement on interventional pulmonology European Respiratory Society/American Thoracic Society. Eur. Respir. J. 19, 356-373 (2002).
- Ettensohn, D. B., Jankowski, M. J., Duncan, P. G., Lalor, P. A. Bronchoalveolar lavage in the normal volunteer subject. I. Technical aspects and intersubject variability. Chest. 94, 275-280 (1988).
- Ettensohn, D. B., Jankowski, M. J., Redondo, A. A., Duncan, P. G. Bronchoalveolar lavage in the normal volunteer subject. 2. Safety and results of repeated BAL, and use in the assessment of intrasubject variability. Chest. 94, 281-285 (1988).
- De Brauwer, E. I., Jacobs, J. A., Nieman, F., Bruggeman, C. A., Drent, M. Bronchoalveolar lavage fluid differential cell count. How many cells should be counted. Anal. Quant. Cytol. Histol. 24, 337-341 (2002).
- Mtunthama, N., et al. Malawians permit research bronchoscopy due to perceived need for healthcare. J. Med. Ethics. 34, 303-307 (2008).
- Pereira, W., Kovnat, D. M., Snider, G. L. A prospective cooperative study of complications following flexible fiberoptic bronchoscopy. Chest. 73, 813-816 (1978).
- Huang, Y. C., Bassett, M. A., Levin, D., Montilla, T., Ghio, A. J. Acute phase reaction in healthy volunteers after bronchoscopy with lavage. Chest. 129, 1565-1569 (2006).
- Gritzfeld, J. F., et al. Experimental Human Pneumococcal Carriage. J. Vis. Exp. (72), (2013).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon