Method Article
La purificación de la fibrosis quística regulador de conductancia transmembrana de proteínas expresadas en
En este artículo
Resumen
La expresión heteróloga y purificación del regulador de la conductancia transmembrana de la fibrosis quística (CFTR) son retos importantes y los factores limitantes en el desarrollo de terapias con medicamentos para la fibrosis quística. Este protocolo describe dos métodos para el aislamiento de cantidades de miligramos de CFTR adecuados para los estudios funcionales y estructurales.
Resumen
Los defectos en el regulador de la conductancia transmembrana de la fibrosis quística (CFTR) de proteínas causan la fibrosis quística (FQ), una enfermedad autosómica recesiva que actualmente limita la esperanza media de vida de los enfermos a <40 años de edad. El desarrollo de moléculas de drogas nuevas para restaurar la actividad de CFTR es un objetivo importante en el tratamiento de la FQ, y el aislamiento de CFTR funcionalmente activo es una medida útil para lograr este objetivo.
Se describen dos métodos para la purificación de CFTR de un sistema de expresión heteróloga eucariótica, S. cerevisiae. Al igual que los sistemas procariotas, S. cerevisiae se puede cultivar rápidamente en el laboratorio a bajo costo, sino también el tráfico y después de la traducción puede modificar proteínas de membrana grandes. La selección de los detergentes para la solubilización y purificación es un paso crítico en la purificación de cualquier proteína de membrana. Habiendo proyectado para la solubilidad de CFTR en varios detergentes, hemos elegido dos contrasting detergentes para su uso en la purificación que permiten la preparación de CFTR final para ser adaptado a los experimentos planificados posteriormente.
En este método, proporcionamos comparación de la purificación de CFTR en dodecil-β-D-maltósido (DDM) y 1-tetradecanoil-sn-glicero-3-fosfo-(1'-rac-glicerol) (GLP-14). La proteína purificada en DDM por este método muestra la actividad ATPasa en ensayos funcionales. Proteína purificada en GLP-14 muestra una alta pureza y rendimiento, se pueden emplear para estudiar las modificaciones post-traduccionales, y se puede utilizar para los métodos estructurales tales como de pequeño ángulo de dispersión de rayos X y microscopía electrónica. Sin embargo, muestra la actividad de la ATPasa significativamente menor.
Introducción
La fibrosis quística (FQ) es la enfermedad genética más común en Europa y América del Norte, con una incidencia de aproximadamente 1 de cada 2.500 nacidos vivos. CF ocurre cuando las mutaciones en el regulador de la conductancia transmembrana de la fibrosis quística (CFTR) causa la proteína pérdida de su función en la membrana plasmática de las células epiteliales 1. La consecuencia más grave de este defecto es el daño pulmonar irreversible, lo cual acorta la esperanza de vida de los enfermos a <40 años de edad 2,3.
CFTR es un ATP vinculante cassette (ABC) transportador que ha evolucionado para convertirse en un 1,4 del canal iónico. A pesar de su función bastante alterado en la membrana plasmática de las células, que aún conserva homología de secuencia significativa con otros transportadores ABC. Curiosamente, las partes especializadas del CFTR (es decir, su región reguladora y su N-y C-terminales) comparten ninguna similitud de secuencia significativa con otros metazoos transportadores ABC, por lo tanto, no hay pistas en cuanto a the orígenes de estas secuencias en CFTR. Sobre la base de su estructura primaria, CFTR está clasificado como un miembro de la familia C-de la familia de transportadores ABC, pero no hay evidencia fuerte para un enlace funcional residual para esta sub-familia. Ha habido algunos informes de la actividad del transporte glutatión para CFTR 5-7, lo que sería coherente con el papel de los otros miembros de la familia C-8,9, aunque otros informes sugieren que el glutatión reducido puede inhibir la actividad CFTR ATPasa, en lugar de mostrar la estimulación inducida por sustrato-que caracterizan a los transportadores ABC 10. La medición de la conductancia de iones es suficientemente sensible para permitir la actividad de los canales de CFTR moléculas individuales que se estudió 1 y las propiedades del canal CFTR han sido controlados como una función de tiempo, temperatura, concentración de ATP, potencial de membrana, y estado de fosforilación, así como en la presencia de una gran cantidad de inhibidores de moléculas pequeñas, potenciadores, y modificadores. Estosestudios también han aumentado considerablemente nuestro conocimiento de cómo funcionan los transportadores ABC. Sin embargo, la expresión de CFTR en cantidades significativas y su posterior purificación ha demostrado ser particularmente difícil y el éxito ha sido limitado a unos pocos laboratorios 10-13.
La necesidad de desarrollar fármacos más eficaces es apremiante, sin embargo, este proceso se ha visto obstaculizado por la falta de CFTR purificada para la detección de moléculas pequeñas. Resolver el problema de la expresión de CFTR y purificación permitiría la detección de drogas de alto rendimiento destinado a corregir el defecto primario en la FQ y podría también abrir una ruta para estudios estructurales de alta resolución para informar el diseño racional de fármacos. Por otra parte, incluso características bioquímicas relativamente básicas de la proteína, tales como su estado oligomérico funcional, las proteínas que interactúan y la actividad ATPasa permanecen pobremente caracterizados. Hemos informado anteriormente de un protocolo para la expresión a gran escala de las buenas prácticas agrarias y CFTR murino marcado con Hisen S. cerevisiae 14 y ahora también describen protocolos para la purificación de CFTR. Hemos utilizado estos métodos para purificar cinco orthologues de CFTR, y los datos presentes para la purificación de CFTR pollo como un ejemplo. La selección de los detergentes para la solubilización y purificación es un paso crítico en la purificación de cualquier proteína de membrana. Después de haber proyectado para la solubilidad de CFTR en varios detergentes, hemos elegido dos detergentes de contraste para uso en la purificación. Dodecil-β-D-maltósido (DDM) es un detergente no iónico que se ha utilizado ampliamente para ambos estudios estructurales y funcionales de las proteínas de membrana 15-21. El detergente iónico 1-tetradecanoil-sn-glicero-3-fosfo-(1'-rac-glicerol) (GLP-14) es altamente eficaz en la solubilización de CFTR y se ha utilizado anteriormente en la purificación de proteínas de membrana funcionales 10, 22,23, incluyendo la purificación de CFTR a partir de S. cerevisiae 24.
Protocolo
1. Preparación de Buffers
- Para hacer el caldo 100x del inhibidor de la proteasa (PI) cóctel disolver 96 mg AEBSF, 3,5 mg quimostatina, 10 mg E64, 16,5 mg leupeptina, pepstatina 16,5 mg, 348 mg de PMSF, y 4 mg bestatina en 20 ml de DMSO. Hacer alícuotas de 1 ml y almacenar a -20 ° C. Para hacer un balance de 100x benzamidina, disolver 720 mg en 20 ml de agua ultrapura (ddH 2 O) y almacenar en alícuotas de 1 ml a -20 ° C. Esta cantidad es suficiente para una purificación. En todos los tampones, las existencias de PI y benzamidina se utilizan en una dilución de 1:100.
- Preparar 'MPIB' (0,3 M Tris, pH 8, 0,3 M de sacarosa, DTT 2 mM) y 'CFTR' (50 mM Tris pH 8, 20% (/ v) de glicerol v, 1 mM de DTT) tampones y el enfriamiento a 4 ° C . Antes de su uso, añadir 1:100 del cóctel inhibidor de la proteasa y 1:100 de benzamidina de acuerdo con el volumen de MPIB utiliza para resuspender el sedimento de células (por ejemplo, utilizar 3,5 ml de PI y 3,5 ml de benzamidina en un volumen total de 350 ml MPIB).
- Preparar solubilization tampones. Tampón de solubilización liso-fosfatidil glicerol-14 (GLP) (50 mM Tris pH 8, 10% (v / v) de glicerol, NaCl 50 mM, DTT 1 mM, inhibidores de la proteasa (IP) y 4% (w / v) GLP) y maltósido dodecil (DDM) tampón de solubilización (Tris 50 mM pH 8, 20% (v / v) de glicerol, NaCl 1 M, DTT 1 mM, inhibidores de la proteasa, 4% (w / v) de DDM). Buffer puede sonicó en un baño de ultrasonidos (35 W, 40 kHz) para ayudar en la dispersión del detergente, pero evite el vórtice de la mezcla, ya que esto crea burbujas. Enfriamiento a 4 ° C antes de su uso.
- Tampón de purificación de CFTR para la purificación de GLP es Tris 50 mM, 10% (v / v) de glicerol, NaCl 50 mM, DTT 1 mM, 0,1% (p / v) inhibidores de GLP-14 y de la proteasa. Preparar 350 ml de este tampón, y 150 ml del mismo tampón más 1 M imidazol. Ajustar el pH de ambos buffers a 8.
- El tampón para la purificación en DDM consta de 50 mM Tris pH 8, 20% (v / v) de glicerol, NaCl 1 M, DTT 1 mM, 0,1% (w / v) de DDM. Preparar 350 ml de este tampón y 150 ml del mismo tampón y 1 M imidazole. Ajustar el pH de ambos buffers a 8.
- Para la cromatografía de permeación en gel (GPC) tampón que contiene GLP, preparar Tris 50 mM pH 8, 10% (v / v) de glicerol, NaCl 50 mM, DTT 1 mM, 0,05% (w / v) de GLP-14. Para GPC usando DDM preparar un tampón de 50 mM de Tris pH 8, 20% (v / v) de glicerol, NaCl 1 M, DTT 1 mM, 0,1% (w / v) de DDM. Todos los tampones y ddH2O utilizados en la columna de la GPC deben ser filtradas (0,2 micras filtro) y desgasificar antes de su uso.
- Tampón de muestra de SDS-PAGE (2x la concentración de trabajo): 50 mM de Tris-HCl, pH 7,6, 5% (v / v) de glicerol, EDTA 5 mM, 0,02% (w / v) de azul de bromofenol. Hacer 700 ml de alícuotas y se almacena a -20 ° C. Antes del uso, añadir 200 l de 20% (w / v) de dodecil sulfato de sodio (SDS) y 100 l de DTT 0,5 M fresca. Incubar durante al menos 10 minutos con la muestra a temperatura ambiente antes de cargar el gel. No caliente; esto va a desnaturalizar la GFP y puede causar CFTR a agregarse.
- Para hacer que las existencias de lípidos para la reconstitución, disolver un 04:01 (w / w) mezcla de E. coli lípidos unad colesterol en cloroformo y metanol (2:1 v / v), y se seca en un vial de vidrio en atmósfera de N2 gas durante 2 horas para formar una película de lípido. Añadir tampón de GPC (sin NaCl) a una concentración de lípidos de 40 mg / ml y utilizar vórtex repetida y sonicación (35 W, 40 kHz) para aclarar la solución.
- Para el ensayo de ATPasa, preparar 100x existencias de los inhibidores de la ATPasa disolviendo SCH28080 a 1 mM en DMSO, NaSCN a 1 M en ddH2O y oligomicina a 2,5 mM en 100% (v / v) de etanol. Almacenar en alícuotas a -20 ° C. Hacer 100 ml de tampón de ATPasa con 50 mM de Tris pH 7,4, 150 mM NH 4 Cl, 5 mM de MgSO4 y 0,02% (w / v) NaN 3. Esto se puede almacenar a temperatura ambiente y se utiliza para varios ensayos. Preparar una acción ATP 5 mM inmediatamente antes de su uso y mantener en hielo. (NB Uso de Na 2 ATP para prevenir la excesiva señal de fondo a partir de fosfato en el ensayo). Preparar la solución de SDS parada (12% (w / v) de SDS en ddH2O).
- Para la detección Chifflet preparar tampón A (3% (w/ V) de ascorbato, 0,5% (w / v) de molibdato de amonio, HCl 0,5 M) inmediatamente antes de su uso y tampón B (2% (w / v) de citrato de sodio, 2% (w / v) de sodio meta-arsenito, 2% (v / v) de ácido acético).
2. Aislamiento de microsomas de levadura
- S. cerevisiae que expresan CFTR pollo se cultivan como se describe en O'Ryan et al. (2012) 14. Guarde el material de una fermentación L 20 en dos alícuotas a -80 ° C durante un máximo de 6 meses.
- Descongelar una alícuota de células rápidamente y volver a suspender en 3 ml MPIB refrigerado por gramo de células.
- Romper las células en un molino de bolas usando perlas de vidrio de 425-600 micras de diámetro. Utilice cinco períodos 1 min de la ruptura celular separadas por períodos de descanso 1 min. (Los períodos de descanso son esenciales para asegurar que las células no se calientan durante la interrupción.)
- Monitorear la disrupción celular por centrifugación de una muestra de 1 ml de lisado de células de la molino de perlas. Se centrifuga (12.000 xg, 4 º C, 5 min) en un centr de sobremesaifuge. Diluir el sobrenadante a 01:50 con MPIB en una cubeta y medir la A 380. Si A 380> 0.1, o ha dejado de crecer a pesar de varios ciclos de cuentas que superaron repetidas, continúe con el siguiente paso. Si no, repita 02.03 a 02.04.
- Centrifugar el lisado celular total (12.000 x g, 4 ° C, 20 min). Conserve el sobrenadante. Deseche el sedimento (que contiene células sin romper y mitocondrias), pero si hay alguna duda acerca de la eficacia de la rotura celular (ver 2.4), luego guarde el pellet también.
- Centrifugar el sobrenadante de la etapa anterior (200.000 xg, 4 ° C, 1,5 h). Desechar el sobrenadante y resuspender las membranas microsomales sedimentadas en tampón de CFTR. Si los microsomas están destinados para la purificación usando DDM, complementar la memoria intermedia de CFTR con 1 M de NaCl.
- Repetir la centrifugación de la fracción de membrana se resuspendió (100.000 x g, 4 ° C, 1 hora) y descartar el sobrenadante.
- Resuspender los microsomas sedimentadas enun volumen mínimo de tampón de CFTR (volumen final de 5-15 ml, proteína microsomal total de 70-200 mg). Un ensayo de Bradford puede ser utilizado para determinar la concentración total de proteínas microsomales 25. Además, el espectro de emisión de fluorescencia de las membranas debe ser medido (excitación = 485 nm, emisión = 500-600 nm) y debe tener un pico distinto fluorescencia de GFP (máximo a 512 nm). CFTR puede ser detectada específicamente en un gel de SDS-PAGE, en condiciones escaneada fluorescencia de GFP (Figura 1).
- Flash congelar los microsomas resuspendidos por inmersión en nitrógeno líquido y se almacenan a -80 ° C, o continuar con el paso 3.
3. Solubilización de microsomas
- Si se congela, descongelar microsomas inmediatamente antes de su uso en un baño de agua a 10 ° C.
- Para la solubilización de las membranas, diluir los microsomas con un volumen igual de tampón de solubilización el relevante (Paso 1.3) para dar una concentración final de detergente de2% (w / v) y una proteína microsomal de concentración de 5 mg / ml. Incubar esta mezcla durante 1 hora a 4 ° C con agitación (rotador tubo). Conserve 200 l para el análisis.
- Centrifugar la mezcla (100.000 xg, 4 ° C, 45 min). Eliminar el sobrenadante que contiene las proteínas de membrana solubilizadas, pasarla a través de un filtro de jeringa de 0,45 micras y almacenar en hielo. Medir la fluorescencia del sobrenadante (como en el paso 2.8).
- Resuspender la fracción insoluble en 1% (w / v) de solución de SDS a un volumen igual a la fracción soluble. Medir la fluorescencia en esta fracción y retener una parte alícuota de 50 l para el análisis de SDS-PAGE.
4. La purificación de afinidad de níquel-de CFTR
- Enlace columnas dos de 5 ml de níquel Sepharose en serie. Lavar con 2 volúmenes de columna (CV) 20% (v / v) de etanol, seguido de 2 CV ddH2O, a continuación, lavar la columna con 2 CV de tampón de solubilización (Paso 1.4 hasta 1.5), que contiene 1 M imidazol. Repita con 2 CV de solubilizationes tampón que carecen de imidazol.
- Añadir imidazol a una concentración final de 5 mM para el material solubilizado (Paso 2.8) y cargar manualmente el material en la columna o en un bucle de muestras si se utiliza un dispositivo de cromatografía de líquidos automatizado.
- Cargar el material solubilizado en la columna a una velocidad de flujo de 0,5 ml / min, y se lava con 2 CV de tampón de imidazol-carente a la misma velocidad de flujo para eliminar el material no unido. Recoger fracciones de 50 ml tubos Falcon.
- Para el primero de lavado, usar 3 CV de tampón de purificación con imidazol 40 mM a una velocidad de flujo de 1 ml / min. Recoger fracciones de 2 ml.
- Para el segundo lavado, use 3 CV de tampón de purificación con imidazol 100 mM. Recoger fracciones de 2 ml.
- Elute CFTR de la columna de HisTrap con 3 CV de tampón de purificación con imidazol 400 mM. Recoger fracciones de 2 ml.
- Monitorear la fluorescencia en las fracciones eluidas (Paso 2.8).
- Conservar alícuotas de fracciones de los picos para el análisis de SDS-PAGE. Congelación flash restante pico fmuestras raction y almacenarlos a -80 ° C, o seguir a la siguiente etapa de purificación.
5. Cromatografía de exclusión molecular (GPC) Purificación de CFTR
- Equilibrar la columna (Superose 6 10/300 GL) con 1,2 CV ddH2O seguido de 1,2 CV de tampón GPC.
- Durante el Paso 5.1, concentrar las de Ni-afinidad fracciones purificadas con la más alta fluorescencia de GFP usando un filtro centrífugo de MWCO de 100.000 a 4 ° C. Si purificador en DDM, evitar la concentración de la muestra por encima de una concentración de proteína de 0,3 mg de proteína / ml, ya que esto hará que la pérdida de muestra significativo. Retire el retenido de la concentrador y se centrifuga a 100.000 x g durante 30 min a 4 ° C para sedimentar las partículas grandes.
- Inyectar la muestra en la columna y eluir con un gradiente isocrático de 1,2 CV de tampón de GPC. Recoger fracciones de 0,5 ml.
- Medir la fluorescencia de GFP como en la sección 2.8 para identificar las fracciones que contienen CFTR. Conserve un pequeño volumen (por ejemplo </ Em> 50 l) de cada uno para el análisis por SDS-PAGE.
- Congele fracciones en nitrógeno líquido y se almacenan a -80 ° C.
6. Reconstitución de CFTR
- Añadir lípidos (Paso 1.8) a la CFTR purificada en ratio de 100:1-lípido a proteína (w / w) y se incuba a 4 ° C durante 1 hora. Del mismo modo establecer un control de lípidos única, la sustitución de la proteína purificada con el mismo volumen de tampón de GPC.
- Retire el detergente de la mezcla de proteína / lípido utilizando perlas adsorbentes hidrófobos. Lavar perlas adsorbentes en 5 CV ddH2O, 5 CV 70% (v / v) de etanol, 5 CV ddH2O, y 5 CV de tampón de GPC que carecen de la detergente. Añadir 200 mg de perlas adsorbentes lavadas por ml de proteína purificada y se incuba a 4 ° C durante la noche con agitación suave.
- Recoger la muestra de la reconstitución de las perlas adsorbentes en un tubo nuevo utilizando una pipeta de punta fina terminación.
7. Medición de la Actividad ATPasa
- Determinar la tasa de CFTActividad de la ATPasa-R específica utilizando un ensayo de Chifflet modificado 26,27 en un formato de placa de 96 pocillos. Con fosfato de sodio solución madre (0,65 mM) preparar 0-20 nmol de fosfato en un volumen final de 50 l como estándares. Utilice una mezcla 1:1 de tampón de CFTR y tampón para diluir la ATPasa de stock de fosfato.
- Incubar ambos CFTR reconstituido y liposomas en blanco con 1:100 (v / v) inhibidores de la ATPasa (Paso 1.9) en hielo durante 10 min. Use al menos 5 g de CFTR reconstituido.
- Añadir ATP (Paso 1.9) a una concentración final de 2 mM y se incuba a 25 ° C durante 1 hora. Detener la reacción mediante la adición de 40 l de 10% (w / v) SDS (Paso 1.9) a cada pocillo (incluyendo los estándares).
- Añadir 100 l de tampón A (paso 1,10) y se incuba durante 10 min. Añadir 100 l de tampón B (1.10) a cada pocillo y medir la absorbancia a una longitud de onda de 800 nm en un Espectrofotómetro UV / VIS compatible con placa de 96 pocillos.
- Convertir la absorbancia a 800 nm en una cantidad de fosfato liberado utilizando elnormas de fosfato. Calcular la tasa de hidrólisis de ATP después de restar la señal de fondo (sólo liposoma pozos).
- Para CFTR no reconstituido seguir el mismo protocolo utilizando tampón de CFTR para las lecturas de fondo.
Resultados
El protocolo descrito anteriormente es un medio eficaz para aislar microsomas de CFTR-enriquecido, con recuperación casi completa de CFTR durante la rotura de células y preparación de los microsomas de crudo (Figura 1). Otros métodos de rotura de células también se pueden emplear eficazmente. Hemos utilizado una célula de presión francesa, y otros dispositivos high-pressure/cavitation (también en combinación con un impacto contra un objetivo rubí) con igual eficacia. Por conveniencia y bajo costo inicial del equipo, nos encontramos con el método de talones paliza el mejor.
El uso de GLP para solubilizar y purificar CFTR produjo 80 g de proteína / l de cultivo en> 90% de pureza (Figura 2). El alto rendimiento fue debido a la solubilización eficiente de CFTR por LPG (comparar Figura 2B, carriles 2 y 4). Además, eficiente y de unión a la columna ajustado resultó en una pérdida mínima de CFTR en la fracción no unida y la ausencia de CFTR en las fracciones de lavado (Figura 2, carriles 3, 5, y6). La proteína eluida tenía una pureza de> 90%, estimada por geles de SDS-PAGE teñidos con Coomassie y mediante densitometría de la CFTR y bandas de contaminantes. Cromatografía de permeación en gel (GPC) separa GLP-CFTR purificado de los contaminantes de bajo peso molecular (Figura 4, panel inferior).
El protocolo para la purificación de CFTR utilizando DDM da pureza de aproximadamente el 60% y el rendimiento de aproximadamente 50 g / L (Figura 3). La microscopía electrónica (EM) de las fracciones teñidas negativamente de la GPC que eluye a aproximadamente 10 ml (Figura 4) mostró que CFTR purificada-DDM contiene agregados de 20-30 nm de diámetro, así como partículas más pequeñas de 10 nm de diámetro (datos no mostrados). Es posible que los pequeños agregados de forma reversible pueden asociar y disociar como ultrafiltración con un filtro de corte de 1 MDa fallado para eliminar los agregados EM-detectables. Material de GLP-purificado no adsorbe a una rejilla resplandor-dado de alta, por lo tanto, fue estudiado por crio-EM de las fracciones teñidas. Esto mostróuna población de partículas muy homogénea de un tamaño relativamente pequeño (6-8 nm de diámetro, datos no mostrados).
Por último, la actividad de ATPasa de las proteínas purificadas se midió (Figura 5). Como miembro de la familia de proteínas ABC, CFTR tiene dos dominios de unión de nucleótidos (NBDs) capaz de unirse y / o hidrólisis de ATP. Los datos indican que la proteína purificada no era capaz de hidrolizar el ATP en el estado-GLP solubilizado y mostró una débil actividad ATPasa en la presencia de DDM (Figura 5, las barras sin relleno). Después de la adición de los lípidos, y la eliminación del detergente, la actividad ATPasa fue 4 veces mayor para las muestras que habían sido purificados en DDM (13 nmol de ATP / min / mg de proteína). La adición de lípidos y la eliminación de GLP actividad similar restaurado a CFTR que había sido aislado utilizando GLP, pero con una menor tasa final (1,5 nmol de ATP / min / mg de proteína) que el material de DDM-purificado y reconstituido.

Figura 1 monitorización de los niveles de CFTR pollo en lisado de células (CL)., Los sobrenadantes (S) y gránulos (P) durante diversas etapas de centrifugación utilizados para el aislamiento de microsomas y lavado. Geles de SDS-PAGE se visualizaron utilizando la fluorescencia en gel de la GFP tag. El sobrenadante después de la rotura celular y la centrifugación a 14000 x g contiene prácticamente todo el CFTR (incluyendo productos de degradación). Ultracentrifugación a 200.000 xg sedimentos todo el CFTR de longitud completa dejando algunos fragmentos en el sobrenadante. Ultracentrifugación a 100.000 xg de sal se lavó microsomas pellets de casi todo el CFTR con la eliminación de algunos fragmentos adicionales.
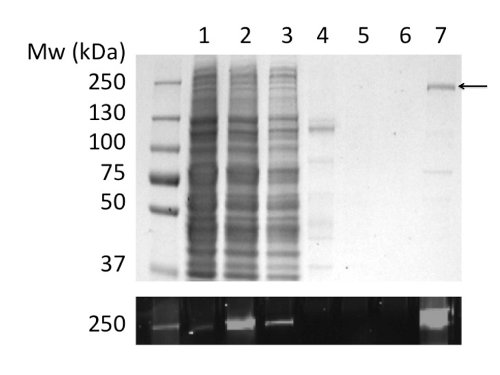
Figura 2. Purificación de CFTR pollo en GLP por cromatografía de afinidad por iones metálicos inmovilizados. Las fracciones se analizaron por SDS-PAGE seguido por tinción de Coomassie (panel superior) y la detección de fluorescencia de la etiqueta GFP (panel inferior). Pistas: (1) Microsomas. (2) GLP-microsomas solubilizados. (3) El material no unido. (4) El material insoluble. (5) y (6) 40 y 100 lavados mM imidazol. (7) El material eluido con imidazol 400 mM.
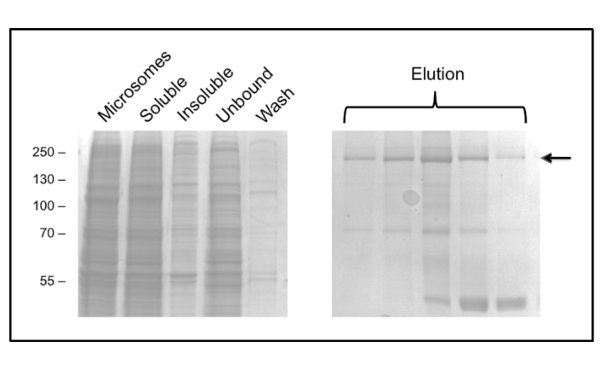
Figura 3. Purificación de CFTR pollo en DDM por cromatografía de afinidad por iones metálicos inmovilizados. Las fracciones se analizaron por SDS-PAGE seguido por tinción de Coomassie. El panel de la izquierda muestra las fracciones antes de la elución. Varias fracciones de elución consecutivos se muestran en el panel de la derecha con CFTR enindicada por la flecha. Las fracciones posteriores se enriquecen en un contaminante de 40 kDa, que ha sido identificado por espectrometría de masas como la proteína ribosomal L3.
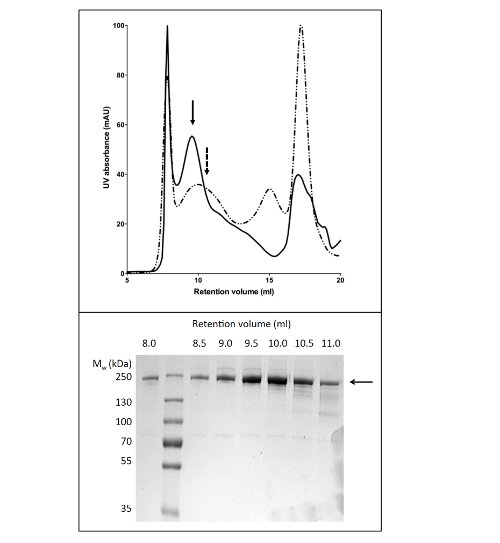
Figura 4. Purificación de CFTR de pollo por cromatografía de permeación en gel. CFTR purificado por cromatografía de afinidad de Ni-se concentró y se aplicó a una columna de GPC. El perfil de elución de CFTR (panel superior) purificado en tampón que contiene GLP-14 (línea continua) o DDM (línea discontinua) se superponen. SDS-PAGE (panel inferior), reveló que CFTR eluye entre 8 y 11 ml.
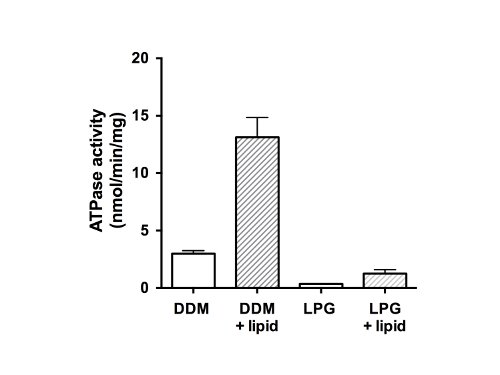
Figura 5. Activit ATPasaY de fracciones purificadas de proteína CFTR de pollo. purificado en DDM o GLP se ensayó usando un ensayo de Chifflet modificado 26 en presencia de un cóctel de inhibidores de ATPasa para eliminar cualquier fondo de actividad de la ATPasa de F-, P-y ATPasas de tipo V (barras sin relleno ). La tasa de hidrólisis de ATP se midió también después de la eliminación del detergente y la adición de lípidos (barras rellenas). El gráfico muestra la media y la desviación estándar (n = 3). Las diferencias entre los valores medios para la actividad ATPasa en presencia y ausencia de lípidos, y la diferencia entre la actividad en DDM y el GLP son significativas a p <0,05.
Discusión
Hemos descrito previamente un método para la sobreexpresión de CFTR murino 14. Desde la publicación de ese protocolo, hemos expresado y purificado varias orthologs diferentes de CFTR utilizando el mismo sistema. Todos los ortólogos probado hasta ahora purificaron bien en el detergente de GLP, mientras que la purificación DDM mostró más variación entre diferentes ortólogos (datos no mostrados). Esta flexibilidad ilustra la fortaleza del enfoque de la levadura: es posible seleccionar muchas construcciones con relativa rapidez con el fin de seleccionar uno para un propósito particular.
Lavar los microsomas de levadura con tampón que contenía 1 M de NaCl antes de la solubilización con resultados DDM en una preparación de microsoma más limpio y reduce los contaminantes en las etapas posteriores. Este paso no es necesario en el protocolo GLP como la muestra final de CFTR es> 90% puro sin el lavado de microsomas. Además, la purificación en DDM requiere varias alteraciones a los tampones para la solubilización de unND purificación, a saber, la adición de glicerol y el exceso de sal. En conjunto, estas adiciones aumentaron considerablemente la unión de la proteína-DDM solubilizado a la columna.
La metodología de purificación DDM tiene margen para la mejora, en particular, la eliminación de un contaminante principal 40 kDa que, juzgado por espectrometría de masas, es debido a la subunidad ribosómica de levadura L3, que parece tener una afinidad inherente para la resina de níquel. No hay una secuencia poliHis obvio en la proteína L3, pero el examen de su estructura 3D cuando se une al ribosoma (AP = 1FFK) muestra que la subunidad L3 plegada tiene un clúster poliHis potencial. Que esta banda es menos problemática en materia de GLP-purificado puede ser debido a que el detergente GLP más dura.
Aunque la purificación en DDM parece ser más pobre que en GLP, detergentes más suaves tales como DDM pueden ser más compatible con los análisis funcionales y estructurales y se han utilizado ya en varios crystall de rayos Xestudios radiográficos de las proteínas de membrana 15-21. Además, nuestros resultados indicaron que el uso de GLP conduce a la pérdida de la función ATPasa en CFTR en relación con la purificación en DDM. Por lo tanto le recomendamos el protocolo de purificación a base de GLP para la generación de CFTR donde la pureza es crucial, por ejemplo, en aplicaciones tales como la caracterización de las modificaciones post-traduccionales, o en la generación de anticuerpos, se elegiría el protocolo basado en GLP . Por otro lado, en aplicaciones en las que es esencial la actividad y estado completamente nativa de la proteína, propondríamos el protocolo basado en DDM como una mejor opción.
Para concluir, este protocolo describe un método reproducible para el aislamiento de CFTR en el detergente zwitteriónico GLP-14 o el detergente no iónico DDM. Como tal, indica una mayor gama de condiciones de purificación para CFTR que han sido previamente informado 10-13. En miligramo Además cantidades de CFTR purificados pueden serobtenido utilizando estos procedimientos cuando se combina con un sistema de crecimiento de la levadura de alto volumen tal como un fermentador de 20 L y un sistema de recolección de células de alta capacidad tal como un 6 L de rotor de la centrifugadora de baja velocidad. El CFTR obtenido tiene una etiqueta GFP escindible que permite la monitorización fácil de la proteína en diversos ensayos bioquímicos y biofísicos.
El reactivo se describe en este manuscrito (plásmido que contiene CFTR-pollo o células de levadura congelados) se puede obtener a través de la Fundación de Fibrosis Quística (EE.UU.).
Divulgaciones
Los autores no tienen intereses financieros en competencia ni otro conflicto de interés con respecto a este trabajo.
Agradecimientos
Este trabajo fue financiado por los EE.UU. Fundación de Fibrosis Quística (CFF) a través de su estructura Consorcio CFTR 3D. TR fue financiado por una beca Unido CF Trust, y Carolina del Norte por una beca Unido BBSRC. Reconocemos a nuestros colegas en la estructura de consorcio CFF CFTR 3D por su ayuda y asesoramiento y para el diseño de las secuencias CFTR pollo y purificación de las etiquetas de codones optimizados.
Materiales
| Name | Company | Catalog Number | Comments |
| 0.2 μm syringe filter | Sartorius | FC121 | |
| 100 kDa MWCO centrifugal concentrator (PES membrane) | Vivaspin | VS0641 | |
| 2 ml microfuge tubes | Sarstedt | 72.695 | |
| 40Ti rotor | Beckman Coulter | 337901 | |
| 50 ml sterile Falcon tubes | Sarstedt | 62.547.254 | |
| Adenosine triphosphate disodium salt (Na2ATP) | Sigma-Aldrich | A26209 | |
| Liquid chromatography system | GE Healthcare | 28-4062-64 | |
| Aminoethylbenzenesulfonyl fluoride (AEBSF) | Sigma-Aldrich | A8456 | |
| Glass bead-beating cell disrupter | BioSpec | 1107900 | |
| Benchtop centrifuge | HERMLE | Z300 | |
| Benchtop centrifuge | Eppendorf | 5417R | |
| Benchtop microfuge | Fisher | 13-100-511 | |
| Benzamidine hydrochloride | Sigma-Aldrich | 434760 | |
| Hydrophobic Beads SM-2 Adsorbent | BioRad | 152-3920 | |
| Bromophenol blue | Sigma-Aldrich | 114391 | |
| Centrifuge tubes | Beckman Coulter | 357000 | |
| Gel imaging system | BioRad | 170-808 | |
| Cholesterol | Sigma-Aldrich | C8667 | |
| Chymostatin | Sigma-Aldrich | C7268 | |
| Dimethylsulfoxide (DMSO) | Sigma-Aldrich | D8418 | |
| Dithiothreitol (DTT) | Sigma-Aldrich | 43815 | |
| E. coli total lipid extract | Avanti lipids | 100500 | |
| Epoxysuccinyl-leucylamido-butane (E-64) | Sigma-Aldrich | E3132 | |
| Glass beads, acid washed | Sigma | G8772 | |
| Glycerol | Fisher | 65017 | |
| HisTrap HP columns (5 ml) | GE Healthcare | 17-5247-05 | |
| Rapid Coomassie Stain | Novexin | ISB1L | |
| Centrifuge JA-17 rotor | Beckman Coulter | 369691 | |
| Leupeptin | Merck | 108975 | |
| Lyso-phosphatidyl glycerol-14 (LPG) | Avanti lipids | 858120 | |
| MgSO4 | Sigma-Aldrich | M7506 | |
| Gel tank SDS-PAGE system | BioRad | 165-8006 | |
| n-Dodecyl-β-D-maltopyranoside (DDM) | Affymetrix | D310S | |
| NaCl | Sigma-Aldrich | S6191 | |
| NaN3 | Sigma-Aldrich | S2002 | |
| NH4Cl | Sigma-Aldrich | A9434 | |
| Oligomycin | Sigma-Aldrich | 75351 | |
| Ultracentrifuge | Beckman Coulter | 392050 | |
| Prestained protein standards | Fermentas | SM1811 | |
| Desalting columns (Sephadex G-25) | GE Healthcare | 17-0851-01 | |
| Pepstatin A | Sigma-Aldrich | P4265 | |
| Phenylmethanesulfonylfluoride (PMSF) | Sigma-Aldrich | P7626 | |
| SCH28080 | Sigma-Aldrich | S4443 | |
| Sodium dodecyl sulfate (SDS) | Sigma-Aldrich | L37771 | |
| Sodium thiocyanate (NaSCN) | Sigma-Aldrich | 251410 | |
| Gel filtration 10/300 GL column | GE Healthcare | 17-5172-01 | |
| Tris-base | Formedium | TRIS01 | |
| Ultracentrifuge tubes | Beckman Coulter | 355618 | |
| Vortex mixer | Star Labs | N2400-0001 | |
| Ultrasonic water bath | Ultrawave | F0002202 | |
| Multimode plate reader | BioTek | BTH1MF |
Referencias
- Aleksandrov, A. A., Aleksandrov, L. A., Riordan, J. R. CFTR (ABCC7) is a hydrolyzable-ligand-gated channel. Pflugers Arch. 453, 693-702 (2007).
- Dodge, J. A., Lewis, P. A., Stanton, M., Wilsher, J. Cystic fibrosis mortality and survival in the UK: 1947-2003. EUR RESPIR J. 29, 522-526 (2007).
- O'Sullivan, B. P., Freedman, S. D. Cystic fibrosis. Lancet. 373, 1891-1904 (2009).
- Rommens, J. M., et al. Identification of the cystic fibrosis gene: chromosome walking and jumping. Science. 245, 1059-1065 (1989).
- Kariya, C., et al. A role for CFTR in the elevation of glutathione levels in the lung by oral glutathione administration. Am J Physiol Lung Cell Mol Physiol. 292, (2007).
- Gould, N. S., Min, E., Martin, R. J., Day, B. J. CFTR is the primary known apical glutathione transporter involved in cigarette smoke-induced adaptive responses in the lung. Free Radic Biol Med. 52, 1201-1206 (2012).
- Childers, M., Eckel, G., Himmel, A., Caldwell, J. A new model of cystic fibrosis pathology: lack of transport of glutathione and its thiocyanate conjugates. Med Hypotheses. 68, 101-112 (2007).
- Cole, S. P., et al. Overexpression of a transporter gene in a multidrug-resistant human lung cancer cell line. Science. 258, 1650-1654 (1992).
- Conseil, G., Deeley, R. G., Cole, S. P. Polymorphisms of MRP1 (ABCC1) and related ATP-dependent drug transporters. Pharmacogenet Genomics. 15, 523-533 (2005).
- Ketchum, C. J., Rajendrakumar, G. V., Maloney, P. C. Characterization of the adenosinetriphosphatase and transport activities of purified cystic fibrosis transmembrane conductance regulator. Biochemistry. 43, 1045-1053 (2004).
- Ramjeesingh, M., et al. A novel procedure for the efficient purification of the cystic fibrosis transmembrane conductance regulator (CFTR). Biochem J. 327 (Pt 1), 17-21 (1997).
- Huang, P., Liu, Q., Scarborough, G. A. Lysophosphatidylglycerol: a novel effective detergent for solubilizing and purifying the cystic fibrosis transmembrane conductance regulator. Anal Biochem. 259, 89-97 (1998).
- Rosenberg, M. F., Kamis, A. B., Aleksandrov, L. A., Ford, R. C., Riordan, J. R. Purification and crystallization of the cystic fibrosis transmembrane conductance regulator (CFTR). J Biol Chem. 279, 39051-39057 (2004).
- O'Ryan, L., Rimington, T., Cant, N., Ford, R. C. Expression and purification of the cystic fibrosis transmembrane conductance regulator protein in Saccharomyces cerevisiae. J Vis Exp. , (2012).
- Oldham, M. L., Chen, J. Snapshots of the maltose transporter during ATP hydrolysis. Proc Natl Acad Sci USA. 108, 15152-15156 (2011).
- Pinkett, H. W., Lee, A. T., Lum, P., Locher, K. P., Rees, D. C. An inward-facing conformation of a putative metal-chelate-type ABC transporter. Science. 315, 373-377 (2007).
- Dawson, R. J. P., Locher, K. P. Structure of a bacterial multidrug ABC transporter. Nature. 443, 180-185 (2006).
- Gerber, S., Comellas-Bigler, M., Goetz, B. A., Locher, K. P. Structural basis of trans-inhibition in a molybdate/tungstate ABC transporter. Science. 321, 246-250 (2008).
- Ward, A., Reyes, C. L., Yu, J., Roth, C. B., Chang, G. Flexibility in the ABC transporter MsbA: Alternating access with a twist. Proc Natl Acad Sci USA. 104, 19005-19010 (2007).
- Kadaba, N. S., Kaiser, J. T., Johnson, E., Lee, A., Rees, D. C. The high-affinity E. coli methionine ABC transporter: structure and allosteric regulation. Science. 321, 250-253 (2008).
- Aller, S. G., et al. Structure of P-Glycoprotein Reveals a Molecular Basis for Poly-Specific Drug Binding. Science. 323, 1718-1722 (2009).
- Koehler, J., et al. Lysophospholipid micelles sustain the stability and catalytic activity of diacylglycerol kinase in the absence of lipids. Biochemistry. 49, 7089-7099 (2010).
- Tian, C., et al. Preparation, functional characterization, and NMR studies of human KCNE1, a voltage-gated potassium channel accessory subunit associated with deafness and long QT syndrome. Biochemistry. 46, 11459-11472 (2007).
- Huang, P., Liu, Q., Scarborough, G. A. Lysophosphatidylglycerol: a novel effective detergent for solubilizing and purifying the cystic fibrosis transmembrane conductance regulator. Anal Biochem. 259, 89-97 (1998).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem. 72, 248-254 (1976).
- Chifflet, S., Torriglia, A., Chiesa, R., Tolosa, S. A method for the determination of inorganic phosphate in the presence of labile organic phosphate and high concentrations of protein: Application to lens ATPases. Analytical Biochemistry. 168, 1-4 (1988).
- Rothnie, A., et al. The importance of cholesterol in maintenance of P-glycoprotein activity and its membrane perturbing influence. Eur Biophys J. 30, 430-442 (2001).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados