Method Article
Purification de la fibrose kystique régulateur de la conductance transmembranaire protéine exprimée dans
Dans cet article
Résumé
Expression hétérologue et purification du régulateur de la conductance transmembranaire de la fibrose kystique (CFTR) sont des défis importants et les facteurs limitants dans le développement de thérapies pour la fibrose kystique. Ce protocole décrit deux méthodes pour l'isolement de quelques milligrammes de CFTR appropriés pour des études fonctionnelles et structurelles.
Résumé
Irrégularités dans le régulateur de la conductance transmembranaire de la fibrose kystique (CFTR) protéines provoquent la fibrose kystique (FK), une maladie autosomique récessive qui limite actuellement l'espérance de vie moyenne des personnes atteintes de <40 ans. Le développement de nouvelles molécules de médicaments à restaurer l'activité de la protéine CFTR est un objectif important dans les FC de traitement, et l'isolement de la protéine CFTR fonctionnellement active est une étape utile pour atteindre cet objectif.
Nous décrivons deux méthodes pour la purification de la protéine CFTR à partir d'un système d'expression hétérologue eucaryote, S. cerevisiae. Comme les systèmes procaryotes, S. cerevisiae peut être cultivée rapidement dans le laboratoire à faible coût, mais peut également le trafic et post-traductionnelle modifier grosses protéines membranaires. La sélection des détergents pour la solubilisation et la purification est une étape critique dans la purification de toute protéine de la membrane. Ayant examiné pour la solubilité de la protéine CFTR dans plusieurs détergents, nous avons choisi deux contrasting détergents pour utilisation dans la purification qui permettent la préparation finale de la protéine CFTR à être adaptée par la suite aux expériences envisagées.
Dans ce procédé, nous proposons des comparaisons de la purification de la protéine CFTR dans le dodécyl-β-D-maltoside (DDM) et de 1-tétradécanoyl-sn-glycéro-3-phospho-(1'-rac-glycérol) (LPG-14). Protéine purifiée dans DDM par cette méthode présente une activité ATPase dans des essais fonctionnels. La protéine purifiée dans le GPL-14 montre une grande pureté et le rendement, peuvent être employés pour étudier les modifications post-traductionnelles, et peut être utilisé pour les méthodes structurelles telles que la diffusion aux petits angles des rayons X et par microscopie électronique. Cependant, il présente une activité d'ATPase significativement plus faible.
Introduction
La fibrose kystique (FK) est la maladie génétique la plus répandue en Europe et en Amérique du Nord avec une incidence d'environ 1 à 2500 naissances vivantes. Se produit quand CF mutations dans le régulateur de la conductance transmembranaire de la fibrose kystique (CFTR) cause la protéine de perte de sa fonction à la membrane plasmique des cellules épithéliales 1. La conséquence la plus grave de ce défaut est dommage irréversible des poumons, ce qui raccourcit l'espérance de vie des personnes souffrant de <40 ans de 2,3 ans.
CFTR est une cassette (ABC) transporteur ATP-binding qui a évolué pour devenir un 1,4 de canal ionique. En dépit de sa fonction tout à fait altéré dans la membrane plasmique des cellules, elle conserve encore une homologie de séquence significative avec d'autres transporteurs ABC. Curieusement, les parties spécialisées du CFTR (sa région réglementaire et son N-et C-terminales) partagent aucune similarité de séquence significative avec d'autres métazoaires transporteurs ABC, donc il n'y a pas d'indices que pour ee origines de ces séquences dans la protéine CFTR. Sur la base de sa structure primaire, la protéine CFTR est classé comme un membre de la famille C-de la famille des transporteurs ABC, mais il n'existe pas de preuves solides pour une liaison fonctionnelle résiduelle de cette sous-famille. Il ya eu des rapports d'activité de transport de glutathion pour CFTR 5-7, ce qui serait compatible avec les rôles des autres membres du C-famille 8,9, bien que d'autres rapports suggèrent que le glutathion réduit peut inhiber l'activité CFTR ATPase, plutôt que de montrer la stimulation induite par le substrat qui caractérisent les transporteurs ABC 10. La mesure de la conductance d'ions est suffisamment sensible pour permettre à l'activité de canal de molécules CFTR simples à étudier 1 et les propriétés du canal CFTR a été surveillée en fonction du temps, de la température, de la concentration de l'ATP, du potentiel de membrane, et de l'état de phosphorylation, comme dans le présence d'une multitude de petites molécules inhibitrices, des potentialisateurs et des modificateurs. Cesétudes ont également ajouté de manière significative à notre connaissance du fonctionnement des transporteurs ABC. Néanmoins, l'expression de la protéine CFTR dans des quantités significatives et sa purification ultérieure s'est avérée particulièrement difficile et le succès a été limité à quelques laboratoires 10-13.
La nécessité de développer des médicaments plus efficaces est criante, mais ce processus a été entravé par le manque de CFTR purifié pour le criblage de petites molécules. Résoudre le problème de l'expression de la protéine CFTR et la purification permettrait le dépistage des drogues à haut débit visant à corriger le défaut primaire dans les FC et aussi ouvrir une route pour des études structurales à haute résolution pour informer la conception rationnelle de médicaments. De plus, même relativement caractéristiques biochimiques de base de la protéine, telle que l'état oligomère fonctionnel, des protéines interagissant et l'activité ATPase restent mal caractérisés. Nous avons précédemment rapporté un protocole pour l'expression à grande échelle de la GFP-CFTR et murine His-taggeddans S. cerevisiae 14 et maintenant décrire plus avant les protocoles pour la purification de la protéine CFTR. Nous avons utilisé ces méthodes pour purifier les cinq orthologues de la protéine CFTR, et des données présentes pour la purification de la protéine CFTR de poulet, par exemple. La sélection des détergents pour la solubilisation et la purification est une étape critique dans la purification de toute protéine de la membrane. Après avoir examiné de la solubilité de la protéine CFTR dans plusieurs détergents, nous avons choisi deux détergents contrastants pour une utilisation dans la purification. Dodécyl-β-D-maltoside (DDM) est un détergent non ionique qui a été largement utilisé à la fois pour des études structurales et fonctionnelles des protéines de membrane de 15 à 21. Le détergent ionique 1-tétradécanoyl-sn-glycéro-3-phospho-(1'-rac-glycérol) (LPG-14) est très efficace dans la solubilisation de la protéine CFTR et a déjà été utilisé dans la purification de protéines membranaires fonctionnelles 10, 22,23, y compris la purification de la protéine CFTR à partir de S. 24 cerevisiae.
Protocole
1. Préparation de tampons
- Pour faire le stock 100x de l'inhibiteur de la protéase (IP) cocktail dissoudre 96 mg AEBSF, 3,5 mg chymostatine, 10 mg E64, 16,5 mg leupeptine, 16,5 mg de pepstatine, 348 mg de PMSF, et 4 mg bestatine dans 20 ml de DMSO. Faire aliquotes de 1 ml et conserver à -20 ° C. Pour faire un bilan de 100x benzamidine, dissoudre 720 mg dans 20 ml d'eau ultra-pure (le trou DDH 2 O) et magasin en aliquotes de 1 ml à -20 ° C. Cette quantité est suffisante pour une purification. Dans tous les tampons, PI et benzamidine stocks sont utilisés à une dilution de 1:100.
- Préparer 'MPIB' (0,3 M Tris pH 8, 0,3 M de saccharose, 2 mM de DTT) et «CFTR» (50 mM Tris pH 8, 20% (v / v) de glycerol, 1 mM DTT) des tampons et refroidissement à 4 ° C . Avant l'utilisation, ajouter 1:100 du cocktail d'inhibiteurs de protease et 1:100 benzamidine en fonction du volume de MPIB utilisé pour remettre en suspension le culot de cellules (par exemple, en utilisant 3,5 ml et 3,5 ml PI benzamidine dans un volume total de 350 ml MPIB).
- Préparer solubilization tampons. Tampon de solubilisation lyso-phosphatidyl-glycérol-14 (LPG) (50 mM Tris pH 8, 10% (v / v) de glycerol, NaCl 50 mM, DTT 1 mM, inhibiteurs de protease (IP) et 4% (p / v) GPL) et maltoside de dodécyle (DDM) du tampon de solubilisation (50 mM Tris pH 8, 20% (v / v) de glycerol, 1 M de NaCl, 1 mM de DTT, les inhibiteurs de protéase, 4% (p / v) DDM). Tampon peut être soumis à des ultrasons dans un bain de sonication (35 W, 40 kHz) pour aider à la dispersion du détergent, mais il faut éviter le mélange au vortex, car cela crée des bulles. Refroidissement à 4 ° C avant utilisation.
- CFTR tampon de purification pour la purification de GPL est Tris 50 mM, 10% (v / v) de glycerol, 50 mM de NaCl, 1 mM de DTT, 0,1% (p / v) de GPL-14 et des inhibiteurs de protéase. Préparer 350 ml de ce tampon, et 150 ml du même tampon plus 1 M d'imidazole. Ajuster le pH des deux tampons à 8.
- Le tampon pour la purification en DDM se compose de 50 mM de Tris pH 8, 20% (v / v) de glycerol, 1 M de NaCl, 1 mM de DTT, 0,1% (p / v) DDM. Préparer 350 ml de ce tampon, et 150 ml du même tampon et 1 M imidazole. Ajuster le pH des deux tampons à 8.
- Par chromatographie de perméation sur gel (GPC) du tampon contenant du GPL, de préparer 50 mM Tris pH 8, 10% (v / v) de glycerol, 50 mM de NaCl, 1 mM de DTT, 0,05% (p / v) de GPL-14. Par GPC en utilisant DDM préparer un tampon de 50 mM Tris pH 8, 20% (v / v) de glycerol, 1 M de NaCl, 1 mM de DTT, 0,1% (p / v) DDM. Tous les tampons et le trou DDH 2 O utilisés sur la colonne de GPC doivent être filtrés (filtre de 0,2 um) et dégazé avant utilisation.
- Tampon échantillon SDS-PAGE (2x la concentration de travail): 50 mM Tris-HCl pH 7,6, 5% (v / v) de glycérol, 5 mM d'EDTA, 0,02% (p / v) de bleu de bromophénol. Faire 700 aliquotes et conserver à -20 ° C. Avant l'utilisation, ajouter 200 ul de 20% (p / v) de dodécylsulfate de sodium (SDS) et 100 pi de frais 0,5 M DTT. Incuber pendant au moins 10 min avec l'échantillon à température ambiante avant de le charger sur le gel. Ne pas chauffer; ce sera dénaturer la GFP et peut provoquer CFTR à agréger.
- Pour rendre les stocks de lipides pour la reconstitution, on dissout un mélange 4:1 (p / p) de E. coli lipides und cholestérol dans du chloroforme et de methanol (2:1 v / v), et la sécher dans un flacon en verre sous atmosphère de N2 gazeux pendant 2 heures pour former un film lipidique. Ajouter tampon GPC (sans NaCl) à une concentration de lipide de 40 mg / ml et en utilisant un vortex répété et traitement par ultrasons (35 W, 40 kHz) pour clarifier la solution.
- Pour le dosage de l'ATPase, 100x préparer des stocks d'inhibiteurs d'ATPase en dissolvant SCH28080 à 1 mM dans du DMSO, NaSCN à 1 M dans le trou DDH 2 O et oligomycine à 2,5 mM dans 100% (v / v) d'éthanol. Magasin à -20 ° C. Ajoutez 100 ml de tampon ATPase avec 50 mM de Tris pH 7,4, 150 mM de NH 4 Cl, 5 mM MgSO4 et 0,02% (p / v) de NaN3. Ceci peut être conservé à température ambiante et utilisée pour plusieurs dosages. Préparer un stock ATP 5 mM immédiatement avant l'utilisation et garder sur la glace. (NB utilisation Na 2 ATP pour éviter excessive signal de fond de phosphate dans le test). Préparer la solution d'arrêt de SDS (12% (p / v) de SDS dans le trou DDH 2 O).
- Pour la détection Chifflet préparer tampon A (3% (en poids/ V) de l'ascorbate, de 0,5% (p / v) de molybdate d'ammonium, du HCl 0,5 M) immédiatement avant l'utilisation et le tampon B (2% (p / v) de citrate de sodium, 2% (p / v) de sodium méta-arsénite, 2% (v / v) d'acide acétique).
2. Isolement des microsomes de levure
- S. cerevisiae exprimant CFTR de poulet sont cultivées comme décrit dans O'Ryan et al. (2012) 14. Stocker le matériel à partir d'une fermentation de 20 L en deux aliquotes à -80 ° C pendant jusqu'à 6 mois.
- Décongeler une aliquote de cellules rapidement et remettre en suspension dans 3 ml de MPIB réfrigéré par gramme de cellules.
- Rompre les cellules dans un broyeur à billes utilisant des billes de verre de diamètre 425-600 um. Utilisez cinq périodes de 1 min de rupture des cellules séparées par une période de repos min. (Les périodes de repos sont essentiels pour s'assurer que les cellules ne sont pas chauffées en cas de perturbation.)
- Surveillance de la rupture des cellules par centrifugation d'un échantillon de 1 ml du lysat cellulaire à partir de l'broyeur à billes. Centrifugeuse (12 000 xg, 4 ° C, 5 min) dans un centr de paillasseifuge. Diluer le surnageant à 1:50 avec MPIB dans une cuvette et mesurer l'A 380. Si A 380> 0,1, ou a cessé d'augmenter malgré plusieurs cycles répétés de perles battement, passez à l'étape suivante. Sinon, répétez 2.3-2.4.
- Centrifuger le lysat cellulaire totale (12.000 x g, 4 ° C, 20 min). Conserver le surnageant. Éliminer le culot (contenant des cellules et des mitochondries intactes), mais si il ya un doute sur l'efficacité de la rupture des cellules (voir 2.4), puis conserver le culot aussi.
- Centrifuger le surnageant provenant de l'étape précédente (200 000 xg, 4 ° C, 1,5 h). Jeter le surnageant et remettre en suspension les membranes microsomales culot dans un tampon de CFTR. Si les microsomes sont destinés à la purification en utilisant DDM, compléter le tampon de la protéine CFTR avec 1 M de NaCl.
- Répéter la centrifugation de la fraction membranaire remis en suspension (100000 x g, 4 ° C, 1 h) et jeter le surnageant.
- Remettre en suspension les granulés dans des microsomesun volume minimum de tampon CFTR (volume final de 5 à 15 ml au total, la protéine microsomale de 70 à 200 mg). Un dosage de Bradford peut être utilisée pour déterminer la concentration totale de protéines microsomales 25. En outre, le spectre d'émission de fluorescence de la membrane doit être mesurée (excitation = 485 nm, émission = 500 à 600 nm) et doit avoir une fluorescence GFP pic distinct (maximum à 512 nm). CFTR peut être spécifiquement détecté sur un gel SDS-PAGE, numérisée dans des conditions de fluorescence de GFP (Figure 1).
- Flash geler les microsomes remises en suspension par immersion dans l'azote liquide et conserver à -80 ° C, ou passez à l'étape 3.
3. Solubilisation de microsomes
- En cas de gel, décongeler microsomes immédiatement avant utilisation dans un bain-marie réglé à 10 ° C.
- Pour la solubilisation des membranes, diluer les microsomes avec un volume égal de tampon de solubilisation approprié (étape 1.3) pour donner une concentration finale de détergent de2% (p / v) et une protéine microsomale concentration de 5 mg / ml. Incuber ce mélange pendant une heure à 4 ° C avec agitation (tube de rotateur). Conserver 200 pi pour analyse.
- Centrifuger le mélange (100 000 x g, 4 ° C, 45 min). Retirer le surnageant contenant les protéines membranaires solubilisées, le passer à travers un filtre à seringue de 0,45 um et stocker sur de la glace. Mesurer la fluorescence du surnageant (comme à l'étape 2.8).
- Remettre en suspension la fraction insoluble dans 1% (p / v) de solution de SDS à un volume égal à la fraction soluble. Mesurer la fluorescence dans cette fraction et de retenir une partie aliquote de 50 pi pour l'analyse SDS-PAGE.
4. Nickel-purification par affinité de la protéine CFTR
- Lien colonnes deux 5 ml nickel sépharose en série. Laver avec 2 volumes de colonne (CV) de 20% (v / v) d'éthanol, suivi par 2 CV ddH 2 O, puis laver la colonne avec 2 CV de tampon de solubilisation (étape 1.4 à 1.5), contenant 1 M d'imidazole. Répéter l'opération avec 2 CV de solubilization tampon manque imidazole.
- Ajouter imidazole à une concentration finale de 5 mM pour le matériau solubilisé (étape 2.8) et de charger manuellement la matière sur la colonne ou dans une boucle d'échantillon si on utilise un dispositif de chromatographie en phase liquide automatisée.
- Chargez le matériau solubilisé sur la colonne à un débit de 0,5 ml / min, et laver avec 2 CV de tampon imidazole-défaut au même débit à éliminer le matériel libre. Recueillir des fractions en tubes de 50 ml Falcon.
- Pour le premier lavage, utiliser 3 CV de tampon de purification avec 40 mM d'imidazole à un débit de 1 ml / min. Recueillir fractions de 2 ml.
- Pour le second lavage, utiliser 3 CV de tampon de purification avec 100 mM d'imidazole. Recueillir fractions de 2 ml.
- Elute CFTR de la colonne HisTrap avec 3 CV de tampon de purification avec 400 mM d'imidazole. Recueillir fractions de 2 ml.
- Surveillance de fluorescence dans les fractions éluées (étape 2.8).
- Conserver des aliquotes de fractions de pic pour l'analyse SDS-PAGE. Un gel rapide restant pic féchantillons de raction et conserver à -80 ° C, ou continuent de l'étape de purification suivante.
5. Chromatographie sur gel perméable (GPC) Purification de la protéine CFTR
- Équilibrer la colonne (Superose 6 10/300 GL) avec 1,2 CV ddH 2 O suivie par 1.2 tampon CV GPC.
- Lors de l'étape 5.1, concentrer les Ni-affinité fractions purifiées avec la fluorescence de la GFP plus élevé en utilisant un filtre centrifuge 100 000 MWCO à 4 ° C. Si purification dans DDM, d'éviter la concentration de l'échantillon au-dessus d'une concentration de protéine de 0,3 mg / ml de protéine car cela entraînerait une perte importante de l'échantillon. Retirez la rétention du concentrateur et centrifuger à 100 000 x g pendant 30 min à 4 ° C pour sédimenter les grosses particules.
- Injecter cet échantillon sur la colonne et éluer avec un gradient isocratique de 1,2 CV de tampon GPC. Recueillir fractions de 0,5 ml.
- Mesurer la fluorescence de la GFP comme dans la section 2.8 pour identifier les fractions contenant la protéine CFTR. Conserver un petit volume (par exemple </ Em> 50 ul) de chacune pour analyse par SDS-PAGE.
- Congeler fractions dans l'azote liquide et conserver à -80 ° C.
6. Reconstitution de la protéine CFTR
- Ajouter lipides (étape 1.8) pour le CFTR purifiée selon un rapport de 100:1 à-lipide-protéine (p / p) et incuber à 4 ° C pendant 1 heure. Même mis en place un contrôle des lipides seule, en remplaçant la protéine purifiée avec le même volume de tampon GPC.
- Retirer le détergent du mélange protéine / lipide en utilisant des billes d'adsorbant hydrophobes. Laver les billes d'adsorbant en 5 CV trou DDH 2 O, 5 CV de 70% (v / v) d'éthanol, 5 CV trou DDH 2 O, et 5 CV de tampon GPC dépourvu du détergent. Ajouter 200 mg de billes d'adsorbant lavé par ml de protéine purifiée et incuber à 4 ° C pendant une nuit sous agitation douce.
- Recueillir l'échantillon de reconstitution des billes d'adsorbant dans un nouveau tube à l'aide d'une pipette fine indéterminée.
7. Mesure de l'activité ATPase
- Déterminer le taux de FTActivité ATPase spécifique-R en utilisant un dosage modifié 26,27 Chifflet dans un format de plaque à 96 puits. Avec du phosphate de sodium solution stock (0,65 mM) préparer 0-20 phosphate nmol dans un volume final de 50 pi en tant que normes. Utilisez un mélange 1:1 de tampon de CFTR et tampon ATPase de diluer le phosphate actions.
- Incuber deux CFTR reconstitué et des liposomes vides avec 1:100 (v / v) les inhibiteurs de l'ATPase (étape 1.9) sur la glace pendant 10 min. Utilisez au moins 5 ug de la protéine CFTR reconstitué.
- Ajouter ATP (étape 1.9) à une concentration finale de 2 mM et incuber à 25 ° C pendant 1 heure. Arrêter la réaction en ajoutant 40 ul de 10% (p / v) de SDS (étape 1.9) à chaque puits (y compris les normes).
- Ajouter 100 pi de tampon A (étape 1.10) et incuber pendant 10 min. Ajouter 100 ul de tampon B (1,10) à chaque puits et mesurer l'absorbance à une longueur d'onde de 800 nm dans un spectrophotomètre UV / VIS à une plaque de 96 puits compatible.
- Autre absorbance à 800 nm dans une quantité de phosphate libéré en utilisant lales normes de phosphate. Calculer le taux de l'hydrolyse d'ATP après soustraction de signal de fond (liposomes seuls puits).
- Pour CFTR non reconstitué suivre le même protocole en utilisant un tampon CFTR pour les lectures de fond.
Résultats
Le protocole décrit ci-dessus est un moyen efficace pour isoler les microsomes CFTR enrichi, avec récupération presque complète de CFTR au cours de la rupture des cellules et la préparation des microsomes bruts (figure 1). D'autres procédés de rupture des cellules peuvent également être utilisés efficacement. Nous avons utilisé une cellule de pression française, et d'autres dispositifs de high-pressure/cavitation (également en combinaison avec un impact contre une cible de rubis) avec la même efficacité. Pour plus de commodité et de faible coût initial de l'équipement, on trouve la méthode perle de battre le meilleur.
Utilisation de GPL pour solubiliser et purifier la protéine CFTR a abouti à 80 pg de protéine / L de culture de pureté> 90% (figure 2). Le rendement élevé est dû à la solubilisation efficace de CFTR par GPL (comparer la figure 2b, les voies 2 et 4). En outre, l'efficacité et la liaison étanche à la colonne ont donné lieu à une perte minimale de la protéine CFTR dans la fraction non liée et de l'absence de la protéine CFTR dans les fractions de lavage (figure 2, pistes 3, 5, et6). La protéine éluée a une pureté de> 90%, estimée par coloration au bleu de Coomassie de gels SDS-PAGE et par densitométrie de la CFTR et bandes de contaminants. Chromatographie par perméation de gel (GPC) séparé CFTR GPL-purifié à partir de contaminants de faible poids moléculaire (Figure 4, panneau inférieur).
Le protocole de purification de la protéine CFTR en utilisant DDM donne une pureté d'environ 60% et un rendement d'environ 50 ug / L (Figure 3). La microscopie électronique (EM) des fractions colorées négativement à partir de la GPC éluant à environ 10 ml (figure 4) a montré que la protéine CFTR DDM-purifiée contient des agrégats ayant un diamètre de 20 à 30 nm, ainsi que de plus petites particules de diamètre 10 nm (données non présentées). Il est possible que les petits agrégats peuvent réversible associer et dissocier comme ultrafiltration avec un filtre de coupure 1 Mda pas éliminer les agrégats EM-détectables. matière de GPL purifié n'a pas adsorber une grille de lueur déchargée, où a été étudiée par cryo-EM de fractions non colorées. Ceci a montréune population d'une taille relativement petite de particules très homogène (6-8 nm de diamètre, données non présentées).
Enfin, l'activité ATPase des protéines purifiées a été mesurée (figure 5). En tant que membre de la famille des protéines ABC, CFTR a deux domaines de fixation des nucléotides (NBD) capable de se lier et / ou l'hydrolyse de l'ATP. Les données indiquent que la protéine purifiée n'était pas capable d'hydrolyser l'ATP dans l'état de GPL-solubilisé et a montré une faible activité d'ATPase en présence de DDM (Figure 5, les barres en carnet). Après l'addition de lipides et élimination du détergent, de l'activité ATPase a été de 4 fois supérieure pour les échantillons qui avaient été purifiées à DDM (13 nmol d'ATP / min / mg de protéine). L'addition de lipides et de suppression de GPL activité est similaire à la protéine CFTR restauré qui a été isolé en utilisant le GPL, mais avec un taux final inférieur (1,5 nmol d'ATP / min / mg de protéine) de la matière DDM-purifiée et reconstituée.

Figure 1. Des niveaux de CFTR de poulet dans un lysat de cellules (CL) de contrôle, les surnageants (S) et des pastilles (P) au cours de diverses étapes de centrifugation utilisées pour l'isolement de microsomes et de lavage. Gels SDS-PAGE ont été visualisées à l'aide de la fluorescence in-gel de la GFP tag. Le surnageant après la rupture des cellules et centrifugation à 14 000 xg contient la quasi-totalité de la protéine CFTR (y compris les produits de dégradation). Ultracentrifugation à 200000 sédiments xg tous pleine longueur CFTR laissant quelques fragments dans le surnageant. Ultracentrifugation à 100 000 xg de sel lavé microsomes pastilles presque tout le CFTR avec la suppression de certaines autres fragments.
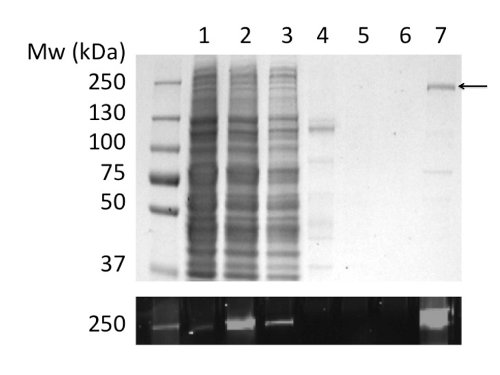
Figure 2. Purification de la protéine CFTR de poulet en GPL par chromatographie d'affinité sur ions métalliques immobilisés. Fractions ont été analysées par SDS-PAGE suivie d'une coloration au Coomassie (panneau supérieur) et la détection de fluorescence du marqueur GFP (panneau inférieur). Tracks: (1) des microsomes. (2) des microsomes GPL solubilisé. (3) Le matériau non lié. (4) La matière insoluble. (5) et (6) 40 et 100 mM d'imidazole lavages. (7) Matériel élue avec 400 mM d'imidazole.
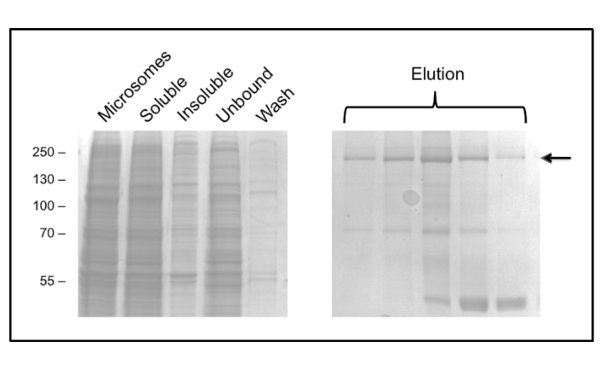
Figure 3. Purification de la protéine CFTR dans DDM de poulet par chromatographie d'affinité sur ions métalliques immobilisés. Fractions ont été analysées par SDS-PAGE suivie d'une coloration au bleu de Coomassie. Le panneau de gauche montre fractions avant l'élution. Plusieurs fractions d'élution consécutifs sont affichés dans le panneau de droite avec CFTR dansindiqué par la flèche. Dernières fractions sont enrichies en un contaminant 40 kDa, qui a été identifié par spectrométrie de masse en tant que protéine ribosomique L3.
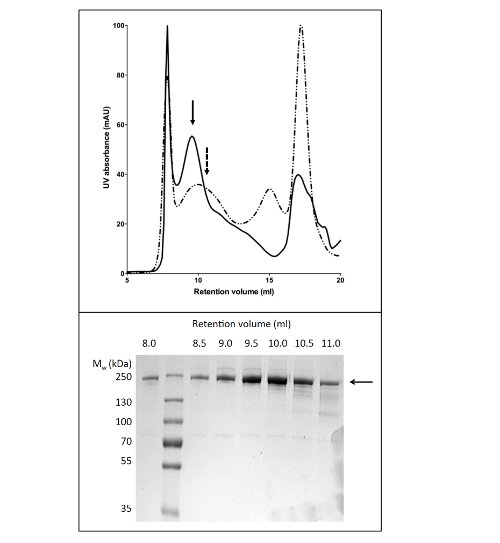
Figure 4. Purification de la protéine CFTR de poulet par chromatographie par perméation de gel. CFTR a été purifié par Chromatographie d'affinité Ni-a été concentré et appliqué à une colonne de GPC. Le profil d'élution de la protéine CFTR (panneau supérieur) purifié dans un tampon contenant du GPL-14 (trait plein) ou DDM (ligne en pointillés) sont superposées. SDS-PAGE (panneau inférieur) a révélé que la protéine CFTR élue entre 8 et 11 ml.
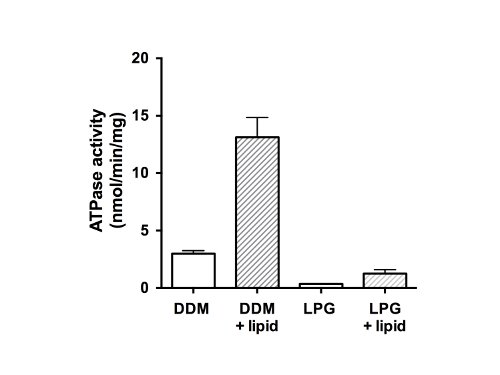
Figure 5. ATPase activity des fractions de CFTR de poulet purifiées. protéine purifiée dans DDM ou LPG a été dosée en utilisant un dosage Chifflet modifié 26 en présence d'un cocktail d'inhibiteurs d'ATPase pour éliminer toute activité d'ATPase de fond à partir de F-, P-et les ATPases de type V (barres en carnet ). Le taux de l'hydrolyse d'ATP a également été mesurée après élimination du détergent et plus de lipides (barres pleines). Le graphique montre la moyenne et l'écart type (n = 3). Les différences entre les valeurs moyennes de l'activité ATPase en présence et en absence de lipides, et de la différence entre l'activité et du GPL dans DDM sont significatifs à p <0,05.
Discussion
Nous avons précédemment décrit un procédé pour la surexpression de la protéine CFTR murine 14. Depuis la publication de ce protocole, nous avons exprimé et purifié plusieurs orthologues différents de CFTR en utilisant le même système. Tous les orthologues testés jusqu'à présent bien purifiés dans le détergent pour le GPL, tandis que la purification DDM a montré une plus grande variation entre les différents orthologues (données non présentées). Cette flexibilité illustre la force de l'approche de la levure: il est possible de dépister de nombreuses constructions avec rapidité relative afin de sélectionner un à un usage particulier.
Le lavage des microsomes de levure avec un tampon contenant 1 M de NaCl avant la solubilisation avec des résultats DDM dans une préparation de microsomes de nettoyage et de réduire les contaminants à des stades ultérieurs. Cette étape n'est pas nécessaire dans le protocole de GPL comme l'échantillon de CFTR finale est> 90% pure, sans le lavage de microsomes. En outre, la purification dans DDM nécessite plusieurs modifications des tampons pour la solubilisation d'unnd purification, à savoir l'ajout de glycérol et de sel supplémentaire. Ensemble, ces additions considérablement augmenté la liaison de la protéine de DDM-solubilisé à la colonne.
La méthodologie de purification DDM a des possibilités d'amélioration, notamment l'élimination d'un contaminant majeur de 40 kDa qui, évaluée par spectrométrie de masse, est due à la sous-unité ribosomique L3 levure, qui semble avoir une affinité inhérente de la résine de nickel. Il n'y a pas de séquence polyHis évident dans la protéine L3, mais l'examen de la structure 3D lorsqu'il est lié au ribosome (PDB = 1FFK) montre que la sous-unité L3 pliée a une grappe des polyHis potentiel. Que ce groupe est moins problématique en matière de GPL-purifié peut être dû à la lessive de GPL sévère.
Bien que la purification dans DDM semble être plus faible que celle en GPL, détergents doux tels que DDM peuvent être plus compatible avec les analyses fonctionnelles et structurelles et ont déjà été utilisés dans plusieurs Crystall X-rayographiques études de protéines membranaires de 15 à 21. En outre, nos résultats indiquent que l'utilisation du GPL conduit à la perte de la fonction ATPase dans CFTR par rapport à la purification dans DDM. Par conséquent, nous recommandons le protocole de purification à base de GPL pour la production de la protéine CFTR, où la pureté est essentiel, par exemple dans des applications telles que la caractérisation des modifications post-traductionnelles, ou dans la génération d'anticorps, le protocole à base de GPL-serait choisi . D'autre part dans les applications où l'activité et l'état entièrement native de la protéine est essentielle, nous proposons le protocole basé DDM, comme une meilleure option.
Pour conclure, ce protocole décrit une méthode reproductible pour l'isolement de la protéine CFTR dans le détergent GPL-14 ou le détergent non-ionique DDM zwitterionique. Comme tel, il indique une plus grande gamme de conditions de purification pour CFTR que nous avons déjà communiqués 10-13. En outre milligramme quantités de CFTR purifié peuvent êtreobtenu à l'aide de ces procédures lorsqu'il est combiné avec un système de croissance de la levure à grand volume, tel qu'un fermenteur de 20 L et un système de récolte des cellules de grande capacité tel qu'un 6 L faible vitesse de rotor de centrifugeuse. Le CFTR obtenu présente une étiquette de GFP clivable qui permet une surveillance facile de la protéine dans les divers dosages biochimiques et biophysiques.
Le réactif décrit dans ce manuscrit (poulet de plasmide contenant CFTR ou des cellules de levure congelés) peut être obtenu par la Cystic Fibrosis Foundation (Etats-Unis).
Déclarations de divulgation
Les auteurs n'ont aucun intérêt financier ni les autres concurrents conflits d'intérêts à l'égard de ce travail.
Remerciements
Ce travail a été financé par les États-Unis Cystic Fibrosis Foundation (CFF) à travers sa structure Consortium CFTR 3D. TR a été financée par une bourse UK CF Trust, et NC par une bourse au Royaume-Uni BBSRC. Nous reconnaissons nos collègues de la structure consortium CFF CFTR 3D pour leur aide et des conseils et de la conception de la séquence de la protéine CFTR poulet et de purification des tags de codons optimisés.
matériels
| Name | Company | Catalog Number | Comments |
| 0.2 μm syringe filter | Sartorius | FC121 | |
| 100 kDa MWCO centrifugal concentrator (PES membrane) | Vivaspin | VS0641 | |
| 2 ml microfuge tubes | Sarstedt | 72.695 | |
| 40Ti rotor | Beckman Coulter | 337901 | |
| 50 ml sterile Falcon tubes | Sarstedt | 62.547.254 | |
| Adenosine triphosphate disodium salt (Na2ATP) | Sigma-Aldrich | A26209 | |
| Liquid chromatography system | GE Healthcare | 28-4062-64 | |
| Aminoethylbenzenesulfonyl fluoride (AEBSF) | Sigma-Aldrich | A8456 | |
| Glass bead-beating cell disrupter | BioSpec | 1107900 | |
| Benchtop centrifuge | HERMLE | Z300 | |
| Benchtop centrifuge | Eppendorf | 5417R | |
| Benchtop microfuge | Fisher | 13-100-511 | |
| Benzamidine hydrochloride | Sigma-Aldrich | 434760 | |
| Hydrophobic Beads SM-2 Adsorbent | BioRad | 152-3920 | |
| Bromophenol blue | Sigma-Aldrich | 114391 | |
| Centrifuge tubes | Beckman Coulter | 357000 | |
| Gel imaging system | BioRad | 170-808 | |
| Cholesterol | Sigma-Aldrich | C8667 | |
| Chymostatin | Sigma-Aldrich | C7268 | |
| Dimethylsulfoxide (DMSO) | Sigma-Aldrich | D8418 | |
| Dithiothreitol (DTT) | Sigma-Aldrich | 43815 | |
| E. coli total lipid extract | Avanti lipids | 100500 | |
| Epoxysuccinyl-leucylamido-butane (E-64) | Sigma-Aldrich | E3132 | |
| Glass beads, acid washed | Sigma | G8772 | |
| Glycerol | Fisher | 65017 | |
| HisTrap HP columns (5 ml) | GE Healthcare | 17-5247-05 | |
| Rapid Coomassie Stain | Novexin | ISB1L | |
| Centrifuge JA-17 rotor | Beckman Coulter | 369691 | |
| Leupeptin | Merck | 108975 | |
| Lyso-phosphatidyl glycerol-14 (LPG) | Avanti lipids | 858120 | |
| MgSO4 | Sigma-Aldrich | M7506 | |
| Gel tank SDS-PAGE system | BioRad | 165-8006 | |
| n-Dodecyl-β-D-maltopyranoside (DDM) | Affymetrix | D310S | |
| NaCl | Sigma-Aldrich | S6191 | |
| NaN3 | Sigma-Aldrich | S2002 | |
| NH4Cl | Sigma-Aldrich | A9434 | |
| Oligomycin | Sigma-Aldrich | 75351 | |
| Ultracentrifuge | Beckman Coulter | 392050 | |
| Prestained protein standards | Fermentas | SM1811 | |
| Desalting columns (Sephadex G-25) | GE Healthcare | 17-0851-01 | |
| Pepstatin A | Sigma-Aldrich | P4265 | |
| Phenylmethanesulfonylfluoride (PMSF) | Sigma-Aldrich | P7626 | |
| SCH28080 | Sigma-Aldrich | S4443 | |
| Sodium dodecyl sulfate (SDS) | Sigma-Aldrich | L37771 | |
| Sodium thiocyanate (NaSCN) | Sigma-Aldrich | 251410 | |
| Gel filtration 10/300 GL column | GE Healthcare | 17-5172-01 | |
| Tris-base | Formedium | TRIS01 | |
| Ultracentrifuge tubes | Beckman Coulter | 355618 | |
| Vortex mixer | Star Labs | N2400-0001 | |
| Ultrasonic water bath | Ultrawave | F0002202 | |
| Multimode plate reader | BioTek | BTH1MF |
Références
- Aleksandrov, A. A., Aleksandrov, L. A., Riordan, J. R. CFTR (ABCC7) is a hydrolyzable-ligand-gated channel. Pflugers Arch. 453, 693-702 (2007).
- Dodge, J. A., Lewis, P. A., Stanton, M., Wilsher, J. Cystic fibrosis mortality and survival in the UK: 1947-2003. EUR RESPIR J. 29, 522-526 (2007).
- O'Sullivan, B. P., Freedman, S. D. Cystic fibrosis. Lancet. 373, 1891-1904 (2009).
- Rommens, J. M., et al. Identification of the cystic fibrosis gene: chromosome walking and jumping. Science. 245, 1059-1065 (1989).
- Kariya, C., et al. A role for CFTR in the elevation of glutathione levels in the lung by oral glutathione administration. Am J Physiol Lung Cell Mol Physiol. 292, (2007).
- Gould, N. S., Min, E., Martin, R. J., Day, B. J. CFTR is the primary known apical glutathione transporter involved in cigarette smoke-induced adaptive responses in the lung. Free Radic Biol Med. 52, 1201-1206 (2012).
- Childers, M., Eckel, G., Himmel, A., Caldwell, J. A new model of cystic fibrosis pathology: lack of transport of glutathione and its thiocyanate conjugates. Med Hypotheses. 68, 101-112 (2007).
- Cole, S. P., et al. Overexpression of a transporter gene in a multidrug-resistant human lung cancer cell line. Science. 258, 1650-1654 (1992).
- Conseil, G., Deeley, R. G., Cole, S. P. Polymorphisms of MRP1 (ABCC1) and related ATP-dependent drug transporters. Pharmacogenet Genomics. 15, 523-533 (2005).
- Ketchum, C. J., Rajendrakumar, G. V., Maloney, P. C. Characterization of the adenosinetriphosphatase and transport activities of purified cystic fibrosis transmembrane conductance regulator. Biochemistry. 43, 1045-1053 (2004).
- Ramjeesingh, M., et al. A novel procedure for the efficient purification of the cystic fibrosis transmembrane conductance regulator (CFTR). Biochem J. 327 (Pt 1), 17-21 (1997).
- Huang, P., Liu, Q., Scarborough, G. A. Lysophosphatidylglycerol: a novel effective detergent for solubilizing and purifying the cystic fibrosis transmembrane conductance regulator. Anal Biochem. 259, 89-97 (1998).
- Rosenberg, M. F., Kamis, A. B., Aleksandrov, L. A., Ford, R. C., Riordan, J. R. Purification and crystallization of the cystic fibrosis transmembrane conductance regulator (CFTR). J Biol Chem. 279, 39051-39057 (2004).
- O'Ryan, L., Rimington, T., Cant, N., Ford, R. C. Expression and purification of the cystic fibrosis transmembrane conductance regulator protein in Saccharomyces cerevisiae. J Vis Exp. , (2012).
- Oldham, M. L., Chen, J. Snapshots of the maltose transporter during ATP hydrolysis. Proc Natl Acad Sci USA. 108, 15152-15156 (2011).
- Pinkett, H. W., Lee, A. T., Lum, P., Locher, K. P., Rees, D. C. An inward-facing conformation of a putative metal-chelate-type ABC transporter. Science. 315, 373-377 (2007).
- Dawson, R. J. P., Locher, K. P. Structure of a bacterial multidrug ABC transporter. Nature. 443, 180-185 (2006).
- Gerber, S., Comellas-Bigler, M., Goetz, B. A., Locher, K. P. Structural basis of trans-inhibition in a molybdate/tungstate ABC transporter. Science. 321, 246-250 (2008).
- Ward, A., Reyes, C. L., Yu, J., Roth, C. B., Chang, G. Flexibility in the ABC transporter MsbA: Alternating access with a twist. Proc Natl Acad Sci USA. 104, 19005-19010 (2007).
- Kadaba, N. S., Kaiser, J. T., Johnson, E., Lee, A., Rees, D. C. The high-affinity E. coli methionine ABC transporter: structure and allosteric regulation. Science. 321, 250-253 (2008).
- Aller, S. G., et al. Structure of P-Glycoprotein Reveals a Molecular Basis for Poly-Specific Drug Binding. Science. 323, 1718-1722 (2009).
- Koehler, J., et al. Lysophospholipid micelles sustain the stability and catalytic activity of diacylglycerol kinase in the absence of lipids. Biochemistry. 49, 7089-7099 (2010).
- Tian, C., et al. Preparation, functional characterization, and NMR studies of human KCNE1, a voltage-gated potassium channel accessory subunit associated with deafness and long QT syndrome. Biochemistry. 46, 11459-11472 (2007).
- Huang, P., Liu, Q., Scarborough, G. A. Lysophosphatidylglycerol: a novel effective detergent for solubilizing and purifying the cystic fibrosis transmembrane conductance regulator. Anal Biochem. 259, 89-97 (1998).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem. 72, 248-254 (1976).
- Chifflet, S., Torriglia, A., Chiesa, R., Tolosa, S. A method for the determination of inorganic phosphate in the presence of labile organic phosphate and high concentrations of protein: Application to lens ATPases. Analytical Biochemistry. 168, 1-4 (1988).
- Rothnie, A., et al. The importance of cholesterol in maintenance of P-glycoprotein activity and its membrane perturbing influence. Eur Biophys J. 30, 430-442 (2001).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon