Method Article
で表現する嚢胞性線維症膜コンダクタンス制御因子タンパク質の精製
要約
異種発現および嚢胞性線維症膜コンダクタンス制御因子(CFTR)の精製は、重大な課題および嚢胞性線維症のための薬物療法の開発における制限因子である。このプロトコルは、機能的および構造的研究に適しCFTRのミリグラム量の単離のための2つの方法について説明します。
要約
嚢胞性線維症膜コンダクタンス制御因子(CFTR)の欠陥は、タンパク質嚢胞性線維症(CF)、現在の年齢<40歳までの患者の平均寿命を制限し、常染色体劣性疾患を引き起こす。 CFTRの活性を回復させる新規な薬物分子の開発は、治療CFにおける重要な目標であり、機能的に活性なCFTRの単離は、この目標の達成に向けて有用なステップである。
我々は、S.、真核生物の異種発現系からCFTRを精製するための二つの方法を記載サッカロミセス·セレビシエ 。原核生物系と同様に、S.セレビシエは急速に低コストで実験室で増殖させることができるだけでなく、トラフィックおよび翻訳後の大きな膜タンパク質を修飾することができる。可溶化および精製のための界面活性剤の選択は、任意の膜タンパク質の精製における重要なステップである。いくつかの洗剤にCFTRの溶解性のためにスクリーニングしたので、我々は2人の共同を選択した最終的なCFTRの準備がその後、計画の実験に合わせて調整することを可能にする精製に使用するための洗剤ntrasting。
この方法では、ドデシル-β-D-マルトシド(DDM)中のCFTRの精製の 比較および1 -テトラデカノイル-sn-グリセロ-3 -ホスホ-(1'- てrac-グリセロール)(LPG-14)を提供する。この方法により、DDMに精製されたタンパク質は、機能アッセイにおけるATPアーゼ活性を示す。 LPG-14で精製されたタンパク質は、高純度および収率を示し、翻訳後修飾を研究するために用いることができ、例えば小角X線散乱および電子顕微鏡法のような構造を用いることができる。しかし、それはかなり低いATPアーゼ活性を示す。
概要
嚢胞性線維症(CF)は2500出生約1の発生率とヨーロッパと北アメリカで最も一般的な遺伝性疾患である。 CFは発生したときに、嚢胞性線維症膜コンダクタンス制御因子(CFTR)1上皮細胞の原形質膜でのその機能のタンパク質の損失の原因における変異。この欠陥の最も深刻な結果は、年齢2,3 <40年に患者の平均寿命が短くなり、不可逆的な肺の損傷です。
CFTRは、イオンチャネル1,4になるように進化しているATP結合カセット(ABC)トランスポーターである。細胞の原形質膜におけるそのかなり変化した機能にもかかわらず、さらに他のABC輸送体と有意な配列相同性を保持する。興味深いことに、CFTRの専門的な部分( すなわち 、その調節領域およびそのN末端 およびC末端)は、他の後生動物ABCトランスポーターとの有意な配列類似性を共有しない、それゆえ目について何ら手がかりはありませんCFTRにおけるこれらの配列のeが起源。その一次構造に基づいて、CFTRは、ABCトランスポーターファミリーのCファミリーのメンバーとして分類されますが、このサブファミリーに残留の機能的結合のための強力な証拠は存在していません。他のレポートは、還元型グルタチオンはなく表示よりも、CFTR ATPアーゼ活性を阻害する可能性があることを示唆しているが、他のC-ファミリーのメンバー8,9の役割と一致するであろう、これCFTR 5-7のためのグルタチオン輸送活性のいくつかの報告がなされているABCトランスポーター10を特徴付ける基板によって誘発される刺激。イオン伝導度の測定は、単一CFTR分子のチャンネル活性は、1を研究すると、CFTRチャネル特性は時間の関数、温度、ATP濃度、膜電位、およびリン酸化状態、ならびに同様に監視されている可能にするのに十分に敏感である小分子阻害剤、増強、および修飾子のホストが存在する。これらの研究はまた、ABCトランスポーターは、どのように機能するかについての我々の知識に大きく追加されました。それにもかかわらず、かなりの量のCFTRの発現およびその後の精製は特に困難であることが証明された成功は、いくつかの研究室10〜13に制限されてきた。
より効果的な薬物を開発する必要性が押圧されて、まだ、このプロセスは、小分子をスクリーニングするための精製されたCFTRの欠如によって妨げられてきた。 CFTRの発現および精製の問題を解決することは、CFにおける主要な欠陥の修正を目的としたハイスループット薬剤スクリーニングを可能にし、また合理的なドラッグデザインを通知するために、高解像度の構造研究のためのルートを開くだろう。さらに、そのようなその機能オリゴマー状態のようなタンパク質、タンパク質相互作用し、ATPアーゼ活性の比較的基本的な生化学的特性は、特徴付けが乏しいまま。我々は以前、GFP-およびHisタグマウスCFTRの大量発現のためのプロトコルを報告しているS.中サッカロミセス·セレビシエ 14は 、今、さらにCFTRの精製の ためのプロトコルを記述します。ここでは、例として、鶏のCFTRの精製のために5 CFTRのオルソログ、および現在のデータを浄化するために、これらのメソッドを使用している。可溶化および精製のための界面活性剤の選択は、任意の膜タンパク質の精製における重要なステップである。いくつかの洗剤にCFTRの溶解性のためにスクリーニングしたので、我々は精製に使用するために2対照的な洗剤を選択しました。ドデシル-β-D-マルトシド(DDM)広範囲の膜タンパク質15-21の構造的および機能的研究の両方のために使用されている非イオン性界面活性剤である。イオン性界面活性剤1 -テトラデカノイル-sn-グリセロ-3 -ホスホ-(1'- てrac-グリセロール)(LPG-14)は、CFTRの可溶化に非常に効率的であり、以前に機能的な膜タンパク質10の精製に使用されているSからCFTRの精製を含む22,23、 サッカロミセス·セレビシエ24。</ pの>
プロトコル
バッファの1。準備
- プロテアーゼ阻害剤の100倍ストックを作るために(PI)のカクテル96ミリグラムAEBSF、3.5ミリグラムキモスタチン、10 mgのE64、16.5 mgのロイペプチン、16.5 mgのペプスタチン、348ミリグラムのPMSF、および20ミリリットルのDMSO中ベスタチン4ミリグラムを溶解する。 -20℃で1ミリリットルのアリコートとストアを作るベンズアミジンの100Xストックを作るために、-20℃で1ミリリットルのアリコートで20ミリリットル超純水(蒸留H 2 O)およびストアに720ミリグラムを溶解この量は、一つの精製のために十分である。すべてのバッファでは、PIとベンズアミジンストックは100倍希釈で使用されている。
- 4°C 'のmPIB'(0.3 Mトリス、8、0.3 Mスクロース、2mMのDTT)および「CFTR」(50mMトリスpH8の20%(v / v)グリセロール、1mMのDTT)の緩衝液および悪寒を調製。使用前に、mPIBの量に応じてプロテアーゼ阻害剤カクテル1:100ベンズアミジンの1:100を追加します( たとえば 、350ミリリットルmPIBの総容量3.5ミリリットルPIと3.5ミリリットルベンズアミジンを使用する)細胞ペレットを再懸濁するために使用される。
- Sを準備しますolubilizationバッファ。リゾホスファチジルグリセロール-14(LPG)可溶化緩衝液(50mMトリスpH8の10%(v / v)グリセロール、50mMのNaCl、1mMのDTT、プロテアーゼ阻害剤(PI)および4%(w / v)のLPG)およびドデシルマルトシド(DDM)可溶化緩衝液(50mMトリスpH8の20%(v / v)グリセロール、1 M NaCl、1mMのDTT、プロテアーゼ阻害剤、4%(w / v)のDDM)。これは泡を作成するように、緩衝液は、界面活性剤の分散を補助するが、この混合物をボルテックスすることを避けるためにソニケーター浴(35 W、40 kHz)の中で超音波処理することができる。使用前に4℃の寒さ。
- LPG精製のためのCFTR精製緩衝液は、50mMトリス、10%(v / v)グリセロール、50mMのNaCl、1mMのDTT、0.1%(w / v)のLPG-14およびプロテアーゼ阻害剤である。このバッファの350ミリリットル、そして同じ緩衝液を加え、1Mイミダゾールの150ミリリットルを用意します。 8に両方のバッファのpHを調整する。
- DDMにおける精製のための緩衝液は、50mMトリスpH8の20%(v / v)グリセロール、1 M NaCl、1mMのDTT、0.1%(w / v)のDDMからなる。このバッファの350ミリリットルと同じ緩衝液150ミリリットルを加え、1Mイミダゾを準備ル。 8に両方のバッファのpHを調整する。
- LPGを含有するゲルパーミエーションクロマトグラフィー(GPC)緩衝液は、50mMトリスpH8の10%(v / v)グリセロール、50mMのNaCl、1mMのDTT、0.05%(w / v)のLPG-14を調製する。 GPCは、DDMを用いて、50 mMトリスpH8の20%(v / v)グリセロール、1 M NaCl、1mMのDTT、0.1%(w / v)のDDMの緩衝液を調製する。 GPCカラムで使用されるすべてのバッファーとのddH 2 Oを濾過(0.2μmのフィルター)し、使用前に脱ガスする必要があります。
- SDS-PAGEサンプルバッファー(作業濃度を2×):50mMのトリス-HCl、pH7.6、5%(v / v)グリセロール、5mMのEDTA、0.02%(w / v)のブロモフェノールブルー。 -20℃で700μlのアリコートとストアを作る使用前に、20%の200μL(w / v)のドデシル硫酸ナトリウム(SDS)、新鮮な0.5 M DTTを100μlを加える。ゲル上でロードする前に、室温で試料と、少なくとも10分間インキュベートする。加熱しないでください。これは、GFPを変性し、CFTRが凝集することがあります。
- 再構成のための脂質ストックを作るために、Eの4:1(w / w)の混合物を溶解大腸菌脂質脂質フィルムを形成する2時間N 2ガ ス下でガラスバイアル中のd、クロロホルムとメタノール(2:1 v / v)の中のコレステロール、および乾燥。ミリリットル40ミリグラム/の脂質濃度に(無NaClで)、GPCバッファを追加して、解決策を明確にするために繰り返さボルテックスおよび超音波処理(35 W、40 kHz)を使用しています。
- ATPアーゼアッセイのために、のddH 2 OでM 1及びオリゴ100%(v / v)エタノール中の2.5 mMのDMSOに、のNaSCNで1mMまでSCH28080を溶解することによってATPアーゼ阻害剤の100倍ストックを調製する。 -20℃での分量を保存する50mMのトリス、pH7.4、150mMのNH 4 Cl を 、5mMのMgSO 4で0.02%(w / v)のNaN 3を用いてATPアーゼ緩衝液100mlを加える。これは、室温で保存し、いくつかのアッセイのために使用することができる。使用し、氷上で維持する直前に5のATP原液を準備します。 (アッセイ中のリン酸過剰なバックグラウンド信号を防止するために、NBの使用のNa 2 ATP)。 SDS停止溶液(12%(w / v)のSDS中のddH 2 O)を調製する。
- Chifflet検出のために(3%(Wをバッファリングする準備/ v)のアスコルビン酸、0.5%(w / v)のモリブデン酸アンモニウム、0.5 M HCl)を使用直前およびBバッファ(2%(w / v)のクエン酸ナトリウム、2%(w / v)のメタ亜ヒ酸ナトリウム、2% (v / v)の酢酸)。
酵母ミクロソームの2。分離
- O'Ryan らに説明したように鶏のCFTRを発現している出芽酵母を増殖させる。(2012)14。最長6ヶ月間-80℃で2分注して20Lの発酵から材料を保管してください。
- 急速に細胞の1アリコートを解凍し、細胞1g当たり3ミリリットルチルドmPIBに懸濁します。
- 425〜600ミクロン径のガラスビーズを用いたビーズミルで細胞を破壊する。 1分休憩時間で区切られた細胞破壊の5分の1の期間を使用してください。 (休憩時間は、細胞が分裂中に加熱されていないことを確認するために不可欠である。)
- ビーズミルから細胞溶解物の1ミリリットルのサンプルの遠心分離により細胞破壊を監視します。ベンチトップCENTR遠心機(12,000×gで、4℃、5分)ifuge。キュベットにmPIBで1:50上清を希釈し、A 380を測定します。 380> 0.1、またはいくつか繰り返してビーズビーティングサイクルにもかかわらず、増加が停止した場合は、次のステップに進みます。そうでない場合は、2.3から2.4を繰り返します。
- 遠心分離機の全細胞溶解物(12,000 X gで4°C、20分)。上清を保持します。 (破壊されていない細胞とミトコンドリアを含む)のペレットを廃棄しますが、細胞破壊の効率についての疑いが(2.4を参照)がある場合、また、ペレットを保持します。
- 前のステップ(200,000 XG、4℃、1.5時間)からの上清を遠心分離する。上澄み液を捨て、CFTRバッファ内のペレット化ミクロソーム膜を懸濁します。ミクロソームは、DDMを用いた精製を目的としている場合は、1M NaClでのCFTRバッファを補足。
- 再懸濁した膜画分の遠心分離を繰り返して(100,000 X G、4℃、1時間)し、上澄みを捨てる。
- ペレット化ミクロソームを再懸濁CFTRバッファーの最小容量(最終容量5〜15ミリリットル、総ミクロソームタンパク質70〜200 mg)を得た。 Bradfordアッセイは、ミクロソームタンパク質25の総濃度を決定するために使用されてもよい。また、膜の蛍光発光スペクトルを測定すべきである(励起= 485 nm、発光= 500〜600nmの)別個のGFPの蛍光ピーク(512 nmで最大)を有するべきである。 CFTRは、具体的にGFP蛍光状態( 図1)の下でスキャンされたSDS-PAGEゲル上で検出することができる。
- フラッシュ凍結液体窒素に沈めることにより再懸濁ミクロソームをし、-80℃で保存するか、手順3に進みます。
ミクロソームの3。可溶化
- 凍結した場合は、すぐに10℃に設定したウォーターバスで使用する前にミクロソームを解凍
- 膜の可溶化、洗浄剤の最終濃度を得るために、関連する可溶化緩衝液(工程1.3)の等量を希釈ミクロソーム2%(w / v)のおよびミクロソームタンパク質濃度5 mg / mlの。攪拌しながら4℃(チューブ回転)で1時間、この混合物をインキュベートする。分析のための200μLを保持します。
- 遠心分離機混合(100,000 XG、4℃、45分)。可溶化された膜タンパク質を含む上清を外し、0.45μmのシリンジフィルターに通し、氷上に保存します。 (ステップ2.8のように)上清の蛍光を測定する。
- 1%の不溶性画分の可溶性画分に等しい体積の(w / v)のSDS溶液を再懸濁する。この画分に蛍光を測定し、SDS-PAGE分析のために50μlのアリコートを保持します。
CFTRの4。ニッケルアフィニティー精製
- シリーズ内のリンク2 5ミリリットルのニッケルセファロースカラム。次いで1 Mのイミダゾールを含有する可溶化緩衝液(工程1.4〜1.5)の2 CVでカラムを洗浄し、2カラム容量(CV)CV 2のddH 2 O、続いて20%(v / v)エタノールで洗浄する。 solubilizatの2 CVの繰り返しイミダゾールを欠いイオンバッファー。
- 可溶化された材料(ステップ2.8)に5 mMの最終濃度になるようにイミダゾールを追加し、自動化された液体クロマトグラフィー装置を使用している場合、手動でカラム上に、またはサンプルループに材料をロードします。
- 0.5ml /分の流速でカラムに可溶化された材料をロードし、非結合物質を除去するために同じ流速でイミダゾール欠く緩衝液2 CVで洗浄した。 50ミリリットルファルコンチューブ内の分画を収集します。
- 最初の洗浄のために、1ml /分の流速で40mMのイミダゾールで精製緩衝液の3 CVを使用する。 2ミリリットルの分画を収集します。
- 第二の洗浄のために、100 mMイミダゾールを精製緩衝液の3履歴書を使用しています。 2ミリリットルの分画を収集します。
- 400 mMイミダゾールで精製緩衝液の3 CVのHisTrapカラムから溶出CFTR。 2ミリリットルの分画を収集します。
- 溶出画分(ステップ2.8)で蛍光を監視します。
- SDS-PAGE解析のためのピーク画分のアリコートを保持します。フラッシュ凍結残りのピークFractionサンプルと店-80℃で、または次の精製工程に進みます。
CFTRの5。ゲル浸透クロマトグラフィー(GPC)を精製
- 1.2 CV GPCバッファに続く1.2 CVのddH 2 Oでのカラム(スーパーロース6 300分の10 GL)を平衡化させます。
- ステップ5.1の間に、4℃で10万MWCO遠心フィルターを使用して最高のGFP蛍光のNi-アフィニティ精製画分を集中DDMにおける精製が、これは有意なサンプルのロスの原因となるように0.3 mg / mlのタンパク質のタンパク質濃度以上のサンプルを濃縮する場合には避ける。 10万xでコンセントレータと遠心分離機から残留物を取り除く 大きな粒子をペレット化し、4℃で30分間添加した。
- カラムに、このサンプルを注入し、1.2 CVのGPCバッファのアイソクラティック勾配で溶出する。 0.5ミリリットルの分画を収集します。
- CFTRを含む画分を特定するために2.8節のように、GFPの蛍光を測定します。小さ なボリュームを保持し( 例えば、</ em>のSDS-PAGEによる分析のためにそれぞれ50μL)。
- -80℃で液体窒素とストア内画分を凍結する
CFTRの6。再構成
- 脂質対タンパク質比100:1(w / w)の時、精製CFTRに脂質(ステップ1.8)を追加し、1時間4℃でインキュベートする。同様に、GPCバッファ同容量の精製タンパク質に置き換えて、脂質のみの制御を設定する。
- 疎水性吸着ビーズを用いたタンパク質/脂質混合物から界面活性剤を除去。 5 CVのddH 2 O、5 CV 70%(v / v)エタノール、5 CVのddH 2 O、および界面活性剤を欠いている5 CV GPC緩衝液に吸着剤ビーズを洗浄する。精製タンパク質のミリリットルあたりの洗浄吸着剤ビーズの200ミリグラムを加え、穏やかに攪拌しながら4℃で一晩インキュベートする。
- シン·エンド·ピペットチップを用いて新しいチューブに吸着剤ビーズからの再構成のサンプルを収集します。
ATPアーゼ活性の7。測定
- CFTの速度を決定する96ウェルプレートフォーマットで修飾Chiffletアッセイ26,27を用いてR-特異的ATPアーゼ活性。リン酸ナトリウムのストック溶液(0.65 mM)を標準として50μlの最終体積中0-20 nmolのリン酸を準備します。リンの株式を希釈するためのCFTRバッファとATPアーゼバッファーの1:1混合物を使用してください。
- 10分間氷上で1:100(v / v)のATPase阻害剤(ステップ1.9)で再構成し、CFTRとブランクリポソームの両方をインキュベートする。再構成されたCFTRの少なくとも5μgのを使用してください。
- 2 mMの最終濃度になるようにATP(ステップ1.9)を加え、1時間25℃でインキュベートする。 (規格を含む)を各ウェルに10%40μlの(w / v)のSDS(工程1.9)を加えることにより反応を停止させる。
- 緩衝液A(ステップ1.10)の100μLを加え、10分間インキュベートする。各ウェルに100μlのバッファーB(1.10g)を加え、96ウェルプレート互換UV /可視分光光度計で800nmの波長で吸光度を測定する。
- 使用した遊離リン酸の量に800 nmの吸光度を変換するリン酸標準。バックグラウンドシグナル(リポソームのみのウエル)を差し引いた後のATP加水分解速度を計算します。
- 非再構成されたCFTRの背景測定値のためのCFTRバッファを使用して、同じプロトコルに従う。
結果
上記のプロトコルは、粗ミクロソーム( 図1)の細胞破壊と準備中のCFTRのほぼ完全な回復と、CFTRに富むミクロソームを分離する効率的な手段である。他の細胞破壊方法も効果的に使用することができる。我々は等しい効率でフレンチプレス細胞、および他のhigh-pressure/cavitationデバイス(またRubyのターゲットに衝突と組み合わせて)を利用してきた。利便性と機器の低イニシャルコストのために、我々はビーズビーティング法に最高のを見つける。
CFTRを可溶化し、精製するためにLPGを使用すると、純度> 90%( 図2)、80μgタンパク質/ L培養液を得た。高収量は、LPG( 図2b、レーン2および4を比較)によるCFTRの効率的な可溶化したことによるものです。また、タイトな、効率的で、カラムへの結合は5、最小の非結合画分におけるCFTRの損失および洗浄画分( 図2、レーン3におけるCFTRの不在をもたらしたと6)。溶出したタンパク質は、クマシー染色SDS-PAGEゲルにより推定し、CFTRと汚染物質のバンドのデンシトメトリーを用いて、> 90%の純度を有していた。ゲルパーミエーションクロマトグラフィー(GPC)は、低分子量の汚染物質から精製されたLPG CFTR( 図4、下のパネル)を分離した。
DDMを用いてCFTR精製の ためのプロトコールは、約60%の純度と約50μg/ Lが( 図3)の収量が得られる。約10ml( 図4)で溶出するGPCから負に染色された画分の電子顕微鏡(EM)は、DDM精製CFTR 20〜30 nmの直径ならびに直径10nm(データは示さず)のより小さな粒子の凝集体を含有することを示した。それは、小さな凝集が可逆的にEM-検出可能な凝集体を除去するために失敗した関連付け、1 MDaのカットオフフィルターで限外濾過として解離することができない可能性があります。 LPガス精製物質は、したがって、未染色画分の低温電子顕微鏡によって研究された、グロー放電し、グリッドに吸着しなかった。これがあった比較的小さいサイズの非常に均一な粒子集団(6-8 nmの直径を、データは示していない)。
最後に、精製されたタンパク質のATPアーゼ活性( 図5)を測定した。 ABCタンパク質ファミリーの一員として、CFTR結合および/またはATPを加水分解することができる2ヌクレオチド結合ドメイン(のNBD)があります。データは、精製されたタンパク質は、LPG·可溶化状態で、ATPを加水分解することができませんでしたし、DDM( 図5、未充填バー)の存在下で弱いATPアーゼ活性を示したことを示している。脂質および界面活性剤の除去を添加した後、ATPアーゼ活性は、DDM(13ナノモルATP /分/ mgタンパク質)で精製した試料を4倍高かった。脂質やLPGを使用して単離されていたCFTRへのLPG同様に復元された活動の除去に加え、最終的な低いレートDDM-精製され、再構成された材料よりも(1.5ナノモルのATP /分/ mgタンパク質)で。

図1の監視細胞溶解物(CL)中のニワトリCFTRのレベルを、上清(S)及びペレット(P)ミクロソーム単離および洗浄のために使用される種々の遠心分離工程の間。SDS-PAGEゲルをGFPのゲル内蛍光を用いて可視化したタグ。 14,000×gで細胞破砕し、遠心分離後の上澄み液(分解生成物を含む)の実質的にすべてのCFTRが含まれています。 20万XG堆積物の超遠心上清中のいくつかの断片を残して、すべての完全長CFTR。塩洗浄ミクロソームペレットさらにいくつかの断片を除去しながら、ほぼすべてのCFTRのを100,000×gの超遠心分離。
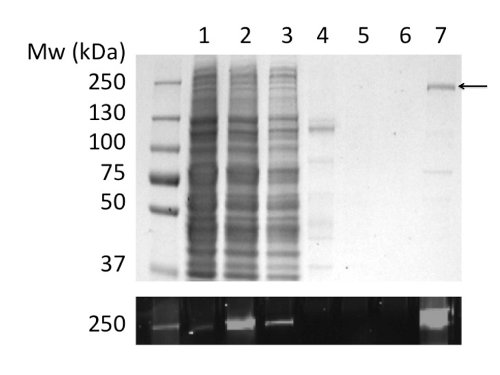
図2:固定化金属イオンアフィニティークロマトグラフィーによるLPGニワトリCFTRの精製画分をクマシー染色(上パネル)およびGFPタグ(下のパネル)の蛍光検出に続いてSDS-PAGEにより分析した。トラック:(1)ミクロソーム。 (2)LPガス可溶化ミクロソーム。 (3)非結合物質。 (4)不溶性物質。 (5)及び(6)40〜100 mMのイミダゾール洗浄。 (7)素材は、400 mMイミダゾールで溶出した。
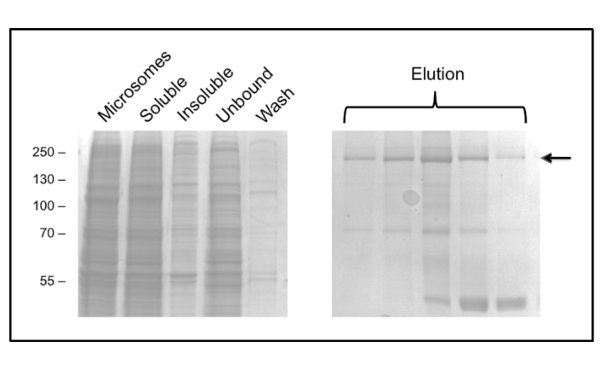
図3:固定化金属イオンアフィニティークロマトグラフィーによるDDMニワトリCFTRの精製画分をクマシー染色に続くSDS-PAGEにより分析した。左側のパネルには、溶出前に画分を示しています。複数の連続した溶出画分をCFTRにおけるとの右側のパネルに表示され矢印でdicated。後でフラクションをリボソームタンパク質L3として質量分析により同定された40kDaの夾雑物に濃縮される。
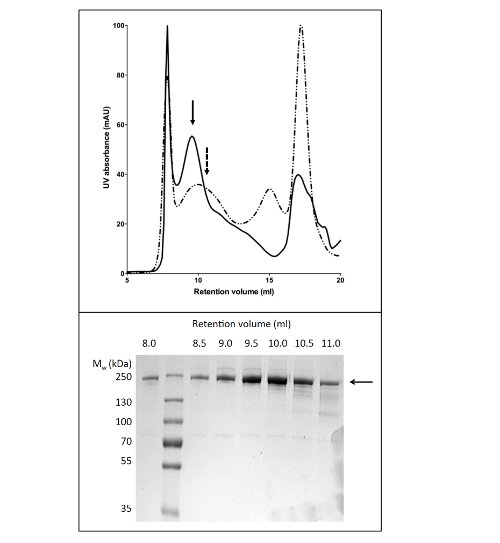
ゲルパーミエーションクロマトグラフィーによるニワトリCFTRの図4の精製は、Niアフィニティークロマトグラフィーにより精製した。CFTRを濃縮し、GPCカラムに適用した。 LPG-14(実線)又はDDM(破線)を含有する緩衝液中で精製CFTRの溶出プロファイル(上パネル)が重ね合わされる。 SDS-PAGE(下パネル)はCFTRを8,11 mlで溶出したことを明らかにした。
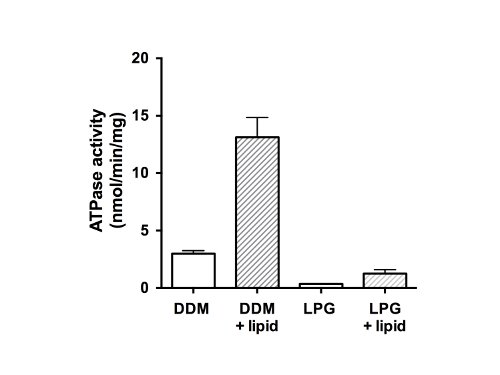
図5。ATPアーゼactivit精製されたニワトリCFTR画分のyのDDM又はLPG中で精製タンパク質はF-、P-およびV型ATPアーゼ(未充填のバーからバックグラウンドATPアーゼ活性を排除するためにATPアーゼ阻害剤のカクテルの存在下で変性Chiffletアッセイ26を使用してアッセイした)。 ATP加水分解の速度はまた、界面活性剤除去および脂質付加(黒棒)後に測定した。プロットは、平均および標準偏差を示す(n = 3)であった 。平均脂質の存在下および非存在下におけるATPase活性の値、及びDDMにおける活性の差とLPGの間の差は、p <0.05に有意である。
ディスカッション
我々は以前、マウスCFTR 14の過剰発現のための方法を記載している。そのプロトコルの公開以来、我々は、同じ発現系を用いてCFTRのいくつかの異なる相同分子種を精製している。 DDM精製が異なるオルソログを横切る複数のバリエーション(データは示さず)を示した一方で、試験した全てのオルソログは、これまで、LPG洗剤でよく精製した。この柔軟性は、酵母のアプローチの強さを示しています。それは、特定の目的のための1つを選択するために、相対的な速さで多くの構造物をスクリーニングすることが可能である。
クリーナーミクロソーム準備でのDDMの結果による可溶化する前に、1MのNaClを含む緩衝液で酵母ミクロソームを洗浄し、後の段階での汚染物質を低減します。最終的なCFTRサンプルはミクロソーム洗浄なしで> 90%の純度であるため、このステップでは、LPGプロトコルは不要である。さらに、DDMでの精製は、可溶化A用のバッファには、いくつかの変更を必要とするND浄化、余分なグリセリン、塩、すなわちほか。一緒に、これらの追加はかなりの列にDDM可溶化タンパク質の結合を増加させた。
DDM精製方法は改善の余地を有しており、特に、質量分析により判断し、40kDaの主要な汚染物質の除去は、ニッケル樹脂に対する固有の親和性を有すると思われる酵母リボソームサブユニットL3、に起因する。そこL3タンパク質における明らかなポリHis配列はないが、リボソーム(PDB = 1FFK)に結合し、その3次元構造の検査は、折り畳まれたL3サブユニットが潜在的なポリHisクラスタを有することを示している。このバンドは、LPG精製物質はあまり問題があると厳しいLPG用洗剤に起因する可能性がある。
DDMでの精製は、LPGに比べて劣るように見えるけれども、そのようなDDMなどの穏やかな洗剤は、機能と構造解析との互換性があり、すでにいくつかのX線crystallで使用されてきた膜タンパク質15-21のographic研究。さらに、我々の結果は、LPGの使用は、DDMで精製に対するCFTRの相対的なATPアーゼ機能の損失につながることが示された。したがって我々はそのような翻訳後修飾の特性評価などのアプリケーションで、たとえば、純度が非常に重要であるCFTRの世代のために、LPGベースの精製プロトコルを推薦するか、または抗体の生成において、LPGベースのプロトコルが選択されるであろう。タンパク質の活性と完全に天然の状態が不可欠なアプリケーションでは一方で、私たちはより良いオプションとしてDDMベースのプロトコルを提案する。
結論するには、このプロトコルは、両性イオン性界面活性剤、LPG-14または非イオン性界面活性剤DDMにCFTRの単離のための再現可能な方法を説明します。そのため、それ以前に10月13日に報告されているよりも、CFTRの精製条件のより大きな範囲を示している。また精製されたCFTRのミリグラム量は、することができます例えば、20 Lの発酵槽と、このような6 L低速遠心ロータのような高容量の電池回収システムのような高容量酵母増殖·システムと組み合わせた場合、これらの手順を使用して得られた。得CFTRは、様々な生化学的および生物物理学的アッセイにおけるタンパク質の容易な監視を可能にする切断可能なGFPタグを持っています。
本稿(ニワトリCFTRを含むプラスミドまたは凍結酵母細胞)に記載された試薬は、嚢胞性線維症財団(USA)により得ることができる。
開示事項
著者らは、競合する経済的利益も、この作品に関しては、他の利害を持っていない。
謝辞
この作品は、そのCFTR 3D構造のコンソーシアムを通じて米国嚢胞性線維症財団(CFF)によって賄われていた。 TRは英国BBSRCの学生の身分で、英国のCF信託学生の身分、およびNCによって資金を供給された。私たちは、彼らの助けやアドバイスをしてコドン最適化鶏のCFTRシーケンスおよび精製タグの設計のためのCFFのCFTR 3D構造コンソーシアムの私達の仲間を認める。
資料
| Name | Company | Catalog Number | Comments |
| 0.2 μm syringe filter | Sartorius | FC121 | |
| 100 kDa MWCO centrifugal concentrator (PES membrane) | Vivaspin | VS0641 | |
| 2 ml microfuge tubes | Sarstedt | 72.695 | |
| 40Ti rotor | Beckman Coulter | 337901 | |
| 50 ml sterile Falcon tubes | Sarstedt | 62.547.254 | |
| Adenosine triphosphate disodium salt (Na2ATP) | Sigma-Aldrich | A26209 | |
| Liquid chromatography system | GE Healthcare | 28-4062-64 | |
| Aminoethylbenzenesulfonyl fluoride (AEBSF) | Sigma-Aldrich | A8456 | |
| Glass bead-beating cell disrupter | BioSpec | 1107900 | |
| Benchtop centrifuge | HERMLE | Z300 | |
| Benchtop centrifuge | Eppendorf | 5417R | |
| Benchtop microfuge | Fisher | 13-100-511 | |
| Benzamidine hydrochloride | Sigma-Aldrich | 434760 | |
| Hydrophobic Beads SM-2 Adsorbent | BioRad | 152-3920 | |
| Bromophenol blue | Sigma-Aldrich | 114391 | |
| Centrifuge tubes | Beckman Coulter | 357000 | |
| Gel imaging system | BioRad | 170-808 | |
| Cholesterol | Sigma-Aldrich | C8667 | |
| Chymostatin | Sigma-Aldrich | C7268 | |
| Dimethylsulfoxide (DMSO) | Sigma-Aldrich | D8418 | |
| Dithiothreitol (DTT) | Sigma-Aldrich | 43815 | |
| E. coli total lipid extract | Avanti lipids | 100500 | |
| Epoxysuccinyl-leucylamido-butane (E-64) | Sigma-Aldrich | E3132 | |
| Glass beads, acid washed | Sigma | G8772 | |
| Glycerol | Fisher | 65017 | |
| HisTrap HP columns (5 ml) | GE Healthcare | 17-5247-05 | |
| Rapid Coomassie Stain | Novexin | ISB1L | |
| Centrifuge JA-17 rotor | Beckman Coulter | 369691 | |
| Leupeptin | Merck | 108975 | |
| Lyso-phosphatidyl glycerol-14 (LPG) | Avanti lipids | 858120 | |
| MgSO4 | Sigma-Aldrich | M7506 | |
| Gel tank SDS-PAGE system | BioRad | 165-8006 | |
| n-Dodecyl-β-D-maltopyranoside (DDM) | Affymetrix | D310S | |
| NaCl | Sigma-Aldrich | S6191 | |
| NaN3 | Sigma-Aldrich | S2002 | |
| NH4Cl | Sigma-Aldrich | A9434 | |
| Oligomycin | Sigma-Aldrich | 75351 | |
| Ultracentrifuge | Beckman Coulter | 392050 | |
| Prestained protein standards | Fermentas | SM1811 | |
| Desalting columns (Sephadex G-25) | GE Healthcare | 17-0851-01 | |
| Pepstatin A | Sigma-Aldrich | P4265 | |
| Phenylmethanesulfonylfluoride (PMSF) | Sigma-Aldrich | P7626 | |
| SCH28080 | Sigma-Aldrich | S4443 | |
| Sodium dodecyl sulfate (SDS) | Sigma-Aldrich | L37771 | |
| Sodium thiocyanate (NaSCN) | Sigma-Aldrich | 251410 | |
| Gel filtration 10/300 GL column | GE Healthcare | 17-5172-01 | |
| Tris-base | Formedium | TRIS01 | |
| Ultracentrifuge tubes | Beckman Coulter | 355618 | |
| Vortex mixer | Star Labs | N2400-0001 | |
| Ultrasonic water bath | Ultrawave | F0002202 | |
| Multimode plate reader | BioTek | BTH1MF |
参考文献
- Aleksandrov, A. A., Aleksandrov, L. A., Riordan, J. R. CFTR (ABCC7) is a hydrolyzable-ligand-gated channel. Pflugers Arch. 453, 693-702 (2007).
- Dodge, J. A., Lewis, P. A., Stanton, M., Wilsher, J. Cystic fibrosis mortality and survival in the UK: 1947-2003. EUR RESPIR J. 29, 522-526 (2007).
- O'Sullivan, B. P., Freedman, S. D. Cystic fibrosis. Lancet. 373, 1891-1904 (2009).
- Rommens, J. M., et al. Identification of the cystic fibrosis gene: chromosome walking and jumping. Science. 245, 1059-1065 (1989).
- Kariya, C., et al. A role for CFTR in the elevation of glutathione levels in the lung by oral glutathione administration. Am J Physiol Lung Cell Mol Physiol. 292, (2007).
- Gould, N. S., Min, E., Martin, R. J., Day, B. J. CFTR is the primary known apical glutathione transporter involved in cigarette smoke-induced adaptive responses in the lung. Free Radic Biol Med. 52, 1201-1206 (2012).
- Childers, M., Eckel, G., Himmel, A., Caldwell, J. A new model of cystic fibrosis pathology: lack of transport of glutathione and its thiocyanate conjugates. Med Hypotheses. 68, 101-112 (2007).
- Cole, S. P., et al. Overexpression of a transporter gene in a multidrug-resistant human lung cancer cell line. Science. 258, 1650-1654 (1992).
- Conseil, G., Deeley, R. G., Cole, S. P. Polymorphisms of MRP1 (ABCC1) and related ATP-dependent drug transporters. Pharmacogenet Genomics. 15, 523-533 (2005).
- Ketchum, C. J., Rajendrakumar, G. V., Maloney, P. C. Characterization of the adenosinetriphosphatase and transport activities of purified cystic fibrosis transmembrane conductance regulator. Biochemistry. 43, 1045-1053 (2004).
- Ramjeesingh, M., et al. A novel procedure for the efficient purification of the cystic fibrosis transmembrane conductance regulator (CFTR). Biochem J. 327 (Pt 1), 17-21 (1997).
- Huang, P., Liu, Q., Scarborough, G. A. Lysophosphatidylglycerol: a novel effective detergent for solubilizing and purifying the cystic fibrosis transmembrane conductance regulator. Anal Biochem. 259, 89-97 (1998).
- Rosenberg, M. F., Kamis, A. B., Aleksandrov, L. A., Ford, R. C., Riordan, J. R. Purification and crystallization of the cystic fibrosis transmembrane conductance regulator (CFTR). J Biol Chem. 279, 39051-39057 (2004).
- O'Ryan, L., Rimington, T., Cant, N., Ford, R. C. Expression and purification of the cystic fibrosis transmembrane conductance regulator protein in Saccharomyces cerevisiae. J Vis Exp. , (2012).
- Oldham, M. L., Chen, J. Snapshots of the maltose transporter during ATP hydrolysis. Proc Natl Acad Sci USA. 108, 15152-15156 (2011).
- Pinkett, H. W., Lee, A. T., Lum, P., Locher, K. P., Rees, D. C. An inward-facing conformation of a putative metal-chelate-type ABC transporter. Science. 315, 373-377 (2007).
- Dawson, R. J. P., Locher, K. P. Structure of a bacterial multidrug ABC transporter. Nature. 443, 180-185 (2006).
- Gerber, S., Comellas-Bigler, M., Goetz, B. A., Locher, K. P. Structural basis of trans-inhibition in a molybdate/tungstate ABC transporter. Science. 321, 246-250 (2008).
- Ward, A., Reyes, C. L., Yu, J., Roth, C. B., Chang, G. Flexibility in the ABC transporter MsbA: Alternating access with a twist. Proc Natl Acad Sci USA. 104, 19005-19010 (2007).
- Kadaba, N. S., Kaiser, J. T., Johnson, E., Lee, A., Rees, D. C. The high-affinity E. coli methionine ABC transporter: structure and allosteric regulation. Science. 321, 250-253 (2008).
- Aller, S. G., et al. Structure of P-Glycoprotein Reveals a Molecular Basis for Poly-Specific Drug Binding. Science. 323, 1718-1722 (2009).
- Koehler, J., et al. Lysophospholipid micelles sustain the stability and catalytic activity of diacylglycerol kinase in the absence of lipids. Biochemistry. 49, 7089-7099 (2010).
- Tian, C., et al. Preparation, functional characterization, and NMR studies of human KCNE1, a voltage-gated potassium channel accessory subunit associated with deafness and long QT syndrome. Biochemistry. 46, 11459-11472 (2007).
- Huang, P., Liu, Q., Scarborough, G. A. Lysophosphatidylglycerol: a novel effective detergent for solubilizing and purifying the cystic fibrosis transmembrane conductance regulator. Anal Biochem. 259, 89-97 (1998).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem. 72, 248-254 (1976).
- Chifflet, S., Torriglia, A., Chiesa, R., Tolosa, S. A method for the determination of inorganic phosphate in the presence of labile organic phosphate and high concentrations of protein: Application to lens ATPases. Analytical Biochemistry. 168, 1-4 (1988).
- Rothnie, A., et al. The importance of cholesterol in maintenance of P-glycoprotein activity and its membrane perturbing influence. Eur Biophys J. 30, 430-442 (2001).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved