Method Article
Purificazione della fibrosi cistica regolatore della conduttanza transmembrana proteina espressa in
In questo articolo
Riepilogo
Espressione eterologa e purificazione del regolatore della conduttanza transmembrana della fibrosi cistica (CFTR) sono sfide importanti e fattori limitanti per lo sviluppo di terapie farmacologiche per la fibrosi cistica. Questo protocollo descrive due metodi per l'isolamento di quantitativi milligrammo di CFTR adatti per studi funzionali e strutturali.
Abstract
Difetti nel regolatore di conduttanza transmembrana della fibrosi cistica (CFTR) proteine causano fibrosi cistica (CF), una malattia autosomica recessiva che limita l'aspettativa media di vita dei malati a <40 anni di età. Lo sviluppo di molecole di farmaci innovativi per ripristinare l'attività di CFTR è un obiettivo importante nel CF trattamento, e l'isolamento di CFTR funzionalmente attivo è un utile passo verso il raggiungimento di questo obiettivo.
Descriviamo due metodi per la purificazione di CFTR da un sistema di espressione eterologo eucariotico, S. cerevisiae. Come sistemi procariotici, S. cerevisiae può essere rapidamente coltivata in laboratorio a basso costo, ma può anche traffico e posttranslationally modificare grandi proteine di membrana. La selezione di detergenti per solubilizzazione e purificazione è un passaggio fondamentale nella purificazione di qualsiasi proteina di membrana. Dopo aver proiettato per la solubilità di CFTR in diversi detergenti, abbiamo scelto due contrasting detergenti per uso nella purificazione che permette la preparazione finale CFTR venga adattata agli esperimenti successivamente pianificati.
In questo metodo, forniamo confronto della purificazione di CFTR in dodecil-β-D-maltoside (DDM) e 1-tetradecanoyl-sn-glicero-3-fosfo-(1'-rac-glicerolo) (LPG-14). Proteina purificata in DDM con questo metodo mostra ATPasi in saggi funzionali. Proteina purificata in GPL-14 mostra elevata purezza e resa, possono essere utilizzati per studiare le modificazioni post-traduzionali, e può essere utilizzato per i metodi strutturali come piccolo angolo X-ray scattering e microscopia elettronica. Tuttavia visualizza ATPasi notevolmente inferiore.
Introduzione
La fibrosi cistica (FC) è la malattia genetica più diffusa in Europa e Nord America, con un'incidenza di circa 1 su 2.500 nati vivi. CF si verifica quando le mutazioni del regolatore transmembrana della fibrosi cistica conduttanza (CFTR) perdita di proteine causa della sua funzione a livello della membrana plasmatica delle cellule epiteliali 1. La conseguenza più grave di questo difetto è un danno polmonare irreversibile, che riduce l'aspettativa di vita dei malati a <40 anni di 2,3 anni.
CFTR è un ATP-binding cassette (ABC) trasportatore che si è evoluto per diventare un 1,4 canale ionico. Nonostante la sua funzione abbastanza alterato nella membrana plasmatica delle cellule, mantiene ancora una significativa omologia di sequenza con altri trasportatori ABC. Curiosamente, le parti specializzate di CFTR (cioè la sua regione regolatrice e il suo N-e C-terminali) non condividono rilevante somiglianza di sequenza con altri metazoi ABC trasportatori, quindi non ci sono indizi al secoloe le origini di queste sequenze in CFTR. Sulla base della sua struttura primaria, CFTR è classificato come un membro C-famiglia della famiglia trasportatore ABC, ma non vi è una forte evidenza di un legame funzionale residua a questa sottofamiglia. Ci sono state alcune segnalazioni di attività di trasporto glutatione per CFTR 5-7, che sarebbe coerente con i ruoli degli altri membri della famiglia C-8,9, anche se altri rapporti suggeriscono che il glutatione ridotto può inibire l'attività di CFTR ATPasi, piuttosto che mostrare l' substrato indotta da stimoli che caratterizzano i trasportatori ABC 10. Misurazione della conduttanza ionica è sufficientemente sensibile per consentire l'attività del canale di singole molecole CFTR da studiare 1 e proprietà del canale CFTR è stata monitorata in funzione del tempo, temperatura, concentrazione di ATP, potenziale di membrana, e stato di fosforilazione, nonché nella presenza di una miriade di piccoli inibitori della molecola, potenziatori e modificatori. QuesteGli studi hanno anche aggiunto in modo significativo alla nostra conoscenza di come funzionano trasportatori ABC. Tuttavia, l'espressione di CFTR in quantità significativa e la sua successiva purificazione ha dimostrato di essere particolarmente impegnativo e successo limitato a pochi laboratori 10-13.
La necessità di sviluppare farmaci più efficaci è pressante, ma questo processo è stato ostacolato dalla mancanza di CFTR purificato per lo screening di piccole molecole. Risolvere il problema espressione CFTR e purificazione consentirebbe high-throughput screening di farmaci volti a correggere il difetto primario nella FC e sarebbe anche aprire un percorso per studi strutturali ad alta risoluzione per informare la progettazione razionale di farmaci. Inoltre, anche relativamente caratteristiche biochimiche fondamentali della proteina, come lo stato oligomerico funzionale, proteine interagenti e ATPasi rimangono poco caratterizzati. Abbiamo precedentemente riportato un protocollo per l'espressione su larga scala di GFP-e His-tag CFTR murinoin S. cerevisiae 14 e ora descrivere ulteriormente i protocolli per la purificazione della proteina CFTR. Abbiamo usato questi metodi per purificare cinque ortologhi di CFTR e dati presenti per la purificazione di CFTR pollo come esempio. La selezione di detergenti per solubilizzazione e purificazione è un passaggio fondamentale nella purificazione di qualsiasi proteina di membrana. Avendo a screening per la solubilità di CFTR in diversi detergenti, abbiamo scelto due contrastanti detergenti per uso nella purificazione. Dodecil-β-D-maltoside (DDM) è un detergente non ionico che è stato ampiamente utilizzato per entrambi gli studi strutturali e funzionali delle proteine di membrana 15-21. Il detergente ionico 1-tetradecanoyl-sn-glicero-3-fosfo-(1'-rac-glicerolo) (LPG-14) è molto efficace nella solubilizzazione di CFTR ed è stato precedentemente utilizzato nella purificazione di proteine di membrana funzionali 10, 22,23, compreso purificazione della CFTR da S. cerevisiae 24.
Protocollo
1. Preparazione di buffer
- Per rendere lo stock 100x inibitori della proteasi (PI) cocktail sciogliere 96 mg AEBSF, 3,5 mg chimostatina, 10 mg E64, 16,5 mg leupeptina, 16,5 mg pepstatina, 348 mg PMSF, e 4 mg Bestatin in 20 ml di DMSO. Fai aliquote da 1 ml e conservare a -20 ° C. Per fare una scorta 100x di benzamidina sciogliere 720 mg in 20 ml di acqua ultrapura (DDH 2 O) e conservare in 1 ml aliquote a -20 ° C. Questa quantità è sufficiente per una purificazione. In tutti i buffer, le scorte PI e benzamidina sono usati alla diluizione 1:100.
- Preparare 'MPIB' (0,3 M Tris pH 8, 0.3 M saccarosio, 2 mM DTT) e 'CFTR' (50 mM Tris pH 8, 20% (v / v) di glicerolo, 1 mM DTT) tamponi e freddo a 4 ° C . Prima dell'uso, aggiungere 1:100 del cocktail di inibitori di proteasi e 1:100 benzamidina base al volume di MPIB usato per risospendere il pellet cellulare (ad esempio, utilizzare 3,5 ml PI e 3,5 ml benzamidina in un volume totale di 350 ml MPIB).
- Preparare solubilization buffer. Liso-fosfatidil glicerolo-14 (GPL) tampone di solubilizzazione (50 mM Tris pH 8, 10% (v / v) di glicerolo, 50 mM NaCl, 1 mM DTT, inibitori della proteasi (PI) e 4% (w / v) GPL) e maltoside dodecil (DDM) tampone di solubilizzazione (50 mM Tris pH 8, 20% (v / v) glicerolo, 1 M NaCl, 1 mM DTT, inibitori della proteasi, 4% (w / v) DDM). Buffer può essere sonicata in un bagno di sonicazione (35 W, 40 kHz) per assistere con dispersione del detersivo, ma evitare vortex la miscela, come questo crea bolle. Freddo a 4 ° C prima dell'uso.
- CFTR buffer di purificazione per la purificazione GPL è Tris 50 mM, 10% (v / v) di glicerolo, 50 mM NaCl, 1 mM DTT, 0,1% (p / v) GPL-14 e inibitori della proteasi. Preparare 350 ml di questo buffer, e 150 ml dello stesso tampone e 1 M imidazolo. Regolare il pH di entrambi i buffer a 8.
- Il tampone per la purificazione in DDM costituito da 50 mM Tris pH 8, 20% (v / v) glicerolo, 1 M NaCl, 1 mM DTT, 0.1% (w / v) DDM. Preparare 350 ml di questo buffer, e 150 ml dello stesso tampone e 1 M imidazoLe. Regolare il pH di entrambi i buffer a 8.
- Per la cromatografia a permeazione di gel (GPC) tampone contenente GPL, preparare 50 mM Tris pH 8, 10% (v / v) di glicerolo, 50 mM NaCl, 1 mM DTT, 0,05% (w / v) GPL-14. Per GPC usando DDM preparare un tampone di 50 mM Tris pH 8, 20% (v / v) glicerolo, 1 M NaCl, 1 mM DTT, 0.1% (w / v) DDM. Tutti i tamponi e DDH 2 O utilizzati sulla colonna GPC devono essere filtrati (0,2 micron filtro) e degasate prima dell'uso.
- Tampone campione SDS-PAGE (2x la concentrazione di lavoro): 50 mM Tris-HCl pH 7,6, 5% (v / v) glicerolo, EDTA 5 mM, 0,02% (w / v) di blu di bromofenolo. Rendere 700 microlitri aliquote e conservare a -20 ° C. Prima dell'uso, aggiungere 200 ml di 20% (w / v) di sodio dodecil solfato (SDS) e 100 ml di fresco 0,5 M DTT. Incubare per almeno 10 min con il campione a temperatura ambiente prima di caricare su gel. Non riscaldare; questo denaturare la GFP e può causare CFTR aggregare.
- Per rendere le scorte lipidiche per la ricostituzione, sciogliere un 4:01 (w / w), miscela di E. coli lipidi und in cloroformio e metanolo colesterolo (2:1 v / v), e secca in una fiala di vetro sotto N 2 gas per 2 ore per formare un film lipidico. Aggiungere tampone GPC (senza NaCl) ad una concentrazione lipidica di 40 mg / ml e utilizzare vortex ripetuta e sonicazione (35 W, 40 kHz) per chiarire la soluzione.
- Per il saggio ATPasi, preparare 100x scorte di inibitori ATPasi sciogliendo SCH28080 a 1 mM in DMSO, NaSCN a 1 M in DDH 2 O e oligomicina a 2,5 mM in 100% (v / v) di etanolo. Conservare in aliquote a -20 ° C. Rendere 100 ml di tampone ATPasi con 50 mM Tris pH 7,4, 150 mM NH 4 Cl, 5 mM MgSO 4 e 0,02% (w / v) NaN 3. Questo può essere conservato a temperatura ambiente e utilizzato per diversi saggi. Preparare uno stock di 5 mM ATP immediatamente prima dell'uso e tenere in ghiaccio. (NB Usa Na 2 ATP per evitare un eccessivo segnale di fondo del fosfato nel saggio). Preparare la soluzione di SDS arresto (12% (w / v) di SDS in DDH 2 O).
- Per la rilevazione Chifflet preparare tampone A (3% (w/ V) ascorbato, 0.5% (w / v) molibdato di ammonio, 0,5 M HCl) immediatamente prima dell'uso e tampone B (2% (w / v) citrato di sodio, 2% (w / v) di sodio meta-arsenito, 2% (v / v) di acido acetico).
2. Isolamento di Microsomes lievito
- S. cerevisiae esprimendo CFTR pollo sono coltivate come descritto in O'Ryan et al. (2012) 14. Conservare il materiale da una fermentazione L 20 in due aliquote a -80 ° C per 6 mesi.
- Scongelare una aliquota di cellule rapidamente e risospendere in 3 ml MPIB refrigerate per grammo di cellule.
- Distruggere le cellule in un mulino a sfere con perle di vetro di 425-600 micron di diametro. Utilizzare cinque periodi 1 min di rottura delle cellule separate da 1 min periodi di riposo. (I periodi di riposo sono essenziali per assicurare che le cellule non sono riscaldate durante l'interruzione.)
- Controllo rottura delle cellule mediante centrifugazione di un campione di 1 ml di lisato cellulare dal mulino a sfere. Centrifuga (12.000 xg, 4 ° C, 5 min) in un centr da bancoifuge. Diluire il surnatante a 1:50 con MPIB in una provetta e misurare la A 380. Se A 380> 0,1, o ha smesso di aumentare, nonostante diversi cicli bead-battenti ripetuti, procedere al passo successivo. In caso contrario, ripetere 2,3-2,4.
- Centrifugare il lisato cellulare totale (12.000 x g, 4 ° C, 20 min). Conservare il surnatante. Eliminare il pellet (contenente cellule intatte e mitocondri), ma se c'è qualche dubbio circa l'efficienza di rottura cella (si veda 2.4), quindi conservare il pellet anche.
- Centrifugare il surnatante della fase precedente (200.000 xg, a 4 ° C, 1,5 hr). Eliminare il surnatante e sospendere nuovamente le membrane microsomiali pellet in tampone CFTR. Se i microsomi sono destinati purificazione utilizzando DDM, integrare il buffer CFTR con 1 M NaCl.
- Ripetere la centrifugazione della frazione di membrana risospeso (100.000 x g, 4 ° C, 1 ora) e scartare il surnatante.
- Risospendere il pellet in microsomiun volume minimo di tampone CFTR (volume finale 5-15 ml, proteina microsomiale totale 70-200 mg). Un saggio Bradford può essere utilizzato per determinare la concentrazione totale di proteine microsomiali 25. Inoltre deve essere misurato lo spettro di emissione di fluorescenza delle membrane (eccitazione = 485 nm, emissione = 500-600 nm) e dovrebbe avere un picco di fluorescenza GFP distinta (massimo a 512 nm). CFTR può essere specificamente rilevato su un gel SDS-PAGE, scansionata in condizioni fluorescenza GFP (Figura 1).
- Flash-congelare i microsomi risospeso immergendo in azoto liquido e conservare a -80 ° C, o passare alla Fase 3.
3. Solubilizzazione di Microsomes
- Se congelato, scongelare microsomi immediatamente prima dell'uso in un bagnomaria regolato a 10 ° C.
- Per la solubilizzazione delle membrane, diluire i microsomi con un volume uguale di tampone di solubilizzazione pertinente (Passo 1.3) per ottenere una concentrazione finale di detersivo2% (w / v) e una proteina microsomiale concentrazione 5 mg / ml. Incubare questa miscela per 1 ora a 4 ° C con agitazione (tubo rotatore). Conservare 200 ml per l'analisi.
- Centrifugare la miscela (100.000 xg, a 4 ° C, 45 min). Rimuovere il surnatante contenente le proteine di membrana solubilizzate, passare attraverso un filtro a siringa da 0,45 micron e memorizzare sul ghiaccio. Misurare la fluorescenza del sovranatante (come al punto 2.8).
- Risospendere frazione insolubile in 1% (w / v) di SDS per un volume corrispondente alla frazione solubile. Misurare la fluorescenza in questa frazione e mantenere una aliquota di 50 microlitri per l'analisi SDS-PAGE.
4. Nickel-affinità Purificazione di CFTR
- Colonne collegamento due 5 ml di nichel sefarosio in serie. Lavare con 2 volumi di colonna (CV) 20% (v / v) etanolo, seguito da 2 CV DDH 2 O, poi lavare la colonna con 2 CV di tampone di solubilizzazione (Passo 1.4-1.5), contenente 1 M imidazolo. Ripetere con 2 CV di solubilization tampone privo di imidazolo.
- Aggiungere imidazolo ad una concentrazione finale di 5 mM al materiale solubilizzato (Passo 2.8) e caricate manualmente il materiale sulla colonna o in un ciclo campione se si utilizza un dispositivo automatizzato di cromatografia liquida.
- Caricare il materiale solubilizzato sulla colonna ad una velocità di flusso di 0,5 ml / min, e lavare con 2 CV di tampone imidazolo-lacunoso a parità di portata per rimuovere materiale non legato. Raccogliere le frazioni in 50 ml provette Falcon.
- Per il primo lavaggio, utilizzare 3 CV di tampone di purificazione con imidazolo 40 mM ad un flusso di 1 ml / min. Raccogliere 2 ml frazioni.
- Per il secondo lavaggio, utilizzare 3 CV di tampone di purificazione con imidazolo 100 mM. Raccogliere 2 ml frazioni.
- Eluire CFTR dalla colonna HisTrap con 3 CV di tampone depurazione mediante imidazolo 400 mm. Raccogliere 2 ml frazioni.
- Controllo fluorescenza in frazioni eluite (Passo 2.8).
- Conservare le aliquote di frazioni di punta per l'analisi SDS-PAGE. Freeze flash restante picco fcampioni raction e conservare a -80 ° C, o continuano a purificazione prossimo passo.
5. Permeazione di gel Chromatography (GPC) Purificazione di CFTR
- Equilibrare la colonna (Superose 6 10/300 GL) con 1,2 CV DDH 2 O seguita da 1,2 tampone CV GPC.
- Durante Fase 5.1, concentrare le Ni-affinità frazioni purificate con la massima fluorescenza GFP usando un filtro centrifugo 100.000 MWCO a 4 ° C. Se purificante in DDM, evitare di concentrare l'esempio di sopra di una concentrazione proteica di 0,3 mg / ml di proteine come questo causerà la perdita significativa del campione. Rimuovere il ritentato dal concentratore e centrifugare a 100.000 x g per 30 min a 4 ° C per sedimentare le particelle più grandi.
- Iniettare il campione attraverso la colonna ed eluire con una pendenza isocratica di 1,2 CV buffer di GPC. Raccogliere 0,5 ml frazioni.
- Misurare la fluorescenza GFP come nella sezione 2.8 di identificare quelle frazioni contenenti CFTR. Conservare un piccolo volume (ad es </ Em> 50 microlitri) di ciascuno per analisi mediante SDS-PAGE.
- Congelare le frazioni in azoto liquido e conservare a -80 ° C.
6. Ricostituzione di CFTR
- Aggiungere lipidi (passo 1,8) al CFTR purificata ad lipide-to-proteina rapporto 100:1 (w / w) e incubare a 4 ° C per 1 ora. Analogamente impostare un controllo solo lipidi, sostituendo la proteina purificata con lo stesso volume di tampone GPC.
- Rimuovere il detersivo dalla miscela di proteine / lipidi con perline adsorbenti idrofobiche. Lavare perline adsorbenti in 5 CV DDH 2 O, 5 CV 70% (v / v) etanolo, 5 CV DDH 2 O e 5 tampone CV GPC manca il detersivo. Aggiungere 200 mg di perline adsorbenti lavate per ml di proteina purificata e incubare a 4 ° C per una notte con agitazione.
- Raccogliere il campione di ricostituzione delle perle adsorbenti in una nuova provetta utilizzando un puntale sottile-ended.
7. Misurazione della ATPasi attività
- Determinare il tasso di CFTATPasi attività specifica-R utilizzando un saggio modificato Chifflet 26,27 in un formato di piastra da 96 pozzetti. Con la soluzione stock di fosfato di sodio (0,65 mm) preparare 0-20 nmol fosfato in un volume finale di 50 microlitri come standard. Utilizzare una miscela 1:1 di tampone CFTR e tampone ATPasi per diluire il brodo fosfato.
- Incubare sia CFTR ricostituito e liposomi bianco con 1:100 (v / v) gli inibitori ATPasi (Passo 1.9) in ghiaccio per 10 min. Utilizzare almeno 5 mg di CFTR ricostituito.
- Aggiungere ATP (Passo 1.9) ad una concentrazione finale di 2 mM e incubare a 25 ° C per 1 ora. Arrestare la reazione aggiungendo 40 ml di 10% (w / v) di SDS (punto 1.9) a ciascun pozzetto (compresi gli standard).
- Aggiungere 100 ml di tampone A (punto 1.10) e incubare per 10 min. Aggiungere 100 microlitri tampone B (1,10) a ciascun pozzetto e misurare l'assorbanza alla lunghezza d'onda di 800 nm in un 96-ben UV / Vis spettrofotometro compatibile piastra.
- Convertire assorbanza a 800 nm in una quantità di fosfato liberato usando l'standard di fosfati. Calcolare il tasso di idrolisi dopo aver sottratto il segnale di fondo (liposomi solo pozzetti).
- Per CFTR non ricostituito seguire lo stesso protocollo utilizzando tampone CFTR per le letture di fondo.
Risultati
Il protocollo descritto sopra è un mezzo efficace per isolare microsomi CFTR arricchito, con quasi totale recupero del CFTR durante la rottura delle cellule e la preparazione dei microsomi greggi (Figura 1). Altri metodi di rottura delle cellule possono anche essere impiegati efficacemente. Abbiamo utilizzato una cella francese pressione, e altri dispositivi high-pressure/cavitation (anche in combinazione con un impatto contro un bersaglio rubino) con uguale efficienza. Per comodità e basso costo iniziale delle attrezzature, troviamo il metodo bead-battere i migliori.
Utilizzo di GPL per solubilizzare e purificare proteine CFTR prodotto 80 ug / L coltura a> 90% di purezza (Figura 2). L'alto rendimento è dovuto alla solubilizzazione efficiente di CFTR GPL (confronta Figura 2b, corsie 2 e 4). Inoltre, efficiente e stretto legame alla colonna provocato minima perdita di CFTR della frazione non legata e l'assenza di CFTR nelle frazioni di lavaggio (figura 2, corsie 3, 5, e6). La proteina eluita aveva una purezza> 90%, stimato da Coomassie macchiati gel SDS-PAGE e utilizzando densitometria del CFTR e bande contaminanti. Cromatografia a permeazione di gel (GPC) separato GPL-CFTR purificato da contaminanti a basso peso molecolare (Figura 4, pannello inferiore).
Il protocollo di purificazione CFTR utilizzando DDM dà purezza di circa il 60% e la resa di circa 50 mg / L (Figura 3). La microscopia elettronica (EM) di frazioni colorate negativamente dalla GPC eluizione a circa 10 ml (Figura 4) ha mostrato che CFTR DDM-purificato contiene aggregati di diametro 20-30 nm e le particelle più piccole di 10 nm di diametro (dati non mostrati). E 'possibile che i piccoli aggregati possono reversibilmente associare e dissociare come ultrafiltrazione con un filtro cut-off 1 MDa omesso di rimuovere gli aggregati EM-rilevabili. Materiale LPG-purificato non assorbire a una griglia incandescente scaricata, quindi è stato studiato da Cryo-EM delle frazioni non colorati. Questo ha dimostratouna popolazione molto omogenea delle particelle di una dimensione relativamente piccola (6-8 nm di diametro, dati non mostrati).
Infine, l'attività ATPasi delle proteine purificate è stata misurata (Figura 5). Come membro della famiglia delle proteine ABC, CFTR ha due domini nucleotide-binding (NBDS) in grado di legare e / o idrolisi dell'ATP. I dati indicano che la proteina purificata non era in grado di idrolizzare ATP nello stato GPL-solubilizzato e ha mostrato attività ATPasi debole in presenza di DDM (Figura 5, bar vacanti). Dopo l'aggiunta di lipidi e rimozione detersivo, ATPasi è 4 volte maggiore per campioni che erano stati purificati in DDM (13 nmol ATP / min / mg di proteina). L'aggiunta di lipidi e rimozione di GPL attività simile ripristinato CFTR che era stato isolato utilizzando GPL, ma con un tasso inferiore finale (1,5 nmol ATP / min / mg proteina) rispetto al materiale DDM purificato e ricostituito.

Figura 1. Livelli di monitoraggio di CFTR pollo in lisato cellulare (CL), surnatanti (S) e pellets (P) durante varie fasi di centrifugazione utilizzati per l'isolamento microsome e lavaggio. Gel SDS-PAGE sono state visualizzate utilizzando la fluorescenza in-gel della GFP tag. Il surnatante dopo la rottura delle cellule e centrifugazione a 14.000 xg contiene praticamente tutto il CFTR (compresi i prodotti di degradazione). Ultracentrifugazione a 200.000 xg sedimenti tutto il full-length CFTR lasciando alcuni frammenti nel supernatante. Ultracentrifugazione a 100.000 xg di sale lavato microsomi pellets quasi tutto il CFTR con la rimozione di alcune ulteriori frammenti.
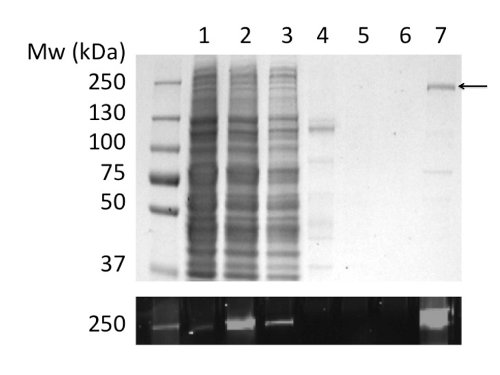
Figura 2. Purificazione di CFTR pollo in GPL mediante cromatografia di affinità ione metallo immobilizzato. Frazioni sono state analizzate mediante SDS-PAGE seguita da colorazione con Coomassie (pannello superiore) e rivelazione per fluorescenza del tag GFP (pannello inferiore). Tracks: (1) microsomi. (2) microsomi GPL-solubilizzati. (3) Il materiale non legato. (4) Il materiale insolubile. (5) e (6) 40 e 100 mM imidazolo lavaggi. (7) Materiale eluita con imidazolo 400 mM.
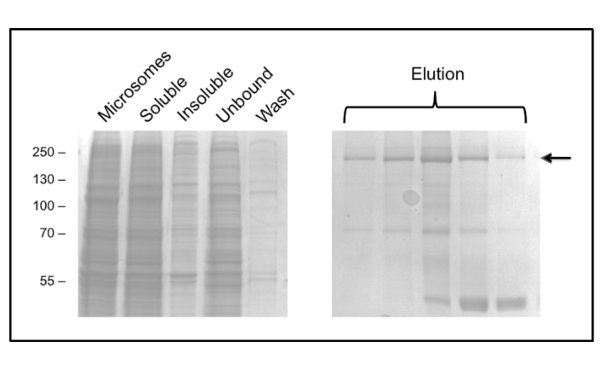
Figura 3. Purificazione di CFTR pollo in DDM mediante cromatografia di affinità ione metallo immobilizzato. Frazioni sono state analizzate mediante SDS-PAGE seguita da colorazione con Coomassie. Il pannello a sinistra mostra le frazioni prima di eluizione. Più frazioni di eluizione consecutivi sono mostrati nel pannello a destra con CFTR inindicato da freccia. Frazioni successive sono arricchiti in un contaminante 40 kDa, che è stato identificato mediante spettrometria di massa come proteina ribosomiale L3.
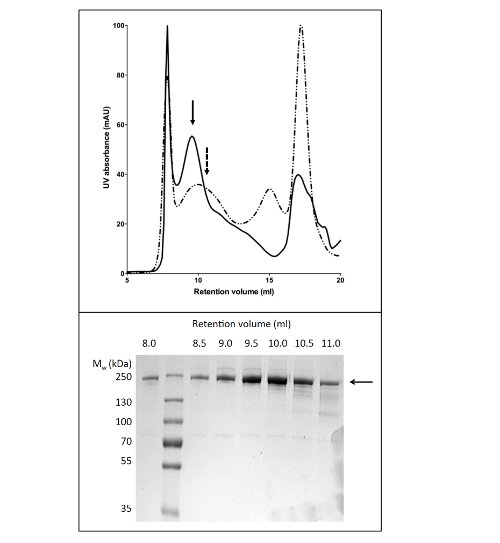
Figura 4. Purificazione di CFTR pollo mediante cromatografia a permeazione di gel. CFTR purificato mediante cromatografia Ni-affinità è stata concentrata e applicata a una colonna GPC. Il profilo di eluizione per CFTR (pannello superiore) purificato in tampone contenente GPL-14 (linea continua) o DDM (linea tratteggiata) sono sovrapposti. SDS-PAGE (pannello inferiore) ha rivelato che CFTR eluito tra 8 e 11 ml.
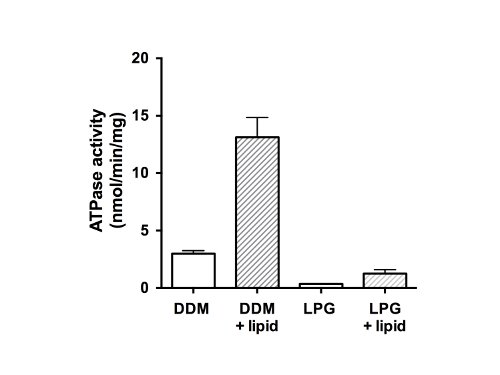
Figura 5. ATPasi activitY di frazioni purificate CFTR pollo. proteina purificata in DDM o GPL è stata saggiata usando un saggio modificato Chifflet 26 in presenza di un cocktail di inibitori ATPasi di eliminare qualsiasi sfondo ATPasi da F-, P-e V-ATPasi di tipo (bar vacanti ). Il tasso di idrolisi dell'ATP è stata misurata anche dopo la rimozione del detersivo e l'aggiunta di lipidi (barre piene). Il grafico mostra la media e la deviazione standard (n = 3). Le differenze tra i valori medi per ATPasi in presenza e assenza di lipidi, e differenza tra attività DDM e GPL sono significativi per p <0,05.
Discussione
Abbiamo precedentemente descritto un metodo per la sovraespressione di CFTR murino 14. Dopo la pubblicazione di tale protocollo, abbiamo espresso e purificato diversi ortologhi diversi di CFTR utilizzando lo stesso sistema. Tutti gli ortologhi testati finora purificati bene il detersivo GPL, mentre la purificazione DDM mostrato più variazione tra differenti ortologhi (dati non mostrati). Questa flessibilità illustra la forza dell'approccio lievito: è possibile schermare molti costrutti con relativa rapidità al fine di selezionare uno per uno scopo particolare.
Lavare i microsomi lievito con tampone contenente 1 M NaCl prima di solubilizzazione con i risultati DDM in una preparazione microsome più pulita e riduce gli agenti inquinanti in fasi successive. Questo passo è necessario nel protocollo GPL come campione CFTR finale è> 90% puro senza lavaggio microsome. Inoltre, purificazione nel DDM richiede alcune modifiche ai buffer di solubilizzazione unnd purificazione, cioè l'aggiunta di glicerolo oliva e sale. Insieme, queste aggiunte notevolmente aumentato il legame della proteina DDM-solubilizzato alla colonna.
La metodologia purificazione DDM ha margini di miglioramento, in particolare alla rimozione di un importante contaminante 40 kDa che, giudicato mediante spettrometria di massa, è dovuto alla subunità ribosomiale L3 lievito, che sembra avere un'affinità intrinseca per la resina nichel. Non c'è polyHis evidente sequenza nella proteina L3, ma l'esame della sua struttura 3D quando si lega al ribosoma (PDB = 1FFK) mostra che la subunità L3 piegato ha un potenziale polyHis cluster. Che questa band è meno problematica in materia GPL-purificato potrebbe essere dovuto al più duro detersivo GPL.
Sebbene la purificazione nel DDM sembra essere più povera di quella a GPL, detergenti lievi come DDM può essere più compatibile con analisi funzionali e strutturali e sono già stati utilizzati in vari crystall X-raystudi radiografico delle proteine di membrana 15-21. Inoltre, i nostri risultati hanno indicato che l'uso del GPL porta alla perdita della funzione ATPasi in CFTR relativo alla purificazione in DDM. Quindi si consiglia il protocollo di purificazione a base di GPL per la generazione di CFTR dove la purezza è cruciale, per esempio in applicazioni come la caratterizzazione di modificazioni post-traduzionali, o nella generazione di anticorpi, il protocollo basato GPL-verrebbe scelto . D'altra parte in applicazioni dove è essenziale l'attività e stato completamente nativo della proteina, proponiamo il protocollo basato DDM-come una scelta migliore.
Per concludere, questo protocollo descrive un metodo riproducibile per l'isolamento di CFTR nella zwitterionici detersivo GPL-14 o il detergente non ionico DDM. Come tale indica una più ampia gamma di condizioni di depurazione per CFTR che precedentemente sono stati segnalati 10-13. Inoltre milligrammi quantità di CFTR purificata possono essereottenuti mediante questi procedimenti quando combinato con un sistema di crescita del lievito alto volume come un fermentatore 20 L e un sistema di raccolta di cellule di capacità elevata come una L 6 bassa velocità del rotore della centrifuga. Il CFTR ottenuto ha un tag GFP scindibile, che consente un facile monitoraggio della proteina in vari saggi biochimici e biofisici.
Il reagente descritto in questo manoscritto (pollo plasmide-CFTR contenenti o cellule di lievito congelate) può essere ottenuto attraverso la Cystic Fibrosis Foundation (USA).
Divulgazioni
Gli autori non hanno interessi finanziari in competizione né altri interessi in conflitto rispetto a questo lavoro.
Riconoscimenti
Questo lavoro è stato finanziato dalla US Cystic Fibrosis Foundation (CFF), attraverso la sua struttura consortile CFTR 3D. TR è stato finanziato da una borsa di studio nel Regno Unito CF Trust, e NC da una borsa di studio nel Regno Unito BBSRC. Noi riconosciamo i nostri colleghi della struttura consortile CFF CFTR 3D per il loro aiuto e consigli e per la progettazione dei polli sequenza CFTR e di depurazione tag codone ottimizzato.
Materiali
| Name | Company | Catalog Number | Comments |
| 0.2 μm syringe filter | Sartorius | FC121 | |
| 100 kDa MWCO centrifugal concentrator (PES membrane) | Vivaspin | VS0641 | |
| 2 ml microfuge tubes | Sarstedt | 72.695 | |
| 40Ti rotor | Beckman Coulter | 337901 | |
| 50 ml sterile Falcon tubes | Sarstedt | 62.547.254 | |
| Adenosine triphosphate disodium salt (Na2ATP) | Sigma-Aldrich | A26209 | |
| Liquid chromatography system | GE Healthcare | 28-4062-64 | |
| Aminoethylbenzenesulfonyl fluoride (AEBSF) | Sigma-Aldrich | A8456 | |
| Glass bead-beating cell disrupter | BioSpec | 1107900 | |
| Benchtop centrifuge | HERMLE | Z300 | |
| Benchtop centrifuge | Eppendorf | 5417R | |
| Benchtop microfuge | Fisher | 13-100-511 | |
| Benzamidine hydrochloride | Sigma-Aldrich | 434760 | |
| Hydrophobic Beads SM-2 Adsorbent | BioRad | 152-3920 | |
| Bromophenol blue | Sigma-Aldrich | 114391 | |
| Centrifuge tubes | Beckman Coulter | 357000 | |
| Gel imaging system | BioRad | 170-808 | |
| Cholesterol | Sigma-Aldrich | C8667 | |
| Chymostatin | Sigma-Aldrich | C7268 | |
| Dimethylsulfoxide (DMSO) | Sigma-Aldrich | D8418 | |
| Dithiothreitol (DTT) | Sigma-Aldrich | 43815 | |
| E. coli total lipid extract | Avanti lipids | 100500 | |
| Epoxysuccinyl-leucylamido-butane (E-64) | Sigma-Aldrich | E3132 | |
| Glass beads, acid washed | Sigma | G8772 | |
| Glycerol | Fisher | 65017 | |
| HisTrap HP columns (5 ml) | GE Healthcare | 17-5247-05 | |
| Rapid Coomassie Stain | Novexin | ISB1L | |
| Centrifuge JA-17 rotor | Beckman Coulter | 369691 | |
| Leupeptin | Merck | 108975 | |
| Lyso-phosphatidyl glycerol-14 (LPG) | Avanti lipids | 858120 | |
| MgSO4 | Sigma-Aldrich | M7506 | |
| Gel tank SDS-PAGE system | BioRad | 165-8006 | |
| n-Dodecyl-β-D-maltopyranoside (DDM) | Affymetrix | D310S | |
| NaCl | Sigma-Aldrich | S6191 | |
| NaN3 | Sigma-Aldrich | S2002 | |
| NH4Cl | Sigma-Aldrich | A9434 | |
| Oligomycin | Sigma-Aldrich | 75351 | |
| Ultracentrifuge | Beckman Coulter | 392050 | |
| Prestained protein standards | Fermentas | SM1811 | |
| Desalting columns (Sephadex G-25) | GE Healthcare | 17-0851-01 | |
| Pepstatin A | Sigma-Aldrich | P4265 | |
| Phenylmethanesulfonylfluoride (PMSF) | Sigma-Aldrich | P7626 | |
| SCH28080 | Sigma-Aldrich | S4443 | |
| Sodium dodecyl sulfate (SDS) | Sigma-Aldrich | L37771 | |
| Sodium thiocyanate (NaSCN) | Sigma-Aldrich | 251410 | |
| Gel filtration 10/300 GL column | GE Healthcare | 17-5172-01 | |
| Tris-base | Formedium | TRIS01 | |
| Ultracentrifuge tubes | Beckman Coulter | 355618 | |
| Vortex mixer | Star Labs | N2400-0001 | |
| Ultrasonic water bath | Ultrawave | F0002202 | |
| Multimode plate reader | BioTek | BTH1MF |
Riferimenti
- Aleksandrov, A. A., Aleksandrov, L. A., Riordan, J. R. CFTR (ABCC7) is a hydrolyzable-ligand-gated channel. Pflugers Arch. 453, 693-702 (2007).
- Dodge, J. A., Lewis, P. A., Stanton, M., Wilsher, J. Cystic fibrosis mortality and survival in the UK: 1947-2003. EUR RESPIR J. 29, 522-526 (2007).
- O'Sullivan, B. P., Freedman, S. D. Cystic fibrosis. Lancet. 373, 1891-1904 (2009).
- Rommens, J. M., et al. Identification of the cystic fibrosis gene: chromosome walking and jumping. Science. 245, 1059-1065 (1989).
- Kariya, C., et al. A role for CFTR in the elevation of glutathione levels in the lung by oral glutathione administration. Am J Physiol Lung Cell Mol Physiol. 292, (2007).
- Gould, N. S., Min, E., Martin, R. J., Day, B. J. CFTR is the primary known apical glutathione transporter involved in cigarette smoke-induced adaptive responses in the lung. Free Radic Biol Med. 52, 1201-1206 (2012).
- Childers, M., Eckel, G., Himmel, A., Caldwell, J. A new model of cystic fibrosis pathology: lack of transport of glutathione and its thiocyanate conjugates. Med Hypotheses. 68, 101-112 (2007).
- Cole, S. P., et al. Overexpression of a transporter gene in a multidrug-resistant human lung cancer cell line. Science. 258, 1650-1654 (1992).
- Conseil, G., Deeley, R. G., Cole, S. P. Polymorphisms of MRP1 (ABCC1) and related ATP-dependent drug transporters. Pharmacogenet Genomics. 15, 523-533 (2005).
- Ketchum, C. J., Rajendrakumar, G. V., Maloney, P. C. Characterization of the adenosinetriphosphatase and transport activities of purified cystic fibrosis transmembrane conductance regulator. Biochemistry. 43, 1045-1053 (2004).
- Ramjeesingh, M., et al. A novel procedure for the efficient purification of the cystic fibrosis transmembrane conductance regulator (CFTR). Biochem J. 327 (Pt 1), 17-21 (1997).
- Huang, P., Liu, Q., Scarborough, G. A. Lysophosphatidylglycerol: a novel effective detergent for solubilizing and purifying the cystic fibrosis transmembrane conductance regulator. Anal Biochem. 259, 89-97 (1998).
- Rosenberg, M. F., Kamis, A. B., Aleksandrov, L. A., Ford, R. C., Riordan, J. R. Purification and crystallization of the cystic fibrosis transmembrane conductance regulator (CFTR). J Biol Chem. 279, 39051-39057 (2004).
- O'Ryan, L., Rimington, T., Cant, N., Ford, R. C. Expression and purification of the cystic fibrosis transmembrane conductance regulator protein in Saccharomyces cerevisiae. J Vis Exp. , (2012).
- Oldham, M. L., Chen, J. Snapshots of the maltose transporter during ATP hydrolysis. Proc Natl Acad Sci USA. 108, 15152-15156 (2011).
- Pinkett, H. W., Lee, A. T., Lum, P., Locher, K. P., Rees, D. C. An inward-facing conformation of a putative metal-chelate-type ABC transporter. Science. 315, 373-377 (2007).
- Dawson, R. J. P., Locher, K. P. Structure of a bacterial multidrug ABC transporter. Nature. 443, 180-185 (2006).
- Gerber, S., Comellas-Bigler, M., Goetz, B. A., Locher, K. P. Structural basis of trans-inhibition in a molybdate/tungstate ABC transporter. Science. 321, 246-250 (2008).
- Ward, A., Reyes, C. L., Yu, J., Roth, C. B., Chang, G. Flexibility in the ABC transporter MsbA: Alternating access with a twist. Proc Natl Acad Sci USA. 104, 19005-19010 (2007).
- Kadaba, N. S., Kaiser, J. T., Johnson, E., Lee, A., Rees, D. C. The high-affinity E. coli methionine ABC transporter: structure and allosteric regulation. Science. 321, 250-253 (2008).
- Aller, S. G., et al. Structure of P-Glycoprotein Reveals a Molecular Basis for Poly-Specific Drug Binding. Science. 323, 1718-1722 (2009).
- Koehler, J., et al. Lysophospholipid micelles sustain the stability and catalytic activity of diacylglycerol kinase in the absence of lipids. Biochemistry. 49, 7089-7099 (2010).
- Tian, C., et al. Preparation, functional characterization, and NMR studies of human KCNE1, a voltage-gated potassium channel accessory subunit associated with deafness and long QT syndrome. Biochemistry. 46, 11459-11472 (2007).
- Huang, P., Liu, Q., Scarborough, G. A. Lysophosphatidylglycerol: a novel effective detergent for solubilizing and purifying the cystic fibrosis transmembrane conductance regulator. Anal Biochem. 259, 89-97 (1998).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem. 72, 248-254 (1976).
- Chifflet, S., Torriglia, A., Chiesa, R., Tolosa, S. A method for the determination of inorganic phosphate in the presence of labile organic phosphate and high concentrations of protein: Application to lens ATPases. Analytical Biochemistry. 168, 1-4 (1988).
- Rothnie, A., et al. The importance of cholesterol in maintenance of P-glycoprotein activity and its membrane perturbing influence. Eur Biophys J. 30, 430-442 (2001).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon