Method Article
Очистка муковисцидоза трансмембранного регулятора проводимости белка выражается в
В этой статье
Резюме
Гетерологичная экспрессия и очистка муковисцидозный трансмембранного регулятора проводимости (CFTR) значительные проблемы и ограничивающие факторы в развитии лекарственной терапии для муковисцидоза. Этот протокол описывает два способа выделения миллиграмм количества CFTR, пригодных для функциональных и структурных исследований.
Аннотация
Дефекты в муковисцидоза трансмембранного регулятора проводимости (CFTR) белок вызывает кистозный фиброз (CF), аутосомно-рецессивные заболевания, что в настоящее время ограничивает среднюю продолжительность жизни больных до <40 лет. Разработка новых лекарственных молекул восстановить активность CFTR является важной целью в CF лечения, а также изоляция функционально активной CFTR является полезным шагом на пути к достижению этой цели.
Опишем два способа очистки CFTR от эукариотической гетерологического системы экспрессии, S. CEREVISIAE. Как прокариотических системах, С. CEREVISIAE можно быстро растет в лаборатории при низких затратах, но может также трафик и посттрансляционно изменить большие мембранные белки. Выбор моющих средств для растворения и очистки является важным шагом в очистке любого мембранного белка. После скринингу на растворимости CFTR в нескольких моющих средств, мы выбрали двух соntrasting моющие средства для использования в очистке, которые позволяют заключительная подготовка CFTR, чтобы быть адаптированы к впоследствии запланированных экспериментов.
В этом методе, мы предлагаем сравнение очистки CFTR в додецил-β-D-мальтозид (DDM) и 1-тетрадеканоил-Sn-глицеро-3-фосфо-(1'-рац-глицерин) (LPG-14). Белок очищали в DDM этим методом показывает АТФазы в функциональных анализах. Белок очищают LPG-14 показывает высокую чистоту и выход, может быть использован для изучения посттрансляционных модификаций, и может быть использован для структурных методов, таких как малоуглового рассеяния рентгеновских лучей и электронной микроскопии. Однако он отображает значительно ниже АТФазы.
Введение
Муковисцидоз (МВ) является наиболее распространенным генетическим заболеванием, в Европе и Северной Америке с частотой около 1 в 2500 живорожденных. CF происходит, когда мутации в муковисцидоза трансмембранного регулятора проводимости (CFTR) привести к потере белка своей функции на плазматической мембране эпителиальных клеток 1. Наиболее серьезным последствием этого дефекта является необратимое повреждение легких, что сокращает продолжительность жизни больных до <40 лет 2,3.
CFTR является АТФ-связывающего кассетного (ABC) транспортер, что превратилась ионный канал 1,4. Несмотря на довольно измененной функции в плазматической мембране клеток, он все еще сохраняет значительную гомологию последовательностей с другими транспортеров АВС. Интересно, что специализированные части CFTR (т.е. его регуляторной области и его N-и С-концы) не поделиться значительного сходства последовательности с другой многоклеточных ABC транспортеров, следовательно, нет никаких улик, как в гое истоки этих последовательностей в CFTR. На основе его первичной структуры, CFTR классифицируется в качестве члена C-семьи транспортера семьи ABC, но нет никаких убедительных доказательств для остаточной функциональной привязки к этой суб-семьи. Там было несколько сообщений о глутатион транспортной деятельности для CFTR 5-7, который будет соответствовать роли других членов С-семейных 8,9, хотя другие источники предполагают, что восстановленный глутатион может ингибировать активность CFTR АТФазную, а не показывая субстрат-индуцированного стимуляции, которые характеризуют перевозчиков ABC 10. Измерение ионной проводимости является достаточно чувствительным, чтобы позволить канал активность одиночных молекул CFTR быть изучены 1 и свойства канала CFTR были регистрируют как функцию времени, температуры, концентрации АТФ, мембранного потенциала и состояния фосфорилирования, а также в Наличие множества низкомолекулярные ингибиторы, усилителей и модификаторами. Этиисследования также добавил значительно к нашему знанию о том, как функционируют ABC транспортеры. Тем не менее, выражение CFTR в значительных количествах и его последующей очистки оказалась особенно сложной и успех был ограничен несколькими лабораториями 10-13.
Необходимость разработки более эффективных препаратов давит, но этот процесс был сдерживается отсутствием очищенного CFTR для скрининга малых молекул. Решение проблемы экспрессии CFTR и очистки позволит высокопроизводительного скрининга наркотиков, направленных на исправление основной дефект в CF, а также будет открыть маршрут для структурных исследований с высоким разрешением, чтобы сообщить рациональную конструкцию наркотиков. Более того, даже относительно основные биохимические характеристики белка, например, его функциональной олигомерного состояния, взаимодействующих белков и АТФазы остаются плохо охарактеризованы. Ранее мы уже сообщали протокол для крупномасштабной экспрессии GFP и его-меченых мышиных CFTRв S. CEREVISIAE 14 и теперь дополнительно описывают протоколы для очистки CFTR. Мы использовали эти методы, чтобы очистить пять ортологи CFTR и представления данных для очистки куриного CFTR в качестве примера. Выбор моющих средств для растворения и очистки является важным шагом в очистке любого мембранного белка. После скринингу на растворимости CFTR в нескольких моющих средств, мы выбрали два противоположных моющие средства для использования в очистке. Додецил-β-D-мальтозид (DDM) представляет собой неионный детергент, который широко используется как для структурных и функциональных исследований мембранных белков 15-21. Ионный детергент 1-тетрадеканоил-Sn-глицеро-3-фосфо-(1'-рац-глицерин) (LPG-14) является высокоэффективным в солюбилизации CFTR и ранее был использован в очищении функциональных мембранных белков 10, 22,23, в том числе очистки CFTR от S. CEREVISIAE 24.
протокол
1. Подготовка буферов
- Для того, чтобы 100x запас ингибитора протеазы (ИП) коктейль растворить 96 мг AEBSF, 3,5 мг химостатина, 10 мг E64, 16,5 мг лейпептина 16,5 мг пепстатин, 348 мг PMSF, и 4 мг бестатин в 20 мл ДМСО. Сделать 1 мл аликвоты и хранят при температуре -20 ° С. Чтобы сделать 100x запас бензамидина, растворить 720 мг в 20 мл воды высокой степени очистки (DDH 2 O) и магазин в 1 мл аликвоты при -20 ° С. Это количество является достаточным для одной очистки. Во всех буферов, PI и бензамидина запасы используются в разведении 1:100.
- Подготовка "mPIB '(0,3 М Трис, рН 8, 0,3 М сахарозы, 2 мМ DTT) и' CFTR '(50 мМ Трис рН 8, 20% (об / об) глицерина, 1 мМ DTT) буферы и холод до 4 ° С . Перед использованием добавьте 1:100 от коктейлем ингибиторов протеаз и 1:100 бензамидина в соответствии с объемом mPIB используется для ресуспендируют осадок клеток (например, использование 3,5 мл PI и 3,5 мл бензамидин в общем объеме 350 мл mPIB).
- Подготовка секolubilization буферы. Лизолецитин фосфатидилглицерин-14 (LPG) солюбилизацию буфер (50 мМ Трис рН 8, 10% (об / об) глицерина, 50 мМ NaCl, 1 мМ ДТТ, ингибиторы протеазы (ИП) и 4% (вес / объем) LPG) и додецилмальтозид (DDM) солюбилизацию буфер (50 мМ Трис рН 8, 20% (об / об) глицерина, 1 М NaCl, 1 мМ ДТТ, ингибиторы протеазы, 4% (вес / объем) DDM). Буфер можно ультразвуком в ультразвуковом бане (35 Вт, 40 кГц), чтобы помочь с разгона моющего средства, но избежать встряхивания смеси, так как это создает пузыри. Холод до 4 ° С перед использованием.
- CFTR очистка буфера для очистки сжиженного газа составляет 50 мМ Трис, 10% (об / об) глицерина, 50 мМ NaCl, 1 мМ ДТТ, 0,1% (вес / объем) LPG-14 и ингибиторы протеазы. Подготовка 350 мл этого буфера и 150 мл того же буфера плюс 1 М имидазолом. Отрегулируйте рН обоих буферов до 8.
- Буфер для очистки в DDM состоит из 50 мМ Трис, рН 8, 20% (об / об) глицерина, 1 М NaCl, 1 мМ ДТТ, 0,1% (вес / объем) DDM. Подготовка 350 мл этого буфера и 150 мл того же буфера плюс 1 М имидазоле. Отрегулируйте рН обоих буферов до 8.
- Для гель-проникающей хроматографии (ГПХ) буфера, содержащего сжиженный нефтяной газ, готовить 50 мМ Трис рН 8, 10% (об / об) глицерина, 50 мМ NaCl, 1 мМ DTT, 0,05% (вес / объем) LPG-14. Для GPC с использованием DDM подготовить буфер 50 мМ Трис, рН 8, 20% (об / об) глицерина, 1 М NaCl, 1 мМ DTT, 0,1% (вес / объем) DDM. Все буферы и DDH 2 O, используемые на колонке ГПХ должны быть отфильтрованы (0,2 мкм фильтр) и дегазировали перед использованием.
- Образец SDS-PAGE буфера (2x рабочую концентрацию): 50 мМ Трис-HCl рН 7,6, 5% (об / об) глицерина, 5 мМ ЭДТА, 0,02% (вес / объем) бромфенолового синего. Сделать 700 мкл аликвоты и хранят при температуре -20 ° С. Перед использованием добавьте 200 мкл 20% (вес / объем) додецилсульфата натрия (SDS) и 100 мкл свежей 0,5 М DTT. Выдержите в течение не менее 10 мин с образца при комнатной температуре перед загрузкой на геле. Не нагревайте; это будет денатурации GFP и может привести к агрегации CFTR.
- Чтобы сделать запасы липидов для восстановления, растворить 4:1 (вес / вес) смеси Е. палочка липидыD (2:1 об / об) холестерина в хлороформе и метаноле и сушат в стеклянную пробирку в атмосфере N2 газа в течение 2 часов с образованием липидной пленки. Добавить GPC буфер (без NaCl) до концентрации липидов 40 мг / мл и использовать повторное вихревание и ультразвуком (35 Вт, 40 кГц), чтобы разъяснить решение.
- Для анализа АТФазы, готовят 100x запасов ингибиторов АТФазы путем растворения SCH28080 до 1 мМ в ДМСО, NaSCN до 1 М в DDH 2 O и олигомицин до 2,5 мМ в 100% (объем / объем) этанола. Хранить в аликвоты при -20 ° С. Сделать 100 мл АТФазы буфера 50 мМ Трис, рН 7,4, 150 мМ NH 4 Cl, 5 мМ MgSO 4 и 0,02% (вес / объем) NaN 3. Это можно хранить при комнатной температуре и использовать в течение нескольких анализов. Подготовить запас 5 мМ АТФ непосредственно перед использованием и держать на льду. (NB Использование Na 2 АТФ, чтобы предотвратить чрезмерное фонового сигнала от фосфата в анализе). Подготовка стоп-раствора SDS (12% (вес / объем) SDS в DDH 2 O).
- Для обнаружения Chifflet подготовить буфером А (3% (мас/ Объем) аскорбат, 0,5% (вес / объем) молибдат аммония, 0,5 М HCl) непосредственно перед использованием и буфер Б (2% (вес / объем) цитрат натрия, 2% (вес / объем) натрий мета-Арсенит, 2% (объем / объем) уксусной кислоты).
2. Выделение дрожжей микросомах
- S.cerevisiae, выражая куриный CFTR выращивают, как описано в O'Ryan и соавт. (2012) 14. Храните материал из 20 L брожения в две аликвоты при -80 ° С в течение до 6 месяцев.
- Размораживание одну аликвоту клеток быстро и ресуспендируют в 3 мл охлажденной mPIB на грамм клеток.
- Разрушить клетки в шаровой мельнице с использованием стеклянных шариков диаметром 425-600 мкм. Используйте пять 1 мин периоды разрушения клеток, разделенных 1 мин периодами отдыха. (В периоды отдыха имеют важное значение для обеспечения того, чтобы клетки не подогреваются в срывов.)
- Монитор разрушение клеток центрифугированием в 1 мл образца клеточного лизата от шаровой мельнице. Центрифуга (12000 мкг, 4 ° С, 5 мин) в Настольные CENTRifuge. Развести супернатант до 1:50 с mPIB в кювете и измерить A 380. Если 380> 0,1, или уже перестали расти, несмотря на несколько повторяющихся циклов шарик избиение, перейдите к следующему шагу. Если нет, повторите 2,3-2,4.
- Центрифуга общее лизата клеток (12000 х г, 4 ° C, 20 мин). Сохранить супернатант. Откажитесь от осадка (содержащего неразрушенные клетки и митохондрии), но если есть какие-либо сомнения в эффективности клеточной поломки (см. 2.4), то сохранить осадок также.
- Центрифуга супернатант от предыдущей стадии (200 000 мкг, 4 ° C, 1,5 ч.). Удалите супернатант и ресуспендирования осаждали микросомальные мембраны в CFTR буфера. Если микросомы предназначены для очистки с использованием DDM, дополнить буфера CFTR с помощью 1 М NaCl.
- Повторите центрифугирования ресуспендировали в мембранной фракции (100000 х г, 4 ° С, 1 ч) и отбросить супернатант.
- Ресуспендируют осаждали микросом вМинимальный объем CFTR буфера (конечный объем 5-15 мл, общий микросомального белка 70-200 мг). Bradford анализ может быть использован для определения общей концентрации микросомальных белков 25. Кроме того, спектр флуоресценции мембран должны быть измерены (возбуждение = 485 нм, излучение = 500-600 нм) и должны иметь различные GFP пика флуоресценции (максимум при 512 нм). CFTR могут быть конкретно обнаруживается в геле SDS-PAGE, отсканированные под GFP условиях флуоресценции (рис. 1).
- Флеш-заморозить ресуспендированные микросом, погружаясь в жидком азоте и хранить при температуре -80 ° С, или перейдите к шагу 3.
3. Солюбилизация микросомах
- Если заморожены, размораживание микросом непосредственно перед применением в вод ной бане до 10 ° С
- Для солюбилизации мембран, разбавленный микросомах с равным объемом соответствующего буфера солюбилизации (этап 1.3), чтобы получить конечную концентрацию моющего средства2% (вес / объем) и микросомального белка концентрации 5 мг / мл. Инкубировать эту смесь в течение 1 часа при 4 ° С при перемешивании (трубка ротатора). Сохраните 200 мкл для анализа.
- Центрифуга смеси (100000 х г, 4 ° С, 45 мин). Удалить супернатант, содержащий растворенные мембранные белки, пропустить через шприцевой фильтр 0,45 мкм и хранить на льду. Измерить флуоресценцию супернатанта (как на шаге 2,8).
- Ресуспендируют нерастворимой фракции в 1% (вес / объем) SDS раствора в объеме, равном растворимой фракции. Измеряют флуоресценцию в этой фракции и удерживать аликвоту 50 мкл для анализа SDS-PAGE.
4. Никель-аффинной очистки CFTR
- Ссылка два 5 мл никель сефарозными колонки в серии. Промыть 2 объемами колонки (CV) 20% (объем / объем) этанола, с последующим 2 CV DDH 2 O, затем колонку промывают 2 CV буфера солюбилизации (шаг 1,4-1,5), содержащего 1 М имидазола. Повторите с 2 CV из solubilizatионный буфер хватает имидазола.
- Добавить имидазол до конечной концентрации 5 мМ до солюбилизированного вещества (этап 2.8) и вручную загрузить материал на колонку или в петлю образца при использовании автоматизированной хроматографической устройство жидкости.
- Загрузить солюбилизированного материала на колонку при скорости потока 0,5 мл / мин и промывают 2 CV имидазольного-хватает буфере при той же скорости потока для удаления несвязанного материала. Сбор фракций в 50 мл пробирки Фалкон.
- Для первой стирки, использовать 3 CV буфера очистки с 40 мМ имидазола при скорости потока 1 мл / мин. Сбор 2 мл фракции.
- Для второй стирки, использовать 3 CV буфера очистки с 100 мМ имидазола. Сбор 2 мл фракции.
- Элюировать CFTR из колонки HisTrap с 3 CV буфера очистки с 400 мМ имидазола. Сбор 2 мл фракции.
- Монитор флуоресценцию в элюированных фракций (Шаг 2.8).
- Сохранение аликвоты пиковых фракций для анализа SDS-PAGE. Ледяная вспышка оставаясь пик еОбразцы raction и хранить при температуре -80 ° С, или перейдите к следующему стадии очистки.
5. Гель-проникающей хроматографии (ГПХ) Очистка CFTR
- Равновесие столбец (суперозой 6 10/300 GL) с 1,2 CV DDH 2 O, затем на 1,2 CV ГПХ буфера.
- В шаге 5.1, сконцентрировать Ni-аффинно-очищенные фракции с самой высокой флуоресценции GFP с помощью 100000 MWCO центробежный фильтр при 4 ° С. Если в DDM очистки, во избежание концентрации образца выше концентрации белка 0,3 мг белка / мл так как это вызовет значительную потерю образца. Извлеките ретентата от концентратора и центрифуге при 100000 х г в течение 30 мин при 4 ° С для осаждения крупных частиц.
- Введите этот образец в колонку и элюируют градиентом изократическом 1,2 CV буфера ГПХ. Сбор 0,5 мл фракции.
- Измерьте флуоресценции GFP как в разделе 2.8, чтобы определить те фракции, содержащие CFTR. Сохраните небольшой объем (например, </ EM> 50 мкл) из каждой для анализа с помощью SDS-PAGE.
- Замораживание фракции в жидком азоте и хранят при температуре -80 ° С.
6. Реконституция CFTR
- Добавить липиды (шаг 1.8) к очищенной CFTR на липидный-к-белка соотношении 100:1 (W / W) и инкубировать при температуре 4 ° С в течение 1 часа. Аналогичным образом настроить контроль липидов только, заменяя очищенный белок с таким же объемом буфера ГПХ.
- Удалить моющее средство из белка / липидной смеси с использованием адсорбента бусы. Промыть адсорбента шарики в 5 CV DDH 2 O, 5 CV 70% (объем / объем) этанола, 5 CV DDH 2 O, и 5 CV ГПХ буфере без моющего средства. Добавить 200 мг промытого адсорбента шариков на мл очищенного белка и инкубируют при 4 ° С в течение ночи при осторожном перемешивании.
- Соберите реконституции образец из адсорбента бисера в чистую пробирку, используя тонкую состава пипетки.
7. Измерение АТФазы
- Определите скорость ФТR конкретных АТФазы с использованием модифицированного анализа Chifflet 26,27 в формате 96-луночного планшета. С натрий-фосфатного раствора (0,65 мМ) готовить 0-20 нмоль фосфата в конечном объеме 50 мкл в качестве стандартов. Использование смесь 1:1 буфера CFTR и АТФазы буфера для разбавления фосфата запас.
- Выдержите как восстановленного CFTR и пустые липосомы с 1:100 (V / V) ингибиторов АТФазы (шаг 1.9) на льду в течение 10 мин. Используйте как минимум 5 мкг восстановленного CFTR.
- Добавить АТФ (этап 1,9) до конечной концентрации 2 мМ и инкубируют при 25 ° С в течение 1 часа. Остановить реакцию добавлением 40 мкл 10% (вес / объем) SDS (шаг 1,9) в каждую лунку (в том числе стандартам).
- Добавить 100 мкл буфера А (Шаг 1,10) и инкубировать в течение 10 мин. Добавить 100 мкл буфера В (1.10) в каждую лунку и измеряют поглощение при длине волны 800 нм в 96-луночный планшет-совместимый UV / VIS спектрофотометр.
- Преобразование оптической плотности при 800 нм в количестве освобожденной фосфата с помощьюстандарты фосфатные. Рассчитайте скорость гидролиза АТФ после вычитания фонового сигнала (липосом только скважин).
- Для не-восстановленного CFTR следовать той же протокол помощью CFTR буфера для чтения фона.
Результаты
Протокол, описанный выше, является эффективным средством изолировать CFTR обогащенный микросом, с почти полного восстановления CFTR во время клеточного повреждения и подготовки сырой микросомах (рис. 1). Другие методы клеток поломки также могут быть использованы эффективно. Мы использовали французскую ячейку давления, и другие high-pressure/cavitation устройств (также в сочетании с влияя против цели рубинового) с одинаковой эффективностью. Для удобства и низкой начальной стоимости оборудования, мы находим методом шарик избиение лучших.
Использование сжиженного газа для растворения и очистки CFTR дали 80 мкг белка / л культуры на> 90% чистоты (рис. 2). Высокий выход было связано с эффективной солюбилизации CFTR на LPG (ср. фиг.2В, дорожки 2 и 4). Кроме того, эффективным и сильной связи в колонну привело к минимальной потерей CFTR в несвязанной фракции и отсутствие CFTR в промывной фракции (рис. 2, дорожки 3, 5, и6). Элюированный белок имел чистоту> 90%, по оценкам Кумасси окрашенных ПААГ с ДСН и с помощью денситометрии в CFTR и загрязняющих групп. Гель-проникающей хроматографии (ГПХ), разделенных СНГ очищенный CFTR от загрязнений низкомолекулярных (рис. 4, нижняя панель).
Протокол для очистки CFTR с помощью DDM дает чистоту примерно 60% и выходом около 50 мкг / л (рис. 3). Электронной микроскопии (ЭМ) из отрицательно окрашенных фракций из ГПХ, элюирующихся при примерно 10 мл (рис. 4) показали, что очищенный DDM-CFTR содержит агрегаты диаметром 20-30 нм, а также более мелкие частицы диаметром 10 нм (данные не показаны). Вполне возможно, что небольшие агрегаты могут обратимо связывать и отделить как ультрафильтрации с 1 МДа отсечения фильтра не удалось удалить ЭМ-обнаруживаемые агрегатов. LPG-очищенный материал не адсорбировать на тлеющем разряжен сетки, следовательно, был изучен крио-ЭМ неокрашенных фракций. Это показало,очень однородной популяции частиц из относительно малого размера (6-8 нм в диаметре, данные не показаны).
Наконец, АТФазы из очищенных белков измеряли (рис. 5). Как член семейства белков ABC, CFTR имеет два нуклеотидных-связывающие домены (NBDs) способны связывать и / или гидролиза АТФ. Данные показывают, что очищенный белок был не в состоянии для гидролиза АТФ в LPG-солюбилизированного состоянии и показали слабую АТФ-азной активностью в присутствии DDM (рис. 5, незаполненные столбики). После добавления липидов и удаления детергента, АТФазы была в 4 раза выше для образцов, очищенный в DDM (13 нмоль ATP / мин / мг белка). Добавление липидов и удаления LPG аналогично восстановленной активности в CFTR, которые были изолированы с помощью LPG, но с меньшей скоростью окончательного (1,5 нмоль ATP / мин / мг белка), чем DDM-очищенного и восстановленного материала.
Рисунок 1. Уровни мониторинга куриного CFTR в лизата клеток (CL), супернатанты (S) и гранулы (P) во время различных стадиях центрифугирования, используемых для изоляции микросомной и промывки. ПААГ с ДСН были визуализированы с помощью в-гель флуоресценции GFP тег. Супернатант после клеточной поломки и центрифугирования при 14000 х г содержит практически все CFTR (в том числе продуктов распада). Ультрацентрифугирование 200000 XG отложений все полнометражный CFTR, оставляя некоторые фрагменты в супернатанте. Ультрацентрифугирование при 100000 х г соленых промывают микросомах гранул почти все CFTR с удалением некоторых дополнительных фрагментов.
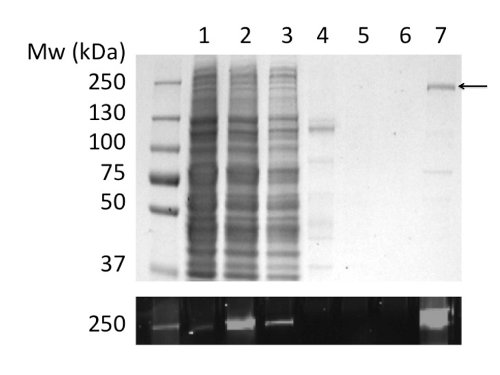
Рисунок 2. Очистка куриного CFTR в СНГ по иммобилизованным ионом металла аффинной хроматографии. Фракции анализировали электрофорезом в ДСН-ПААГ с последующим окрашиванием кумасси (верхняя панель) и обнаружения флуоресценции GFP тега (нижняя панель). Количество треков: (1) микросом. (2) LPG-солюбилизированы Микросомы. (3) Несвязанный материал. (4) Нерастворимый материал. (5) и (6) 40 и 100 мМ имидазола моет. (7) Материал элюировали 400 мМ имидазола.
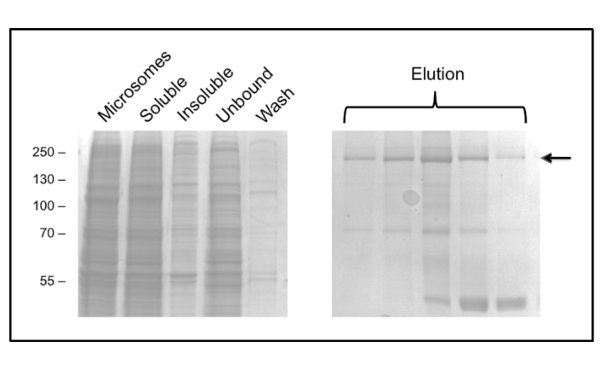
Рисунок 3. Очистка куриного CFTR в DDM по иммобилизованным ионом металла аффинной хроматографии. Фракции анализировали с помощью SDS-PAGE с последующим окрашиванием Кумасси. Левой панели показывает фракций до элюирования. Несколько последовательных фракции элюции приведены в правой панели с CFTR вdicated стрелкой. Более поздние фракции обогащены в 40 кДа примеси, который был определен методом масс-спектрометрии, как рибосомного белка L3.
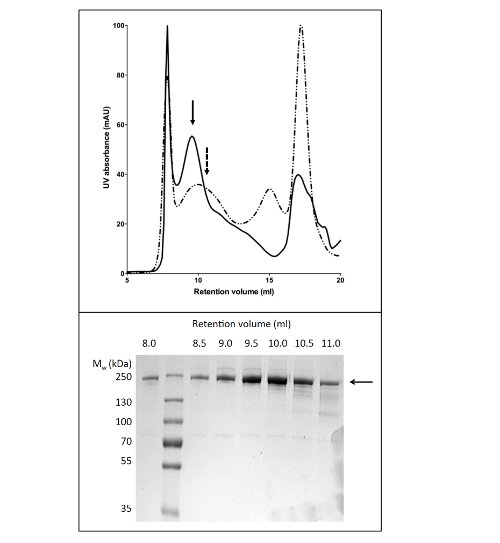
Рисунок 4. Очистка куриного CFTR с помощью гель-проникающей хроматографии. CFTR очищают Ni-афинной хроматографии концентрировали и наносили на колонку ГПХ. Профиль элюции для CFTR (верхняя панель), очищенный буфере, содержащем LPG-14 (сплошная линия) или DDM (пунктирная линия) накладываются. SDS-PAGE (нижняя панель) показал, что CFTR элюируют между 8 и 11 мл.
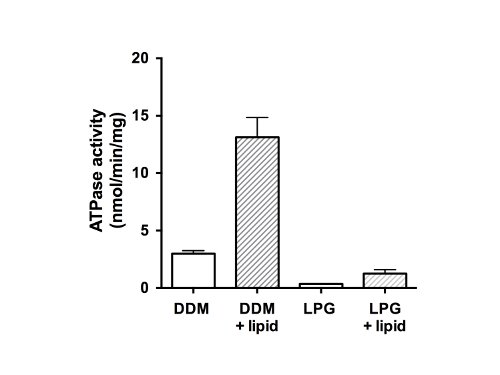
Рисунок 5. АТФазы Activitу очищенных курица CFTR фракций. Белок очищенный DDM или СНГ анализировали с помощью модифицированного Chifflet анализа 26 в присутствии коктейля ингибиторов АТФазы, чтобы устранить любые фона АТФазы от F-, P-и АТФаз V-типа (незаполненные баров ). Скорость гидролиза АТФ была также измерена после удаления детергента и липида того (закрашенные столбцы). Сюжет показывает среднее и стандартное отклонение (п = 3). Различия между средними значениями для АТФазы в присутствии и в отсутствие липида и разницы между активностью в DDM и сжиженного нефтяного газа являются существенными для р <0,05.
Обсуждение
Ранее мы описали метод сверхэкспрессией мышиного CFTR 14. С момента публикации этого протокола, мы выразили и очищенный несколько различных Ортологи CFTR используя ту же систему. Все испытанные ортологи так далеко очищают хорошо в LPG моющего средства, в то время как очистка DDM показали больший разброс между различными ортологи (данные не показаны). Эта гибкость иллюстрирует прочность подход дрожжей: можно экранировать много конструкций с относительной скоростью, чтобы выбрать один для определенной цели.
Стиральная дрожжевых микросом с буфером, содержащим 1 М NaCl до солюбилизации с результатами DDM в более чистой подготовки микросомной и снижает загрязняющих веществ на более поздних стадиях. Этот шаг не является необходимым в протоколе СНГ как окончательная проба CFTR является> 90% чистоты без микросомной стирки. Кроме того, очистка в DDM требует нескольких изменений в буферов для солюбилизации аочистка й, а именно добавление дополнительной глицерин и соли. Вместе эти добавки значительно увеличилось связывание DDM-солюбилизированного белка в колонку.
Методика очистки DDM имеет возможности для совершенствования, в частности удаление 40 кДа основной примеси, которые, если судить по масс-спектрометрии, связано с дрожжи рибосомной субъединицы L3, который появляется иметь характеристическую сродство к смоле никеля. Там нет очевидного polyHis последовательность в белке L3, но экспертиза его 3D структуры при связывании с рибосомой (PDB = 1FFK) показывает, что сложил L3 субъединицы имеет потенциальную polyHis кластер. То, что это группа менее проблематично в СНГ очищенный материал может быть связано с более жесткой СНГ моющего средства.
Хотя очистка в DDM-видимому, беднее, чем в СНГ, более мягкие детергенты, такие как DDM может быть более совместимым с функциональной и структурной анализов и уже используется в нескольких рентгеновских Кристаллographic исследования мембранных белков 15-21. Кроме того, наши результаты показывают, что использование сжиженного газа приводит к потере функции АТФазы в CFTR относительно очистки в DDM. Поэтому мы рекомендуем протокол очистки LPG основе для генерации CFTR, где чистота имеет решающее значение, например, в таких приложениях, как характеристике пост-трансляционных модификаций, или в генерации антител, протокол СНГ на основе будет выбран . С другой стороны в случаях, когда деятельность и полностью родное государство белка имеет важное значение, мы бы предложить протокол DDM основе в качестве лучшего варианта.
В заключение, этот протокол описывает воспроизводимый метод для изоляции CFTR в цвиттерионного моющего средства LPG-14 или неионные моющего DDM. Как таковой, он указывает на более широкий спектр очистных условий для CFTR чем уже сообщалось ранее 10-13. В дополнение миллиграмм количеств очищенного CFTR может бытьполученные с использованием этих процедур в сочетании с высокой объемной системы рост дрожжей, таких как 20-литровом ферментере и системой сбора клеток с высокой пропускной способностью, такой как 6 л низкой скорости ротора центрифуги с. CFTR получены имеет отщепляемую GFP тег, который позволяет легко контролировать белка в различных биохимических и биофизических анализов.
Реагента, описанного в этой рукописи (CFTR курица, содержащие плазмиды или замороженные дрожжевые клетки) могут быть получены путем кистозного фиброза Foundation (США).
Раскрытие информации
Авторы не имеют конкурирующие финансовые интересы, ни других противоречивых интересов в отношении этой работы.
Благодарности
Эта работа финансировалась американским Муковисцидоз Фонда (CFF) через свою CFTR 3D Consortium структуры. TR финансировалось за счет Великобритании CF Целевой студенчества и NC на студенчества Великобритании BBSRC. Мы признаем, наших коллег в структуре консорциума CFF CFTR 3D для их помощью и советом, и для конструкции курица последовательности CFTR и очистки тегов кодон-оптимизированный.
Материалы
| Name | Company | Catalog Number | Comments |
| 0.2 μm syringe filter | Sartorius | FC121 | |
| 100 kDa MWCO centrifugal concentrator (PES membrane) | Vivaspin | VS0641 | |
| 2 ml microfuge tubes | Sarstedt | 72.695 | |
| 40Ti rotor | Beckman Coulter | 337901 | |
| 50 ml sterile Falcon tubes | Sarstedt | 62.547.254 | |
| Adenosine triphosphate disodium salt (Na2ATP) | Sigma-Aldrich | A26209 | |
| Liquid chromatography system | GE Healthcare | 28-4062-64 | |
| Aminoethylbenzenesulfonyl fluoride (AEBSF) | Sigma-Aldrich | A8456 | |
| Glass bead-beating cell disrupter | BioSpec | 1107900 | |
| Benchtop centrifuge | HERMLE | Z300 | |
| Benchtop centrifuge | Eppendorf | 5417R | |
| Benchtop microfuge | Fisher | 13-100-511 | |
| Benzamidine hydrochloride | Sigma-Aldrich | 434760 | |
| Hydrophobic Beads SM-2 Adsorbent | BioRad | 152-3920 | |
| Bromophenol blue | Sigma-Aldrich | 114391 | |
| Centrifuge tubes | Beckman Coulter | 357000 | |
| Gel imaging system | BioRad | 170-808 | |
| Cholesterol | Sigma-Aldrich | C8667 | |
| Chymostatin | Sigma-Aldrich | C7268 | |
| Dimethylsulfoxide (DMSO) | Sigma-Aldrich | D8418 | |
| Dithiothreitol (DTT) | Sigma-Aldrich | 43815 | |
| E. coli total lipid extract | Avanti lipids | 100500 | |
| Epoxysuccinyl-leucylamido-butane (E-64) | Sigma-Aldrich | E3132 | |
| Glass beads, acid washed | Sigma | G8772 | |
| Glycerol | Fisher | 65017 | |
| HisTrap HP columns (5 ml) | GE Healthcare | 17-5247-05 | |
| Rapid Coomassie Stain | Novexin | ISB1L | |
| Centrifuge JA-17 rotor | Beckman Coulter | 369691 | |
| Leupeptin | Merck | 108975 | |
| Lyso-phosphatidyl glycerol-14 (LPG) | Avanti lipids | 858120 | |
| MgSO4 | Sigma-Aldrich | M7506 | |
| Gel tank SDS-PAGE system | BioRad | 165-8006 | |
| n-Dodecyl-β-D-maltopyranoside (DDM) | Affymetrix | D310S | |
| NaCl | Sigma-Aldrich | S6191 | |
| NaN3 | Sigma-Aldrich | S2002 | |
| NH4Cl | Sigma-Aldrich | A9434 | |
| Oligomycin | Sigma-Aldrich | 75351 | |
| Ultracentrifuge | Beckman Coulter | 392050 | |
| Prestained protein standards | Fermentas | SM1811 | |
| Desalting columns (Sephadex G-25) | GE Healthcare | 17-0851-01 | |
| Pepstatin A | Sigma-Aldrich | P4265 | |
| Phenylmethanesulfonylfluoride (PMSF) | Sigma-Aldrich | P7626 | |
| SCH28080 | Sigma-Aldrich | S4443 | |
| Sodium dodecyl sulfate (SDS) | Sigma-Aldrich | L37771 | |
| Sodium thiocyanate (NaSCN) | Sigma-Aldrich | 251410 | |
| Gel filtration 10/300 GL column | GE Healthcare | 17-5172-01 | |
| Tris-base | Formedium | TRIS01 | |
| Ultracentrifuge tubes | Beckman Coulter | 355618 | |
| Vortex mixer | Star Labs | N2400-0001 | |
| Ultrasonic water bath | Ultrawave | F0002202 | |
| Multimode plate reader | BioTek | BTH1MF |
Ссылки
- Aleksandrov, A. A., Aleksandrov, L. A., Riordan, J. R. CFTR (ABCC7) is a hydrolyzable-ligand-gated channel. Pflugers Arch. 453, 693-702 (2007).
- Dodge, J. A., Lewis, P. A., Stanton, M., Wilsher, J. Cystic fibrosis mortality and survival in the UK: 1947-2003. EUR RESPIR J. 29, 522-526 (2007).
- O'Sullivan, B. P., Freedman, S. D. Cystic fibrosis. Lancet. 373, 1891-1904 (2009).
- Rommens, J. M., et al. Identification of the cystic fibrosis gene: chromosome walking and jumping. Science. 245, 1059-1065 (1989).
- Kariya, C., et al. A role for CFTR in the elevation of glutathione levels in the lung by oral glutathione administration. Am J Physiol Lung Cell Mol Physiol. 292, (2007).
- Gould, N. S., Min, E., Martin, R. J., Day, B. J. CFTR is the primary known apical glutathione transporter involved in cigarette smoke-induced adaptive responses in the lung. Free Radic Biol Med. 52, 1201-1206 (2012).
- Childers, M., Eckel, G., Himmel, A., Caldwell, J. A new model of cystic fibrosis pathology: lack of transport of glutathione and its thiocyanate conjugates. Med Hypotheses. 68, 101-112 (2007).
- Cole, S. P., et al. Overexpression of a transporter gene in a multidrug-resistant human lung cancer cell line. Science. 258, 1650-1654 (1992).
- Conseil, G., Deeley, R. G., Cole, S. P. Polymorphisms of MRP1 (ABCC1) and related ATP-dependent drug transporters. Pharmacogenet Genomics. 15, 523-533 (2005).
- Ketchum, C. J., Rajendrakumar, G. V., Maloney, P. C. Characterization of the adenosinetriphosphatase and transport activities of purified cystic fibrosis transmembrane conductance regulator. Biochemistry. 43, 1045-1053 (2004).
- Ramjeesingh, M., et al. A novel procedure for the efficient purification of the cystic fibrosis transmembrane conductance regulator (CFTR). Biochem J. 327 (Pt 1), 17-21 (1997).
- Huang, P., Liu, Q., Scarborough, G. A. Lysophosphatidylglycerol: a novel effective detergent for solubilizing and purifying the cystic fibrosis transmembrane conductance regulator. Anal Biochem. 259, 89-97 (1998).
- Rosenberg, M. F., Kamis, A. B., Aleksandrov, L. A., Ford, R. C., Riordan, J. R. Purification and crystallization of the cystic fibrosis transmembrane conductance regulator (CFTR). J Biol Chem. 279, 39051-39057 (2004).
- O'Ryan, L., Rimington, T., Cant, N., Ford, R. C. Expression and purification of the cystic fibrosis transmembrane conductance regulator protein in Saccharomyces cerevisiae. J Vis Exp. , (2012).
- Oldham, M. L., Chen, J. Snapshots of the maltose transporter during ATP hydrolysis. Proc Natl Acad Sci USA. 108, 15152-15156 (2011).
- Pinkett, H. W., Lee, A. T., Lum, P., Locher, K. P., Rees, D. C. An inward-facing conformation of a putative metal-chelate-type ABC transporter. Science. 315, 373-377 (2007).
- Dawson, R. J. P., Locher, K. P. Structure of a bacterial multidrug ABC transporter. Nature. 443, 180-185 (2006).
- Gerber, S., Comellas-Bigler, M., Goetz, B. A., Locher, K. P. Structural basis of trans-inhibition in a molybdate/tungstate ABC transporter. Science. 321, 246-250 (2008).
- Ward, A., Reyes, C. L., Yu, J., Roth, C. B., Chang, G. Flexibility in the ABC transporter MsbA: Alternating access with a twist. Proc Natl Acad Sci USA. 104, 19005-19010 (2007).
- Kadaba, N. S., Kaiser, J. T., Johnson, E., Lee, A., Rees, D. C. The high-affinity E. coli methionine ABC transporter: structure and allosteric regulation. Science. 321, 250-253 (2008).
- Aller, S. G., et al. Structure of P-Glycoprotein Reveals a Molecular Basis for Poly-Specific Drug Binding. Science. 323, 1718-1722 (2009).
- Koehler, J., et al. Lysophospholipid micelles sustain the stability and catalytic activity of diacylglycerol kinase in the absence of lipids. Biochemistry. 49, 7089-7099 (2010).
- Tian, C., et al. Preparation, functional characterization, and NMR studies of human KCNE1, a voltage-gated potassium channel accessory subunit associated with deafness and long QT syndrome. Biochemistry. 46, 11459-11472 (2007).
- Huang, P., Liu, Q., Scarborough, G. A. Lysophosphatidylglycerol: a novel effective detergent for solubilizing and purifying the cystic fibrosis transmembrane conductance regulator. Anal Biochem. 259, 89-97 (1998).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem. 72, 248-254 (1976).
- Chifflet, S., Torriglia, A., Chiesa, R., Tolosa, S. A method for the determination of inorganic phosphate in the presence of labile organic phosphate and high concentrations of protein: Application to lens ATPases. Analytical Biochemistry. 168, 1-4 (1988).
- Rothnie, A., et al. The importance of cholesterol in maintenance of P-glycoprotein activity and its membrane perturbing influence. Eur Biophys J. 30, 430-442 (2001).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены