Method Article
Purificação da fibrose cística condutância transmembrana Regulador proteína expressa em
Neste Artigo
Resumo
A expressão heteróloga e purificação da fibrose cística reguladora da condutância transmembrana (CFTR) são desafios significativos e fatores limitantes para o desenvolvimento de drogas terapêuticas para a fibrose cística. Este protocolo descreve dois métodos para o isolamento de quantidades de miligrama de CFTR adequados para estudos funcionais e estruturais.
Resumo
Defeitos no regulador de condutância transmembrana da fibrose cística (CFTR) proteína causar fibrose cística (FC), uma doença autossômica recessiva que limita actualmente a esperança média de vida de quem sofre a <40 anos de idade. O desenvolvimento de novas moléculas da droga para restaurar a atividade da CFTR é uma meta importante no tratamento CF, eo isolamento de CFTR funcional ativa é um passo importante para atingir este objectivo.
Descrevem-se dois métodos para a purificação de CFTR a partir de um sistema de expressão heterólogo eucariótica, S. cerevisiae. Como os sistemas procariotas, S. cerevisiae pode ser crescido rapidamente no laboratório a um custo baixo, mas também de tráfego e posttranslationally possível modificar as proteínas da membrana de grandes dimensões. A selecção de detergentes para a solubilização e purificação é um passo crítico na purificação de qualquer proteína de membrana. Tendo examinado para a solubilidade do CFTR em vários detergentes, escolhemos dois contrasting detergentes para utilização na purificação que permitem a preparação de CFTR final a ser adaptado para as experiências posteriormente planeadas.
Neste método, nós fornecemos comparação da purificação de CFTR em dodecil-β-D-maltósido (DDM) e de 1-Tetradecanoil-sn-glicero-3-fosfo-(1'-rac-glicerol) (GLP-14). A proteína purificada no DDM por este método mostra a actividade de ATPase em ensaios funcionais. A proteína purificada de GLP-14 apresenta elevada pureza e rendimento, podem ser empregues para estudar as modificações pós-traducionais, e pode ser usado para os métodos estruturais, tais como pequeno ângulo de dispersão de raios X e por microscopia de electrões. No entanto, apresenta atividade ATPase significativamente menor.
Introdução
A fibrose cística (FC) é a doença genética mais comum na Europa e América do Norte, com uma incidência de cerca de 1 em 2.500 nascidos vivos. CF ocorre quando as mutações no regulador de condutância transmembranar da fibrose cística (CFTR) proteínas provocam perda da sua função na membrana plasmática das células epiteliais 1. A conseqüência mais grave deste defeito é a lesão pulmonar irreversível, o que reduz a expectativa de vida dos portadores de a <40 anos de idade 2,3.
CFTR é uma cassete (ABC) transportador ATP-binding que evoluiu para se tornar um canal iônico 1,4. Apesar da sua função de muito alterada na membrana plasmática das células, que ainda retém uma homologia de sequência significativa com outros transportadores ABC. Curiosamente, as partes especializadas da CFTR (ou seja, sua região reguladora e sua N-e C-terminais) compartilham nenhuma semelhança seqüência significativa com outros metazoários transportadores ABC, daí não há pistas sobre o the origens destas seqüências em CFTR. Com base na sua estrutura primária, CFTR é classificado como um membro do C-família da família de transportadores ABC, mas não existe qualquer evidência forte para uma ligação funcional residual para esta sub-família. Houve alguns relatos de atividade de transporte de glutationa para CFTR 5-7, o que seria consistente com os papéis de outros membros da família C-8,9, embora outros relatos sugerem que a glutationa reduzida pode inibir a atividade CFTR ATPase, em vez de mostrar o estimulação induzida por substrato, que caracterizam os transportadores ABC 10. Medição da condutância de iões é suficientemente sensível para permitir que a actividade do canal de moléculas individuais de CFTR a ser estudado 1 e propriedades do canal CFTR foram monitorizadas em função do tempo, temperatura, concentração de ATP, potencial de membrana, e estado de fosforilação, bem como na presença de uma série de pequenas moléculas inibidoras, potenciadores, e modificadores. Estesestudos também têm contribuído significativamente para o nosso conhecimento de como transportadores ABC funcionar. No entanto, a expressão do gene CFTR em quantidades significativas, e sua purificação subsequente provou ser particularmente difícil e o sucesso tem sido limitado a alguns laboratórios 10-13.
A necessidade de desenvolver medicamentos mais eficazes está pressionando, mas este processo tem sido dificultada pela falta de CFTR purificado para a triagem de pequenas moléculas. Resolvendo a expressão CFTR e purificação problema permitiria high-throughput screening de drogas destinadas a corrigir o defeito primário na CF e também abrir uma rota para estudos estruturais de alta resolução para informar desenho racional de drogas. Além disso, até mesmo características bioquímicas relativamente básicas da proteína, tal como o seu estado oligomérico funcional, as proteínas que interagem e actividade de ATPase permanecem pouco caracterizados. Em estudo prévio, um protocolo para a expressão em larga escala de GFP-e His-marcado CFTR murinoem S. cerevisiae 14 e agora descrever mais protocolos para a purificação de CFTR. Temos usado esses métodos para purificar cinco ortólogos de CFTR, e dados atuais para a purificação de CFTR frango como exemplo. A selecção de detergentes para a solubilização e purificação é um passo crítico na purificação de qualquer proteína de membrana. Tendo rastreados para a solubilidade de CFTR em vários detergentes, escolhemos dois detergentes de contraste para utilização na purificação. Dodecil-β-D-maltósido (DDM) é um detergente não iónico que tem sido extensivamente utilizado para ambos os estudos estruturais e funcionais de proteínas de membrana 15-21. O detergente iónico 1-tetradecanoil-sn-glicero-3-fosfo-(1'-rac-glicerol) (GLP-14) é altamente eficaz na solubilização de CFTR e foi previamente utilizado para a purificação de proteínas da membrana funcionais 10, 22,23, incluindo a purificação de CFTR a partir de S. cerevisiae 24.
Protocolo
1. Preparação de amortecedores
- Para fazer com que o estoque de 100x de inibidor da protease (PI) cocktail dissolver 96 mg de AEBSF, 3,5 mg de quimostatina, 10 mg E64, 16,5 mg de leupeptina, pepstatina 16,5 mg, 348 mg de PMSF, e 4 mg de bestatina em 20 ml de DMSO. Faça alíquotas e armazenar 1 ml a -20 ° C. Para fazer um estoque de benzamidina 100x, dissolver 720 mg em 20 ml de água ultrapura (DDH 2 O) e armazenar em 1 ml alíquotas a -20 ° C. Esta quantidade é suficiente para uma purificação. Em todos os buffers, os estoques de PI e de benzamidina são usados na diluição de 1:100.
- Prepare 'MPIB' (0,3 M de Tris pH 8, 0,3 M de sacarose, 2 mM de DTT) e 'CFTR' (50 mM Tris pH 8, 20% (v /) de glicerol v, 1 mM de DTT) e tampões frio a 4 ° C . Antes da utilização, adicionar 1:100 do cocktail inibidor da protease e 1:100 de benzamidina de acordo com o volume de MPIB utilizado para ressuspender o sedimento de células (por exemplo, usar 3,5 ml de PI e 3,5 ml de benzamidina em um volume total de 350 ml MPIB).
- Prepare solubilization tampões. Tampão de solubilização liso-fosfatidil-glicerol-14 (GLP) (50 mM Tris pH 8, 10% (v / v) de glicerol, 50 mM de NaCl, 1 mM de DTT, inibidores da protease (PIs) e 4% (w / v) GPL) e maltósido de dodecilo (DDM), tampão de solubilização (50 mM Tris pH 8, 20% (v / v) glicerol, 1 M de NaCl, 1 mM de DTT, inibidores da protease, 4% (w / v) DDM). Buffer pode ser sonicada num banho de ultra-sons (35 W, 40 kHz) para auxiliar na dispersão do detergente, mas evitar o vortex mistura, pois isso cria bolhas. Frio a 4 ° C antes da utilização.
- Tampão de purificação CFTR para a purificação de GLP é Tris 50 mM, 10% (v / v) de glicerol, 50 mM de NaCl, 1 mM de DTT, 0,1% (p / v) de GLP-14 e inibidores da protease. Preparar 350 ml deste tampão, e 150 ml do mesmo tampão, mais 1 H-imidazol. Ajustar o pH de ambas as memórias intermédias para 8.
- O tampão para a purificação em DDM consiste em 50 mM Tris pH 8, 20% (v / v) glicerol, 1 M de NaCl, 1 mM de DTT, 0,1% (w / v) de DDM. Preparar 350 ml deste tampão, e 150 ml do mesmo tampão e 1 H-imidazole. Ajustar o pH de ambas as memórias intermédias para 8.
- Por cromatografia de permeação em gel (GPC) de tampão contendo GLP, preparar 50 mM Tris pH 8, 10% (v / v) de glicerol, 50 mM de NaCl, 1 mM de DTT, 0,05% (w / v) de GLP-14. Por GPC utilizando DDM preparar um tampão de 50 mM Tris pH 8, 20% (v / v) glicerol, 1 M de NaCl, 1 mM de DTT, 0,1% (w / v) de DDM. Todos os tampões e ddH2O utilizados na coluna de GPC deve ser filtrada (0,2 nm) e desgaseificados antes da sua utilização.
- De tampão de amostra de SDS-PAGE (2x a concentração de trabalho): 50 mM Tris-HCl pH 7,6, 5% (v / v) de glicerol, 5 mM de EDTA, 0,02% (w / v) de azul de bromofenol. Fazer 700 mL alíquotas e armazenar a -20 ° C. Antes da utilização, adicionar 200 mL de 20% (w / v) de sulfato de dodecilo de sódio (SDS) e 100 ul de fresco 0,5 M DTT. Incubar durante pelo menos 10 minutos com a amostra à temperatura ambiente antes de carregar no gel. Não aqueça; isto irá desnaturar o GFP e pode causar CFTR para agregar.
- Para fazer com que os estoques de lipídios para reconstituição, dissolver uma mistura 4:1 (w / w) de E. coli lipídios umad colesterol em clorofórmio e metanol (2:1 v / v), e seco num frasco de vidro sob N2 gasoso durante 2 horas para formar um filme lipídico. Adicionar tampão GPC (sem NaCl) para uma concentração de lípido de 40 mg / ml e usar vórtex repetida e ultra-sons (35 W, 40 kHz) para clarificar a solução.
- Para o ensaio de ATPase, 100x preparar stocks de inibidores da ATPase pela dissolução SCH28080 a 1 mM em DMSO, NaSCN a 1 M em ddH2O e oligomicina e 2,5 mM em 100% (v / v) de etanol. Loja em alíquotas a -20 ° C. Adicione 100 ml de tampão ATPase, com 50 mM Tris pH 7,4, 150 mM de NH 4 Cl, 5 mM de MgSO 4 e 0,02% (w / v), NaN 3. Este pode ser armazenado à temperatura ambiente e utilizada para vários ensaios. Preparar um estoque 5 mM de ATP, imediatamente antes de usar e manter em gelo. (NB Utilização Na 2 ATP para impedir o sinal de fundo elevado de fosfato no ensaio). Preparar a solução de SDS a paragem (12% (w / v) de SDS em ddH2O).
- Para a detecção Chifflet preparar tampão A (3% (w/ V) de ácido ascórbico, 0,5% (w / v), molibdato de amónio, HCl 0,5 M), imediatamente antes da utilização e o tampão B (2% (w / v) de citrato de sódio, 2% (w / v) de sódio meta-arsenito, 2% (v / v) de ácido acético).
2. Isolamento de microssomas de levedura
- S. cerevisiae expressando CFTR frango são crescidas como descrito em 'Ryan et al. (2012) 14. Armazenar o material a partir de uma fermentação de 20 L em duas alíquotas a -80 ° C durante até 6 meses.
- Descongelar uma alíquota de células rapidamente e ressuspender em 3 ml MPIB refrigerada por grama de células.
- Romper as células em um moinho de esferas com esferas de vidro de diâmetro de 425-600 um. Use cinco períodos de 1 mínimo de rompimento celular, separados por um período de repouso mínimo. (O período de repouso é essencial para assegurar que as células não são aquecidas durante a interrupção.)
- Monitorar rompimento celular por centrifugação de uma amostra de 1 ml do ligado celular a partir do moinho de esferas. Centrífuga (12.000 xg, a 4 ° C, 5 min) numa centr topo da bancadaifuge. Dilui-se o sobrenadante a 1:50 com MPIB numa cuvete e medir a A 380. Se A 380> 0,1, ou parou de aumentar, apesar de vários ciclos de talão batendo repetidas, prossiga para a etapa seguinte. Caso contrário, repita 2,3-2,4.
- Centrifuga-se o lisado celular total (12.000 x g, 4 ° C, 20 min). Manter o sobrenadante. Descarte o pellet (contendo células inteiras e mitocôndrias), mas se houver qualquer dúvida sobre a eficiência da quebra da célula (ver 2.4), em seguida, manter o pellet também.
- Centrifugar o sobrenadante do passo anterior (200.000 x g, 4 ° C, 1,5 h). Descartar o sobrenadante e ressuspender as membranas microssomais peletizadas em tampão de CFTR. Se os microssomas são destinados para a purificação utilizando DDM, completar o tampão CFTR com 1 M de NaCl.
- Repetir a centrifugação da fracção de membrana de suspensão (100.000 x g, 4 ° C, 1 hora) e desprezar o sobrenadante.
- Volte a suspender as microssomas peletizadas emum volume mínimo de tampão de CFTR (volume final de 5-15 ml, proteína microssomal total de 70-200 mg). Um ensaio de Bradford pode ser utilizado para determinar a concentração total de proteínas microssomais 25. Além disso, o espectro de emissão de fluorescência das membranas deve ser medida (excitação = 485 nm, emissão = 500-600 nm) e deve ter um pico de fluorescência da GFP distinta (máximo a 512 nm). CFTR pode ser especificamente detectada num gel de SDS-PAGE, sob condições digitalizada de fluorescência de GFP (Figura 1).
- Flash-congelar os microssomas ressuspensão por mergulhar em nitrogênio líquido e armazenar a -80 ° C, ou prossiga para a Etapa 3.
3. Solubilização de microssomas
- Se congelados, descongelam microssomas imediatamente antes da sua utilização em um banho de água regulado a 10 ° C.
- Para a solubilização de membranas, os microssomas diluídos com um volume igual do tampão de solubilização relevante (Passo 1,3) para dar uma concentração final de detergente2% (w / v) e uma proteína microssomal concentração de 5 mg / ml. Incubar a mistura durante 1 hora a 4 ° C com agitação (rotador tubo). Guarde 200 mL para análise.
- Centrifugar a mistura (100.000 x g, 4 ° C, 45 min). Retirar o sobrenadante contendo as proteínas de membrana solubilizadas, passar através de um filtro de seringa de 0,45 um e armazenar em gelo. Medir a fluorescência do sobrenadante (como no Passo 2.8).
- Ressuspender a fracção insolúvel em 1% (w / v) de solução de SDS para um volume igual ao da fracção solúvel. Medir a fluorescência nesta fracção e reter uma parte alíquota de 50 uL para análise de SDS-PAGE.
4. Níquel afinidade Purificação de CFTR
- Colunas Ligação dois sepharose níquel 5 ml em série. Lava-se com 2 volumes de coluna (CV) de 20% (v / v) de etanol, seguido de 2 CV ddH2O, em seguida, lava-se a coluna com 2 VC de tampão de solubilização (Passo 1,4-1,5), contendo 1 M de imidazol. Repita com 2 CV de solubilizatião tampão falta imidazol.
- Adicionar imidazole até uma concentração final de 5 mM para o material solubilizado (Etapa 2.8) e colocar manualmente o material na coluna ou a um circuito de amostra, se utilizar um dispositivo automático de cromatografia líquida.
- Carregar o material solubilizado para a coluna a uma taxa de fluxo de 0,5 ml / min, e lavou-se com 2 VC de tampão de imidazol-faltando ao mesmo caudal para remover o material não ligado. Colete frações em tubos de 50 ml Falcon.
- Para a primeira lavagem, usar 3 VC de tampão de purificação com 40 mM de imidazol, a uma taxa de fluxo de 1 ml / min. Recolher 2 ml frações.
- Para a segunda lavagem, usar 3 VC de tampão de purificação com 100 mM de imidazole. Recolher 2 ml frações.
- Eluir CFTR a partir da coluna HisTrap com 3 CV de tampão de purificação, com 400 mM de imidazole. Recolher 2 ml frações.
- Monitorizar a fluorescência nas fracções eluidas (Passo 2.8).
- Reter alíquotas de fracções de pico para a análise de SDS-PAGE. Flash congelamento restante pico famostras rAction e armazenar a -80 ° C, ou continuar para a próxima etapa de purificação.
5. Cromatografia de Permeação em Gel (GPC) Purificação de CFTR
- Equilibrar a coluna (Superose 6 10/300 GL) com 1,2 CV ddH2O seguido de 1,2 CV de tampão de GPC.
- Durante o Passo 5.1, concentrar os Ni-afinidade fracções purificadas com o mais alto de fluorescência de GFP utilizando um filtro centrífugo 100.000 MWCO em 4 ° C. Se purificação no DDM, evitar a concentração da amostra acima de uma concentração de proteína de 0,3 mg / ml de proteína, pois isso fará com que a perda de amostra significativa. Remover o retentado do concentrador e centrifugar a 100.000 x g durante 30 min a 4 ° C para sedimentar as partículas maiores.
- Injectar esta amostra na coluna e eluir com um gradiente isocrãtico de 1,2 CV de tampão de GPC. Recolher 0,5 ml frações.
- Medir a fluorescência da GFP como na secção 2.8 para identificar as fracções contendo CFTR. Manter um pequeno volume (por exemplo, </ Em> 50 ul) de cada para análise por SDS-PAGE.
- Congelar frações em nitrogênio líquido e armazenar a -80 ° C.
6. Reconstituição de CFTR
- Adicionar lípidos (Passo 1.8) para o CFTR purificada em lípido para proteína proporção de 100:1 (w / w) e incubar a 4 ° C durante 1 hora. Similarmente configurar um controlo só de lípido, substituindo a proteína purificada com o mesmo volume de tampão de GPC.
- Remova o detergente da mistura de proteína / lípido usando pérolas adsorventes hidrófobos. Lavar as pérolas adsorventes em 5 CV ddH2O, 5 CV de 70% (v / v) de etanol, 5 CV ddH2O e 5 VC de tampão de GPC falta de detergentes. Adicionar 200 mg de grânulos de adsorventes lavadas por ml de proteína purificada e incubar a 4 ° C durante a noite com agitação suave.
- Recolha da amostra de reconstituição a partir das pérolas adsorventes para um novo tubo com uma pipeta de ponta fina na extremidade.
7. Medição da Actividade da ATPase
- Determinar a taxa de CFTActividade específica da ATPase-R, utilizando um ensaio modificado 26,27 Chifflet num formato de placa de 96 poços. Com a solução de fosfato de sódio (0,65 mM) preparar 0-20 nmol de fosfato num volume final de 50 ul, como padrões. Use uma mistura 1:1 de tampão de CFTR e tampão ATPase para diluir o material de fosfato.
- Incubar tanto CFTR reconstituído e lipossomas vazios com 1:100 (v / v) inibidores da ATPase (Passo 1,9) em gelo durante 10 min. Use pelo menos 5 mg de CFTR reconstituído.
- Adicionar ATP (Passo 1,9) para uma concentração final de 2 mM e incuba-se a 25 ° C durante 1 hora. Parar a reacção por adição de 40 ul de 10% (w / v) de SDS (Passo 1.9) a cada poço (incluindo os padrões).
- Adicionar 100 ul de tampão A (Passo 1,10) e incubar durante 10 min. Adicionar 100 ul de tampão B (1,10) a cada poço e medir a absorvância a um comprimento de onda de 800 nm em um de 96 poços de UV / Vis placa compatível.
- Converter a absorvância a 800 nm, em uma quantidade de fosfato libertada utilizando opadrões de fosfato. Calcula-se a taxa de hidrólise de ATP depois de subtrair o sinal de fundo (apenas lipossoma-poços).
- Para CFTR não reconstituído seguem o mesmo protocolo, utilizando tampão de CFTR para as leituras de fundo.
Resultados
O protocolo descrito acima é um meio eficiente para isolar microssomas enriquecidos-CFTR, com recuperação quase completa de CFTR durante a quebra das células e preparação dos microssomas bruto (Figura 1). Outros métodos de ruptura de células também podem ser utilizados eficazmente. Nós utilizamos uma célula francesa de pressão e outros dispositivos high-pressure/cavitation (também em combinação com o impacto de encontro a um alvo de rubi) com igual eficiência. Para maior comodidade e baixo custo inicial do equipamento, encontramos o método talão espancamento a melhor.
Usando GPL para solubilizar e purificar CFTR rendeu 80 ug de proteína / l de cultura em> 90% de pureza (Figura 2). O alto rendimento deveu-se a solubilização eficaz de CFTR por GLP (comparar com a figura 2b, pistas 2 e 4). Além disso, eficaz e forte ligação à coluna resultou em uma perda mínima de CFTR na fracção não ligada e na ausência de CFTR nas fracções de lavagem (Figura 2, pistas 3, 5, e6). A proteína eluída tinha uma pureza> 90%, estimado pela corados com Coomassie géis de SDS-PAGE e por densitometria de CFTR e bandas contaminantes. Cromatografia de permeação em gel (GPC), separadas CFTR purificou-GLP a partir de contaminantes de baixo peso molecular (Figura 4, painel inferior).
O protocolo para a purificação de CFTR utilizando DDM dá pureza de cerca de 60% e um rendimento de cerca de 50 ug / L (Figura 3). A microscopia electrónica (ME) de fracções coradas negativamente de GPC que eluíram a cerca de 10 ml (Figura 4) mostrou que CFTR DDM-purificado contém agregados de 20-30 nm de diâmetro, bem como pequenas partículas de 10 nm de diâmetro (dados não mostrados). É possível que os pequenos agregados podem associar de forma reversível e dissociar como ultrafiltração com um 1 MDa de corte do filtro não conseguiram remover os agregados EM-detectáveis. Material purificado por GLP não absorver a uma grade descarregada-brilho, por isso foi estudado por crio-EM das frações não coradas. Isto mostrouuma população de partículas muito homogénea de um tamanho relativamente pequeno (6-8 nm de diâmetro, dados não mostrados).
Finalmente, a actividade ATPase das proteínas purificadas foi medida (Figura 5). Como um membro da família de proteínas ABC, CFTR tem dois domínios de ligação a nucleótidos (NBDs) capaz de se ligar e / ou a hidrólise de ATP. Os dados indicam que a proteína purificada não foi capaz de hidrolisar ATP no estado de GLP-solubilizado e mostrou actividade de ATPase fraco na presença de DDM (Figura 5, as barras não preenchidas). Após a adição de lípidos, e a remoção de detergente, a actividade da ATPase foi 4 vezes mais elevada para as amostras que tinham sido purificadas em DDM (13 nmol de ATP / min / mg de proteína). A adição de lípidos e remoção do GLP actividade semelhante restaurado para CFTR que tinha sido isolado utilizando GLP, mas com uma menor taxa final (1,5 nmol de ATP / min / mg de proteína) do que o material de DDM-purificado e reconstituído.

Figura 1. Níveis de monitorização de CFTR frango em lisado de células (CL), os sobrenadantes (S) e de pelotas de (P), durante vários passos de centrifugação utilizados para o isolamento de microssomas e lavagem. Géis de SDS-PAGE foram visualizadas utilizando a fluorescência em gel da GFP tag. O sobrenadante após a ruptura das células e centrifugação a 14.000 xg, contém praticamente todo o CFTR (incluindo produtos de degradação). Ultracentrifugação a 200.000 xg sedimentos todo o gene CFTR de tamanho completo, deixando alguns fragmentos no sobrenadante. Ultracentrifugação a 100.000 xg de lavou-sal microssomas peletes quase todo o gene CFTR com a remoção de alguns outros fragmentos.
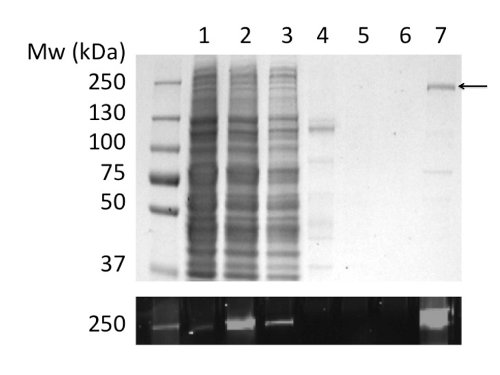
Figura 2. Purificação de CFTR frango em GLP por cromatografia de afinidade com iões metálicos imobilizados. Fracções foram analisadas por SDS-PAGE seguido por coloração com Coomassie (painel superior) e de detecção de fluorescência do marcador GFP (painel inferior). Tracks: (1) microssomas. (2) microssomas solubilizado a GPL. (3) O material não ligado. (4) O material insolúvel. (5) e (6), 40 e 100 mM de imidazole lavagens. (7) Material de eluição com 400 mM de imidazole.
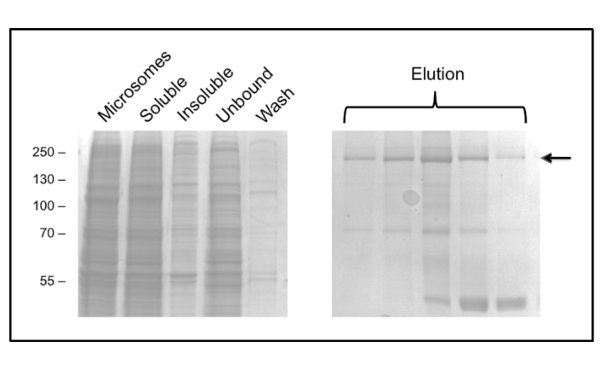
Figura 3. Purificação de CFTR frango em DDM por cromatografia de afinidade com iões metálicos imobilizados. Fracções foram analisadas por SDS-PAGE seguido por coloração com Coomassie. O painel esquerdo mostra frações antes da eluição. Várias frações de eluição consecutivos são mostrados no painel do lado direito com CFTR emindicado pela seta. As últimas fracções são enriquecidos em um contaminante de 40 kDa, que foi identificado pela espectrometria de massa de proteína ribossomal L3.
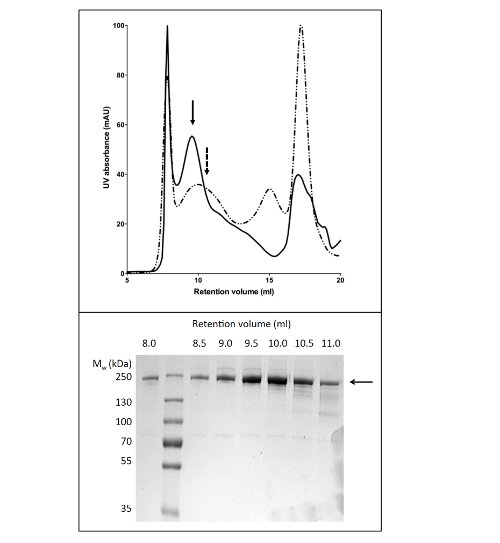
Figura 4. Purificação de CFTR galinha por cromatografia de permeação em gel. CFTR purificado por cromatografia Ni-afinidade foi concentrada e aplicada a uma coluna de GPC. O perfil de eluição para o CFTR (painel superior) purificado em tampão contendo GLP-14 (linha contínua), ou DDM (linha a tracejado) estão sobrepostas. SDS-PAGE (painel inferior) revelou que CFTR eluída entre 8 e 11 ml.
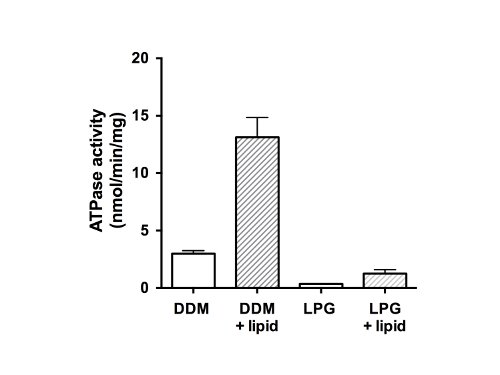
Figura 5. Actividade ATPasey de fracções CFTR galinha purificadas. proteína purificada em DDM ou GLP foi ensaiada utilizando um ensaio modificado Chifflet 26 na presença de um cocktail de inibidores de ATPase para eliminar qualquer actividade da ATPase fundo de ATPases de tipo V (barras não preenchidas F-, P-e ). A taxa de hidrólise de ATP foi medida, também após a remoção do detergente e adição de lípidos (barras a cheio). O gráfico mostra a média e o desvio padrão (n = 3). As diferenças entre os valores médios da atividade ATPase na presença e ausência de lipídios, ea diferença entre a atividade na DDM e GLP são significativas para p <0,05.
Discussão
Nós já descrito um método para a sobre-expressão de CFTR murino 14. Desde a publicação desse protocolo, temos expressa e purificada vários ortólogos diferentes de CFTR utilizando o mesmo sistema. Todos os ortólogos testadas até agora purificada bem o detergente GPL, enquanto a purificação DDM mostrou mais variações entre diferentes ortólogos (dados não mostrados). Esta flexibilidade ilustra a força da abordagem de levedura: é possível rastrear muitas construções com relativa rapidez, a fim de seleccionar uma para uma finalidade específica.
Lavar os microssomas de levedura com um tampão contendo 1 M de NaCl antes da solubilização com resultados DDM numa preparação de microssoma de pó e reduz os contaminantes em fases posteriores. Este passo não é necessário, no protocolo de GPL como a amostra de CFTR final é> 90% pura sem a lavagem microssoma. Além disso, a purificação em DDM requer várias alterações para os buffers para a solubilização de umnd de purificação, isto é, a adição de glicerol extra e sal. Em conjunto, estas adições aumentou consideravelmente a ligação da proteína de DDM-solubilizado para a coluna.
A metodologia de purificação DDM tem possibilidades de melhoria, em particular, a remoção de um contaminante principal de 40 kDa que, julgado por espectrometria de massa, é devido à subunidade ribossómica levedura L3, que parece ter uma afinidade inerente para a resina de níquel. Não há nenhuma sequência de poliHis óbvio na proteína L3, mas o exame de sua estrutura 3D quando ligado ao ribossoma (APO = 1FFK) mostra que a subunidade L3 dobrado tem um potencial de cluster poliHis. Que esta banda é menos problemática em material purificado por GPL pode ser devido ao detergente GLP mais dura.
Embora a purificação em DDM parece ser mais pobre do que aquela de GLP, detergentes leves, como DDM pode ser mais compatível com as análises funcionais e estruturais e já têm sido utilizados em vários crystall de raios-Xographic estudos de proteínas de membrana 15-21. Além disso, os nossos resultados indicam que o uso do GLP leva à perda de função de ATPase em CFTR em relação à purificação de DDM. Assim, recomendamos o protocolo de purificação com base em GLP para a geração de CFTR quando a pureza é essencial, por exemplo, em aplicações tais como a caracterização de modificações pós-tradução, ou na geração de anticorpos, o protocolo à base de GLP seria escolhido . Por outro lado, em aplicações onde a atividade e estado totalmente nativa da proteína é essencial, sugere-se a protocolo baseado em DDM como uma opção melhor.
Para finalizar, este protocolo descreve um método reprodutível para o isolamento de CFTR no detergente zwitteriónico GLP-14 ou o detergente não iónico DDM. Como tal, ele indica uma maior gama de condições de purificação para CFTR que foram previamente relatados 10-13. Além miligrama quantidades de CFTR pode ser purificadoobtido usando estes procedimentos, quando combinado com um elevado volume do sistema de crescimento de levedura, tais como um fermentador de 20 L e um sistema de colheita de células de elevada capacidade, tal como um 6 L de baixa velocidade de rotor da centrifugadora. O CFTR obtido tem uma marcação GFP clivável que permite a monitorização fácil da proteína em vários ensaios bioquímicos e biofísicos.
O reagente descrito neste manuscrito (galinha contendo CFTR plasmídeo ou as células de levedura congeladas) pode ser obtido através da Cystic Fibrosis Foundation (EUA).
Divulgações
Os autores não têm concorrentes interesses financeiros nem outros interesses conflitantes com relação a este trabalho.
Agradecimentos
Este trabalho foi financiado por os EUA Fundação de Fibrose Cística (CFF), através de seu Consórcio Estrutura CFTR 3D. TR foi financiado por uma bolsa de estudo UK CF Trust, e NC por um studentship Unido BBSRC. Nós reconhecemos os nossos colegas na estrutura consórcio CFF CFTR 3D para a sua ajuda e conselhos e para a concepção da seqüência CFTR frango e purificação marcas otimizado códon.
Materiais
| Name | Company | Catalog Number | Comments |
| 0.2 μm syringe filter | Sartorius | FC121 | |
| 100 kDa MWCO centrifugal concentrator (PES membrane) | Vivaspin | VS0641 | |
| 2 ml microfuge tubes | Sarstedt | 72.695 | |
| 40Ti rotor | Beckman Coulter | 337901 | |
| 50 ml sterile Falcon tubes | Sarstedt | 62.547.254 | |
| Adenosine triphosphate disodium salt (Na2ATP) | Sigma-Aldrich | A26209 | |
| Liquid chromatography system | GE Healthcare | 28-4062-64 | |
| Aminoethylbenzenesulfonyl fluoride (AEBSF) | Sigma-Aldrich | A8456 | |
| Glass bead-beating cell disrupter | BioSpec | 1107900 | |
| Benchtop centrifuge | HERMLE | Z300 | |
| Benchtop centrifuge | Eppendorf | 5417R | |
| Benchtop microfuge | Fisher | 13-100-511 | |
| Benzamidine hydrochloride | Sigma-Aldrich | 434760 | |
| Hydrophobic Beads SM-2 Adsorbent | BioRad | 152-3920 | |
| Bromophenol blue | Sigma-Aldrich | 114391 | |
| Centrifuge tubes | Beckman Coulter | 357000 | |
| Gel imaging system | BioRad | 170-808 | |
| Cholesterol | Sigma-Aldrich | C8667 | |
| Chymostatin | Sigma-Aldrich | C7268 | |
| Dimethylsulfoxide (DMSO) | Sigma-Aldrich | D8418 | |
| Dithiothreitol (DTT) | Sigma-Aldrich | 43815 | |
| E. coli total lipid extract | Avanti lipids | 100500 | |
| Epoxysuccinyl-leucylamido-butane (E-64) | Sigma-Aldrich | E3132 | |
| Glass beads, acid washed | Sigma | G8772 | |
| Glycerol | Fisher | 65017 | |
| HisTrap HP columns (5 ml) | GE Healthcare | 17-5247-05 | |
| Rapid Coomassie Stain | Novexin | ISB1L | |
| Centrifuge JA-17 rotor | Beckman Coulter | 369691 | |
| Leupeptin | Merck | 108975 | |
| Lyso-phosphatidyl glycerol-14 (LPG) | Avanti lipids | 858120 | |
| MgSO4 | Sigma-Aldrich | M7506 | |
| Gel tank SDS-PAGE system | BioRad | 165-8006 | |
| n-Dodecyl-β-D-maltopyranoside (DDM) | Affymetrix | D310S | |
| NaCl | Sigma-Aldrich | S6191 | |
| NaN3 | Sigma-Aldrich | S2002 | |
| NH4Cl | Sigma-Aldrich | A9434 | |
| Oligomycin | Sigma-Aldrich | 75351 | |
| Ultracentrifuge | Beckman Coulter | 392050 | |
| Prestained protein standards | Fermentas | SM1811 | |
| Desalting columns (Sephadex G-25) | GE Healthcare | 17-0851-01 | |
| Pepstatin A | Sigma-Aldrich | P4265 | |
| Phenylmethanesulfonylfluoride (PMSF) | Sigma-Aldrich | P7626 | |
| SCH28080 | Sigma-Aldrich | S4443 | |
| Sodium dodecyl sulfate (SDS) | Sigma-Aldrich | L37771 | |
| Sodium thiocyanate (NaSCN) | Sigma-Aldrich | 251410 | |
| Gel filtration 10/300 GL column | GE Healthcare | 17-5172-01 | |
| Tris-base | Formedium | TRIS01 | |
| Ultracentrifuge tubes | Beckman Coulter | 355618 | |
| Vortex mixer | Star Labs | N2400-0001 | |
| Ultrasonic water bath | Ultrawave | F0002202 | |
| Multimode plate reader | BioTek | BTH1MF |
Referências
- Aleksandrov, A. A., Aleksandrov, L. A., Riordan, J. R. CFTR (ABCC7) is a hydrolyzable-ligand-gated channel. Pflugers Arch. 453, 693-702 (2007).
- Dodge, J. A., Lewis, P. A., Stanton, M., Wilsher, J. Cystic fibrosis mortality and survival in the UK: 1947-2003. EUR RESPIR J. 29, 522-526 (2007).
- O'Sullivan, B. P., Freedman, S. D. Cystic fibrosis. Lancet. 373, 1891-1904 (2009).
- Rommens, J. M., et al. Identification of the cystic fibrosis gene: chromosome walking and jumping. Science. 245, 1059-1065 (1989).
- Kariya, C., et al. A role for CFTR in the elevation of glutathione levels in the lung by oral glutathione administration. Am J Physiol Lung Cell Mol Physiol. 292, (2007).
- Gould, N. S., Min, E., Martin, R. J., Day, B. J. CFTR is the primary known apical glutathione transporter involved in cigarette smoke-induced adaptive responses in the lung. Free Radic Biol Med. 52, 1201-1206 (2012).
- Childers, M., Eckel, G., Himmel, A., Caldwell, J. A new model of cystic fibrosis pathology: lack of transport of glutathione and its thiocyanate conjugates. Med Hypotheses. 68, 101-112 (2007).
- Cole, S. P., et al. Overexpression of a transporter gene in a multidrug-resistant human lung cancer cell line. Science. 258, 1650-1654 (1992).
- Conseil, G., Deeley, R. G., Cole, S. P. Polymorphisms of MRP1 (ABCC1) and related ATP-dependent drug transporters. Pharmacogenet Genomics. 15, 523-533 (2005).
- Ketchum, C. J., Rajendrakumar, G. V., Maloney, P. C. Characterization of the adenosinetriphosphatase and transport activities of purified cystic fibrosis transmembrane conductance regulator. Biochemistry. 43, 1045-1053 (2004).
- Ramjeesingh, M., et al. A novel procedure for the efficient purification of the cystic fibrosis transmembrane conductance regulator (CFTR). Biochem J. 327 (Pt 1), 17-21 (1997).
- Huang, P., Liu, Q., Scarborough, G. A. Lysophosphatidylglycerol: a novel effective detergent for solubilizing and purifying the cystic fibrosis transmembrane conductance regulator. Anal Biochem. 259, 89-97 (1998).
- Rosenberg, M. F., Kamis, A. B., Aleksandrov, L. A., Ford, R. C., Riordan, J. R. Purification and crystallization of the cystic fibrosis transmembrane conductance regulator (CFTR). J Biol Chem. 279, 39051-39057 (2004).
- O'Ryan, L., Rimington, T., Cant, N., Ford, R. C. Expression and purification of the cystic fibrosis transmembrane conductance regulator protein in Saccharomyces cerevisiae. J Vis Exp. , (2012).
- Oldham, M. L., Chen, J. Snapshots of the maltose transporter during ATP hydrolysis. Proc Natl Acad Sci USA. 108, 15152-15156 (2011).
- Pinkett, H. W., Lee, A. T., Lum, P., Locher, K. P., Rees, D. C. An inward-facing conformation of a putative metal-chelate-type ABC transporter. Science. 315, 373-377 (2007).
- Dawson, R. J. P., Locher, K. P. Structure of a bacterial multidrug ABC transporter. Nature. 443, 180-185 (2006).
- Gerber, S., Comellas-Bigler, M., Goetz, B. A., Locher, K. P. Structural basis of trans-inhibition in a molybdate/tungstate ABC transporter. Science. 321, 246-250 (2008).
- Ward, A., Reyes, C. L., Yu, J., Roth, C. B., Chang, G. Flexibility in the ABC transporter MsbA: Alternating access with a twist. Proc Natl Acad Sci USA. 104, 19005-19010 (2007).
- Kadaba, N. S., Kaiser, J. T., Johnson, E., Lee, A., Rees, D. C. The high-affinity E. coli methionine ABC transporter: structure and allosteric regulation. Science. 321, 250-253 (2008).
- Aller, S. G., et al. Structure of P-Glycoprotein Reveals a Molecular Basis for Poly-Specific Drug Binding. Science. 323, 1718-1722 (2009).
- Koehler, J., et al. Lysophospholipid micelles sustain the stability and catalytic activity of diacylglycerol kinase in the absence of lipids. Biochemistry. 49, 7089-7099 (2010).
- Tian, C., et al. Preparation, functional characterization, and NMR studies of human KCNE1, a voltage-gated potassium channel accessory subunit associated with deafness and long QT syndrome. Biochemistry. 46, 11459-11472 (2007).
- Huang, P., Liu, Q., Scarborough, G. A. Lysophosphatidylglycerol: a novel effective detergent for solubilizing and purifying the cystic fibrosis transmembrane conductance regulator. Anal Biochem. 259, 89-97 (1998).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem. 72, 248-254 (1976).
- Chifflet, S., Torriglia, A., Chiesa, R., Tolosa, S. A method for the determination of inorganic phosphate in the presence of labile organic phosphate and high concentrations of protein: Application to lens ATPases. Analytical Biochemistry. 168, 1-4 (1988).
- Rothnie, A., et al. The importance of cholesterol in maintenance of P-glycoprotein activity and its membrane perturbing influence. Eur Biophys J. 30, 430-442 (2001).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados