Method Article
Die Reinigung des Cystic Fibrosis Transmembran Regulator-Protein in Ausgedrückt
In diesem Artikel
Zusammenfassung
Die heterologe Expression und Reinigung des Mukoviszidose Transmembran Regulator (CFTR) sind bedeutende Herausforderungen und limitierende Faktoren bei der Entwicklung von Arzneimitteltherapien für Mukoviszidose. Dieses Protokoll beschreibt zwei Verfahren zur Isolierung von Milligramm-Mengen von CFTR für funktionelle und strukturelle Untersuchungen.
Zusammenfassung
Defekte in der Mukoviszidose-Transmembran Regulator (CFTR)-Protein führen zystischer Fibrose (CF), eine autosomal-rezessive Erkrankung, die derzeit begrenzt die durchschnittliche Lebenserwartung der Erkrankten bis <40 Jahre alt. Die Entwicklung neuer Wirkstoffmoleküle, die Aktivität von CFTR wiederherzustellen, ist ein wichtiges Ziel in der Behandlung CF, und die Isolation von funktionell aktiven CFTR ist ein sinnvoller Schritt zur Erreichung dieses Ziels.
Wir beschreiben zwei Verfahren zur Reinigung von CFTR aus einer eukaryotischen heterologen Expressionssystem, S. cerevisiae. Wie prokaryotischen Systemen, S. cerevisiae kann schnell im Labor mit geringen Kosten angebaut werden, kann aber auch Verkehrs-und posttranslational große Membranproteine modifizieren. Die Auswahl von Detergentien zur Solubilisierung und Reinigung ist ein kritischer Schritt bei der Reinigung von jeder Membranprotein. Nachdem die Löslichkeit von CFTR in mehreren Detergenzien gescreent, haben wir zwei Co ausgewähltntrasting Detergenzien zur Verwendung bei der Reinigung, die die endgültige CFTR Vorbereitung auf die später geplanten Experimenten zugeschnitten werden können.
Bei diesem Verfahren stellen wir Vergleich der Reinigung von CFTR in Dodecyl-β-D-maltosid (DDM) und 1-Tetradecanoyl-sn-glycero-3-phospho-(1'-rac-glycerin) (LPG-14). Protein in DDM mit dieser Methode gereinigt zeigt ATPase-Aktivität in funktionellen Tests. Protein in LPG-14 gereinigt zeigt hoher Reinheit und Ausbeute, kann verwendet werden, um post-translationale Modifikationen zu untersuchen, und für strukturelle Methoden wie Kleinwinkelröntgenstreuung und Elektronenmikroskopie eingesetzt werden. Aber es zeigt deutlich niedriger ATPase-Aktivität.
Einleitung
Cystische Fibrose (CF) ist die häufigste genetische Erkrankung in Europa und Nordamerika mit einer Inzidenz von etwa 1 zu 2.500 Lebendgeburten. CF tritt bei Mutationen in der Mukoviszidose-Transmembran-Leitfähigkeitsregulator (CFTR)-Protein zu einem Verlust der Funktion an der Plasmamembran von Epithelzellen 1. Die schwerwiegendste Folge dieses Mangels ist irreversible Lungenschäden, die die Lebenserwartung der Betroffenen bis <40 Jahre 2,3 verkürzt.
CFTR ist ein ATP-binding cassette (ABC)-Transporter, die sich entwickelt hat, um ein Ionenkanal 1,4 geworden. Trotz seiner ziemlich veränderte Funktion in der Plasmamembran von Zellen, ist es noch immer eine signifikante Sequenzhomologie mit anderen ABC-Transportern. Interessanter, die Sonderteile von CFTR (dh seine regulatorischen Region und ihre N-und C-Termini) teilen sich keine signifikante Sequenzähnlichkeit mit anderen Metazoen ABC-Transporter, daher gibt es keine Hinweise auf thE Ursprünge dieser Sequenzen in CFTR. Auf der Basis seiner Primärstruktur wird CFTR als C-Familienmitglied der ABC-Transporter-Familie eingestuft, aber es gibt keine starken Beweise für eine Rest funktionellen Verknüpfung zu dieser Unterfamilie. Es wurden für 5-7 CFTR einige Berichte von Glutathion Transportaktivität, das wäre im Einklang mit den Rollen der anderen C-Familienmitglieder 8,9, obwohl auch andere Berichte deuten darauf hin, dass reduzierte Glutathion kann das CFTR-ATPase-Aktivität zu hemmen, statt, die die Substrat-induzierte Stimulation, die der ABC-Transporter 10 charakterisieren. Messung der Ionenleitfähigkeit ist empfindlich genug, damit die Kanalaktivität einzelner CFTR-Moleküle zu unter 1 und CFTR-Kanals Eigenschaften wurden als Funktion der Zeit, der Temperatur, der ATP-Konzentration, Membranpotential und Phosphorylierung als auch in der überwacht Vorhandensein einer Vielzahl von niedermolekularen Inhibitoren, Potentiatoren und Modifikatoren. DieseStudien haben auch wesentlich zu unserem Wissen, wie ABC-Transporter funktionieren aufgenommen. Dennoch Expression von CFTR in signifikanten Mengen und ihre anschließende Reinigung hat sich als besonders anspruchsvoll und Erfolg auf einige wenige Labors 10-13 beschränkt zu sein.
Die Notwendigkeit, wirksamere Medikamente zu entwickeln drängt, doch dieser Prozess durch den Mangel an CFTR gereinigt für das Screening kleiner Moleküle behindert. Die Lösung des CFTR-Expression und Reinigung Problem wäre Hochdurchsatz-Wirkstoff-Screening auf eine Korrektur des primären Defekt in CF ausgerichtet und ermöglichen würden zudem eine Route für hochauflösende Strukturuntersuchungen zu Rational Drug Design zu informieren. Selbst relativ grundlegenden biochemischen Eigenschaften des Proteins, wie seine funktionellen oligomeren Zustand, interagierende Proteine und ATPase-Aktivität bleiben schlecht charakterisiert. Wir haben zuvor ein Protokoll für die großtechnische Expression von GFP-und His-markierten murinen CFTR berichtetin S. cerevisiae 14 und nun beschriebenen Protokolle für die Reinigung von CFTR. Wir haben diese Methoden verwendet, um fünf Orthologe von CFTR und Darstellung von Daten für die Reinigung von Hühner CFTR als Beispiel zu reinigen. Die Auswahl von Detergentien zur Solubilisierung und Reinigung ist ein kritischer Schritt bei der Reinigung von jeder Membranprotein. Nachdem die Löslichkeit von CFTR in mehreren Detergenzien gescreent, haben wir zwei kontras Detergenzien zur Verwendung in der Reinigung ausgewählt. Dodecyl-β-D-maltosid (DDM) ein nicht-ionisches Detergens wurde ausgiebig sowohl für strukturelle und funktionelle Studien von Membranproteinen 15-21 verwendet. Das ionische Detergens 1-Tetradecanoyl-sn-glycero-3-phospho-(1'-rac-glycerin) (LPG-14) ist bei der Solubilisierung von CFTR hocheffiziente und vorher bei der Reinigung von funktionellen Membranproteine 10 verwendet wurde, 22,23, einschließlich Reinigung des CFTR von S. 24 cerevisiae.
Protokoll
1. Herstellung von Puffern
- Um den Bestand der 100x-Protease-Inhibitor zu machen (PI) Cocktail auflösen 96 mg AEBSF, 3,5 mg Chymostatin, 10 mg E64, 16,5 mg Leupeptin, Pepstatin 16,5 mg, 348 mg PMSF und 4 mg Bestatin in 20 ml DMSO. Stellen Sie 1 ml Aliquots und bei -20 ° C Um eine 100x Stock Benzamidin zu machen, lösen sich 720 mg in 20 ml Reinstwasser (ddH2O) und Speicher in 1 ml Aliquots bei -20 ° C. Diese Menge reicht für eine Reinigung. In allen Puffern werden PI und Benzamidin Aktien zu einem 1:100-Verdünnung eingesetzt.
- Vorbereiten "mPIB '(0,3 M Tris pH 8, 0,3 M Saccharose, 2 mM DTT) und" CFTR' (50 mM Tris pH 8, 20% (v / v) Glycerin, 1 mM DTT) Puffer und Kälte auf 4 ° C . Vor Gebrauch hinzuzufügen 1:100 der Protease-Inhibitor-Cocktail und 1:100 Benzamidin nach dem Volumen der mPIB verwendet, um die Zellpellet zu resuspendieren (zB Einsatz 3.5 ml PI und 3,5 ml Benzamidin in einem Gesamtvolumen von 350 ml mPIB).
- Bereiten solubilization Puffer. Lyso-Phosphatidyl-Glycerin-14 (LPG)-Lösungspuffer (50 mM Tris pH 8, 10% (v / v) Glycerol, 50 mM NaCl, 1 mM DTT, Protease-Inhibitoren (PI) und 4% (w / v) LPG) und Dodecylmaltosid (DDM) Lösungspuffer (50 mM Tris pH 8, 20% (v / v) Glycerin, 1 M NaCl, 1 mM DTT, Protease-Inhibitoren, 4% (w / v) DDM). Puffer können in einem Ultraschallbad (35 W, 40 kHz) mit Ultraschall behandelt werden, um mit der Verbreitung von Waschmittel zu erleichtern, aber vermeiden Vortexen des Gemisches, wie dies erzeugt Blasen. Kühle auf 4 º C vor der Verwendung.
- CFTR Reinigungspuffer für den LPG-Reinigung ist 50 mM Tris, 10% (v / v) Glycerol, 50 mM NaCl, 1 mM DTT, 0,1% (w / v) LPG-14 und Proteaseinhibitoren. Planen 350 ml dieses Puffers und 150 ml des gleichen Puffers plus 1 M Imidazol. Der pH-Wert der beiden Puffer 8.
- Der Puffer für die Reinigung im DDM besteht aus 50 mM Tris pH 8, 20% (v / v) Glycerin, 1 M NaCl, 1 mM DTT, 0,1% (w / v) DDM. Planen 350 ml dieses Puffers und 150 ml des gleichen Puffers plus 1 M Imidazole. Der pH-Wert der beiden Puffer 8.
- Für die Gelpermeationschromatographie (GPC)-Puffer LPG enthält, bereiten 50 mM Tris pH 8, 10% (v / v) Glycerol, 50 mM NaCl, 1 mM DTT, 0,05% (w / v) LPG-14. GPC mit DDM bereiten Puffer von 50 mM Tris pH 8, 20% (v / v) Glycerin, 1 M NaCl, 1 mM DTT, 0,1% (w / v) DDM. Alle Puffer und ddH 2 O auf der GPC-Säule verwendet wird, sollte gefiltert (0,2 &mgr; m-Filter) und vor der Verwendung entgast.
- SDS-PAGE-Probenpuffer (2 x die Arbeitskonzentration): 50 mM Tris-HCl pH 7,6, 5% (v / v) Glycerin, 5 mM EDTA, 0,02% (w / v) Bromphenolblau. Stellen Sie 700 ul Aliquots und bei -20 ° C Vor der Verwendung, 200 ul 20% (w / v) Natriumdodecylsulfat (SDS) und 100 ml frisches 0,5 M DTT. Inkubation für mindestens 10 min mit der Probe bei Raumtemperatur vor dem Laden auf Gel. Nicht erhitzen; Dies wird das GFP denaturieren und kann dazu führen CFTR zu aggregieren.
- Um Lipid-Aktien für die Rekonstitution zu machen, lösen eine 4:1 (w / w) Mischung von E. coli Lipide eind Cholesterin in Chloroform und Methanol (2:1 v / v), und trocken in eine Glasampulle unter N 2-Gas für 2 Stunden, um einen Lipidfilm zu bilden. Hinzufügen GPC-Puffer (ohne NaCl) auf eine Lipidkonzentration von 40 mg / ml und nach mit Verwirbelung und Beschallung (35 W, 40 kHz), um die Lösung zu klären.
- Für den ATPase-Assay herzustellen 100x Bestände ATPase-Inhibitoren durch Auflösen SCH28080 bis 1 mM in DMSO, NaSCN bis 1 M in ddH 2 O und Oligomycin bis 2,5 mM in 100% (v / v) Ethanol. Shop bei -20 ° C 100 ml zu der ATPase-Puffer mit 50 mM Tris pH 7,4, 150 mM NH 4 Cl, 5 mM MgSO &sub4; und 0,02% (w / v) NaN 3. Dies kann bei Raumtemperatur gelagert und für mehrere Tests verwendet werden. Eine 5 mM ATP Lager unmittelbar vor der Verwendung und auf Eis zu halten. (NB Verwenden Na 2 ATP zu hohe Hintergrundsignal von Phosphat in dem Test zu verhindern). Vorbereitung der SDS-Stop-Lösung (12% (w / v) SDS in ddH 2 O).
- Für die Erkennung Chifflet vorzubereiten Puffer A (3% (w/ V) Ascorbat, 0,5% (w / v) Ammoniummolybdat, 0,5 M HCl) unmittelbar vor dem Gebrauch und Puffer B (2% (w / v) Natrium-Citrat, 2% (w / v) Natrium-meta-Arsenit, 2% (v / v) Essigsäure).
2. Isolierung von Hefe-Mikrosomen
- S. cerevisiae Huhn CFTR exprimieren, werden wie in O'Ryan et al (2012) 14 gewachsen.. Speichern das Material aus einer 20 l-Fermentation in zwei Aliquots bei -80 ° C für bis zu 6 Monate.
- Tauen Sie ein Aliquot von Zellen schnell und resuspendieren in 3 ml pro Gramm gekühlt mPIB von Zellen.
- Stören Zellen in einer Kugelmühle mit Glasperlen von 425-600 Mikrometer Durchmesser. Verwenden Sie fünf 1 min Perioden der Zellaufschluss durch 1 min Ruhezeiten getrennt. (Die Ruhezeiten sind wichtig, um sicherzustellen, dass die Zellen nicht während der Unterbrechung aufgeheizt.)
- Überwachung der Zellaufschluß durch Zentrifugation einer 1 ml-Probe des Zelllysats aus der Kugelmühle. Zentrifuge (12.000 × g, 4 ° C, 5 min) in einer Tisch zentrifuge. Verdünnen Sie den Überstand in 1:50 mit mPIB in einer Küvette und messen Sie die A 380. Wenn A 380> 0.1, oder hat trotz mehrerer wiederholt Wulst-Prügel Zyklen gestoppt zu, mit dem folgenden Schritt fort. Wenn nicht, wiederholen 2,3-2,4.
- Zentrifugieren Sie die Gesamt Zelllysat (12.000 x g, 4 ° C, 20 min). Bewahren Sie den Überstand. Entsorgen Sie die Pellet (mit aufgebrochenen Zellen und Mitochondrien), aber wenn es irgendeinen Zweifel über die Effizienz der Zellbruch (siehe 2.4), dann behalten die Pellet auch.
- Zentrifugieren des Überstands aus dem vorherigen Schritt (200.000 × g, 4 ° C, 1,5 h). Überstand verwerfen und Resuspendieren der pelletiert mikrosomalen Membranen in CFTR-Puffer. Wenn die Mikrosomen werden für die Reinigung unter Verwendung DDM soll, ergänzen das CFTR-Puffer mit 1 M NaCl.
- Wiederholen Sie die Zentrifugation der Membranfraktion suspendiert (100.000 x g, 4 ° C, 1 h), und den Überstand verwerfen.
- Resuspendieren der pelletiert Mikrosomen inein Mindestvolumen von CFTR-Puffer (endgültige Volumen 5-15 ml, insgesamt mikrosomalen Protein 70-200 mg). Ein Bradford-Assay kann verwendet werden, um die Gesamtkonzentration der mikrosomalen Proteine 25 zu bestimmen. Zusätzlich das Fluoreszenzemissionsspektrum der Membranen sollte gemessen (Anregung = 485 nm, Emission = 500-600 nm) und sollte eine deutliche GFP-Fluoreszenz-Peak (Maximum bei 512 nm) haben. CFTR spezifisch auf einem SDS-PAGE-Gel unter Bedingungen gescannt GFP-Fluoreszenz (Fig. 1) erkannt werden.
- Blitz Einfrieren der resuspendiert Mikrosomen durch Eintauchen in flüssigen Stickstoff und bei -80 ° C, oder fahren Sie mit Schritt 3 fort.
3. Solubilisierung von Mikrosomen
- Wenn gefroren, auftauen Mikros unmittelbar vor der Verwendung in einem Wasserbad auf 10 ° C eingestellt
- Zur Solubilisierung von Membranen, verdünnt den Mikrosomen mit einem gleichen Volumen des jeweiligen Lösungspuffer (Schritt 1.3), um eine endgültige Konzentration von Waschmittel geben2% (w / v) und eine mikrosomale Proteinkonzentration von 5 mg / ml. Inkubieren dieser Mischung für 1 h bei 4 ° C unter Rühren (Schwenker). Bewahren Sie 200 ul für die Analyse.
- Zentrifugieren der Mischung (100.000 × g, 4 ° C, 45 min). Entfernen Sie den Überstand der solubilisierten Membranproteine enthalten, führt es durch einen 0,45 um Spritzenfilter speichern und auf Eis. Messung der Fluoreszenz des Überstands (wie in Schritt 2.8).
- Resuspendieren der unlöslichen Fraktion in 1% (w / v) SDS-Lösung auf ein Volumen gleich der löslichen Fraktion. Messung der Fluoreszenz in dieser Fraktion und behalten ein Aliquot von 50 &mgr; l SDS-PAGE-Analyse.
4. Nickel-Affinitätsreinigung von CFTR
- Link-zwei 5 ml Nickel-Sepharose Säulen in Reihe. Waschen mit 2 Säulenvolumina (CV) 20% (v / v) Ethanol, gefolgt von 2 CV ddH 2 O, dann waschen Sie die Säule mit 2 CV Solubilisierungspuffer (Schritt 1,4 bis 1,5), die 1 M Imidazol. Wiederholen Sie mit 2 CV von solubilizatIonen-Puffer fehlt Imidazol.
- Hinzufügen Imidazol bis zu einer Endkonzentration von 5 mM zu dem solubilisierten Material (Schritt 2.8) und manuell, wenn unter Verwendung eines automatisierten Flüssigkeitschromatographievorrichtung das Material auf die Säule oder in eine Probenschleife geladen.
- Laden des gelösten Materials auf die Säule bei einer Fließgeschwindigkeit von 0,5 ml / min, und wäscht mit 2 CV Imidazol-Puffer fehlen bei der gleichen Fließrate, um ungebundenes Material zu entfernen. Sammeln Fraktionen in 50 ml Falcon-Röhrchen.
- Zum ersten Wäsche mit 3 CV des Reinigungspuffer mit 40 mM Imidazol bei einer Durchflussrate von 1 ml / min. 2 ml Fraktionen.
- Für die zweite Wäsche mit 3 SV Reinigungspuffer mit 100 mM Imidazol. 2 ml Fraktionen.
- Elute CFTR vom HisTrap Säule mit 3 CV von Reinigungspuffer mit 400 mM Imidazol. 2 ml Fraktionen.
- Überwachung der Fluoreszenz in eluierten Fraktionen (Schritt 2.8).
- Bewahren Aliquots der Peak-Fraktionen für die SDS-PAGE-Analyse. Flash-Freeze verbleibenden Spitzen fraction Proben und bei -80 ° C, bzw. den nächsten Reinigungsschritt weiter.
5. Gelpermeationschromatographie (GPC) Reinigung des CFTR
- Äquilibrieren die Spalte (Superose 6 10/300 GL) mit 1,2 CV ddH 2 O, gefolgt von 1,2 CV GPC-Puffer.
- Während des Schrittes 5.1, konzentrieren die Ni-Affinitäts-gereinigten Fraktionen mit der höchsten GFP-Fluoreszenz unter Verwendung einer 100.000 MWCO Filterzentrifuge bei 4 ° C. Wenn Reinigung in DDM vermeiden Konzentrieren der Probe über einer Proteinkonzentration von 0,3 mg / ml Protein, wie dies signifikante Probenverlust. Entfernen Sie den Rückstand aus dem Konzentrator und Zentrifuge bei 100.000 x g für 30 min bei 4 ° C, um große Partikel zu pelletieren.
- Spritzen Sie dieses Beispiel auf die Säule und Elution mit einem isokratischen Gradienten von 1,2 CV GPC-Puffer. Sammeln Sie 0,5 ml-Fraktionen.
- Messen GFP-Fluoreszenz, wie in Abschnitt 2.8, diese Fraktionen, die CFTR identifizieren. Bewahren Sie eine kleine Menge (zB </ Em> 50 &mgr; l) von jedem für die Analyse durch SDS-PAGE.
- Frieren Fraktionen in flüssigem Stickstoff und bei -80 ° C
6. Rekonstitution von CFTR
- Hinzufügen Lipide (Schritt 1,8) zu dem gereinigten CFTR an Lipid-zu-Protein-Verhältnis 100:1 (w / w) und Inkubation bei 4 ° C für 1 Stunde. Ebenso eine lipid nur Steuerung eingestellt, und ersetzen Sie das gereinigte Protein mit dem gleichen Volumen GPC-Puffer.
- Entfernen Sie Reinigungsmittel aus dem Protein / Lipid-Mischung mit hydrophoben Adsorbens Perlen. In 5 CV ddH 2 O, 5 CV 70% (v / v) Ethanol, 5 CV ddH 2 O und 5 CV GPC Puffer ohne Waschmittel waschen Adsorbens Perlen. 200 mg Adsorbens gewaschen Perlen pro ml gereinigtem Protein und Inkubieren bei 4 ° C über Nacht unter leichtem Schütteln.
- Sammeln Sie die Rekonstitution Probe aus den Adsorbens Perlen in ein frisches Röhrchen mit einem dünnen-ended Pipettenspitze.
7. Messung der ATPase-Aktivität
- Bestimmen Sie die Rate der CFTR-spezifische ATPase-Aktivität unter Verwendung eines modifizierten Chifflet Assay 26,27 in einer 96-Well-Plattenformat. Mit Natriumphosphat-Stammlösung (0,65 mM) vorzubereiten 0-20 nmol Phosphat in einem Gesamtvolumen von 50 ul als Standards. Verwenden Sie eine 1:1-Mischung von CFTR-ATPase-Puffer und Puffer, um die Phosphat-Lager zu verdünnen.
- Inkubation sowohl wiederhergestellt CFTR und leere Liposomen mit 1:100 (v / v) ATPase-Inhibitoren (Schritt 1,9) auf Eis für 10 min. Verwenden Sie mindestens 5 ug wiederhergestellt CFTR.
- Hinzufügen ATP (Schritt 1,9) zu einer Endkonzentration von 2 mM und Inkubation bei 25 ° C für 1 Stunde. Stoppen der Reaktion durch Zugabe von 40 ul 10% (w / v) SDS (Schritt 1,9) zu jeder Vertiefung (einschließlich der Standards).
- 100 l Puffer A (Schritt 1.10) und Inkubation für 10 min. Füge 100 &mgr; l Puffer B (1,10) in jede Vertiefung und die Extinktion bei einer Wellenlänge von 800 nm in einer 96-Well-Platte-kompatible UV / Vis-Spektrophotometers.
- Konvertieren Absorption bei 800 nm in einer Menge an freigesetztem Phosphat mittels derPhosphat-Standards. Berechnen Sie die Geschwindigkeit der ATP-Hydrolyse nach Abzug der Hintergrundsignal (Liposomen nur Brunnen).
- Für nicht wiederhergestellt CFTR folgen dem gleichen Protokoll mit CFTR-Puffer für die Hintergrundwerte.
Ergebnisse
Das oben beschriebene Protokoll ist ein effizientes Mittel, um CFTR angereicherte Mikros fast vollständige Wiederherstellung der CFTR während des Zellbruch und Herstellung der Roh-Mikrosomen (Fig. 1) zu isolieren. Andere Zellbruchverfahren können auch effektiv verwendet werden. Wir haben eine Druckzelle Französisch und andere high-pressure/cavitation Geräte (auch in Kombination mit Auftreffen auf einem Rubin Ziel) mit gleicher Effizienz eingesetzt. Für Komfort und niedrigen Anschaffungskosten der Geräte, finden wir die Wulst-Verfahren die besten Schläge.
Mit LPG um sie zu lösen und zu reinigen CFTR ergab 80 ug Protein / L Kultur bei> 90% Reinheit (Abbildung 2). Die hohe Ausbeute war durch effiziente Solubilisierung von CFTR von LPG (vgl. Abb. 2b, Spuren 2 und 4). Außerdem effizient und feste Bindung an die Säule führte zu einem minimalen Verlust von CFTR in der ungebundenen Fraktion und der Abwesenheit von CFTR in den Waschfraktionen (Fig. 2, Bahnen 3, 5, und6). Das eluierte Protein besaß eine Reinheit von> 90%, durch Coomassie-gefärbte SDS-PAGE-Gelen abgeschätzt und mit Densitometrie des CFTR-und Schadstoff Bands. Gelpermeationschromatographie (GPC) getrennt LPG-CFTR gereinigt von Verunreinigungen Gewicht niedermolekularen (Abbildung 4, unteres Bild).
Das Protokoll für die Reinigung unter Verwendung von CFTR DDM gibt Reinheit von etwa 60% und die Ausbeute von etwa 50 ug / l (Fig. 3). Elektronenmikroskopie (EM) von negativ gefärbten Fraktionen, die von der GPC-Elution bei 10 ml (Fig. 4) zeigte, dass DDM-gereinigt CFTR enthält Aggregate von 20-30 nm Durchmesser und kleinere Teilchen von 10 nm Durchmesser (Daten nicht gezeigt). Es ist möglich, dass die kleinen Aggregate reversibel zu verknüpfen und distanzieren wie Ultrafiltration mit einer 1 MDa cut-off Filter war nicht in der EM-nachweisbar Aggregate zu entfernen. LPG-gereinigte Material nicht zu einer Schein-Netz entladen adsorbieren, daher wurde durch Kryo-EM der ungefärbten Fraktionen untersucht. Dies zeigte,eine sehr homogene Kornpopulation einer relativ geringen Größe (6-8 nm Durchmesser, Daten nicht gezeigt).
Schließlich wurde die ATPase-Aktivität der gereinigten Proteine (Abbildung 5) gemessen. Als Mitglied der ABC-Protein-Familie, hat CFTR zwei Nukleotid-Bindungsdomänen (NBDs), die zur Bindung und / oder Hydrolyse von ATP. Die Daten zeigen, daß das gereinigte Protein war nicht in der Lage, ATP in der LPG-solubilisierten Zustand hydrolysieren und zeigte schwache ATPase-Aktivität in Gegenwart von DDM (Abbildung 5, ungefüllte Balken). Nach der Zugabe von Lipiden und Entfernen des Detergens wurde die ATPase-Aktivität 4-fach höher für Proben, die in DDM (13 nmol ATP / min / mg Protein) gereinigt worden war. Die Zugabe von Lipiden und Entfernen von LPG ähnlich wiederhergestellt Aktivität CFTR isoliert worden waren, die mit LPG, jedoch mit einer abschließenden Untersatz (1,5 nmol ATP / min / mg Protein) als die DDM-gereinigt und wiederhergestellten Materials.

1. Überwachungsebenen Huhn CFTR im Zelllysat (CL), die Überstände (S) und Pellets (P) während der verschiedenen Schritte der Zentrifugation für Mikros Isolierung und Waschen verwendet. SDS-PAGE Gele wurden unter Verwendung des in-Gel-Fluoreszenz des GFP visualisiert -Tag. Der Überstand nach dem Aufbrechen der Zellen und Zentrifugation bei 14000 × g enthält praktisch alle CFTR (einschließlich Abbauprodukte). Ultrazentrifugation bei 200.000 xg Sedimente alle in voller Länge CFTR verlassen einige Fragmente im Überstand. Ultrazentrifugation bei 100.000 × g salz gewaschen Mikros Pellets fast alle CFTR mit dem Entfernen einiger weiterer Fragmente.
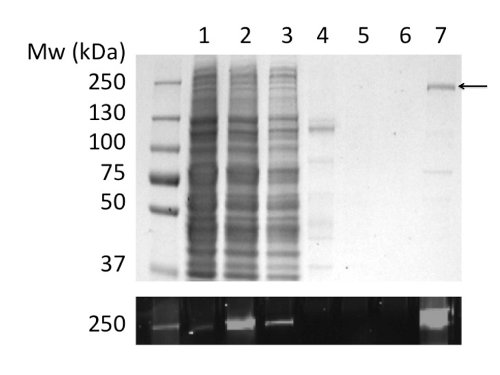
2. Reinigung von Hühner CFTR in LPG durch immobilisierte Metallionen-Affinitätschromatographie. Die Fraktionen wurden durch SDS-PAGE, gefolgt von Coomassie-Färbung (oberes Feld) und Fluoreszenz-Detektion des GFP-Tag (untere Tafel) untersucht. Tracks: (1) Mikrosomen. (2) LPG-Mikrosomen gelöst. (3) Nicht konsolidiert Material. (4) Das unlösliche Material. (5) und (6) 40 bis 100 mM Imidazol-Waschanlagen. (7) Material eluiert mit 400 mM Imidazol.
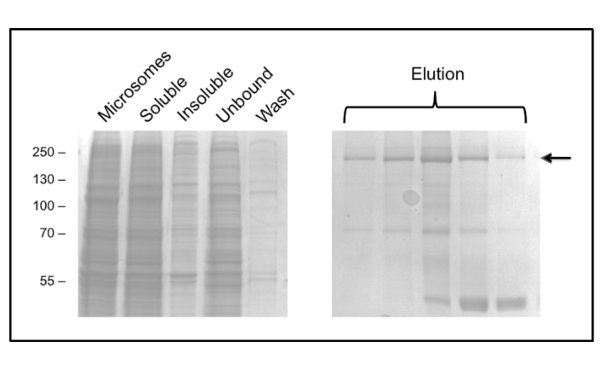
3. Reinigung von Hühner CFTR in DDM durch immobilisierte Metallionen-Affinitätschromatographie. Die Fraktionen wurden durch SDS-PAGE, gefolgt von Coomassie-Färbung analysiert. Die Linke Tafel zeigt Fraktionen vor der Elution. Mehrere aufeinanderfolgende Elution Fraktionen werden in der rechten Panel mit CFTR in gezeigtdurch den Pfeil dicated. Später Fraktionen werden in einem 40 kDa Verunreinigung, die durch Massenspektrometrie als ribosomale Protein L3 identifiziert wurde bereichert.
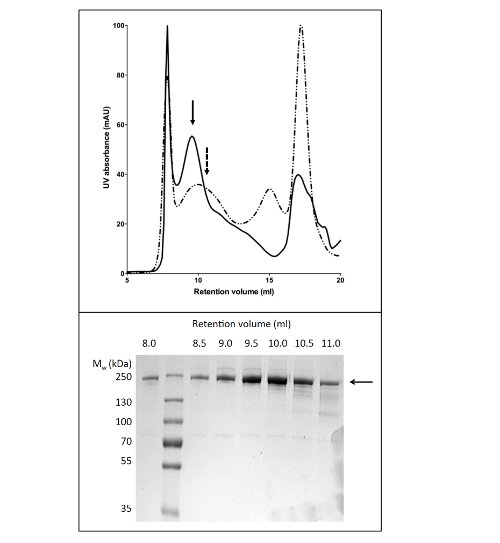
4. Reinigung von Hühner CFTR durch Gelpermeationschromatographie. CFTR durch Ni-Affinitätschromatographie gereinigt wurde, eingeengt und auf einem GPC-Säule aufgetragen. Das Elutionsprofil für CFTR (oben) in Puffer gereinigt enthalten LPG-14 (durchgezogene Linie) oder DDM (gestrichelte Linie) überlagert werden. SDS-PAGE (unten) ergab, dass CFTR zwischen 8 und 11 ml eluiert.
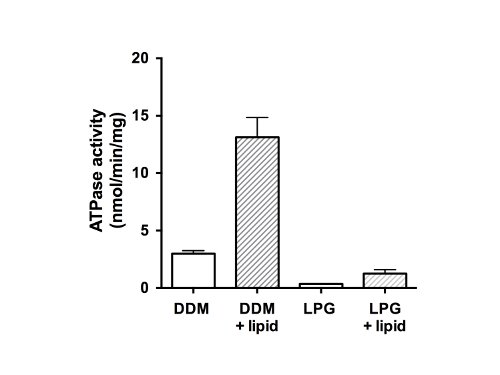
Abbildung 5. ATPase activity gereinigtes Hühner CFTR Fraktionen. Protein in DDM oder LPG gereinigt wurde unter Verwendung einer modifizierten Chifflet Assay 26 in Gegenwart eines Cocktails von ATPase-Inhibitoren, jede Hintergrund-ATPase-Aktivität von F-, P-und V-Typ-ATPasen (ungefüllte Balken zu entfernen getestet ). Die Rate der ATP-Hydrolyse wurde auch nach Entfernung des Detergens und Lipid-Zugabe (gefüllte Balken) gemessen. Das Diagramm zeigt den Mittelwert und Standardabweichung (n = 3). Unterschiede zwischen den Mittelwerten für die ATPase-Aktivität in Gegenwart und Abwesenheit von Lipid und Differenz-Aktivität in DDM und LPG signifikant für p <0,05.
Diskussion
Wir haben zuvor für die Überexpression des murinen CFTR 14 beschriebenen Verfahrens. Seit der Veröffentlichung des Protokolls, haben wir verschiedene Orthologen von CFTR Ausdruck gebracht haben und gereinigt mit dem gleichen System. Orthologe alle bisher getesteten und in dem Flüssiggas-Waschmittel gereinigt, während die DDM-Reinigung zeigte mehr Variation in verschiedenen Orthologe (Daten nicht gezeigt). Diese Flexibilität zeigt die Stärke des Hefe-Ansatz: Es ist möglich, viele Konstrukte relativ rasch, um ein für einen bestimmten Zweck zu wählen screenen.
Waschen der Hefe-Mikrosomen mit Puffer, enthaltend 1 M NaCl vor der DDM-Ergebnisse in einer Reinigungsmikros Herstellung Solubilisierung und reduziert Verunreinigungen in späteren Phasen. Dieser Schritt ist nicht notwendig in der LPG-Protokoll als die endgültige CFTR Probe> 90% rein, ohne die Mikros waschen. Außerdem, Reinigung im DDM erfordert mehrere Änderungen der Puffer zur Solubilisierung einnd Reinigung, nämlich die zusätzliche Zugabe von Glycerin und Salz. Zusammen stellen diese Zusätze deutlich die Bindung des DDM-solubilisierten Protein an der Säule erhöht.
Das DDM Reinigungsmethode hat Raum für Verbesserungen, insbesondere die Entnahme eines 40 kDa großen Verunreinigung, die durch Massenspektrometrie beurteilt, ist aufgrund der Hefe ribosomalen Untereinheit L3, die eine inhärente Affinität für Nickel Harz zu haben scheint. Es gibt keinen offensichtlichen polyHis-Sequenz in der L3-Protein, aber Prüfung der 3D-Struktur, wenn das Ribosom gebunden (PDB = 1FFK) zeigt, dass der gefaltete L3-Untereinheit hat ein Potential polyHis Cluster. Dass diese Band ist in LPG-gereinigte Material weniger problematisch kann aufgrund der härteren LPG Reinigungsmittel sein.
Obwohl die Reinigung in DDM scheint schlechter als die in der LPG zu sein, kann milder Detergenzien wie DDM mehr mit funktionellen und strukturellen Analysen kompatibel sein und haben bereits in mehreren Röntgen crystall verwendetographic Studien von Membranproteinen 15-21. Ferner bezeichnet unsere Ergebnisse, dass die Verwendung von LPG führt zum Verlust der ATPase-Funktion in Bezug auf die Reinigung CFTR in DDM. Daher würden wir die LPG-basierte Reinigungsprotokoll für die Erzeugung von CFTR wobei die Reinheit entscheidend empfehlen, beispielsweise in Anwendungen wie der Charakterisierung von posttranslationaler Modifikationen, oder bei der Erzeugung von Antikörpern, die LPG-basiertes Protokoll gewählt werden würde . Auf der anderen Seite in Anwendungen, bei denen die Aktivität und vollständig nativen Zustand des Proteins ist wesentlich, würden wir die DDM-basiertes Protokoll als eine bessere Option vorschlagen.
Abschließend Dieses Protokoll beschreibt ein reproduzierbares Verfahren zur Isolierung von CFTR in der zwitterionischen Detergens-LPG 14 oder das nicht-ionische Detergens DDM. Als solche zeigt eine größere Palette von Reinigungsbedingungen für CFTR als zuvor berichtet worden, 10-13. Zusätzlich Milligramm-Mengen von gereinigtem CFTR kannunter Verwendung dieser Verfahren, wenn sie mit einem hohen Volumen Hefewachstum System wie einem 20 L Fermenter und einer hohen Kapazität Zellerntesystem, wie ein 6 L niedriger Geschwindigkeit Zentrifugenrotor in Verbindung erhalten. Das erhaltene CFTR einen spalt GFP-Tag, das eine einfache Überwachung des Proteins in verschiedenen biochemischen und biophysikalischen Untersuchungen ermöglicht.
Die in dieser Handschrift (Huhn CFTR-haltige Plasmid oder gefrorene Hefe-Zellen) beschrieben Reagenz kann durch die Cystic Fibrosis Foundation (USA) bezogen werden.
Offenlegungen
Die Autoren haben keine finanziellen Interessen im Wettbewerb noch andere widerstreitenden Interessen in Bezug auf diese Arbeit.
Danksagungen
Diese Arbeit wurde von der US-Cystic Fibrosis Foundation (CFF) durch ihre Struktur Consortium CFTR 3D finanziert. TR wurde von einem britischen CF Treu Stipendium und NC von einer britischen BBSRC Stipendium finanziert. Wir bekennen uns zu unserer Kollegen in der CFF CFTR 3D-Struktur Konsortium für ihre Hilfe und Beratung und für die Gestaltung der Codon-optimierten Huhn CFTR-Sequenz und Reinigung Tags.
Materialien
| Name | Company | Catalog Number | Comments |
| 0.2 μm syringe filter | Sartorius | FC121 | |
| 100 kDa MWCO centrifugal concentrator (PES membrane) | Vivaspin | VS0641 | |
| 2 ml microfuge tubes | Sarstedt | 72.695 | |
| 40Ti rotor | Beckman Coulter | 337901 | |
| 50 ml sterile Falcon tubes | Sarstedt | 62.547.254 | |
| Adenosine triphosphate disodium salt (Na2ATP) | Sigma-Aldrich | A26209 | |
| Liquid chromatography system | GE Healthcare | 28-4062-64 | |
| Aminoethylbenzenesulfonyl fluoride (AEBSF) | Sigma-Aldrich | A8456 | |
| Glass bead-beating cell disrupter | BioSpec | 1107900 | |
| Benchtop centrifuge | HERMLE | Z300 | |
| Benchtop centrifuge | Eppendorf | 5417R | |
| Benchtop microfuge | Fisher | 13-100-511 | |
| Benzamidine hydrochloride | Sigma-Aldrich | 434760 | |
| Hydrophobic Beads SM-2 Adsorbent | BioRad | 152-3920 | |
| Bromophenol blue | Sigma-Aldrich | 114391 | |
| Centrifuge tubes | Beckman Coulter | 357000 | |
| Gel imaging system | BioRad | 170-808 | |
| Cholesterol | Sigma-Aldrich | C8667 | |
| Chymostatin | Sigma-Aldrich | C7268 | |
| Dimethylsulfoxide (DMSO) | Sigma-Aldrich | D8418 | |
| Dithiothreitol (DTT) | Sigma-Aldrich | 43815 | |
| E. coli total lipid extract | Avanti lipids | 100500 | |
| Epoxysuccinyl-leucylamido-butane (E-64) | Sigma-Aldrich | E3132 | |
| Glass beads, acid washed | Sigma | G8772 | |
| Glycerol | Fisher | 65017 | |
| HisTrap HP columns (5 ml) | GE Healthcare | 17-5247-05 | |
| Rapid Coomassie Stain | Novexin | ISB1L | |
| Centrifuge JA-17 rotor | Beckman Coulter | 369691 | |
| Leupeptin | Merck | 108975 | |
| Lyso-phosphatidyl glycerol-14 (LPG) | Avanti lipids | 858120 | |
| MgSO4 | Sigma-Aldrich | M7506 | |
| Gel tank SDS-PAGE system | BioRad | 165-8006 | |
| n-Dodecyl-β-D-maltopyranoside (DDM) | Affymetrix | D310S | |
| NaCl | Sigma-Aldrich | S6191 | |
| NaN3 | Sigma-Aldrich | S2002 | |
| NH4Cl | Sigma-Aldrich | A9434 | |
| Oligomycin | Sigma-Aldrich | 75351 | |
| Ultracentrifuge | Beckman Coulter | 392050 | |
| Prestained protein standards | Fermentas | SM1811 | |
| Desalting columns (Sephadex G-25) | GE Healthcare | 17-0851-01 | |
| Pepstatin A | Sigma-Aldrich | P4265 | |
| Phenylmethanesulfonylfluoride (PMSF) | Sigma-Aldrich | P7626 | |
| SCH28080 | Sigma-Aldrich | S4443 | |
| Sodium dodecyl sulfate (SDS) | Sigma-Aldrich | L37771 | |
| Sodium thiocyanate (NaSCN) | Sigma-Aldrich | 251410 | |
| Gel filtration 10/300 GL column | GE Healthcare | 17-5172-01 | |
| Tris-base | Formedium | TRIS01 | |
| Ultracentrifuge tubes | Beckman Coulter | 355618 | |
| Vortex mixer | Star Labs | N2400-0001 | |
| Ultrasonic water bath | Ultrawave | F0002202 | |
| Multimode plate reader | BioTek | BTH1MF |
Referenzen
- Aleksandrov, A. A., Aleksandrov, L. A., Riordan, J. R. CFTR (ABCC7) is a hydrolyzable-ligand-gated channel. Pflugers Arch. 453, 693-702 (2007).
- Dodge, J. A., Lewis, P. A., Stanton, M., Wilsher, J. Cystic fibrosis mortality and survival in the UK: 1947-2003. EUR RESPIR J. 29, 522-526 (2007).
- O'Sullivan, B. P., Freedman, S. D. Cystic fibrosis. Lancet. 373, 1891-1904 (2009).
- Rommens, J. M., et al. Identification of the cystic fibrosis gene: chromosome walking and jumping. Science. 245, 1059-1065 (1989).
- Kariya, C., et al. A role for CFTR in the elevation of glutathione levels in the lung by oral glutathione administration. Am J Physiol Lung Cell Mol Physiol. 292, (2007).
- Gould, N. S., Min, E., Martin, R. J., Day, B. J. CFTR is the primary known apical glutathione transporter involved in cigarette smoke-induced adaptive responses in the lung. Free Radic Biol Med. 52, 1201-1206 (2012).
- Childers, M., Eckel, G., Himmel, A., Caldwell, J. A new model of cystic fibrosis pathology: lack of transport of glutathione and its thiocyanate conjugates. Med Hypotheses. 68, 101-112 (2007).
- Cole, S. P., et al. Overexpression of a transporter gene in a multidrug-resistant human lung cancer cell line. Science. 258, 1650-1654 (1992).
- Conseil, G., Deeley, R. G., Cole, S. P. Polymorphisms of MRP1 (ABCC1) and related ATP-dependent drug transporters. Pharmacogenet Genomics. 15, 523-533 (2005).
- Ketchum, C. J., Rajendrakumar, G. V., Maloney, P. C. Characterization of the adenosinetriphosphatase and transport activities of purified cystic fibrosis transmembrane conductance regulator. Biochemistry. 43, 1045-1053 (2004).
- Ramjeesingh, M., et al. A novel procedure for the efficient purification of the cystic fibrosis transmembrane conductance regulator (CFTR). Biochem J. 327 (Pt 1), 17-21 (1997).
- Huang, P., Liu, Q., Scarborough, G. A. Lysophosphatidylglycerol: a novel effective detergent for solubilizing and purifying the cystic fibrosis transmembrane conductance regulator. Anal Biochem. 259, 89-97 (1998).
- Rosenberg, M. F., Kamis, A. B., Aleksandrov, L. A., Ford, R. C., Riordan, J. R. Purification and crystallization of the cystic fibrosis transmembrane conductance regulator (CFTR). J Biol Chem. 279, 39051-39057 (2004).
- O'Ryan, L., Rimington, T., Cant, N., Ford, R. C. Expression and purification of the cystic fibrosis transmembrane conductance regulator protein in Saccharomyces cerevisiae. J Vis Exp. , (2012).
- Oldham, M. L., Chen, J. Snapshots of the maltose transporter during ATP hydrolysis. Proc Natl Acad Sci USA. 108, 15152-15156 (2011).
- Pinkett, H. W., Lee, A. T., Lum, P., Locher, K. P., Rees, D. C. An inward-facing conformation of a putative metal-chelate-type ABC transporter. Science. 315, 373-377 (2007).
- Dawson, R. J. P., Locher, K. P. Structure of a bacterial multidrug ABC transporter. Nature. 443, 180-185 (2006).
- Gerber, S., Comellas-Bigler, M., Goetz, B. A., Locher, K. P. Structural basis of trans-inhibition in a molybdate/tungstate ABC transporter. Science. 321, 246-250 (2008).
- Ward, A., Reyes, C. L., Yu, J., Roth, C. B., Chang, G. Flexibility in the ABC transporter MsbA: Alternating access with a twist. Proc Natl Acad Sci USA. 104, 19005-19010 (2007).
- Kadaba, N. S., Kaiser, J. T., Johnson, E., Lee, A., Rees, D. C. The high-affinity E. coli methionine ABC transporter: structure and allosteric regulation. Science. 321, 250-253 (2008).
- Aller, S. G., et al. Structure of P-Glycoprotein Reveals a Molecular Basis for Poly-Specific Drug Binding. Science. 323, 1718-1722 (2009).
- Koehler, J., et al. Lysophospholipid micelles sustain the stability and catalytic activity of diacylglycerol kinase in the absence of lipids. Biochemistry. 49, 7089-7099 (2010).
- Tian, C., et al. Preparation, functional characterization, and NMR studies of human KCNE1, a voltage-gated potassium channel accessory subunit associated with deafness and long QT syndrome. Biochemistry. 46, 11459-11472 (2007).
- Huang, P., Liu, Q., Scarborough, G. A. Lysophosphatidylglycerol: a novel effective detergent for solubilizing and purifying the cystic fibrosis transmembrane conductance regulator. Anal Biochem. 259, 89-97 (1998).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem. 72, 248-254 (1976).
- Chifflet, S., Torriglia, A., Chiesa, R., Tolosa, S. A method for the determination of inorganic phosphate in the presence of labile organic phosphate and high concentrations of protein: Application to lens ATPases. Analytical Biochemistry. 168, 1-4 (1988).
- Rothnie, A., et al. The importance of cholesterol in maintenance of P-glycoprotein activity and its membrane perturbing influence. Eur Biophys J. 30, 430-442 (2001).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten