Method Article
טיהור של חלבון הטרנסממברני מוליכות רגולטור סיסטיק פיברוזיס שבא לידי ביטוי ב
In This Article
Summary
ביטוי וטיהור של רגולטור פיברוזיס הטרנסממברני סיסטיק המוליכות (CFTR) Heterologous אתגרים משמעותיים וגורמים מגבילים בפיתוח הטיפולים תרופתיים לסיסטיק פיברוזיס. פרוטוקול זה מתאר שתי שיטות לבידוד של כמויות מיליגרם של CFTR מתאימות ללימודים תפקודיים ומבניים.
Abstract
פגמים ברגולטור פיברוזיס המוליכות הטרנסממברני פיברוזיס (CFTR) חלבון גורמים סיסטיק פיברוזיס (CF), מחלה אוטוזומלית רצסיבית שכרגע מגבילה את תוחלת החיים הממוצעת של חולים ל< 40 שנים של גיל. הפיתוח של מולקולות תרופה חדשניות כדי לשחזר את הפעילות של CFTR הוא מטרה חשובה בטיפול CF, והבידוד של CFTR תפקודי הפעיל הוא צעד שימושי להשגת מטרה זו.
אנו מתארים שתי שיטות לטיהור של CFTR ממערכת אוקריוטים Heterologous ביטוי, ש ' cerevisiae. כמו מערכות פרוקריוטים, ש ' cerevisiae ניתן לגדל במהירות במעבדה בעלות נמוכה, אלא גם תנועה וposttranslationally יכול לשנות את החלבונים בממברנה גדולים. הבחירה של חומרי ניקוי לsolubilization וטיהור היא שלב קריטי בטיהור של כל חלבון בממברנה. לאחר שהוקרן למסיסות של CFTR בכמה חומרי ניקוי, בחרנו שני שיתוףntrasting חומרי ניקוי לשימוש בטיהור שתאפשר הכנת CFTR הסופית להיות מותאמת לניסויים המתוכננים בהמשך.
בשיטה זו, אנו מספקים השוואה של הטיהור של CFTR בdodecyl-β-D-maltoside (DDM) ו1-tetradecanoyl-SN-glycero-3-phospho-(1'-RAC-גליצרול) (גפ"מ-14). החלבון מטוהר בDDM בשיטה זו מעיד על פעילות ATPase במבחנים תפקודיים. החלבון מטוהר בגפ"מ-14 תערוכות טוהר גבוה ותשואה, יכולים להיות מועסק על מנת ללמוד שלאחר translational שינויים, ויכול לשמש לשיטות מבניות כגון פיזור קרני רנטגן בזווית קטנה ומיקרוסקופים אלקטרונים. עם זאת הוא מציג פעילות ATPase נמוכה באופן משמעותי.
Introduction
סיסטיק פיברוזיס (CF) הוא המחלה הגנטית הנפוצה ביותר באירופה ובצפון אמריקה עם שכיחות של 1 ל 2,500 לידה חי. CF מתרחש כאשר מוטציות ברגולטור פיברוזיס המוליכות הטרנסממברני פיברוזיס (CFTR) הפסד סיבת חלבון של תפקודו בקרום הפלזמה של תאי האפיתל 1. התוצאה החמורה ביותר של פגם זה היא נזק בלתי הפיך ריאות, מה שמקצר את תוחלת החיים של חולים ל< 40 גיל 2,3.
CFTR הוא קלטת ATP מחייב טרנספורטר (ABC) שהתפתחה להיות 1,4 ערוץ יון. למרות הפונקציה די שינתה בקרום הפלזמה של תאים, היא עדיין שומרת הומולוגיה ברצף משמעותית עם מובילי ABC אחרים. מעניין לגלות שהחלקים מיוחדים של CFTR (כלומר אזור הרגולציה שלה ו-N-ו-C-Termini) חולקים שום דמיון רצף משמעותי עם מובילי ABC מטזואניים אחרים, ומכאן שאין רמזים לגבי המקורות דואר של רצפים אלה בCFTR. על בסיס המבנה הראשוני שלה, CFTR מסווג חבר של משפחת טרנספורטר ABC C-משפחה, אבל אין ראיות חזקות להצמדה פונקציונלית שיורית למשנה המשפחה הזאת. היו כמה דיווחים על פעילות תחבורת גלוטתיון לCFTR 5-7, וזה יהיה בקנה אחד עם התפקידים של חברי C-משפחה אחרות 8,9, אם כי דיווחים אחרים עולה כי גלוטתיון מופחת עשוי לעכב את פעילות CFTR ATPase, ולא מראה את גירוי-Induced מצע המאפיינים את מובילי ABC 10. מדידת מוליכות יון היא רגישה מספיק כדי לאפשר את פעילות הערוץ של מולקולות CFTR אחת כדי להיחקר 1 ומאפייני ערוץ CFTR כבר במעקב כפונקציה של זמן, טמפרטורה, ריכוז ה-ATP, פוטנציאל הממברנה, ומדינת זירחון, כמו גם ב נוכחותו של מארח של מעכבי מולקולה קטנים, potentiators, ומכפילים. אלהגם מחקרים שהוספנו באופן משמעותי לידע של איך מובילי ABC לתפקד שלנו. עם זאת, ביטוי של CFTR בסכומים משמעותיים והטיהור הבאה שלה הוכיח להיות מאתגר במיוחד וההצלחה הייתה מוגבלת לכמה מעבדות 10-13.
הצורך לפתח תרופות יעילות יותר דוחק, אך תהליך זה התעכב בשל חוסר CFTR מטוהר לסינון מולקולות קטנות. פתרון בעיית ביטוי CFTR והטיהור יאפשר הקרנת סמים תפוקה גבוהה שמטרתה לתקן את הפגם העיקרי בCF וגם לפתוח את מסלול ללימודים מבניים ברזולוציה גבוהה כדי ליידע את עיצוב סמים רציונלית. יתר על כן, אפילו מאפיינים ביוכימיים בסיסיים יחסית של חלבון, כגון מדינת oligomeric הפונקציונלית שלה, חלבוני אינטראקציה ופעילות ATPase יישארו מאופיינים בצורה גרועה. יש לנו דיווח פרוטוקול לביטוי בקנה מידה גדולה של ה-GFP-CFTR והעכברי מתויג-בעברבס 14 cerevisiae ועכשיו יתאר נוסף פרוטוקולים לטיהור של CFTR. יש לנו להשתמש בשיטות אלה כדי לטהר את חמש orthologues של CFTR, ומציג נתונים לטיהור של CFTR עוף לדוגמא ירושלים. הבחירה של חומרי ניקוי לsolubilization וטיהור היא שלב קריטי בטיהור של כל חלבון בממברנה. לאחר שהוקרן למסיסות של CFTR בכמה חומרי ניקוי, בחרנו שני חומרי ניקוי מנוגדים לשימוש בטיהור. Dodecyl-β-D-maltoside (DDM) הוא חומר ניקוי nonionic שכבר נעשה שימוש נרחב לשני מחקרים מבניים ותפקודיים של חלבונים בממברנה 15-21. חומר הניקוי היוני 1-tetradecanoyl-SN-glycero-3-phospho-(1'-RAC-גליצרול) (גפ"מ-14) הוא יעיל ביותר בsolubilization של CFTR ועבר כבר נעשה שימוש בטיהור של חלבונים בממברנה פונקציונליים 10, 22,23, כולל טיהור של CFTR מס 24 cerevisiae.
Protocol
1. הכנת חוצצים
- כדי להפוך את מניית 100x של מעכבי פרוטאז קוקטייל (PI) לפזר 96 AEBSF מ"ג, chymostatin 3.5 מ"ג, 10 מ"ג E64, 16.5 leupeptin מ"ג, 16.5 pepstatin מ"ג, 348 PMSF מ"ג, ו -4 מ"ג bestatin ב20 מיליליטר DMSO. הפוך aliquots 1 מ"ל ולאחסן ב -20 ° C. כדי להפוך את המניה 100x של benzamidine, לפזר 720 מ"ג ב20 מיליליטר מים ultrapure (DDH 2 O) ולאחסן ב 1 מיליליטר aliquots ב -20 ° C. כמות זו תספיק לטיהור אחד. בכל המאגרים, מניות PI וbenzamidine משמשות בדילול 1:100.
- הכן 'mPIB' (0.3 pH M טריס 8, 0.3 M סוכרוז, 2 מ"מ DTT) ו'CFTR '(50 מ"מ טריס pH 8, 20% (v / גליצרול v), 1 מ"מ DTT) חוצצים וצינה עד 4 ° C . לפני השימוש, מוסיף 1:100 של מעכבי פרוטאז הקוקטייל ו1:100 benzamidine בהתאם להיקף של mPIB משמש לresuspend התא גלולה (לדוגמא, השתמש 3.5 PI מיליליטר ו3.5 מיליליטר benzamidine בנפח כולל של 350 מיליליטר mPIB).
- הכן את יםolubilization מאגרים. (, 10% (v / v) גליצרול, 50 mM NaCl, 1 mM DTT, מעכבי פרוטאז (PIS) ו -4% גפ"מ 50 מ"מ טריס pH 8 (w / v)) חיץ solubilization גליצרול-14 (גפ"מ) Lyso-phosphatidyl וחיץ solubilization maltoside dodecyl (DDM) (50 מ"מ טריס pH 8, 20% (v / גליצרול v), 1 M NaCl, 1 mM DTT, מעכבי פרוטאז, 4% (w DDM / V)). ניתן sonicated הצפת באמבטית sonicator (35 W, 40 קילוהרץ) כדי לסייע בפיזור של חומרי הניקוי, אך להימנע vortexing התערובת, כמו זה יוצר בועות. צ'יל עד 4 ° C לפני השימוש.
- חיץ טיהור CFTR לטיהור גפ"מ הוא 50 מ"מ טריס, 10% (v / v) גליצרול, 50 mM NaCl, 1 mM DTT, 0.1% (w / v) גפ"מ-14 ומעכבים פרוטאז. הכן 350 מיליליטר של חיץ זה, ו150 מיליליטר של אותו החיץ בתוספת imidazole ז 1. להתאים את pH של שני המאגרים ל8.
- המאגר לטיהור בDDM מורכב מ50 מ"מ טריס pH 8, 20% (v / v) גליצרול, 1 M NaCl, 1 mM DTT, 0.1% (w / v) DDM. הכן 350 מיליליטר של חיץ זה, ו150 מיליליטר של אותו החיץ בתוספת imidazo 1 Mle. להתאים את pH של שני המאגרים ל8.
- לחיץ כרומטוגרפיה חלחול ג (GPC) המכיל גפ"מ, להכין 50 מ"מ טריס pH 8, 10% גליצרול (V / V), 50 mM NaCl, 1 mM DTT, 0.05% (w / v) גפ"מ-14. לGPC באמצעות DDM להכין מאגר של 50 מ"מ טריס pH 8, 20% (v / v) גליצרול, 1 M NaCl, 1 mM DTT, 0.1% (w / v) DDM. כל המאגרים וDDH 2 O בשימוש בעמודת GPC צריכים להיות מסוננים (0.2 מיקרומטר מסנן) וdegassed לפני השימוש.
- חיץ מדגם SDS-PAGE (2x ריכוז העבודה): 50 מ"מ טריס-HCl pH 7.6, 5% (v / v) גליצרול, 5 מ"מ EDTA, 0.02% (w / v) bromophenol כחול. הפוך 700 aliquots μl ולאחסן ב -20 ° C. לפני השימוש, מוסיף 200 μl של 20% (w / v) נתרן גופרתי dodecyl (SDS) ושל טרי 0.5 M DTT 100 μl. דגירה של לפחות 10 דקות עם דגימה בטמפרטורת חדר לפני הטעינה על ג'ל. אין לחמם; זה לפגל-GFP, ועלול לגרום CFTR לצבור.
- כדי להפוך את מניות שומנים לכינון מחדש, לפזר תערובת 04:01 (w / w) של א ' coli שומניםכולסטרול ד בכלורופורם ומתנול (2:1 V / V), ויבש בבקבוקון זכוכית תחת 2 גז N עבור שעה 2 כדי ליצור סרט שומנים בדם. הוסף חוצץ GPC (ללא NaCl) לריכוז שומנים של 40 מ"ג / מיליליטר ולהשתמש vortexing חוזר ונשנה וsonication (W 35, 40 קילוהרץ) כדי להבהיר את הפתרון.
- עבור assay ATPase, להכין 100x מניות של מעכבי ATPase ידי המסת SCH28080 ל1 מ"מ DMSO, NaSCN לז 1 ב DDH 2 O וoligomycin ל2.5 מ"מ ב100% (v / v) אתנול. חנות בaliquots ב -20 ° C. הפוך של חיץ ATPase 100 מיליליטר עם 50 מ"מ טריס pH 7.4, 150 מ"מ NH 4 Cl, 5 מ"מ MgSO 4 ו0.02% (w / v) NaN 3. זה יכול להיות מאוחסן בטמפרטורת חדר ומשמש לכמה מבחני. הכן מלאי 5 מ"מ ATP מייד לפני השימוש ולשמור על קרח. (נ.ב. השתמש Na 2 ATP כדי למנוע אות רקע מוגזמת מפוספט בassay). הכן את פתרון SDS העצירה (12% (w / v) SDS ב DDH 2 O).
- לגילוי Chifflet להכין חיץ (3% (w/ V ascorbate), 0.5% (w / v) molybdate אמוניום, 0.5 M HCl) מייד לפני השימוש וחיץ B (2% (w / v) ציטרט הנתרן, 2% (w / v) meta-arsenite נתרן, 2% (V / V) חומצה אצטית).
2. בידוד של Microsomes שמרים
- ס cerevisiae להביע CFTR עוף גדלים כפי שמתואר באררייאן et al. (2012) 14. אחסן את החומר מתסיסת L 20 בשני aliquots ב-80 מעלות צלזיוס למשך עד 6 חודשים.
- להפשיר aliquot אחד מתאים במהירות וresuspend ב 3 מיליליטר mPIB המצונן לגרם של תאים.
- לשבש את התאים בטחנת חרוז באמצעות חרוזי זכוכית של 425-600 קוטר מיקרומטר. השתמש בחמש דקות 1 תקופות של שיבוש תא מופרדות על ידי תקופות מנוחת 1 דקות. (תקופות המנוחה הן חיוניות כדי להבטיח כי התאים אינם מחוממים במהלך הפרעה.)
- לפקח על הפרעה תא על ידי צנטריפוגה של מדגם 1 מיליליטר של lysate התא מן טחנת חרוז. צנטריפוגה (12,000 XG, 4 ° C, 5 דקות) בcentr גבי ספסלifuge. לדלל את supernatant ל01:50 עם mPIB בקובט ולמדוד את 380. אם 380> 0.1, או הפסיק הגדלת למרות כמה מחזורי חרוז-מכות חוזרות ונשנות, להמשיך לשלב הבא. אם לא, תחזרו על 2.3-2.4.
- צנטריפוגה lysate התא הכולל (12,000 x גרם, 4 ° C, 20 דקות). שמור את supernatant. זורק את הכדור (המכיל תאים ומיטוכונדריה רצופים), אבל אם יש לו ספקות לגבי היעילות של שבירת תא (ראה 2.4), ואז לשמור גם גלולה.
- צנטריפוגה supernatant מהשלב הקודם (200,000 XG, 4 ° C, 1.5 שעות). בטל supernatant ו resuspend קרומי microsomal pelleted במאגר CFTR. אם microsomes מיועד לטיהור באמצעות DDM, להשלים את חיץ CFTR עם 1 M NaCl.
- חזור על צנטריפוגה של שבריר קרום resuspended (100,000 x גרם, 4 ° C, 1 שעות) וזורקים supernatant.
- Resuspend microsomes pelleted בהיקף מינימאלי של חיץ CFTR (נפח סופי 5-15 מיליליטר, חלבון microsomal סך 70-200 מ"ג). Assay ברדפורד ניתן להשתמש כדי לקבוע את הריכוז הכולל של חלבוני microsomal 25. בנוסף ספקטרום פליטת הקרינה של הקרומים יש למדוד (עירור = 485 ננומטר, פליטה = 500-600 ננומטר) וצריך להיות שיא מובחן GFP פלואורסצנטי (מקסימום ב512 ננומטר). CFTR יכול להיות מזוהה באופן ספציפי על ג'ל SDS-PAGE, נסרק בתנאי הקרינה ה-GFP (איור 1).
- Flash-להקפיא microsomes resuspended ידי צולל לתוך חנקן נוזלי ולאחסן ב -80 מעלות צלזיוס, או להמשיך לשלב 3.
3. Solubilization של Microsomes
- אם קפוא, להפשיר microsomes מייד לפני השימוש באמבט מים מוגדר 10 ° C.
- לsolubilization של ממברנות, לדלל את microsomes עם נפח שווה של החיץ הרלוונטי solubilization (שלב 1.3) לתת ריכוז חומר ניקוי סופי של2% (w / v) וריכוז 5 מ"ג / מיליליטר חלבון microsomal. דגירה את התערובת לשעה 1 ב4 ° C עם תסיסה (מסובב צינור). שמור 200 μl לניתוח.
- צנטריפוגה את התערובת (XG 100,000, 4 ° C, 45 דקות). הסר את supernatant המכיל החלבונים בממברנה solubilized, להעביר אותו דרך מסנן מזרק 0.45 מיקרומטר ולאחסן על קרח. למדוד את הקרינה של supernatant (כמו בשלב 2.8).
- Resuspend שבריר מסיס ב1% (w / v) פתרון SDS לנפח שווה לחלק מסיס. למדוד את הקרינה בחלק זה ולשמור aliquot של 50 μl לניתוח SDS-PAGE.
4. טיהור ניקל זיקה של CFTR
- עמודות שני sepharose ניקל 5 מיליליטר הקישור בסדרה. לשטוף עם 2 כרכי עמודה (CV) 20% אתנול (V / V), ואחרי 2 קורות חיים DDH 2 O, ולאחר מכן לשטוף את העמודה עם 2 קורות חיים של חיץ solubilization (שלב 1.4-1.5), המכיל imidazole ז 1. חזור על פעולה עם 2 קורות חיים של solubilizatיון החיץ חסר imidazole.
- הוספת imidazole לריכוז סופי של 5 מ"מ לחומר solubilized (שלב 2.8) ולטעון את החומר באופן ידני על הטור או לתוך לולאת מדגם אם באמצעות מכשיר כרומטוגרפיה נוזלי אוטומטית.
- טען את חומרי solubilized על הטור בקצב זרימה של 0.5 מיליליטר / דקה, ולשטוף עם 2 קורות חיים של חיץ חסר-imidazole באותו קצב הזרימה להסרת חומר מאוגד. איסוף שברים ב50 צינורות מיליליטר פלקון.
- לכביסה הראשונה, השתמש 3 קורות חיים של חיץ טיהור עם imidazole 40 מ"מ בקצב זרימה של 1 מיליליטר / דקה. לאסוף 2 מיליליטר שברים.
- עבור לשטוף את השני, להשתמש 3 קורות חיים של חיץ טיהור עם imidazole 100 מ"מ. לאסוף 2 מיליליטר שברים.
- Elute CFTR מעמודת HisTrap עם 3 קורות חיים של חיץ טיהור עם imidazole 400 מ"מ. לאסוף 2 מיליליטר שברים.
- לפקח על הקרינה שבברי eluted (שלב 2.8).
- שמור aliquots של שברים שיא לניתוח SDS-PAGE. ו שיא שנותר הקפאת פלאשדגימות raction ולאחסן ב -80 מעלות צלזיוס, או להמשיך לשלב הטיהור הבא.
5. ג'ל חלחול כרומטוגרפיה טיהור (GPC) של CFTR
- לאזן את העמודה (Superose 6 10/300 GL) עם 1.2 קורות חיים DDH 2 O ואחריו 1.2 חיץ קורות החיים GPC.
- במהלך שלב 5.1, לרכז את השברים המטוהרים Ni-הזיקה לקרינת ה-GFP הגבוהה ביותר באמצעות מסנן צנטריפוגלי 100,000 MWCO ב 4 ° C. אם טיהור בDDM, להימנע מריכוז המדגם מעל ריכוז חלבון של 0.3 מ"ג / מיליליטר חלבון כמו זה יגרום לאובדן מדגם משמעותי. הסר את retentate מהרכז ו צנטריפוגות ב 100,000 x גרם במשך 30 דקות ב 4 ° C עד גלולה חלקיקים גדולים.
- הזרק מדגם זה על הטור וelute עם שיפוע isocratic של 1.2 חיץ קורות החיים GPC. לאסוף 0.5 מיליליטר שברים.
- למדוד הקרינה ה-GFP כאמור בסעיף 2.8 לזהות את אותם שברים המכילים CFTR. לשמור על נפח קטן (לדוגמא: </ Em> 50 μl) של כל אחד לניתוח על ידי-SDS.
- להקפיא את השברים בחנקן נוזלים חנות ב -80 ° C.
6. כינונה מחדש של CFTR
- הוספת שומנים (שלב 1.8) לCFTR המטוהרים ב100:1 שומנים בדם לחלבון יחס (w / w) ודגירה על 4 מעלות צלזיוס במשך שעה 1. כמו כן הקים שליטת שומנים בדם בלבד, החלפת החלבון מטוהר עם אותו הנפח של חיץ GPC.
- הסר את חומרי ניקוי מתערובת חלבונים / שומנים בדם באמצעות חרוזים כושר ספיגה הידרופובי. לשטוף חרוזים בעלי כושר ספיגה ב5 קורות חיים DDH 2 O, 5 קורות חיים 70% (v / v) אתנול, 5 קורות החיים DDH 2 O, ו -5 חיץ קורות החיים GPC חסר חומרי הניקוי. הוסף 200 מ"ג של חרוזים כושר ספיגה שטפו לכל מיליליטר של חלבון מטוהר ודגירה על 4 מעלות צלזיוס לילה עם תסיסה עדינה.
- לאסוף את דגימת הכינון מחדש מחרוזי כושר ספיגה לתוך צינור טרי באמצעות פיפטה קצה דק הסתיים.
7. מדידה של פעילות ATPase
- לקבוע את שיעור CFTפעילות ATPase R הספציפי באמצעות assay Chifflet הותאם 26,27 בפורמט צלחת 96 היטב. עם פתרון מניות פוספט נתרן (0.65 מ"מ) להכין 0-20 פוספט nmol בנפח סופי של μl 50 כסטנדרטים. השתמש בתערובת 1:1 של חיץ CFTR וחיץ ATPase כדי לדלל את מניות פוספט.
- דגירה שני CFTR מחדש ויפוזומים ריקים עם 1:100 (V / V) מעכבי ATPase (שלב 1.9) על קרח דק 10. השתמש בלפחות 5 מיקרוגרם של CFTR מחדש.
- הוספת ATP (שלב 1.9) לריכוז סופי של 2 מ"מ ולדגור על 25 מעלות צלזיוס במשך שעה 1. עצור את התגובה על ידי הוספת 40 μl של 10% (w / v) SDS (שלב 1.9) זה טוב (בכלל זה, הסטנדרטים).
- הוספה של חיץ 100 μl (שלב 1.10) ו דגירה עבור 10 דקות. הוספת 100 חיץ μl B (1.10) זה טוב ומדוד את הספיגה באורך גל של 800 ננומטר בUV / VIS ספקטרופוטומטר צלחת תואמת 96 היטב.
- המרת הספיגה ב 800 ננומטר לכמות של פוספט המשוחרר באמצעותסטנדרטים פוספט. חישוב שיעור הידרוליזה ATP לאחר הפחתת אות רקע (ליפוזום בלבד בארות).
- לCFTR הלא מחדש בצע את אותו הפרוטוקול באמצעות חיץ CFTR לקריאה הרקע.
תוצאות
הפרוטוקול שתואר לעיל הוא אמצעי יעיל לבודד microsomes מועשר CFTR, עם התאוששות של CFTR כמעט מוחלטת במהלך שבירת התא והכנת microsomes הגולמי (איור 1). שיטות שבירת תא אחרות גם יכולות להיות מועסקות בצורה יעילה. יש לנו מנוצלים תא לחץ צרפתי, והתקני high-pressure/cavitation אחרים (גם בשילוב עם להשפיע נגד יעד אודם) עם יעילות שווה. לנוחות ועלות הראשונית נמוכה של הציוד, אנו מוצאים את שיטת חרוז ההכאה את הטוב ביותר.
שימוש בגפ"מ לsolubilize ולטהר CFTR הניב 80 תרבות חלבון מיקרוגרם / ליטר ב> טוהר 90% (איור 2). התשואה הגבוהה נובעת solubilization יעיל של CFTR על ידי גפ"מ (השווה איור 2b, מסלולים 2 ו -4). בנוסף, יעיל והדוק מחייב לעמודה הביאו להפסד המינימלי של CFTR בשבריר מאוגד וההיעדרות של CFTR בשברים לשטוף (איור 2, נתיבי 3, 5, ו6). היה חלבון eluted טוהר> 90%, שהוערך על ידי ג'לים SDS-PAGE צבעוני Coomassie ובאמצעות צפיפות של CFTR ולהקות מזהמים. כרומטוגרפיה חלחול ג'ל (GPC) מופרדת CFTR-מטוהר גפ"מ ממזהמים במשקל מולקולרי נמוכים (איור 4, פנל תחתון).
הפרוטוקול לטיהור CFTR באמצעות DDM נותן טוהר% והתשואה של בערך 50 מיקרוגרם / ליטר (איור 3) על 60. במיקרוסקופ אלקטרונים (EM) של שברים צבעוניים שלילי מGPC משחררי בכ -10 מיליליטר (איור 4) הראה כי CFTR מטוהר-DDM מכיל אגרגטים של 20-30 ננומטר בקוטר, כמו גם חלקיקים קטנים בקוטר של 10 ננומטר (מידע לא מוצג). יתכן כי אגרגטים הקטנים הפיך יכולים לקשר ולנתק כאולטרה סינון עם מסנן חתוכים 1 מד"א לא הצליחו להסיר את אגרגטים EM-לזיהוי. חומר מטוהר גפ"מ לא לספוג לרשת-שוחרר זוהר, ומכאן נחקר על ידי cryo-EM של שברים ללא רבב. זה הראהאוכלוסיית חלקיקים מאוד הומוגנית בגודל קטן יחסית (6-8 ננומטר קוטר, מידע לא מוצג).
לבסוף, פעילות ATPase של החלבונים המטוהרים נמדדה (איור 5). כבן למשפחת חלבוני ABC, יש CFTR שני התחומים מחייב נוקלאוטיד (NBDs) מסוגל מחייב ו / או hydrolyzing ה-ATP. הנתונים מצביעים על כך שהחלבון מטוהר לא היה מסוגל hydrolyze ה-ATP במדינת גפ"מ-solubilized והראה פעילות ATPase חלשה בנוכחות DDM (איור 5, בארים ללא מילוי). לאחר התוספת של שומנים, והסרת חומרי ניקוי, פעילות ATPase הייתה פי 4 גבוהה יותר עבור דגימות שטוהרו בDDM (13 nmol ATP / דקות / חלבון מ"ג). התוספת של שומנים וסילוק של פעילות שוחזרה באופן דומה לגפ"מ CFTR שהיה מבודד באמצעות גפ"מ, אך עם שיעור סופי נמוך יותר (1.5 nmol ATP / דקות / חלבון מ"ג) מאשר החומר DDM-מטוהר ומחדש.
"/ files/ftp_upload/51447/51447fig1highres.jpg" = "/ files/ftp_upload/51447/51447fig1.jpg" src
איור 1. רמות ניטור של CFTR העוף בlysate תא (CL), supernatants (S) וכדורים (P) במהלך שלבי צנטריפוגה שונים המשמשים לבידוד גופיפון וכביסה. ג'לי-SDS היו דמיינו באמצעות הקרינה בג'ל של ה-GFP תג. Supernatant לאחר שבירת התא וצנטריפוגה ב14,000 XG מכיל כמעט את כל CFTR (כולל מוצרים פגומים). Ultracentrifugation ב200,000 משקעי XG כל CFTR באורך מלא, והשאירו כמה שברים בsupernatant. Ultracentrifugation ב100,000 XG של כדורי microsomes-שטף מלח כמעט כל CFTR עם ההסרה של כמה שברים נוספים.
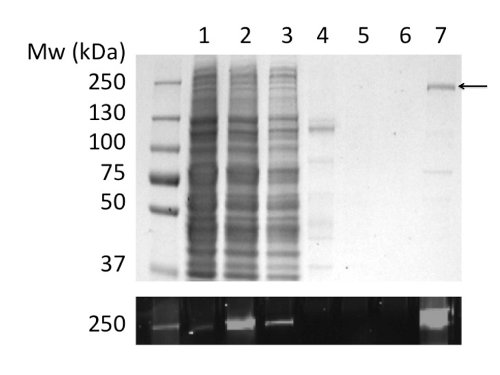
איור 2. טיהור של CFTR העוף בגפ"מ על ידי כרומטוגרפיה זיקת יון מתכת משותקת. שברים נותחו על ידי SDS-PAGE ואחריו מכתים Coomassie (פנל עליון) וגילוי הקרינה של תג ה-GFP (פנל תחתון). שירים: (1) Microsomes. (2) microsomes-solubilized גפ"מ. (3) חומר לא כרוך. (4) חומר בלתי מסיס. (5) (6) 40 ו100 שוטף imidazole מ"מ. (7) חומר eluted עם 400 imidazole מ"מ.
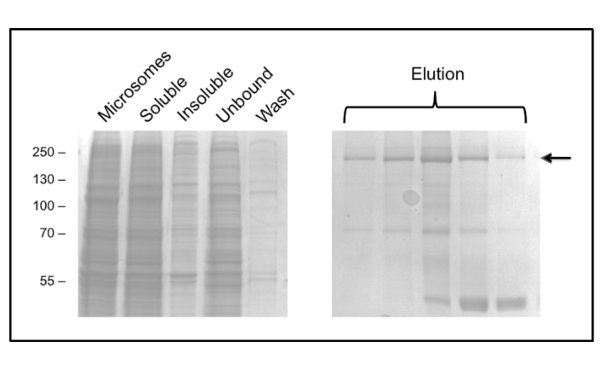
איור 3. טיהור של CFTR העוף בDDM ידי כרומטוגרפיה זיקת יון מתכת משותקת. שברים נותחו על ידי SDS-PAGE ואחריו מכתים Coomassie. יד הלוח השמאלית מציג שברים לפני elution. כמה שברים elution רצופים מוצגים בלוח היד תקין עם CFTR בdicated על ידי החץ. מאוחר יותר שברים מועשרים במזהם kDa 40, אשר זוהה על ידי ספקטרומטריית מסה כחלבון ריבוזומלי L3.
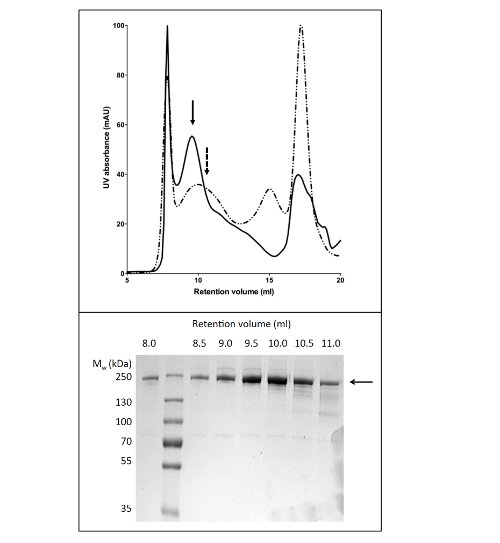
איור 4. טיהור של CFTR עוף ידי כרומטוגרפיה חלחול ג. CFTR מטוהר על ידי כרומטוגרפיה Ni-זיקה הייתה מרוכז ויחול על עמודת GPC. פרופיל elution לCFTR (פנל עליון) מטוהר במאגר המכיל גפ"מ-14 (קו מוצק) או DDM (קו מקווקו) הם מעולף. SDS-PAGE (פנל תחתון) גילה כי CFTR eluted בין 8 ל 11 מיליליטר.
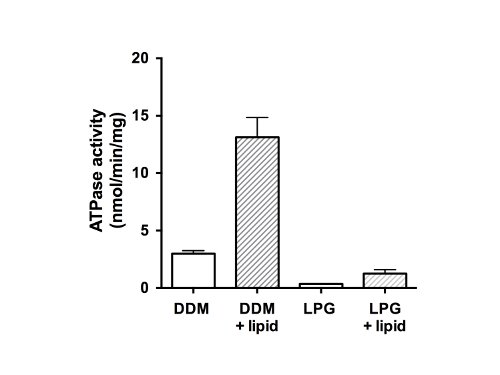
איור 5. Activit ATPasey של שברים CFTR העוף מטוהרים. החלבון מטוהר בDDM או גפ"מ היה assayed באמצעות assay Chifflet הותאם 26 בנוכחות קוקטייל של מעכבי ATPase לחסל כל פעילות ATPase רקע מF-, P-וATPases V-הסוג (ברים ללא מילוי ). שיעור הידרוליזה ATP נמדד גם לאחר הסרת חומר ניקוי ובנוסף שומנים בדם (בארים מלאים). העלילה מציגה את הסטייה הממוצעת וסטנדרטית (n = 3). הבדלים בין ערכים הממוצעים לפעילות ATPase בנוכחות והיעדרות של שומנים בדם, והבדל בין הפעילות בDDM וגפ הם משמעותיים לp <0.05.
Discussion
שתארנו בעבר שיטה לביטוי היתר של CFTR העכברי 14. מאז פרסום כי הפרוטוקול, שהבענו וטהר כמה orthologs שונה של CFTR באמצעות אותה המערכת. כל orthologs נבדק עד כה מטוהר היטב בחומר ניקוי גפ"מ, תוך טיהור DDM הראתה יותר וריאציה על פני orthologs שונה (מידע לא מוצג). גמישות זו ממחישה את עוצמתו של שמרי הגישה: זה אפשרי למסך מבנים רבים במהירות היחסית כדי לבחור באחת למטרה מסוימת.
שטיפת השמרים microsomes עם מאגר המכיל 1 M NaCl לפני solubilization עם תוצאות DDM בהכנת גופיפון נקיה יותר ומפחית את המזהמים בשלבים מאוחר יותר. שלב זה הוא מיותר בפרוטוקול גפ"מ כמדגם CFTR הסופי הוא> 90% טהור בלי לשטוף גופיפון. יתר על כן, טיהור בDDM דורשת מספר שינויים במאגרים לsolubilizationטיהור nd, כלומר התוספת של גליצרול ומלח נוספים. יחד, תוספות אלה הגדילו באופן משמעותי מחייבות של חלבון DDM-solubilized לעמודה.
יש מתודולוגיה טיהור DDM היקף לשיפור, בפרט הסרת מזהמים עיקריים 40 kDa ש, נשפטו על ידי ספקטרומטריית מסה, בשל מקטע השמרים ריבוזומלי L3, אשר נראה כי יש זיקה מהותית לשרף ניקל. אין רצף polyHis ברור בחלבון L3, אך בחינה של מבנה 3D שלה כאשר חייב הריבוזום (PDB = 1FFK) מראה כי יש לו את מקטע L3 המקופל אשכול polyHis פוטנציאלי. שהלהקה הזו היא פחות בעייתית בחומר מטוהר גפ"מ יכול להיות בגלל חומרי ניקוי גפ"מ יותר קשה.
למרות הטיהור בDDM נראית עני יותר מזה בגפ"מ, חומרי ניקוי מתונים יותר כגון DDM עשוי להיות תואמים יותר עם ניתוחים תפקודיים ומבניים וכבר השתמשו בכמה crystall רנטגןמחקרי ographic של חלבונים בממברנה 15-21. יתר על כן, התוצאות שלנו מצביעות על כך שהשימוש בגפ"מ מוביל לאובדן של תפקוד ATPase בביחס CFTR לטיהור בDDM. מכאן אנו ממליצים על פרוטוקול הטיהור מבוסס גפ"מ עבור הדור של CFTR בי טוהר הוא קריטי, למשל ביישומים כגון אפיון לאחר translational שינויים, או בדור של נוגדנים, הפרוטוקול מבוסס גפ"מ ייבחר . מצד השני ביישומים שבם הפעילות והמצב טבעי לחלוטין של החלבון חיוני, היינו מציע מבוסס פרוטוקול DDM כאפשרות טובה יותר.
לסיכום, פרוטוקול זה מתאר שיטה לשחזור לבידוד של CFTR בDDM גפ"מ-14 או חומר הניקוי שאינו היוני חומר ניקוי zwitterionic. ככזו, היא מצביעה על טווח רחב יותר של תנאים לטיהור CFTR מאשר דווחו בעבר 10-13. במיליגרם בנוסף כמויות של CFTR מטוהר יכולות להיותשהושג באמצעות נהלים אלה בשילוב עם מערכת שמרי צמיחה בנפח גבוה, כגון מערכת קצירת תא קיבולת גבוהה כמו הרוטור צנטריפוגה במהירות נמוכה 6 L פרמנטור ו20 L. יש CFTR השיג תג ה-GFP cleavable המאפשר ניטור קל של החלבון במבחני ביוכימיים וbiophysical שונים.
ניתן להשיג מגיב שתואר בכתב היד הזה (פלסמיד המכיל CFTR עוף או תאי שמרים קפוא) באמצעות קרן סיסטיק פיברוזיס (ארה"ב).
Disclosures
יש המחברים אין אינטרסים כלכליים מתחרים ולא אינטרסים נוגדים אחרים ביחס לעבודה זו.
Acknowledgements
עבודה זו מומנה על ידי הקרן האמריקנית סיסטיק פיברוזיס (CFF) באמצעות קונסורציום מבנה CFTR 3D שלה. TR מומן על ידי מלגת לימודים בבריטניה CF אמון, וצפון קרוליינה על ידי מלגת לימודים בבריטניה BBSRC. אנו מכירים עמיתינו בקונסורציום מבנה CFF CFTR 3D לעזרת והעצה ועל העיצוב של תגי רצף CFTR עוף וטיהור מותאמים קודון.
Materials
| Name | Company | Catalog Number | Comments |
| 0.2 μm syringe filter | Sartorius | FC121 | |
| 100 kDa MWCO centrifugal concentrator (PES membrane) | Vivaspin | VS0641 | |
| 2 ml microfuge tubes | Sarstedt | 72.695 | |
| 40Ti rotor | Beckman Coulter | 337901 | |
| 50 ml sterile Falcon tubes | Sarstedt | 62.547.254 | |
| Adenosine triphosphate disodium salt (Na2ATP) | Sigma-Aldrich | A26209 | |
| Liquid chromatography system | GE Healthcare | 28-4062-64 | |
| Aminoethylbenzenesulfonyl fluoride (AEBSF) | Sigma-Aldrich | A8456 | |
| Glass bead-beating cell disrupter | BioSpec | 1107900 | |
| Benchtop centrifuge | HERMLE | Z300 | |
| Benchtop centrifuge | Eppendorf | 5417R | |
| Benchtop microfuge | Fisher | 13-100-511 | |
| Benzamidine hydrochloride | Sigma-Aldrich | 434760 | |
| Hydrophobic Beads SM-2 Adsorbent | BioRad | 152-3920 | |
| Bromophenol blue | Sigma-Aldrich | 114391 | |
| Centrifuge tubes | Beckman Coulter | 357000 | |
| Gel imaging system | BioRad | 170-808 | |
| Cholesterol | Sigma-Aldrich | C8667 | |
| Chymostatin | Sigma-Aldrich | C7268 | |
| Dimethylsulfoxide (DMSO) | Sigma-Aldrich | D8418 | |
| Dithiothreitol (DTT) | Sigma-Aldrich | 43815 | |
| E. coli total lipid extract | Avanti lipids | 100500 | |
| Epoxysuccinyl-leucylamido-butane (E-64) | Sigma-Aldrich | E3132 | |
| Glass beads, acid washed | Sigma | G8772 | |
| Glycerol | Fisher | 65017 | |
| HisTrap HP columns (5 ml) | GE Healthcare | 17-5247-05 | |
| Rapid Coomassie Stain | Novexin | ISB1L | |
| Centrifuge JA-17 rotor | Beckman Coulter | 369691 | |
| Leupeptin | Merck | 108975 | |
| Lyso-phosphatidyl glycerol-14 (LPG) | Avanti lipids | 858120 | |
| MgSO4 | Sigma-Aldrich | M7506 | |
| Gel tank SDS-PAGE system | BioRad | 165-8006 | |
| n-Dodecyl-β-D-maltopyranoside (DDM) | Affymetrix | D310S | |
| NaCl | Sigma-Aldrich | S6191 | |
| NaN3 | Sigma-Aldrich | S2002 | |
| NH4Cl | Sigma-Aldrich | A9434 | |
| Oligomycin | Sigma-Aldrich | 75351 | |
| Ultracentrifuge | Beckman Coulter | 392050 | |
| Prestained protein standards | Fermentas | SM1811 | |
| Desalting columns (Sephadex G-25) | GE Healthcare | 17-0851-01 | |
| Pepstatin A | Sigma-Aldrich | P4265 | |
| Phenylmethanesulfonylfluoride (PMSF) | Sigma-Aldrich | P7626 | |
| SCH28080 | Sigma-Aldrich | S4443 | |
| Sodium dodecyl sulfate (SDS) | Sigma-Aldrich | L37771 | |
| Sodium thiocyanate (NaSCN) | Sigma-Aldrich | 251410 | |
| Gel filtration 10/300 GL column | GE Healthcare | 17-5172-01 | |
| Tris-base | Formedium | TRIS01 | |
| Ultracentrifuge tubes | Beckman Coulter | 355618 | |
| Vortex mixer | Star Labs | N2400-0001 | |
| Ultrasonic water bath | Ultrawave | F0002202 | |
| Multimode plate reader | BioTek | BTH1MF |
References
- Aleksandrov, A. A., Aleksandrov, L. A., Riordan, J. R. CFTR (ABCC7) is a hydrolyzable-ligand-gated channel. Pflugers Arch. 453, 693-702 (2007).
- Dodge, J. A., Lewis, P. A., Stanton, M., Wilsher, J. Cystic fibrosis mortality and survival in the UK: 1947-2003. EUR RESPIR J. 29, 522-526 (2007).
- O'Sullivan, B. P., Freedman, S. D. Cystic fibrosis. Lancet. 373, 1891-1904 (2009).
- Rommens, J. M., et al. Identification of the cystic fibrosis gene: chromosome walking and jumping. Science. 245, 1059-1065 (1989).
- Kariya, C., et al. A role for CFTR in the elevation of glutathione levels in the lung by oral glutathione administration. Am J Physiol Lung Cell Mol Physiol. 292, (2007).
- Gould, N. S., Min, E., Martin, R. J., Day, B. J. CFTR is the primary known apical glutathione transporter involved in cigarette smoke-induced adaptive responses in the lung. Free Radic Biol Med. 52, 1201-1206 (2012).
- Childers, M., Eckel, G., Himmel, A., Caldwell, J. A new model of cystic fibrosis pathology: lack of transport of glutathione and its thiocyanate conjugates. Med Hypotheses. 68, 101-112 (2007).
- Cole, S. P., et al. Overexpression of a transporter gene in a multidrug-resistant human lung cancer cell line. Science. 258, 1650-1654 (1992).
- Conseil, G., Deeley, R. G., Cole, S. P. Polymorphisms of MRP1 (ABCC1) and related ATP-dependent drug transporters. Pharmacogenet Genomics. 15, 523-533 (2005).
- Ketchum, C. J., Rajendrakumar, G. V., Maloney, P. C. Characterization of the adenosinetriphosphatase and transport activities of purified cystic fibrosis transmembrane conductance regulator. Biochemistry. 43, 1045-1053 (2004).
- Ramjeesingh, M., et al. A novel procedure for the efficient purification of the cystic fibrosis transmembrane conductance regulator (CFTR). Biochem J. 327 (Pt 1), 17-21 (1997).
- Huang, P., Liu, Q., Scarborough, G. A. Lysophosphatidylglycerol: a novel effective detergent for solubilizing and purifying the cystic fibrosis transmembrane conductance regulator. Anal Biochem. 259, 89-97 (1998).
- Rosenberg, M. F., Kamis, A. B., Aleksandrov, L. A., Ford, R. C., Riordan, J. R. Purification and crystallization of the cystic fibrosis transmembrane conductance regulator (CFTR). J Biol Chem. 279, 39051-39057 (2004).
- O'Ryan, L., Rimington, T., Cant, N., Ford, R. C. Expression and purification of the cystic fibrosis transmembrane conductance regulator protein in Saccharomyces cerevisiae. J Vis Exp. , (2012).
- Oldham, M. L., Chen, J. Snapshots of the maltose transporter during ATP hydrolysis. Proc Natl Acad Sci USA. 108, 15152-15156 (2011).
- Pinkett, H. W., Lee, A. T., Lum, P., Locher, K. P., Rees, D. C. An inward-facing conformation of a putative metal-chelate-type ABC transporter. Science. 315, 373-377 (2007).
- Dawson, R. J. P., Locher, K. P. Structure of a bacterial multidrug ABC transporter. Nature. 443, 180-185 (2006).
- Gerber, S., Comellas-Bigler, M., Goetz, B. A., Locher, K. P. Structural basis of trans-inhibition in a molybdate/tungstate ABC transporter. Science. 321, 246-250 (2008).
- Ward, A., Reyes, C. L., Yu, J., Roth, C. B., Chang, G. Flexibility in the ABC transporter MsbA: Alternating access with a twist. Proc Natl Acad Sci USA. 104, 19005-19010 (2007).
- Kadaba, N. S., Kaiser, J. T., Johnson, E., Lee, A., Rees, D. C. The high-affinity E. coli methionine ABC transporter: structure and allosteric regulation. Science. 321, 250-253 (2008).
- Aller, S. G., et al. Structure of P-Glycoprotein Reveals a Molecular Basis for Poly-Specific Drug Binding. Science. 323, 1718-1722 (2009).
- Koehler, J., et al. Lysophospholipid micelles sustain the stability and catalytic activity of diacylglycerol kinase in the absence of lipids. Biochemistry. 49, 7089-7099 (2010).
- Tian, C., et al. Preparation, functional characterization, and NMR studies of human KCNE1, a voltage-gated potassium channel accessory subunit associated with deafness and long QT syndrome. Biochemistry. 46, 11459-11472 (2007).
- Huang, P., Liu, Q., Scarborough, G. A. Lysophosphatidylglycerol: a novel effective detergent for solubilizing and purifying the cystic fibrosis transmembrane conductance regulator. Anal Biochem. 259, 89-97 (1998).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem. 72, 248-254 (1976).
- Chifflet, S., Torriglia, A., Chiesa, R., Tolosa, S. A method for the determination of inorganic phosphate in the presence of labile organic phosphate and high concentrations of protein: Application to lens ATPases. Analytical Biochemistry. 168, 1-4 (1988).
- Rothnie, A., et al. The importance of cholesterol in maintenance of P-glycoprotein activity and its membrane perturbing influence. Eur Biophys J. 30, 430-442 (2001).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved