Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Desarrollo de sulfidogénicos lodos de sedimentos marinos y tricloroetileno Reducción en un reactor anaerobio de flujo ascendente Manta lodos
En este artículo
Resumen
Microbial sulfate reduction is a process of great importance in environmental biotechnology. The success of the sulfidogenic reactors depends among other factors on the microbial composition of the sludge. Here, we present a protocol to develop sulfidogenic sludge from hydrothermal vents sediments in a UASB reactor for reductive dechlorination purposes.
Resumen
The importance of microbial sulfate reduction relies on the various applications that it offers in environmental biotechnology. Engineered sulfate reduction is used in industrial wastewater treatment to remove large concentrations of sulfate along with the chemical oxygen demand (COD) and heavy metals. The most common approach to the process is with anaerobic bioreactors in which sulfidogenic sludge is obtained through adaptation of predominantly methanogenic granular sludge to sulfidogenesis. This process may take a long time and does not always eliminate the competition for substrate due to the presence of methanogens in the sludge. In this work, we propose a novel approach to obtain sulfidogenic sludge in which hydrothermal vents sediments are the original source of microorganisms. The microbial community developed in the presence of sulfate and volatile fatty acids is wide enough to sustain sulfate reduction over a long period of time without exhibiting inhibition due to sulfide.
This protocol describes the procedure to generate the sludge from the sediments in an upflow anaerobic sludge blanket (UASB) type of reactor. Furthermore, the protocol presents the procedure to demonstrate the capability of the sludge to remove by reductive dechlorination a model of a highly toxic organic pollutant such as trichloroethylene (TCE). The protocol is divided in three stages: (1) the formation of the sludge and the determination of its sulfate reducing activity in the UASB, (2) the experiment to remove the TCE by the sludge, and (3) the identification of microorganisms in the sludge after the TCE reduction. Although in this case the sediments were taken from a site located in Mexico, the generation of a sulfidogenic sludge by using this procedure may work if a different source of sediments is taken since marine sediments are a natural pool of microorganisms that may be enriched in sulfate reducing bacteria.
Introducción
Una de las contribuciones más importantes a la biotecnología ambiental fue el diseño de biorreactores en los que el lodo utilizado (inóculo) era capaz de realizar en condiciones reductoras de sulfato. La reducción de sulfato (SR) permite el tratamiento de corrientes de aguas residuales que contienen altas concentraciones de sulfato en adición a la eliminación simultánea de DQO, metales pesados y contaminantes orgánicos, un hecho que hace SR una característica deseable de los lodos 1. Algunos ejemplos de los efluentes contaminados con sulfato provienen de industrias de curtiduría, papel, farmacéutica y de fabricación de productos químicos 1. Sin embargo, la mayor parte de la literatura se refiere a sulfidogénicos lodos cuando lodo granular metanogénica se ha adaptado a sulfidogenesis 2. Esta adaptación se logra comúnmente mediante la manipulación de la DQO / SO 4 2- relación en el biorreactor y la adición de productos químicos para inhibir metanógenos en el 2,3 lodos. Además del largo tiempo de que may requerir la formación de los gránulos sulfidogénicos, la competencia entre los metanógenos y reductores de sulfato y la tolerancia de los lodos a altas concentraciones de sulfuro son algunos de los principales problemas que pueden surgir si el lodo sulfidogénicos utilizado en el biorreactor se obtiene de la adaptación de predominantemente lodos metanogénica al sulfato reductoras. En este trabajo, se describe el procedimiento para obtener un lodo predominantemente sulfidogénicos de respiraderos hidrotermales sedimentos (Punta Mita, Nayarit, México) en un reactor de manto de lodo anaerobio de flujo ascendente (UASB), a continuación, evaluamos su sulfato reducción de la actividad en el tiempo y llevamos a cabo un experimento para evaluar su aplicación en la decloración reductiva. Se eligió La ubicación de los sedimentos ya que se ha informado de que en ese sitio hay formación de sulfuros debido a la actividad exhibida por la reducción de sulfato de la comunidad microbiana que habitan en ese particular lugar 4.
Hay severAL ventajas en la obtención de este lodo sulfidogénicos de los sedimentos sobre la adaptación de lodo granular metanogénica a sulfidogenesis. Algunas de estas ventajas son: (1) no es necesario para formar gránulos para el biorreactor de operar, (2) el lodo tolera concentraciones relativamente altas de sulfuro de comparación con otros UASB que operan con lodos metanogénica adaptado, y (3) no se no hay competencia por el sustrato con metanógenos incluso si acetato se utiliza en la mezcla de ácidos grasos volátiles que se incluye en el medio de cultivo para promover la formación de los lodos.
Este procedimiento se siguió para promover sulfidogenesis debido a los sedimentos marinos son una piscina natural de una amplia variedad de microorganismos, tales como sulfato de reducción de las bacterias, fermentación de bacterias y deshalogenar bacterias sólo para mencionar algunos 5,6. El tipo de consorcio desarrollado a partir de sedimentos marinos mediante el uso de este protocolo puede exhibir la eficiencia en la reducción de sulfato y, por lo tanto, altas s ulfate la reducción de actividad con el tiempo y una mayor tolerancia a sulfuro en concentraciones más altas que el reportado como tóxico para los metanógenos y bacterias reductoras de sulfato. Por otra parte, es probable que la capacidad de deshalogenante también se muestra en los sedimentos, siguiendo el protocolo propuesto aquí, pero puede depender de la comunidad microbiana inicial. Esta suposición se hace con base en el hecho de que la decloración reductiva puede ocurrir ya sea por la respiración o cometabolismo, dos condiciones que pueden ser promovidas en la comunidad microbiana marina 7. El cultivo de los sedimentos para obtener el lodo se llevó a cabo mediante el uso de una mezcla de acetato, propionato y butirato como sustrato debido a que estos ácidos grasos volátiles son utilizados por varias cepas de bacterias reductoras de sulfato. Estos ácidos son también el tipo de compuestos de carbono que se encuentran con frecuencia en los sedimentos marinos, según varios reportes en la literatura sobre el material carbonoso en los sedimentos marinos 5,6.
contenido "> Por último, algunos de los compuestos más tóxicos que se encuentran en masas de agua subterránea y otra de agua en todo el mundo estan los disolventes clorados como el tricloroetileno (TCE) o percloroetileno (PCE). Estos compuestos son tóxicos, no sólo para el ser humano, pero también a los microorganismos, particularmente TCE, que todavía se considera un contaminante prioritario por la Agencia de Protección Ambiental de los EE.UU. 8. En este trabajo se propone un experimento en el que el lodo sulfidogénicos se prueba en su capacidad de reducir el TCE en concentraciones que están en el rango reportado para compuestos clorados biodegradación en condiciones metanogénicas 9,10. Vale la pena mencionar que la mayor parte de la investigación sobre la biodegradación de compuestos clorados se ha realizado en condiciones metanogénicas 9,10. Consideramos que el experimento con TCE se propone en este protocolo es un buen ejemplo de las posibles aplicaciones de los lodos. El objetivo de este experimento fue al correovalorar la tolerancia de los lodos a la TCE y el efecto TCE en el sulfato de reducción de la actividad. Teniendo en cuenta que la mayor parte de la investigación sobre la biodegradación de compuestos clorados se lleva a cabo bajo condiciones metanogénicas, este protocolo sugiere la formación de un lodo puede ser usado para simultáneamente: (1) eliminar el sulfato, (2) eliminar la DQO y (3) eliminar compuestos clorados. Un paso más podría ser la de evaluar el lodo en la eliminación simultánea de TCE y los metales pesados (además de sulfato y COD), dos condiciones que no pueden ser evaluados bajo condiciones metanogénicas.Protocolo

Figura 1. Esquema de los pasos del protocolo. Haga clic aquí para ver una versión más grande de esta figura.
1. Recoger los sedimentos marinos de la Formación de los lodos
- Identificar un área accesible submarino ya sea cerca de las chimeneas hidrotermales (debido a la presencia de sulfuros, lo que puede indicar una actividad reductora de sulfato superior) o a un área donde los residuos de materia orgánica son detectables.
- A los efectos de este trabajo, tardará aproximadamente 3 o 4 kg de sedimento y drenar el agua de las muestras. Coloque las muestras en bolsas de plástico oscuro. No se necesita refrigeración.
- Una vez en el laboratorio, mantener las bolsas con las muestras en el refrigerador si no se van a utilizar de inmediato. Para el propósito de este trabajo, samples puede estar en la nevera durante semanas o meses antes de usarlos.
- Tome una gran parte de la muestra de sedimento (es decir, 1 o 2 kg) y el uso de una malla apropiada (0,2 cm) para eliminar de los sedimentos de la gran escombros de material carbonoso que se puede encontrar o algunas rocas que pueden estar presentes.
Nota: En este caso se utilizó una malla de 0,20 cm de diámetro (0,0767 in) pero puede ser de un tamaño diferente según el tamaño de las partículas en la muestra.- Después de pasar el sedimento a través de la malla, mezclar la parte seleccionada para promover que la porción es homogénea.
- Tomar muestras más pequeñas separadas (es decir, de 2 a 3 g) para determinar los sólidos volátiles en suspensión (VSS) de contenido siguiendo los métodos estándar 11.
Nota: Consulte la Figura 2 para conocer los pasos 1.2 a 1.4.

Figura 2. Fotografías de las muestras de sedimentos.Muestras (A) justo después de sedimentos están tomando. De la muestra (B) de sedimentos después de pasar a través de la malla. (C) Muestra tomada para el pesaje antes de sólidos en suspensión volátiles (VSS) determinación. La placa de Petri no necesita ser esterilizado. Por favor haga clic aquí para ver una versión más grande de esta figura.
2. biorreactor Set Up
- Para el propósito de este trabajo, utilizar un reactor de vidrio UASB con un volumen de trabajo total de 3 L. Alternativamente, utilizar un reactor de vidrio de volumen de 1 o 2 L.
- Basándose en el contenido VSS de los sedimentos calcular la cantidad de sedimento para ser utilizado como inóculo para obtener 5 g de VSS en 1 L.
- Tener en cuenta que si la cantidad de sedimento después del cálculo es demasiado grande, entonces el volumen de aproximadamente 25% a 30% del biorreactor debería ser ocupado por los sedimentos en su lugar.
- Registre el contenido VSS ya queva a cambiar cuando la comunidad microbiana se enriquece en el biorreactor. Se necesita el contenido de VSS para los cálculos de sulfato de reducción de la actividad en el biorreactor.
- Asegúrese de que la concentración final de la solución tampón de medio y basal en el biorreactor es similar a la reportada por Guerrero-Barajas et al. (2014) 12.
- Asegúrese de que los volúmenes finales de los sedimentos, medio basal, solución tampón y ácidos grasos volátiles son iguales al volumen de trabajo final del reactor. La receta medio basal 12 contiene las concentraciones apropiadas para la solución de metales traza y vitaminas.
- Preparar una solución madre de medio basal y la solución tampón en una concentración apropiada para el volumen de trabajo del reactor utilizado (es decir, 2, 3 o 4 veces más concentrado que el reportado en el paso 2.4) para asegurar que cuando se diluye, es a la concentración reportada por Guerrero-Barajas et al. (2014)12).
Nota: La solución de stock para el medio basal siempre es necesario, sin embargo, la solución tampón sólo es necesario en la puesta en marcha. No es necesario añadir solución tampón después de este tiempo. - Preparar una solución madre de ácidos grasos volátiles: acetato, propionato y butirato en un 2,5: COD proporción 1: 1. Tome en cuenta para los cálculos del acetato de sodio incluido en el medio basal. La concentración de DQO final en el reactor debe ser 2,7 g / L.
Precaución: Preparar esta solución en una campana de humos. Use guantes de nitrilo y gafas para la preparación de esta solución. Tener en cuenta la estequiometría de las reacciones de sulfato con los ácidos grasos volátiles que se muestra en la Figura 3. - Preparar una solución madre de sulfato de sodio (Na 2 SO 4) en una concentración apropiada para entregar al reactor una concentración final de 4,000 mg / L de la ion sulfato (SO 4 2-). Alternativamente, incluir THe cantidad de sulfato requerida en el medio basal en lugar de añadir que a partir de una solución madre mientras el sulfato de final (SO 4 2-) concentración es correcta.
- Coloque los sedimentos en el reactor mezclado con una porción del medio basal para asegurarse de que lleguen a la parte inferior del reactor.
- Añadir el resto de la solución del medio y tampón basal se mezcla con la solución de ácidos grasos volátiles y la solución de sulfato. Asegúrese de que la solución de los ácidos grasos volátiles se vierte en el líquido. Nota: Realice este paso en una campana de humos.
- Establecer las conexiones y tuberías del reactor a la bomba de reciclaje. Ajuste el caudal de reciclaje en 60 ml / min. Ajuste el biorreactor en la cámara de temperatura a 34 ° C. Compruebe regularmente que las variaciones de temperatura son pequeñas (es decir, 34 ± 1,7 ° C)
- Establezca las conexiones a la columna de desplazamiento de gas.
Nota: Consulte la Figura 4 para conocer los pasos 2.1 a 2.5.
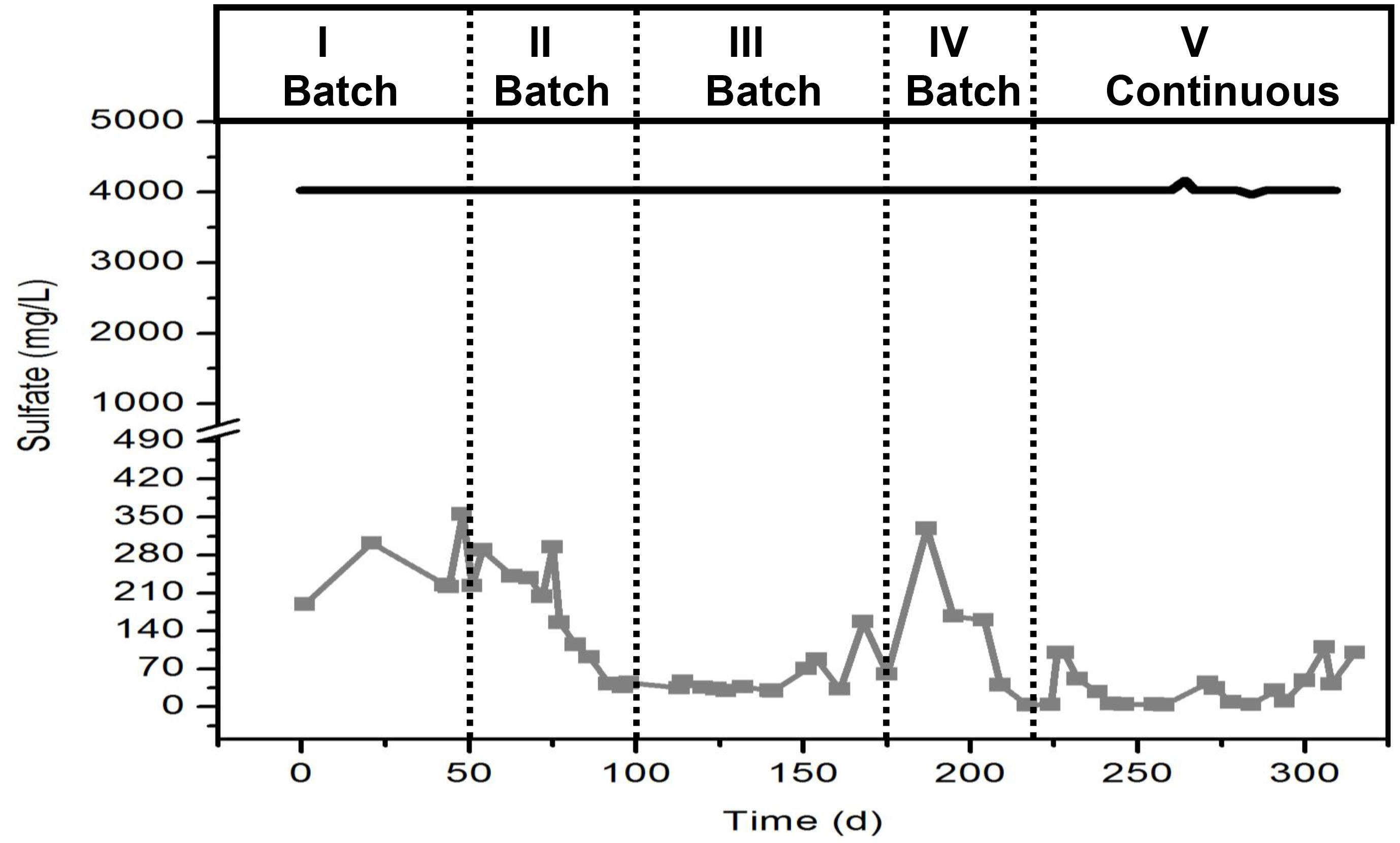
Figura 3. Estequiometría de la reducción de sulfato con VFA (acetato, propionato y butirato). Haga clic aquí para ver una versión más grande de esta figura.
Figura 4. UASB reactor. (A) el tiempo inicial. (B) régimen continuo después de 300 días de operación. Haga clic aquí para ver una versión más grande de esta figura.3. El funcionamiento del reactor para Promover Sulfidogenesis y crecimiento de los microorganismos
Nota: Permitir el inóculo para consumir la vpoco volátil ácidos grasos y de sulfatos. Para este propósito, esperar durante una semana para llevar a cabo el primer análisis para el sulfato, sulfuro y el consumo de DQO.
- Después de una semana de incubación toma una muestra de 5 a 7 ml de líquido para llevar a cabo el análisis de DQO, sulfato y contenido de sulfuro y el pH siguiendo métodos estándar 11, 13.
- Analizar sulfuro en el espectrofotométricamente líquido (a una longitud de onda (λ) de 670 nm) siguiendo el método del azul de metileno 13.
- Colocar 5 ml de una solución de acetato de zinc (2% w / w) en un matraz aforado de 25 ml, añadir rápidamente 200 l de la muestra a la solución de acetato de zinc.
- Añadir 2,5 ml de una N, N dimetil- p-fenilendiamina solución de oxalato (DMP) (0,2% w / w en 20% H 2 SO 4) y 125 l de hierro (III) solución de sulfato amónico (10% w / w en 2% H 2 SO 4) y completa con agua destilada los 25 ml en el matraz volumétrico. Esperar 30 min para la reacciónque se produzca, momento en el que se estabiliza el color azul. 13.
Nota: Espere al menos 15 minutos, pero no más de 60 minutos para poner a prueba las muestras en el espectrofotómetro. Llevar a cabo la lectura de la solución final azul en el espectrofotómetro.
- Analizar sulfato de acuerdo con métodos estándar 11. Aquí, cuantificar sulfato como sulfato de bario mediante el uso de un método turbidimétrico.
- Colocar 5 ml de una solución acondicionado (ácido clorhídrico HCl 1: 1) en un matraz aforado de 25 ml, añadir 1 ml de la muestra previamente centrifugado (a 11.320 × g), completar la 25 ml del matraz aforado con agua destilada y se añadir 1 g de cloruro de bario.
- Mezclar la solución durante 1 min en un vórtice. Espere a 4 min para el sulfato de bario para formar y leer la muestra en el espectrofotómetro a una longitud de onda (λ) de 420 nm 11.
- Analizar DQO acuerdo con métodos estándar 11. Alternativamente, utilice una DQO Determinakit ción.
- Antes de la determinación de la DQO, centrifugar la muestra completamente (en 11.320 xg) para eliminar el sulfuro restante que puedan interferir en la determinación. Si es necesario, centrifugar dos veces: la primera vez inmediatamente después de tomar la muestra y la segunda vez, espere 6 u 8 horas y luego realizar el análisis de COD.
- Añadir 2 ml de la muestra a un vial de reacción del kit de determinación de la DQO, sellar el vial y homogeneizar la mezcla mediante agitación suave. Preparar un blanco mediante la adición de 2 ml de agua destilada a otro vial de reacción y homogeneizar la mezcla.
- Colocar los viales en el reactor de digestión a 150 ° C durante 2 hr. Retire los viales y dejar enfriar en la oscuridad. Tome las lecturas de los viales en el espectrofotómetro a una longitud de onda de 620 nm.
- Obtener el volumen de gas de la columna de desplazamiento de gas.
- Analizar sulfuro en el espectrofotométricamente líquido (a una longitud de onda (λ) de 670 nm) siguiendo el método del azul de metileno 13.
- Espere hasta por otros 5 a 7 días hasta que se consume el sulfato. Sulfato y DQO deben ser consumidos en unproximadamente 85% a 90% antes de que se inicie un nuevo lote alimentado.
- Una vez que el sulfato (y COD) son consumidos, completamente repita el paso 2.4. Suministro medio fresco y nuevos nutrientes para cada lote.
- Repita los pasos 3.1 y 3.2. En este punto cada lote debe durar entre 7 y 10 días.
- Cuando 3 a 4 lotes se han completado, repetir el paso 2.4, pero aumentar la concentración de COD a 4 g / L.
- Repita el paso 3.1 y paso 3.2.
- Repita el paso 3.3, pero aumentar la concentración de DQO a 6 g / L.
- Repita 3.6 y 3.6.1 aumentando gradualmente la concentración de COD hasta que es 10 g / L.
Nota: asegúrese de la gráfica que presenta la concentración de sulfato (mg / L) frente al tiempo (d).
- Cuando el consumo de sulfato es más del 80% en menos de 24 hr y esto ocurre durante más de una semana, conmutar el funcionamiento del reactor de modo continuo. Para el modo continuo establecer el tiempo de retención hidráulica (TRH) a las 24 horas y mantener la concentración de sulfato en 4 g / L y la DQOa 10 g / L.
Nota: Con el tiempo el consumo de sulfato debe ser más rápido.
4. La reducción de sulfato de prueba Actividad
- Antes de esta prueba asegúrese de que el biorreactor bajo el régimen continuo presenta la variación de menos de 10% en la concentración de sulfato restante.
- En un día cualquiera, detener el reactor después de ciclo y conducta paso uno HRT 2.4. Para el paso 2.4.3 utilizar una concentración de COD de 10 g / L.
- Una vez que el biorreactor se alimenta, tomar de 5 a 7 muestras ml de líquido y realizar análisis de DQO, sulfato, sulfuro (paso 3.1) y pH cada hora. Registre el volumen de gas producido.
- Calcular el sulfato de reducción de la actividad de acuerdo con la literatura 14.

SRA = sulfato de reducción de la actividad (mg de COD-H 2 S) / gVSS * d
m H 2 S = concentración de sulfuro expresada en mg de COD-H 2 S
VSS = concentración de sólidos en suspensión volátiles
t = tiempo (d or h)
- Realice los gráficos correspondientes que muestran el porcentaje de consumo de sulfato frente a la concentración de sulfuro en el tiempo en mg / L. Realice los gráficos que muestran el porcentaje de consumo de DQO en el tiempo. Realice los gráficos que muestran la variación del pH en el tiempo.
5. El tricloroetileno (TCE) Prueba de Reducción
- Antes de esta prueba asegúrese de que el biorreactor está trabajando en régimen continuo y presenta la variación de menos de 10% en la concentración de sulfato restante. No empiece este examen si la reducción de sulfato en el biorreactor es inferior al 90%.
- Preparar una solución madre de tricloroetileno (TCE) teniendo en cuenta que la concentración final de este compuesto en la fase líquida del biorreactor debe ser de 300 mM. Considere la partitioning del compuesto para el espacio de cabeza mediante el uso de la constante adimensional Ley Henry's (H') para TCE en 34 ° C. H'at 34 ° C para el TCE es 0.4722.
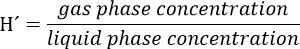
Precaución: Preparar esta solución en una campana de humos y usar guantes y gafas.- Por ejemplo, para una solución madre 5,000 M, calcular como sigue:
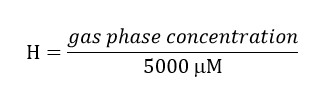
Concentración de TCE fase gaseosa = (0.4722) * (5.000) = 2.139 M. Incluir esta concentración en la preparación de la solución madre ya que esta cantidad de TCE estará en el espacio de cabeza.
Luego, en el líquido (agua) de la solución madre, la concentración de TCE real será: 5.000 + 2.139 = 7.139 M. Densidad TCE = 1,43 g / ml. Convertir el 7,139 M a mg y luego mediante el uso de la densidad de TCE calcular el volumen de TCE para la solución madre.
Nota: La concentración de la solución madre TCE may ser inferior a 5,000 M, es decir, 3.000 o 1.000 M, esto depende de la cantidad de volumen de esta solución puede ser entregado al biorreactor de acuerdo con su volumen de fase líquida.
- Por ejemplo, para una solución madre 5,000 M, calcular como sigue:
- Preparar las curvas de calibración en el cromatógrafo de gases de TCE, cis -1,2-dicloroetileno, trans 1,2 dicloroetileno, cloruro de vinilo y etileno. Preparar el cis 1,2 dicloroetileno y curvas estándar trans 1,2 dicloroetileno de una solución madre de estos compuestos siguiendo el mismo procedimiento descrito en 5.2 para la solución de TCE de valores. Preparar las curvas estándar para cloruro de vinilo y eteno mediante la dilución de la concentración de cada gas a partir de los estándares (cilindros de gas).
- Preparar las curvas estándar de estos compuestos en una gama de 20 a 300 mM. Utilice el método reportado por Guerrero-Barajas et al. (2011) 15 para el análisis de estos compuestos en el cromatógrafo de gases.
Precaución: Prepare éstos destacansoluciones ard en una campana de humos y usar guantes y gafas.
- Preparar las curvas estándar de estos compuestos en una gama de 20 a 300 mM. Utilice el método reportado por Guerrero-Barajas et al. (2011) 15 para el análisis de estos compuestos en el cromatógrafo de gases.
- En un día cualquiera, detener el reactor después de ciclo y conducta paso uno HRT 2.4. Para el paso 2.4.3 utilizar una concentración de COD de 10 g / L.
- Una vez que el biorreactor se alimenta, agregue el TCE directamente en el líquido en el biorreactor de la solución madre preparada en 5,2, la concentración de TCE final en la fase líquida del biorreactor debe ser de 300 mM. Establezca la TRH a 12 h.
- Al final de un ciclo HRT tomar muestras de líquido (500 a 1.000 l) y el análisis de conducta para la DQO, sulfato y sulfuro (pasos 3.1.1, 3.1.2 y 3.1.3). Tomar muestras del espacio de cabeza (100 a 250 l) y llevar a cabo el análisis de las expresiones culturales tradicionales, cis -1,2-dicloroetileno, trans 1,2 dicloroetileno, cloruro de vinilo y etileno en el cromatógrafo de gases.
- Repita el paso 2.4. Para el paso 2.4.3 utilizar una concentración de COD de 10 g / L.
- No repita ninguna prueba de reducción TCE hasta que el biorreactor presenta más de 9Reducción de 0% de sulfato y la variación de menos de 10% tanto, la reducción de sulfato y sulfato restante en el biorreactor.
- Repita 5.4, 5.5 y 5.6 dos o tres veces más.
- Tomar muestras de sedimentos (0,5 g) para llevar a cabo la identificación de los microorganismos justo después de una prueba de reducción de la TCE ha terminado. Haga esto después de 2 o 3 pruebas de reducción de TCE.
6. Reducción de sulfato de prueba Actividad después Experimento TCE Reducción
- Repita el paso 4 por completo.
7. Identificación de los microorganismos
- Tomar muestras de lodos de aproximadamente 0,5 g cada uno y llevar a cabo la extracción de ARN total según el método estándar de 12.
- Amplificar el gen 16S rRNA con transcripción inversa y realizar la reacción en cadena de polimerasa (RT-PCR) de amplificación de un paso 12.
- Diseñar los cebadores para amplificar o utilizar como una primera aproximación los sugeridos en la literatura 11. Siga el amplifprocedimiento icación sugerido en la literatura 12.
- Construir las bibliotecas de 16S rRNA. Amplicones de PCR se pueden clonar mediante el uso de un kit de clonación-11. Típicamente, 10 colonias de cada placa (cada colonia representa un producto PCR) pueden ser clonados. Preparar el ADN de plásmido para la secuenciación de acuerdo con el procedimiento sugerido en la literatura 12.
- Llevar a cabo la secuenciación de fragmentos. Re-amplificar aproximadamente 1400 pb de los productos externos de PCR con el protocolo de PCR para la amplificación se ha descrito previamente (paso 7.4) y el clon de acuerdo con el procedimiento sugerido en la literatura 12. Aislar el plásmido recombinante de E. colonias de E. coli como se sugiere en la literatura 12. No llevar a cabo el procedimiento parcial para la secuenciación con cebadores universales M13 12.
- Llevar a cabo el análisis de secuencias. Alinear las secuencias de nucleótidos utilizando el Clustal X y ajustar manualmente en el editor de texto. Realizar búsquedas BLAST de las databas NCBIe. (http://www.ncbi.nlm.nih.gov/BLAST/Blast.cgi) 12.
- Obtener los números de acceso de secuencia de nucleótidos. Depositar las secuencias de nucleótidos de los clones identificados en la base de datos EMBL secuencia de nucleótidos (Gen-Bank / EMBL / DDBJ) bajo los números de acceso correspondientes (es decir, JQ713915eJQ713925 para las secuencias de amplicones) 12.
Resultados
Un comportamiento típico de la reducción de sulfato en el biorreactor se muestra en la Figura 5. Es importante notar que durante las primeras semanas de la reducción de sulfato de operación será lento. Sin embargo lento, el consumo de más del 90% de sulfato de con el tiempo indica que el inóculo está desarrollando una comunidad microbiana capaz de reducir el sulfato y por lo tanto, enriquecido en bacterias reductoras de sulfato. Los diferentes períodos en la figura indican que ...
Discusión
Hay varias aplicaciones de sulfidogenesis en biotecnología ambiental, una de las aplicaciones más utilizadas del metabolismo de las bacterias reductoras de sulfato en consorcios con la fermentación de bacterias es en el tratamiento de aguas residuales. Reactores UASB son algunos de los principales enfoques de ingeniería para el tratamiento de aguas residuales industriales con altas concentraciones de sulfato. En este trabajo, se presenta un protocolo para obtener lodos sulfidogénicos de sedimentos marinos en un rea...
Divulgaciones
The authors Selene Montserrat García-Solares, Claudio Garibay-Orijel and Claudia Guerrero Barajas submitted (as inventors) in 2012 the application to obtain a patent entitled: “Process for the anaerobic treatment of industrial wastewater with high content of sulfate and chlorinated compounds”. This submission has been approved to the stage of the formatting. The submission has Instituto Politécnico Nacional as the rights owner.
Agradecimientos
The authors are grateful for the financial support provided by Instituto Politécnico Nacional grants 20120110, 20130399 and 20140239 SIP and also by Instituto de Ciencia y Tecnología del Distrito Federal Mexico (PICS 08-79, ICYT-DF, 2009-2012). Thanks also to CONACYT – Mexico for the graduate scholarship (225806) awarded to Selene Montserrat García-Solares and for the financial support provided by grant 82627.
Materiales
| Name | Company | Catalog Number | Comments |
| trichloroethylene | sigma Aldrich | 251402 | |
| cis-1,2-dichlorotehylene | sigma Aldrich | ||
| trans-1,2-dichloroethylene | sigma Aldrich | D-62209 | |
| vinyl chloride scotty standard | supelco | 1,000 ppm v/v in nitrogen | |
| ethene scotty standard | supelco | 99% purity | |
| pump | Masterflex | Model 7553-75 | |
| spectrophotometer | any | ||
| microcentrifuge | any | ||
| gas tight syringes | any | 100 and 200 microliters | |
| UASB glass reactor | any | under design | |
| gas chromatograph | any | FID detector | |
| capillary column SPB-624 | supelco | ||
| pH meter | any | ||
| viton tubing | Masterflex | ||
| basal medium reagents | any | ||
| trace metals reagents | any | ||
| vitamins solution reagents | any | ||
| sodium sulfate | any | ||
| volatile fatty acids | any | ||
| COD determination kit | HACH | range 0-15,000 mg/L | |
| TOPO-TA cloning kit pCR®4.0 | Invitrogen, US | ||
| S.N.A.P. TM Miniprep Kit | Invitrogen, UK | ||
| Pure link TM Quick Plasmid Miniprep kit | Invitrogen |
Referencias
- Lens, P., Esposito, M. V. G., Zandvoort, M. Perspectives of sulfate reducing bioreactors in environmental biotechnology. ReViews Environmental Science and Biotechnology. 1 (4), 311-325 (2002).
- Omil, F., Lens, P., Hulshoff, P., Lettinga, G. Characterization of biomass from a sulfidogenic, volatile fatty acid-degrading granular sludge reactor. Enzyme and MicrobialTechnology. 20, 229-236 (1997).
- Lopes, S. I. C., Wang, X., Capela, M. I., Lens, P. N. L. Sulfate reduction during the acidification of sucrose at pH 5 under thermophilic (55 °C) conditions.II: Effect of sulfide and COD/SO4-2 ratio. Bioresource Technology. 101, 4278-4284 (2010).
- Alfonso, P., Prol-Ledesma, R. M., Canet, C., Melgarejo, J. C., Fallick, A. E. Sulfur isotope geochemistry of the submarine hydrothermal coastal vents of Punta Mita, Mexico. Journal of Geochemical Exploration. 78-79, 301-304 (2003).
- Valdemarsen, T., Kristensen, E. Degradation of dissolved organic monomers and short chain fatty acids in sandy marine sediment by fermentation and sulfate reduction. Geochimica et Cosmochimica Acta. 74, 1593-1605 (2010).
- Quistad, S. D., Valentine, D. L. Anaerobic propane oxidation in marine hydrocarbon seep sediments. Geochimica et Cosmochimica Acta. 75, 2159-2169 (2011).
- Futagami, T., Morono, Y., Terada, T., Kaksonen, A. H., Inagaki, F. Dehalogenation activities and distribution of reductive dehalogenase homologous genes in marine subsurface sediments. Applied and Environmental Microbiology. 75 (21), 6905-6909 (2009).
- U.S. Environmental Protection Agency. List of priority pollutants. Clean Water Methods. , (2014).
- Ozdemir, C., Dursun, S., Karatas, M., Sen, N., Sahinkaya, S. Removal of trichloroethylene (TCE) in upFlow anaerobic sludge blanket reactors (UASB). Biotechnology and Biotechnological Equipment. 21 (1), 107-112 (2007).
- Zhang, Y., Wang, X., Hu, M., Li, P. Effect of hydraulic retention time (HRT) on the biodegradation of trichloroethylene wastewater and anaerobic bacterial community in the UASB reactor. Applied Microbiology and Biotechnology. 99, 1977-1987 (2015).
- . . Standard Methods for the Examination of Water and Wastewater. , (1998).
- Guerrero-Barajas, C., et al. Enhanced sulfate reduction and trichloroethylene (TCE) biodegradation in a UASB reactor operated with sludge developed from hydrothermal vents sediments: process and microbial ecology. International Biodeterioration and Biodegradation. 94, 182-191 (2014).
- Trüper, H. G., Schlegel, H. G. Sulphur metabolism in Thiorhodaceae I. Quantitative measurements on growing cells of Chromatium okenii. Antoine van Leeuwenhoek. 30, 225-238 (1964).
- Gallegos-García, M. G. . Biological processes of sulfate reduction in biofilms for metals precipitation [Ph D thesis]. , (2009).
- Guerrero-Barajas, C., Garibay-Orijel, C., Rosas-Rocha, L. E. Sulfate reduction and trichloroethylene biodegradation by a marine microbial community from hydrothermal vents sediments. International Biodeterioration and Biodegradation. 65, 116-123 (2011).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados