Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Développement de sulfurogènes boues de sédiments marins et la réduction de trichloroéthylène dans une couverture Réacteur à refoulement de boue anaérobie
Dans cet article
Résumé
Microbial sulfate reduction is a process of great importance in environmental biotechnology. The success of the sulfidogenic reactors depends among other factors on the microbial composition of the sludge. Here, we present a protocol to develop sulfidogenic sludge from hydrothermal vents sediments in a UASB reactor for reductive dechlorination purposes.
Résumé
The importance of microbial sulfate reduction relies on the various applications that it offers in environmental biotechnology. Engineered sulfate reduction is used in industrial wastewater treatment to remove large concentrations of sulfate along with the chemical oxygen demand (COD) and heavy metals. The most common approach to the process is with anaerobic bioreactors in which sulfidogenic sludge is obtained through adaptation of predominantly methanogenic granular sludge to sulfidogenesis. This process may take a long time and does not always eliminate the competition for substrate due to the presence of methanogens in the sludge. In this work, we propose a novel approach to obtain sulfidogenic sludge in which hydrothermal vents sediments are the original source of microorganisms. The microbial community developed in the presence of sulfate and volatile fatty acids is wide enough to sustain sulfate reduction over a long period of time without exhibiting inhibition due to sulfide.
This protocol describes the procedure to generate the sludge from the sediments in an upflow anaerobic sludge blanket (UASB) type of reactor. Furthermore, the protocol presents the procedure to demonstrate the capability of the sludge to remove by reductive dechlorination a model of a highly toxic organic pollutant such as trichloroethylene (TCE). The protocol is divided in three stages: (1) the formation of the sludge and the determination of its sulfate reducing activity in the UASB, (2) the experiment to remove the TCE by the sludge, and (3) the identification of microorganisms in the sludge after the TCE reduction. Although in this case the sediments were taken from a site located in Mexico, the generation of a sulfidogenic sludge by using this procedure may work if a different source of sediments is taken since marine sediments are a natural pool of microorganisms that may be enriched in sulfate reducing bacteria.
Introduction
Une des contributions les plus importantes à la biotechnologie environnementale a été la conception de bioréacteurs dans lequel la boue utilisée (inoculum) a été en mesure d'effectuer dans des conditions de sulfate de réduction. Sulfate de réduction (SR) permet le traitement de flux d'eaux usées qui contiennent des concentrations élevées de sulfate en plus de l'élimination simultanée de la DCO, des métaux lourds et des polluants organiques, ce qui rend une caractéristique souhaitable SR de la boue 1. Quelques exemples d'effluents contaminés avec du sulfate proviennent de tannerie, papier, des produits pharmaceutiques et de fabrication de produits chimiques industries 1. Cependant, la plupart de la littérature se réfère à sulfurogènes boues lorsque la boue granulaire méthanogène a été adapté pour sulfidogenesis 2. Cette adaptation est souvent atteint par la manipulation de la COD / SO 4 2- rapport dans le bioréacteur et ajout de produits chimiques pour inhiber les bactéries méthanogènes dans le 2,3 de boues. En plus de la longue période que may exiger la formation des granules sulfurogènes, la concurrence entre les méthanogènes et réducteurs de sulfate et de la tolérance de la boue à de fortes concentrations de sulfure sont quelques-uns des principaux problèmes qui pourraient survenir si la boue sulfurogènes utilisé dans le bioréacteur est obtenu à partir de l'adaptation de principalement boues méthanogène en sulfate des conditions réductrices. Dans ce travail, nous décrivons la procédure pour obtenir une boue principalement sulfurogènes des évents hydrothermaux sédiments (Punta Mita, Nayarit, Mexique) dans un réacteur anaérobie à lit de boues à flux ascendant (UASB), puis nous évaluons son sulfate réduction de l'activité au fil du temps et menons une expérience d'évaluer son application sur la déchloration réductrice. L'emplacement des sédiments a été choisi car il a été rapporté que, dans ce site il ya formation de sulfures en raison de l'activité de sulfate réduire manifestée par la communauté microbienne qui habitent cet endroit particulier 4.
Il ya Severavantages al dans l'obtention de ces boues sulfurogènes des sédiments sur l'adaptation de boue granulaire méthanogène à sulfidogenesis. Certains de ces avantages sont les suivants: (1) il est inutile de former des granulés pour le bioréacteur de fonctionner, (2) des boues tolère des concentrations relativement élevées de sulfure par rapport aux autres UASB qui fonctionnent avec des boues méthanogène adapté, et (3) il est pas de compétition pour le substrat avec de l'acétate méthanogènes même si on utilise dans le mélange des acides gras volatils qui est inclus dans le milieu de culture pour favoriser la formation de la boue.
Cette procédure a été suivie de promouvoir sulfidogenesis parce sédiments marins sont une piscine naturelle d'une grande variété de micro-organismes tels que le sulfate de réduire les bactéries, la fermentation des bactéries et déshalogénante bactéries pour ne citer que quelques-uns de 5,6. Le type de consortium développé à partir de sédiments marins en utilisant ce protocole peut présenter l'efficacité dans la réduction de sulfate et donc grand s ulfate réduction de l'activité au fil du temps et une plus grande tolérance au sulfure à des concentrations supérieures à la signalé comme toxique pour les bactéries méthanogènes et sulfatoréductrices bactéries. D'autre part, il est probable que la capacité de déshalogénation est également représenté dans les sédiments en suivant le protocole proposé ici, mais il peut dépendre de la communauté microbienne d'origine. Cette hypothèse est fait sur la base du fait que la déchloration réductrice peut se produire soit par la respiration ou cométabolisme, deux conditions qui peuvent être promus dans la communauté microbienne marine 7. La culture des sédiments pour obtenir la boue a été réalisée en utilisant un mélange d'acétate, propionate et butyrate en tant que substrat, parce que ces acides gras volatils sont utilisés par plusieurs souches de bactéries sulfato-réductrices. Ces acides sont également le type de composés de carbone fréquemment trouvés dans les sédiments marins, selon plusieurs rapports de la littérature sur la matière carbonée dans les sédiments de la mer 5,6.
contenu "> Enfin, certains des composés les plus toxiques que l'on retrouve dans les corps de l'eau souterraine et d'autres l'eau partout dans le monde sont les solvants chlorés tels que le trichloroéthylène (TCE) et de perchloroéthylène (PCE). Ces composés sont toxiques non seulement à l'être humain, mais également des microorganismes, en particulier TCE, qui est toujours considéré comme un polluant prioritaire par l'Environmental Protection Agency des États-Unis 8. Dans ce travail, nous avons proposé une expérience dans laquelle la boue sulfurogènes est testé sur sa capacité de réduire le TCE à des concentrations qui sont dans la fourchette indiquée pour les composés chlorés biodégradation dans des conditions méthanogènes 9,10. Il est à noter que la plupart des recherches sur la biodégradation des composés chlorés a été menée dans des conditions méthanogènes 9,10. Nous considérons que l'expérience avec TCE proposé dans ce protocole est un bon exemple des applications potentielles de la boue. L'objectif de cette expérience était de evaloriser la tolérance de la boue au TCE et l'effet de TCE sur la réduction de l'activité du sulfate. Tenant compte du fait que la plupart des recherches sur la biodégradation des composés chlorés est effectuée dans des conditions méthanogènes, ce protocole suggère la formation d'une boue peut être utilisé pour simultanément: (1) retirer le sulfate, (2) enlever la DCO et (3) supprimer des composés chlorés. Une autre étape pourrait consister à évaluer la boue sur l'élimination simultanée de TCE et de métaux lourds (en plus de sulfate et de la DCO), deux conditions qui ne peuvent pas être évalués dans des conditions méthanogènes.Protocole

Figure 1. Schéma pour les étapes du protocole. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
1. Recueillir les sédiments marins pour la formation de la boue
- Identifier un domaine sous-marin accessible soit à proximité de sources hydrothermales (due à la présence de sulfures, ce qui peut indiquer un sulfate activité réductrice ultérieure) ou dans une zone où des débris de matière organique sont détectables.
- Aux fins de ce travail, prendre environ 3 ou 4 kg de sédiments et de drainer l'eau hors des échantillons. Placer les échantillons dans des sacs en plastique noirs. Aucune réfrigération est nécessaire.
- Une fois dans le laboratoire, garder les sacs avec les échantillons dans le réfrigérateur si elles ne vont pas être utilisé immédiatement. Aux fins de ce travail, samples peut être dans le réfrigérateur pendant des semaines ou des mois avant de les utiliser.
- Prenez une grande partie de l'échantillon de sédiment (soit 1 ou 2 kg) et utiliser un maillage approprié (0,2 cm) d'éliminer des sédiments les gros débris de matière carbonée qui peut être trouvé ou des roches qui peuvent être présents.
Remarque: Dans ce cas, une ouverture de maille de 0,20 cm de diamètre (0,0767 in) a été utilisé, mais il peut être d'une taille différente en fonction de la taille des particules dans l'échantillon.- Après avoir passé les sédiments à travers les mailles, mélanger la partie sélectionnée de promouvoir ce que la partie est homogène.
- Prenez de plus petits échantillons séparés (soit 2 à 3 g) de déterminer les matières volatiles en suspension (VSS) de contenu en suivant les méthodes standard 11.
Remarque: Voir la Figure 2 pour les étapes 1.2 à 1.4.

Figure 2. Des photographies des échantillons de sédiments.Échantillons (A) de sédiments juste après prises. Échantillon (B) de sédiments après avoir passé à travers les mailles. (C) Échantillon prélevé pour pesée avant de matières volatiles en suspension (VSS) détermination. La boîte de Pétri n'a pas besoin d'être stérilisés. S'il vous plaît cliquez ici pour voir une version plus grande de cette figure.
2. bioréacteur Set Up
- Aux fins de ce travail, utiliser un réacteur en verre UASB avec un volume de travail total de 3 L. Vous pouvez également utiliser un réacteur en verre de volume 1 ou 2 L.
- Basé sur le contenu VSS des sédiments calculer la quantité de sédiments à être utilisé comme inoculum pour obtenir 5 g de VSS en 1 L.
- Prendre en compte que si la quantité de sédiments après calcul est trop grand, le volume, puis environ 25% à 30% du bioréacteur doit être occupée par les sédiments à la place.
- Enregistrer le contenu VSS car ilva changer lorsque la communauté microbienne est enrichi dans le bioréacteur. La teneur VSS est nécessaire pour les calculs de réduction de l'activité du sulfate dans le bioréacteur.
- Assurez-vous que la concentration finale de la solution de milieu et tampon de base dans le bioréacteur est similaire au déclarés par Guerrero-Barajas et al. (2014) 12.
- Assurez-vous que les volumes finaux des sédiments, un milieu de base, une solution tampon et les acides gras volatils sont égaux au volume de travail final du réacteur. Le milieu recette de base 12 contient les concentrations appropriées pour la solution de métaux traces et de vitamines.
- Préparer une solution mère de milieu de base et une solution tampon en une concentration appropriée pour le volume de travail du réacteur utilisé (par exemple, deux, trois ou quatre fois plus concentré que le rapporté à l'étape 2.4) de sorte que lorsqu'elle est diluée, il est à la concentration rapporté par Guerrero-Barajas et al. (2014)12).
Remarque: La solution de stock pour le milieu de base est toujours nécessaire, cependant, la solution tampon est nécessaire uniquement au démarrage. Il est inutile d'ajouter la solution tampon après cette heure. - Préparer une solution stock d'acides gras volatils: acétate, propionate et de butyrate dans un 2.5: COD proportion de 1: 1. Prendre en compte pour les calculs de l'acétate de sodium inclus dans le milieu de base. La concentration de COD finale dans le réacteur doit être de 2,7 g / L.
Attention: Préparer cette solution dans une hotte. Porter des gants et des lunettes de nitrile pour la préparation de cette solution. Prendre en compte la stoechiométrie des réactions de sulfate avec les acides gras volatils qui est représenté en figure 3. - Préparer une solution mère de sulfate de sodium (Na 2 SO 4) dans une concentration appropriée pour fournir au réacteur une concentration finale de 4,000 mg / L de l'ion de sulfate (SO 4 2-). Alternativement, inclure èmee montant de sulfate requis dans le milieu de base lieu de l'ajouter à partir d'une solution de réserve tant que le sulfate final (SO 4 2-) la concentration est à droite.
- Placez les sédiments dans le réacteur mélangé avec une portion du milieu de base pour faire en sorte qu'ils atteignent le fond du réacteur.
- Ajouter le reste de la solution de milieu et tampon de base mélangée avec la solution volatile des acides gras et la solution de sulfate. Assurez-vous que la solution d'acides gras volatils est versé dans le liquide. Remarque: Effectuer cette étape dans une hotte.
- Régler les connexions et les conduites du réacteur à la pompe de recyclage. Réglez le débit de recyclage à 60 ml / min. Réglez le bioréacteur dans la chambre de la température à 34 ° C. Vérifiez régulièrement que les variations de température sont faibles (par exemple, 34 ± 1,7 ° C)
- Régler les connexions à la colonne de déplacement de gaz.
Remarque: Voir la figure 4 pour les étapes 2.1 à 2.5.
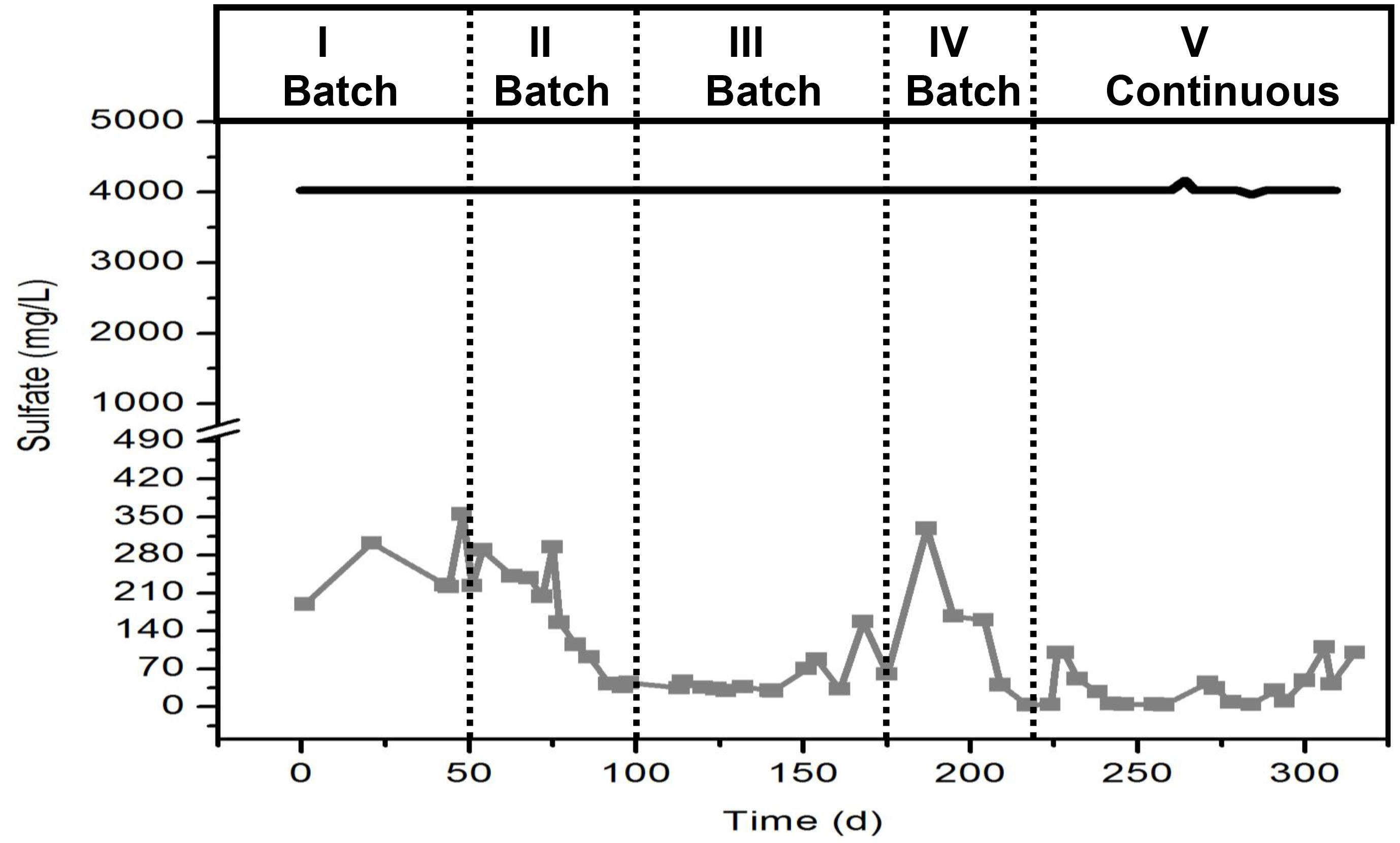
Figure 3. Stœchiométrie de la réduction du sulfate avec VFA (acétate, propionate et butyrate). S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Figure 4. réacteur UASB. (A) le temps initial. (B) régime continu après 300 jours de fonctionnement. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.3. fonctionnement du réacteur pour la promotion Sulfidogenesis et croissance des microorganismes
Remarque: Prévoir l'inoculum de consommer la volatile acides gras et de sulfate. A cet effet, attendre une semaine pour mener à bien la première analyse pour le sulfate, le sulfure et de la consommation COD.
- Après une semaine d'incubation prélever un échantillon de 5 à 7 ml de liquide pour effectuer une analyse de la DCO, sulfate et sulfure et teneur en pH suivant des procédés classiques 11, 13.
- Analyser sulfure dans le liquide par spectrophotométrie (à une longueur d'onde (λ) de 670 nm) en suivant la méthode au bleu de méthylène 13.
- Placer 5 ml d'une solution d'acétate de zinc (2% en poids / poids) dans une fiole jaugée de 25 ml, ajouter rapidement 200 ul de l'échantillon à la solution d'acétate de zinc.
- Ajouter 2,5 ml de p-phénylènediamine l'oxalate de N, N (DMP) solution (0,2% p / p à 20% de H 2 SO 4) et 125 ul du fer (III) une solution de sulfate d'ammonium (10% p / w 2% dans H 2 SO 4) et avec de l'eau distillée 25 ml dans la fiole jaugée. Attendre 30 min pour la réactionde se produire, heure à laquelle la couleur bleue est stabilisé. 13.
REMARQUE: Attendre au moins 15 minutes, mais pas plus de 60 min pour tester les échantillons dans le spectrophotomètre. Effectuer la lecture de la solution finale bleu dans le spectrophotomètre.
- Analyser sulfate selon des procédés standard 11. Ici, quantifier sulfate comme le sulfate de baryum en utilisant une méthode turbidimétrique.
- Introduire 5 ml d'une solution de conditionnement (acide chlorhydrique HCl 1: 1) dans une fiole jaugée de 25 ml, ajouter 1 ml de l'échantillon précédemment centrifugé (à 11 320 x g), de compléter les 25 ml de la fiole jaugée avec de l'eau distillée et ajouter 1 g de chlorure de baryum.
- Mélanger la solution pendant 1 min dans un vortex. Attendre pendant 4 min pour le sulfate de baryum pour former et lire dans l'échantillon au spectrophotomètre à une longueur d'onde (λ) de 420 nm 11.
- Analyser COD selon des procédés standard 11. Sinon, utilisez un COD Determinakit tion.
- Avant la détermination de la DCO, centrifuger à fond l'échantillon (à 11 320 xg) pour enlever le sulfure restant qui peut interférer dans la détermination. Si nécessaire, centrifugeuse à deux reprises: la première fois immédiatement après la prise de l'échantillon et la deuxième fois attendre 6 ou 8 heures, puis procéder à l'analyse COD.
- Ajouter 2 ml d'échantillon dans un flacon de réaction de la trousse de détermination de la DCO, sceller la fiole et homogénéiser le mélange par agitation douce. Préparer un flan en ajoutant 2 ml d'eau distillée dans un autre flacon de réaction et homogénéiser le mélange.
- Placer les flacons dans le réacteur de digestion à 150 ° C pendant 2 heures. Retirer les flacons et les laisser refroidir dans l'obscurité. Prenez les lectures des flacons dans le spectrophotomètre à une longueur d'onde de 620 nm.
- Obtenir le volume de gaz de la colonne de déplacement de gaz.
- Analyser sulfure dans le liquide par spectrophotométrie (à une longueur d'onde (λ) de 670 nm) en suivant la méthode au bleu de méthylène 13.
- Attendre jusqu'à un autre 5 à 7 jours jusqu'à ce que le sulfate est consommé. Sulfate et COD doivent être consommés dans unnviron 85% à 90% avant un nouveau lot Fed est commencé.
- Une fois que le sulfate (et DCO) sont consommés, complètement répétez l'étape 2.4. Fournir un milieu frais et de nouveaux éléments nutritifs pour chaque lot.
- Répétez les étapes 3.1 et 3.2. À ce stade, chaque lot doit durer entre 7 et 10 jours.
- Lorsque 3 à 4 lots ont été achevés, répéter l'étape 2.4, mais augmenter la concentration de COD 4 g / L.
- Répétez l'étape 3.1 et l'étape 3.2.
- Répétez l'étape 3.3, mais augmenter la concentration COD à 6 g / L.
- Répéter 3.6 et 3.6.1 en augmentant progressivement la concentration de DCO jusqu'à ce qu'il soit 10 g / L.
Remarque: Faire le graphique qui présente la concentration en sulfate (mg / L) en fonction du temps (d).
- Lorsque la consommation de sulfate est de plus de 80% en moins de 24 h, ce qui se produit pour plus d'une semaine, commuter le fonctionnement du réacteur en mode continu. Pour le mode continu régler le temps de rétention hydraulique (HRT) à 24 h et de maintenir la concentration de sulfate à 4 g / L et la DCOà 10 g / L.
Remarque: Au fil du temps la consommation de sulfate devrait être plus rapide.
4. Sulfate de réduire l'activité de test
- Avant cet essai vous assurer que le bioréacteur sous régime continu présente moins de 10% dans la variation de la concentration du sulfate restant.
- A un jour donné, arrêter le réacteur après un cycle de HRT et la conduite étape 2.4. Pour l'étape 2.4.3 utiliser une concentration en DCO de 10 g / L.
- Une fois le bioréacteur est alimenté, prendre de 5 à 7 ml d'échantillons de liquide et effectuer une analyse de la DCO, le sulfate, le sulfure (étape 3.1) et le pH toutes les heures. Noter le volume de gaz produit.
- Calculer la réduction de l'activité du sulfate selon la littérature 14.

SRA = réduction de l'activité du sulfate (mg COD-H 2 S) / gVSS * d
m H 2 S = concentration de sulfure exprimée en mg COD-H 2 S
VSS = volatile concentration des matières en suspension
t = temps (d ou h)
- Faire les graphiques correspondants qui montrent le pourcentage de la consommation du sulfate fonction de la concentration de sulfure au fil du temps en mg / L. Faire des graphiques qui montrent le pourcentage de la consommation de morue au fil du temps. Faire des graphiques qui montrent la variation du pH au cours du temps.
5. trichloroéthylène (TCE) test de réduction
- Avant cet essai vous assurer que le bioréacteur fonctionne en régime continu et présente moins de 10% dans la variation de la concentration du sulfate restant. Ne commencez pas à ce test si la réduction du sulfate dans le bioréacteur est inférieur à 90%.
- Préparer une solution stock de trichloroéthylène (TCE), en tenant compte du fait que la concentration finale de ce composé dans la phase liquide du bioréacteur doit être 300 um. Considérons le partitioning du composé à l'espace libre à l'aide de la constante sans dimension loi Henry's (H') pour le TCE à 34 ° C. H'at 34 ° C pour le TCE est 0,4722.
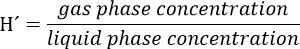
Attention: Préparer cette solution dans une hotte et porter des gants et des lunettes.- Par exemple, pour une solution stock de 5000 uM, calculer comme suit:
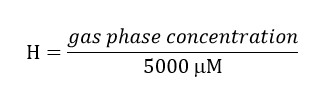
TCE concentration en phase gazeuse = (0,4722) * (5000) = 2,139 uM. Inclure cette concentration dans la préparation de la solution de stock depuis cette quantité de TCE sera dans l'espace libre.
Puis dans le liquide (eau) de la solution mère, la concentration de TCE réelle sera: 5000 + 2,139 = 7,139 uM. Densité = 1,43 TCE g / ml. Convertir le iM 7139 à mg, puis en utilisant la densité du TCE calculer le volume de TCE pour la solution de stock.
Note: La concentration de TCE solution stock may être inférieure à 5,000 uM, à savoir 3000 ou 1000 pM, cela dépend de la quantité de volume de cette solution peut être délivrée dans le bioréacteur en fonction de son volume de phase liquide.
- Par exemple, pour une solution stock de 5000 uM, calculer comme suit:
- Préparer courbes standard dans le chromatographe en phase gazeuse pour le TCE, le cis-1,2-dichloréthylène, trans -1,2-dichloroéthylène, chlorure de vinyle et de l'éthylène. Préparer les cis -1,2-dichloroéthylène et trans -1,2-dichloroéthylène courbes standard à partir d'une solution de réserve de ces composés en suivant la même procédure décrite au paragraphe 5.2 de la solution TCE de stock. Préparer les courbes d'étalonnage pour le chlorure de vinyle et l'éthylène par la dilution de la concentration de chaque gaz à partir des normes (cylindres à gaz).
- Préparer les courbes d'étalonnage de ces composés dans une plage de 20 à 300 uM. Utilisez la méthode rapportée par Guerrero-Barajas et al. (2011) 15 pour l'analyse de ces composés dans le chromatographe en phase gazeuse.
Attention: préparer ces deboutsolutions ARD à une hotte et porter des gants et des lunettes.
- Préparer les courbes d'étalonnage de ces composés dans une plage de 20 à 300 uM. Utilisez la méthode rapportée par Guerrero-Barajas et al. (2011) 15 pour l'analyse de ces composés dans le chromatographe en phase gazeuse.
- A un jour donné, arrêter le réacteur après un cycle de HRT et la conduite étape 2.4. Pour l'étape 2.4.3 utiliser une concentration en DCO de 10 g / L.
- Une fois que le bioréacteur est alimenté, le TCE ajouter directement au liquide dans le bioréacteur à partir de la solution mère préparée en 5,2, la concentration de TCE finale dans la phase liquide du bioréacteur doit être de 300 uM. Réglez le THS à 12 h.
- À la fin d'un cycle de HRT prélever des échantillons du liquide (500 à 1000 pi) et l'analyse de la conduite de la DCO, le sulfate et le sulfure (3.1.1, 3.1.2 et 3.1.3). Prélever des échantillons de l'espace de tête (100 à 250 ul) et effectuer des analyses pour le TCE, le cis -1,2-dichloroéthylène, le trans-1,2-dichloroéthylène, le chlorure de vinyle et d'éthylène dans le chromatographe en phase gazeuse.
- Répétez l'étape 2.4. Pour l'étape 2.4.3 utiliser une concentration en DCO de 10 g / L.
- Ne pas répéter tout test de réduction de TCE jusqu'à ce que le bioréacteur présente plus de 90% de réduction de sulfate et moins de 10% de variation à la fois, la réduction du sulfate et le sulfate restant dans le bioréacteur.
- Répétez 5.4, 5.5 et 5.6, deux ou trois fois plus.
- Prendre des échantillons de sédiments (0,5 g) de procéder à l'identification des micro-organismes, juste après un test de réduction de la TCE est terminé. Pour ce faire, après 2 ou 3 essais de réduction de la TCE.
6. Sulfate de réduire l'activité de test après réduction TCE Expérience
- Répétez l'étape 4 complètement.
7. Identification des micro-organismes
- Prélever des échantillons de boues d'environ 0,5 g chacun et effectuer l'extraction d'ARN totale selon la méthode standard de 12.
- Amplifier le gène de l'ARNr 16S avec transcription inverse et conduire la réaction de polymérisation en chaîne (RT-PCR) une étape 12.
- Concevoir les amorces pour amplifier ou l'utiliser comme une première approche de celles suggérées dans la littérature 11. Suivez l'amplifprocédure de ication suggéré dans la littérature 12.
- Construire les bibliothèques ARNr 16S. Amplicons PCR peuvent être clonées en utilisant un kit de clonage-11. Typiquement, 10 colonies de chaque plaque (chaque colonie représentant un produit de PCR) peuvent être clonées. Préparer l'ADN plasmidique pour le séquençage selon la méthode proposée dans la littérature 12.
- Effectuer le séquençage des fragments. Re-amplifier environ 1400 pb des produits de PCR externes au protocole pour l'amplification PCR décrit précédemment (étape 7.4) et clone selon le mode opératoire proposé dans la littérature 12. Isoler le plasmide recombinant de E. colonies coli comme suggéré dans la littérature 12. Ne mener la procédure partielle pour le séquençage avec des amorces universelles M13 12.
- Effectuer l'analyse des séquences. Alignez les séquences nucléotidiques en utilisant le Clustal X et ajuster manuellement dans l'éditeur de texte. Effectuer des recherches BLAST des databas NCBIe. (http://www.ncbi.nlm.nih.gov/BLAST/Blast.cgi) 12.
- Obtenir les numéros d'accession de la séquence nucléotidique. Déposer les séquences nucléotidiques des clones identifiés dans la base de données de séquence nucléotidique EMBL (Gen-Bank / EMBL / DDBJ) sous les numéros d'accès correspondantes (c.-JQ713915eJQ713925 pour les séquences de amplicons) 12.
Résultats
Un comportement typique de la réduction de sulfate dans le bioréacteur est représenté sur la Figure 5. Il est important de noter que pendant les premières semaines de la réduction de sulfate de fonctionnement sera lente. Cependant lente, la consommation de plus de 90% de sulfate au fil du temps indique que l'inoculum développe une communauté microbienne capable de réduire le sulfate et donc, enrichi en sulfate bactéries réductrices. Les différentes périodes de la figure indiquent que la...
Discussion
Il existe plusieurs applications de sulfidogenesis dans la biotechnologie environnementale, l'une des applications les plus utilisées du métabolisme des bactéries réductrices de sulfate dans des consortiums avec la fermentation des bactéries est en traitement des eaux usées. Réacteurs UASB sont parmi les principales approches conçus pour le traitement des eaux usées industrielles avec des concentrations élevées de sulfate. Dans ce travail, nous présentons un protocole pour obtenir des boues sulfurogènes...
Déclarations de divulgation
The authors Selene Montserrat García-Solares, Claudio Garibay-Orijel and Claudia Guerrero Barajas submitted (as inventors) in 2012 the application to obtain a patent entitled: “Process for the anaerobic treatment of industrial wastewater with high content of sulfate and chlorinated compounds”. This submission has been approved to the stage of the formatting. The submission has Instituto Politécnico Nacional as the rights owner.
Remerciements
The authors are grateful for the financial support provided by Instituto Politécnico Nacional grants 20120110, 20130399 and 20140239 SIP and also by Instituto de Ciencia y Tecnología del Distrito Federal Mexico (PICS 08-79, ICYT-DF, 2009-2012). Thanks also to CONACYT – Mexico for the graduate scholarship (225806) awarded to Selene Montserrat García-Solares and for the financial support provided by grant 82627.
matériels
| Name | Company | Catalog Number | Comments |
| trichloroethylene | sigma Aldrich | 251402 | |
| cis-1,2-dichlorotehylene | sigma Aldrich | ||
| trans-1,2-dichloroethylene | sigma Aldrich | D-62209 | |
| vinyl chloride scotty standard | supelco | 1,000 ppm v/v in nitrogen | |
| ethene scotty standard | supelco | 99% purity | |
| pump | Masterflex | Model 7553-75 | |
| spectrophotometer | any | ||
| microcentrifuge | any | ||
| gas tight syringes | any | 100 and 200 microliters | |
| UASB glass reactor | any | under design | |
| gas chromatograph | any | FID detector | |
| capillary column SPB-624 | supelco | ||
| pH meter | any | ||
| viton tubing | Masterflex | ||
| basal medium reagents | any | ||
| trace metals reagents | any | ||
| vitamins solution reagents | any | ||
| sodium sulfate | any | ||
| volatile fatty acids | any | ||
| COD determination kit | HACH | range 0-15,000 mg/L | |
| TOPO-TA cloning kit pCR®4.0 | Invitrogen, US | ||
| S.N.A.P. TM Miniprep Kit | Invitrogen, UK | ||
| Pure link TM Quick Plasmid Miniprep kit | Invitrogen |
Références
- Lens, P., Esposito, M. V. G., Zandvoort, M. Perspectives of sulfate reducing bioreactors in environmental biotechnology. ReViews Environmental Science and Biotechnology. 1 (4), 311-325 (2002).
- Omil, F., Lens, P., Hulshoff, P., Lettinga, G. Characterization of biomass from a sulfidogenic, volatile fatty acid-degrading granular sludge reactor. Enzyme and MicrobialTechnology. 20, 229-236 (1997).
- Lopes, S. I. C., Wang, X., Capela, M. I., Lens, P. N. L. Sulfate reduction during the acidification of sucrose at pH 5 under thermophilic (55 °C) conditions.II: Effect of sulfide and COD/SO4-2 ratio. Bioresource Technology. 101, 4278-4284 (2010).
- Alfonso, P., Prol-Ledesma, R. M., Canet, C., Melgarejo, J. C., Fallick, A. E. Sulfur isotope geochemistry of the submarine hydrothermal coastal vents of Punta Mita, Mexico. Journal of Geochemical Exploration. 78-79, 301-304 (2003).
- Valdemarsen, T., Kristensen, E. Degradation of dissolved organic monomers and short chain fatty acids in sandy marine sediment by fermentation and sulfate reduction. Geochimica et Cosmochimica Acta. 74, 1593-1605 (2010).
- Quistad, S. D., Valentine, D. L. Anaerobic propane oxidation in marine hydrocarbon seep sediments. Geochimica et Cosmochimica Acta. 75, 2159-2169 (2011).
- Futagami, T., Morono, Y., Terada, T., Kaksonen, A. H., Inagaki, F. Dehalogenation activities and distribution of reductive dehalogenase homologous genes in marine subsurface sediments. Applied and Environmental Microbiology. 75 (21), 6905-6909 (2009).
- U.S. Environmental Protection Agency. List of priority pollutants. Clean Water Methods. , (2014).
- Ozdemir, C., Dursun, S., Karatas, M., Sen, N., Sahinkaya, S. Removal of trichloroethylene (TCE) in upFlow anaerobic sludge blanket reactors (UASB). Biotechnology and Biotechnological Equipment. 21 (1), 107-112 (2007).
- Zhang, Y., Wang, X., Hu, M., Li, P. Effect of hydraulic retention time (HRT) on the biodegradation of trichloroethylene wastewater and anaerobic bacterial community in the UASB reactor. Applied Microbiology and Biotechnology. 99, 1977-1987 (2015).
- . . Standard Methods for the Examination of Water and Wastewater. , (1998).
- Guerrero-Barajas, C., et al. Enhanced sulfate reduction and trichloroethylene (TCE) biodegradation in a UASB reactor operated with sludge developed from hydrothermal vents sediments: process and microbial ecology. International Biodeterioration and Biodegradation. 94, 182-191 (2014).
- Trüper, H. G., Schlegel, H. G. Sulphur metabolism in Thiorhodaceae I. Quantitative measurements on growing cells of Chromatium okenii. Antoine van Leeuwenhoek. 30, 225-238 (1964).
- Gallegos-García, M. G. . Biological processes of sulfate reduction in biofilms for metals precipitation [Ph D thesis]. , (2009).
- Guerrero-Barajas, C., Garibay-Orijel, C., Rosas-Rocha, L. E. Sulfate reduction and trichloroethylene biodegradation by a marine microbial community from hydrothermal vents sediments. International Biodeterioration and Biodegradation. 65, 116-123 (2011).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon