Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Разработка сульфидогенных шлам из морских отложений и уменьшению трихлорэтилена в одеяло реактора с восходящим потоком анаэробного ила
В этой статье
Резюме
Microbial sulfate reduction is a process of great importance in environmental biotechnology. The success of the sulfidogenic reactors depends among other factors on the microbial composition of the sludge. Here, we present a protocol to develop sulfidogenic sludge from hydrothermal vents sediments in a UASB reactor for reductive dechlorination purposes.
Аннотация
The importance of microbial sulfate reduction relies on the various applications that it offers in environmental biotechnology. Engineered sulfate reduction is used in industrial wastewater treatment to remove large concentrations of sulfate along with the chemical oxygen demand (COD) and heavy metals. The most common approach to the process is with anaerobic bioreactors in which sulfidogenic sludge is obtained through adaptation of predominantly methanogenic granular sludge to sulfidogenesis. This process may take a long time and does not always eliminate the competition for substrate due to the presence of methanogens in the sludge. In this work, we propose a novel approach to obtain sulfidogenic sludge in which hydrothermal vents sediments are the original source of microorganisms. The microbial community developed in the presence of sulfate and volatile fatty acids is wide enough to sustain sulfate reduction over a long period of time without exhibiting inhibition due to sulfide.
This protocol describes the procedure to generate the sludge from the sediments in an upflow anaerobic sludge blanket (UASB) type of reactor. Furthermore, the protocol presents the procedure to demonstrate the capability of the sludge to remove by reductive dechlorination a model of a highly toxic organic pollutant such as trichloroethylene (TCE). The protocol is divided in three stages: (1) the formation of the sludge and the determination of its sulfate reducing activity in the UASB, (2) the experiment to remove the TCE by the sludge, and (3) the identification of microorganisms in the sludge after the TCE reduction. Although in this case the sediments were taken from a site located in Mexico, the generation of a sulfidogenic sludge by using this procedure may work if a different source of sediments is taken since marine sediments are a natural pool of microorganisms that may be enriched in sulfate reducing bacteria.
Введение
Одним из наиболее важных вкладов в окружающей биотехнологии была конструкции биореакторов, в котором шлам использовали (инокулята) смог выполнить в соответствии с серопонижающих условиях. Сульфатредукция (SR) позволяет обрабатывать потоков сточных вод, содержащих высокие концентрации сульфата в дополнение к одновременным удалением ХПК, тяжелых металлов и органических загрязнителей, в том, что делает SR желательной характеристикой шлама 1. Некоторые примеры стоков, загрязненных сульфата приходят из кожевенных, бумажных, фармацевтической и химической отраслях обрабатывающей промышленности 1. Тем не менее, в большинстве литературы относится к сульфидогенных шлама при метаногенных гранулированного осадка была адаптирована к sulfidogenesis 2. Эта адаптация обычно достигается путем манипулирования ХПК / SO 4 2- соотношение в биореакторе и добавления химических веществ ингибировать метаногены в иле 2,3. В дополнение к длительного времени, что Mау требует формирования сульфидогенных гранул, конкуренция между метаногенами и сульфатных восстановителей и толерантности ила высоких концентраций сульфида некоторые из основных проблем, которые могут возникнуть, если сульфидогенных шлама используется в биореакторе получают из адаптации преимущественно метаногенных осадка сульфат восстановительных условиях. В этой работе мы описываем процедуру получения преимущественно сульфидогенных шлама из гидротермальных жерл осадков (Punta Mita, Наярит, Мексика) в восходящим анаэробного ила реактора (UASB), то мы оцениваем ее серопонижающих деятельность в течение долгого времени, и провести эксперимент чтобы оценить его заявление о восстановительного дехлорирования. Расположение отложений был выбран потому, что было сообщено, что в этом месте происходит образование сульфидов за счет снижения активности сульфата проявляемой микробного сообщества, обитающих этом конкретном месте 4.
Есть разорватьаль преимущества в получении этой сульфидогенных шлама из осадков в течение адаптации метаногенные гранулированный осадок, чтобы sulfidogenesis. Некоторые из этих преимуществ: (1) нет необходимости, чтобы сформировать гранулы для биореактор в эксплуатации, (2) шлам терпит относительно высокие концентрации сульфида по сравнению с другими UASB, которые работают с адаптированной метаногенного ила, и (3) есть нет конкуренции за субстрат с метаногенами даже если ацетат, используемых в смеси летучих жирных кислот, которые включены в культуральную среду, чтобы способствовать образованию осадка.
Эта процедура последовало способствовать sulfidogenesis потому морские отложения являются естественным пул широкого спектра микроорганизмов, таких как бактерии серопонижающих, ферментации бактерии и бактерии дегалогенирование это лишь несколько 5,6. Тип консорциума разработана из морских отложений с помощью этого протокола может проявлять эффективность в сульфатредукции и поэтому, высокий с ulfate снижения активности в течение долгого времени и более высокую устойчивость к сульфида в концентрациях выше, чем сообщалось в токсичен для метаногенами и сульфатных бактерий. С другой стороны, вполне вероятно, что способность дегалогенирующего также показано в осадках, следуя протокол, предложенный здесь, но это может зависеть от исходного микробного сообщества. Это предположение делается на основании того факта, что восстановительное дехлорирование может происходить либо при дыхании или cometabolism, оба условия, которые могут быть способствовали в морской микробного сообщества 7. Культивирование отложений, чтобы получить шлам был проведен с использованием смеси ацетат, пропионат, бутират и в качестве субстрата, потому что эти летучие жирные кислоты используются несколько штаммов бактерий серопонижающих. Эти кислоты также тип соединений углерода часто встречается в морских отложениях, по мнению ряда отчетов в литературе на углеродистого материала в морских отложениях 5,6.
Содержание "> Наконец, некоторые из наиболее токсичных соединений, которые находятся в подземных и другие водоемы по всему миру являются хлорированные растворители, такие как трихлорэтилен (TCE) или перхлорэтилена (PCE). Эти соединения являются токсичными не только для человека, но также микроорганизмов, особенно ТВК, которая до сих пор считается приоритетным загрязнителем Агентством по охране окружающей среды в США 8. В этой работе мы предложили эксперимент, в котором сульфидогенных осадка проверяется на его способности снижать ТВК в концентрациях, которые находятся в Диапазон сообщалось хлорированные соединения биодеградации метаногенных условиях 9,10. Стоит отметить, что большинство исследований по биодеградации хлорированных соединений было проведено метаногенных условиях 9,10. Мы считаем, что эксперимент с ТВК предложил в этом протоколе является Хорошим примером потенциальных применений ила. Целью этого эксперимента было электроннойvaluate допуск шлама к TCE и TCE влияния на сульфате восстанавливающей активностью. Принимая во внимание, что большинство исследований по биодеградации хлорированных соединений осуществляется метаногенных условиях, этот протокол предполагает формирование осадка могут быть использованы одновременно: (1) удалени сульфата, (2) удалить трески и (3) удалить хлорированные соединения. Следующим шагом может быть, чтобы оценить шлама на одновременным удалением ТВК и тяжелых металлов (в дополнение к сульфату и ХПК), два условия, которые не могут быть оценены метаногенных условиях.протокол

Рисунок 1. Схема для шагов протокола. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
1. Сбор морских отложений для формирования осадка
- Выявить доступным подводного область либо близко к гидротермальных жерл (из-за присутствия сульфидов, которые могут указывать на более высокий серопонижающих деятельность) или на территории, где мусор органического вещества являются обнаружить.
- Для этой работы, занимает примерно 3 или 4 кг осадка и слейте воду образцов. Поместите образцы в темных пластиковых пакетах. Нет холодильное не требуется.
- После того, как в лаборатории, держать сумки с образцами в холодильнике, если они не будут использоваться немедленно. Для этой работы, SAMPле может быть в холодильнике несколько недель или месяцев, прежде чем их использовать.
- Возьмите большую часть образца осадка (т.е., 1 или 2 кг) и использовать соответствующую сетку (0,2 см), чтобы исключить из отложений большой мусора из углеродистого материала, который может быть найден или некоторых пород, которые могут присутствовать.
Примечание: В этом случае сетка 0,20 см в диаметре (0.0767 дюйма) был использован, но он может быть другого размера в зависимости от размера частиц в образце.- После прохождения осадка через сетку, смешать часть выбранного способствовать тому, чтобы часть является однородным.
- Возьмите разделенных меньшие образцы (т.е., от 2 до 3 г), чтобы определить, летучих взвешенных твердых частиц (VSS), содержание, следуя стандартные методы 11.
Примечание: На рисунке 2 шагах 1,2 до 1,4.

Рисунок 2. Фотографии образцов отложений.Образцы (А) засыпные только после того, как принято. Образца (В) осадка после прохождения через сетку. (C) образец, взятый для взвешивания до летучих взвешенных твердых частиц (VSS) определение. Чашку Петри не должны быть стерилизованы. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
2. Биореактор Настроить
- Для этой работы, использовать стеклянную реактор UASB общей рабочим объемом 3 L. Альтернативно, используйте объем стеклянный реактор 1 или 2 л.
- В расчете на содержание VSS осадков рассчитать количество осадка для использования в качестве инокулята для получения 5 г VSS в 1 л
- Следует учитывать, что если количество осадка после вычислений слишком велико, то примерно 25% до 30% объема биореактора следует занятой отложений вместо.
- Запишите содержание VSS, так как онизменится, когда микробного сообщества обогащается в биореакторе. Содержание VSS необходим для расчетов серопонижающих деятельность в биореакторе.
- Убедитесь, что конечная концентрация базальной среды и буферного раствора в биореакторе похож на сообщает Guerrero Барахас и др. (2014) 12.
- Гарантировать, что окончательный объем осадков, базальной среде, буферный раствор и летучих жирных кислот равны окончательного рабочего объема реактора. Базальная среда рецепт 12 содержит соответствующие концентрации для трассировки металлов и витаминов решения.
- Подготовка исходного раствора базальной среде и буферного раствора в соответствующей концентрации для рабочего объема реактора, используемого (т.е. 2, 3 или 4 раза более концентрированный, чем сообщалось в шаге 2.4), чтобы гарантировать, что при разбавлении, что при концентрации сообщили в Герреро-Барахас и др. (2014)12).
Примечание: Исходный раствор для базальной среде всегда необходимо, однако, буферный раствор необходим только при запуске. Нет необходимости добавлять буферный раствор после этого времени. - Подготовка исходного раствора летучих жирных кислот: ацетат, пропионат и бутират в 2,5: 1: 1 ХПК пропорции. Примите во внимание для расчетов ацетат натрия, включенных в основной среде. Конечная концентрация ХПК в реакторе должна быть 2,7 г / л.
Внимание: Подготовьте решение в вытяжном шкафу. Носите нитриловые перчатки и защитные очки для подготовки этого решения. Примите во внимание стехиометрии реакций сульфата с летучих жирных кислот, которые показаны на рисунке 3. - Подготовка исходного раствора сульфата натрия (Na 2 SO 4) в соответствующей концентрации, чтобы доставить в реактор конечной концентрации 4,000 мг / л сульфат-иона (SO 4 2-). Кроме того, включают в себя гое количество сульфата, необходимого в базальной среде вместо добавления его из исходного раствора до тех пор, заключительного сульфата (SO 4 2-) концентрация прав.
- Поместите отложений в реакторе смешанного с частью базальной среды, чтобы убедиться, что они достигают нижней части реактора.
- Добавить остальные базальной среды и буферного раствора, смешанного с летучим раствором жирных кислот и раствор сульфата. Убедитесь, что решение летучих жирных кислот выливают в жидкости. Примечание: Провести этот шаг в вытяжном шкафу.
- Установите соединений и трубопроводов реактора к насосу рециркуляции. Установите скорость переработки потока в 60 мл / мин. Установка биореактора в холодильной камере при температуре 34 ° С. Регулярно проверяйте, что колебания температуры малы (то есть, 34 ± 1,7 ° С)
- Установите подключение к колонке перемещения газа.
Примечание: Рисунок 4 для шагов 2.1 до 2.5.
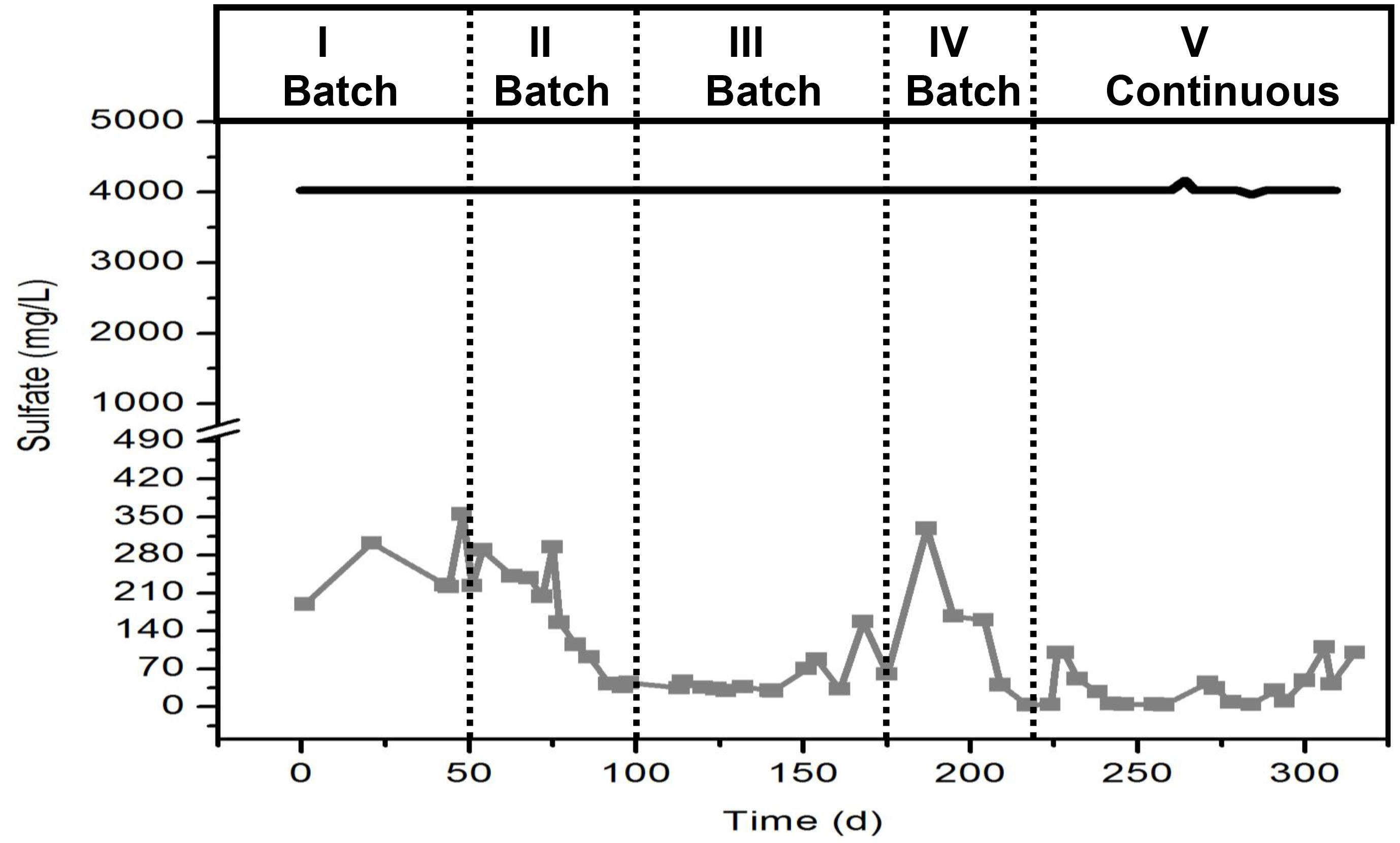
Рисунок 3. стехиометрии восстановления сульфатов с ЛЖК (ацетат, пропионат и бутират). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Рисунок 4. UASB реактора. (А) начальный момент времени. (В) Непрерывный режим после 300 дней работы. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.3. Эксплуатация реактора поощрять Sulfidogenesis и рост микроорганизмов
Примечание: Разрешить для посевной потреблять Volatile жирные кислоты и сульфата. Для этого, ждать неделю, чтобы провести первый анализ для сульфата, сульфид и потребления ХПК.
- После одной недели инкубации взять пробу 5 до 7 мл жидкости для проведения анализа ХПК, сульфат и контент сульфида и pH следующие стандартные методы 11, 13.
- Анализ сульфида в жидкой спектрофотометрически (при длине волны (X) 670 нм), следуя метилен синий метод 13.
- Поместите по 5 мл раствора ацетата цинка (2% вес / вес) в 25 мл мерную колбу, добавить быстро 200 мкл образца к раствору ацетата цинка.
- Добавить 2,5 мл смеси N, N-диметил п -phenylenediamine раствора оксалата (DMP) (0,2% вес / вес в 20% H 2 SO 4) и 125 мкл железа (III), раствор сульфата аммония (10% вес / ж в 2% H 2 SO 4) и в комплекте с дистиллированной водой в 25 мл в мерную колбу. Подождите 30 мин для реакциипроизойти, время, в которое синий цвет стабилизировалась. 13.
Примечание: Подождите по меньшей мере 15 мин, но не более чем за 60 мин до тестирования образцов в спектрофотометр. Провести чтение синей окончательного решения в спектрофотометр.
- Анализ сульфат соответствии со стандартными методами 11. Здесь количественно сульфат бария в виде сульфата с использованием метода Турбидиметрический.
- Поместите по 5 мл раствора для кондиционирования (соляная кислота HCl 1: 1) в мерную колбу на 25 мл, добавляют 1 мл предварительно центрифугируют образца (на 11,320 × г), завершить 25 мл мерную колбу с дистиллированной водой и добавить 1 г хлорида бария.
- Смешайте раствор в течение 1 мин в вихревой. Подождите 4 мин для сульфата бария с образованием и читать образца в спектрофотометре при длине волны (X) 420 нм 11.
- Анализ ХПК в соответствии со стандартными методами 11. В качестве альтернативы, используйте ХПК determinaние комплект.
- До определения ХПК, центрифуги образца тщательно (в 11,320 мкг), чтобы удалить оставшиеся сульфид, который может вмешиваться в определение. При необходимости, центрифуги дважды: первый раз сразу после взятия пробы, а второй раз ждать 6 или 8 ч, а затем провести анализ ХПК.
- Добавить 2 мл образца в реакционную пробирку комплекта определения ХПК, печать флакон и гомогенизации смеси путем легкого встряхивания. Приготовьте чистый добавлением 2 мл дистиллированной воды к другой реакционный сосуд и гомогенизации смеси.
- Поместите флаконов в реакторе пищеварения при 150 ° С в течение 2 ч. Удалить флаконы и дайте им остыть в темноте. Возьмите показания флаконов в спектрофотометре при длине волны 620 нм.
- Получение объем газа из колонки перемещения газа.
- Анализ сульфида в жидкой спектрофотометрически (при длине волны (X) 670 нм), следуя метилен синий метод 13.
- Подождите до другого 5 до 7 дней, пока сульфат не потребляется. Сульфат и ХПК следует употреблять вpproximately 85% до 90%, прежде чем запускается новая партия кормили.
- После того, как сульфат (и ХПК) потребляются полностью повторите шаг 2.4. Поставка свежую среду и новые питательные вещества для каждой партии.
- Повторите шаги 3.1 и 3.2. На данный момент каждая партия должна длиться от 7 до 10 дней.
- При 3 до 4 порции были завершены, повторите шаг 2,4, но увеличивают концентрацию ХПК до 4 г / л.
- Повторите шаг 3.1 и 3.2 шаг.
- Повторите шаг 3,3, но увеличивают концентрацию ХПК до 6 г / л.
- Повторите 3.6 и 3.6.1 постепенно увеличивая концентрацию ХПК до тех пор, пока 10 г / л.
Примечание: сделать график, который представляет концентрации сульфата (мг / л) в зависимости от времени (г).
- При Расход сульфата составляет более 80% менее чем за 24 ч и это имеет место при более чем одной недели, переключение на работу реактора непрерывном режиме. Для непрерывного режима установки времени гидравлического удерживания (HRT) при 24 ч и поддерживать концентрацию сульфата в 4 г / л и COD10 г / л.
Примечание: Со временем потребление сульфата должно быть быстрее.
4. серопонижающих активность тест
- До этого теста убедитесь, что биореактор при непрерывном режиме представляет менее 10% вариации в концентрации сульфата оставшихся.
- В любой день, остановить реактор после цикла и поведения шаге HRT 2.4. На шаге 2.4.3 использовать концентрацию ХПК 10 г / л.
- После того, как биореактор подается, занимает от 5 до 7 мл образцы жидкости и выполнения анализа по ХПК, сульфат, сульфид (этап 3.1) и рН каждый час. Запишите объем газа.
- Рассчитайте серопонижающих деятельность в соответствии с литературой 14.

SRA = серопонижающих деятельность (мг ХПК H 2 S) / gVSS * d
м Н 2 S = концентрация сульфида выраженные в мг ХПК-H 2 S
VSS = летучих Концентрация взвешенных твердых частиц
т = время (d или час)
- Сделайте соответствующие графики, которые показывают процент сульфата потребления в зависимости от концентрации сульфида в течение долгого времени в мг / л. Сделайте графики, которые показывают процент потребления ХПК с течением времени. Сделайте графики, которые показывают изменение рН в течение долгого времени.
5. трихлорэтилен (ТХЭ) Тест Снижение
- До этого теста убедитесь, что биореактор работает под непрерывном режиме и представляет менее 10% вариации в концентрации сульфата оставшихся. Не начать этот тест, если Сульфатредукция в биореакторе составляет менее 90%.
- Подготовка исходного раствора трихлорэтилен (ТХЭ) с учетом, что конечная концентрация указанного соединения в жидкой фазе биореактора должна быть 300 мкм. Рассмотрим partitioniнг соединения в свободном пространстве с помощью безразмерная константа закона Генри (Н ~) для ТВК в 34 ° C. H'at 34 ° С в течение ТВК является 0,4722.
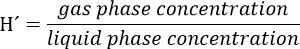
Внимание: Подготовьте решение в fumehood и носить перчатки и защитные очки.- Например, для 5000 мкМ раствора, а затем рассчитать, как:
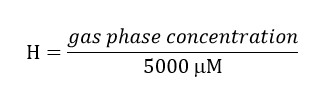
ТВК газовой фазы концентрация = (0,4722) * (5000) = 2,139 мкм. Включить эту концентрацию в подготовке исходного раствора, так как это количество ТХЭ будет в свободном пространстве.
Затем в жидкости (воды) из маточного раствора, фактическую концентрацию ТВК будет: 5000 + 2139 = 7,139 мкМ. Плотность ТВК = 1,43 г / мл. Преобразование 7139 мкм до Mg, а затем с помощью плотности TCE рассчитать объем TCE для исходного раствора.
Примечание: концентрация исходного раствора ТВК мау быть ниже, чем 5000 мкм, т.е., 3000 или 1000 мкМ, это зависит от того, насколько объем этого раствора могут быть доставлены в биореактор по его объему жидкой фазы.
- Например, для 5000 мкМ раствора, а затем рассчитать, как:
- Подготовка стандартных кривых в газовый хроматограф для TCE, цис -1,2-дихлорэтилен транс -1,2-дихлорэтилена, винилхлорид и этилен. Подготовьте СНГ -1,2-дихлорэтилена и транс -1,2-дихлорэтана стандартные кривые из маточного раствора этих соединений, следуя той же процедуре, описанной в пункте 5.2 для ТХЭ маточного раствора. Подготовка стандартных кривых для винилхлорида и этилена путем разбавления концентрацию каждого газа из стандартов (газовые баллоны).
- Подготовка стандартных кривых этих соединений в диапазоне от 20 до 300 мкм. Используйте методом, описанным Герреро-Барахас и др. (2011) 15 для анализа этих соединений в газовый хроматограф.
Внимание: Подготовка них стоятARD решения в fumehood и носить перчатки и защитные очки.
- Подготовка стандартных кривых этих соединений в диапазоне от 20 до 300 мкм. Используйте методом, описанным Герреро-Барахас и др. (2011) 15 для анализа этих соединений в газовый хроматограф.
- В любой день, остановить реактор после цикла и поведения шаге HRT 2.4. На шаге 2.4.3 использовать концентрацию ХПК 10 г / л.
- После того, как биореактор подается, добавить непосредственно к TCE жидкости в биореакторе с маточного раствора, полученного в 5.2, конечная концентрация ТХЭ в жидкой фазе биореактора должна быть 300 мкм. Установите HRT до 12 часов.
- В конце одного цикла ЗГТ взять образцы жидкости (500 до 1000 мкл) и проводить анализ для определения ХПК, сульфат и сульфид (шаги 3.1.1, 3.1.2 и 3.1.3). Брать пробы свободного пространства (от 100 до 250 мкл) и проводят анализ для TCE, цис -1,2-дихлорэтилен транс -1,2-дихлорэтилена, винилхлорид и этилен в газовой хроматографии.
- Повторите шаг 2.4. На шаге 2.4.3 использовать концентрацию ХПК 10 г / л.
- Не повторять тест сокращения ТВК, пока биореактор не представляет более 90% снижение сульфат и менее 10% вариации в обоих, сульфат и сульфат снижение оставшихся в биореактор.
- Повторите 5.4, 5.5 и 5.6 два или три раза больше.
- Возьмем отложений образцы (0,5 г) вести идентификацию микроорганизмов только после испытания уменьшение TCE завершена. Сделайте это после того, как 2 или 3 испытаний по сокращению ТВК.
6. серопонижающих активность тест после сокращения ТВК эксперимента
- Повторите шаг 4 полностью.
7. Идентификация микроорганизмов
- Отбирают образцы шлама приблизительно 0,5 г каждого и проводить экстракцию РНК общую согласно стандартному методу 12.
- Амплификации гена 16S рРНК с обратной транскрипцией и проводить полимеразной цепной реакции (ОТ-ПЦР) на один шаг 12.
- Дизайн праймеров для амплификации или использовать в качестве первоначального подхода те предложенные в литературе 11. Следуйте amplifПроцедура ication предложил в литературе 12.
- Построить библиотеки 16S рРНК. ПЦР ампликонов могут быть клонированы с помощью клонирования-комплект 11. Как правило, 10 колоний из каждой пластины (каждая представляет одну колонию ПЦР-продукт) может быть клонирован. Подготовка плазмидной ДНК для секвенирования в соответствии с процедурой, предложенной в литературе 12.
- Провести секвенирование фрагментов. Повторное амплификации примерно 1400 п.о. внешних продуктов ПЦР с протоколом для ПЦР-амплификации описано ранее (шаг 7,4) и клона в соответствии с процедурой, предложенной в литературе 12. Изолировать рекомбинантную плазмиду из E. палочки колонии как предложено в литературе 12. Есть провести частичную процедуру для секвенирования с универсальными праймерами М13 12.
- Провести анализ последовательности. Совместите нуклеотидные последовательности, используя Clustal X и вручную настроить в текстовом редакторе. Выполните BLAST поисках databas NCBIе. (http://www.ncbi.nlm.nih.gov/BLAST/Blast.cgi) 12.
- Получение нуклеотидной последовательности номерами доступа. Депозит нуклеотидные последовательности клонов, идентифицированных в базе данных EMBL нуклеотидной последовательности (Gen-банк / EMBL / DDBJ) под соответствующими номерами доступа (т.е. JQ713915eJQ713925 для последовательностей из ампликонов) 12.
Результаты
Типичный поведение снижению сульфата в биореакторе показано на рисунке 5. Важно отметить, что в течение первых недель снижения сульфата операции будет медленным. Однако медленно, потребление более 90% сульфата с течением времени означает, что посевной разработке микробное соо?...
Обсуждение
Есть несколько применения sulfidogenesis в окружающей биотехнологии, один из наиболее часто используемых приложений метаболизма серопонижающих бактерий в консорциумы с брожения бактерий в очистке сточных вод. UASB реакторы являются одними из основных инженерных подходов к промышленной очис...
Раскрытие информации
The authors Selene Montserrat García-Solares, Claudio Garibay-Orijel and Claudia Guerrero Barajas submitted (as inventors) in 2012 the application to obtain a patent entitled: “Process for the anaerobic treatment of industrial wastewater with high content of sulfate and chlorinated compounds”. This submission has been approved to the stage of the formatting. The submission has Instituto Politécnico Nacional as the rights owner.
Благодарности
The authors are grateful for the financial support provided by Instituto Politécnico Nacional grants 20120110, 20130399 and 20140239 SIP and also by Instituto de Ciencia y Tecnología del Distrito Federal Mexico (PICS 08-79, ICYT-DF, 2009-2012). Thanks also to CONACYT – Mexico for the graduate scholarship (225806) awarded to Selene Montserrat García-Solares and for the financial support provided by grant 82627.
Материалы
| Name | Company | Catalog Number | Comments |
| trichloroethylene | sigma Aldrich | 251402 | |
| cis-1,2-dichlorotehylene | sigma Aldrich | ||
| trans-1,2-dichloroethylene | sigma Aldrich | D-62209 | |
| vinyl chloride scotty standard | supelco | 1,000 ppm v/v in nitrogen | |
| ethene scotty standard | supelco | 99% purity | |
| pump | Masterflex | Model 7553-75 | |
| spectrophotometer | any | ||
| microcentrifuge | any | ||
| gas tight syringes | any | 100 and 200 microliters | |
| UASB glass reactor | any | under design | |
| gas chromatograph | any | FID detector | |
| capillary column SPB-624 | supelco | ||
| pH meter | any | ||
| viton tubing | Masterflex | ||
| basal medium reagents | any | ||
| trace metals reagents | any | ||
| vitamins solution reagents | any | ||
| sodium sulfate | any | ||
| volatile fatty acids | any | ||
| COD determination kit | HACH | range 0-15,000 mg/L | |
| TOPO-TA cloning kit pCR®4.0 | Invitrogen, US | ||
| S.N.A.P. TM Miniprep Kit | Invitrogen, UK | ||
| Pure link TM Quick Plasmid Miniprep kit | Invitrogen |
Ссылки
- Lens, P., Esposito, M. V. G., Zandvoort, M. Perspectives of sulfate reducing bioreactors in environmental biotechnology. ReViews Environmental Science and Biotechnology. 1 (4), 311-325 (2002).
- Omil, F., Lens, P., Hulshoff, P., Lettinga, G. Characterization of biomass from a sulfidogenic, volatile fatty acid-degrading granular sludge reactor. Enzyme and MicrobialTechnology. 20, 229-236 (1997).
- Lopes, S. I. C., Wang, X., Capela, M. I., Lens, P. N. L. Sulfate reduction during the acidification of sucrose at pH 5 under thermophilic (55 °C) conditions.II: Effect of sulfide and COD/SO4-2 ratio. Bioresource Technology. 101, 4278-4284 (2010).
- Alfonso, P., Prol-Ledesma, R. M., Canet, C., Melgarejo, J. C., Fallick, A. E. Sulfur isotope geochemistry of the submarine hydrothermal coastal vents of Punta Mita, Mexico. Journal of Geochemical Exploration. 78-79, 301-304 (2003).
- Valdemarsen, T., Kristensen, E. Degradation of dissolved organic monomers and short chain fatty acids in sandy marine sediment by fermentation and sulfate reduction. Geochimica et Cosmochimica Acta. 74, 1593-1605 (2010).
- Quistad, S. D., Valentine, D. L. Anaerobic propane oxidation in marine hydrocarbon seep sediments. Geochimica et Cosmochimica Acta. 75, 2159-2169 (2011).
- Futagami, T., Morono, Y., Terada, T., Kaksonen, A. H., Inagaki, F. Dehalogenation activities and distribution of reductive dehalogenase homologous genes in marine subsurface sediments. Applied and Environmental Microbiology. 75 (21), 6905-6909 (2009).
- U.S. Environmental Protection Agency. List of priority pollutants. Clean Water Methods. , (2014).
- Ozdemir, C., Dursun, S., Karatas, M., Sen, N., Sahinkaya, S. Removal of trichloroethylene (TCE) in upFlow anaerobic sludge blanket reactors (UASB). Biotechnology and Biotechnological Equipment. 21 (1), 107-112 (2007).
- Zhang, Y., Wang, X., Hu, M., Li, P. Effect of hydraulic retention time (HRT) on the biodegradation of trichloroethylene wastewater and anaerobic bacterial community in the UASB reactor. Applied Microbiology and Biotechnology. 99, 1977-1987 (2015).
- . . Standard Methods for the Examination of Water and Wastewater. , (1998).
- Guerrero-Barajas, C., et al. Enhanced sulfate reduction and trichloroethylene (TCE) biodegradation in a UASB reactor operated with sludge developed from hydrothermal vents sediments: process and microbial ecology. International Biodeterioration and Biodegradation. 94, 182-191 (2014).
- Trüper, H. G., Schlegel, H. G. Sulphur metabolism in Thiorhodaceae I. Quantitative measurements on growing cells of Chromatium okenii. Antoine van Leeuwenhoek. 30, 225-238 (1964).
- Gallegos-García, M. G. . Biological processes of sulfate reduction in biofilms for metals precipitation [Ph D thesis]. , (2009).
- Guerrero-Barajas, C., Garibay-Orijel, C., Rosas-Rocha, L. E. Sulfate reduction and trichloroethylene biodegradation by a marine microbial community from hydrothermal vents sediments. International Biodeterioration and Biodegradation. 65, 116-123 (2011).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены