Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Síntesis controlada y de seguimiento de la fluorescencia de muy uniforme de poli (
En este artículo
Resumen
Polimerización por precipitación no agitada proporciona un enfoque de prototipado rápido, reproducible para la síntesis de los estímulos sensibles al poli (N -isopropylacrylamide) microgeles de estrecha distribución de tamaños. En esta síntesis protocolo, la caracterización de dispersión de luz y fluorescencia de seguimiento de partículas individuales de estos microgeles en una configuración de la microscopía de campo amplio se demuestran.
Resumen
Los estímulos sensibles poli (N -isopropylacrylamide) (PNIPAM) microgeles tienen diversas aplicaciones prácticas potenciales y usos en la investigación fundamental. En este trabajo, utilizamos solo rastreo de partículas microgeles de PNIPAM marcados con fluorescencia como un escaparate para el tamaño de sintonía microgel por un procedimiento de polimerización por precipitación no agitada rápida. Este enfoque es muy adecuado para la creación de prototipos nuevas composiciones y condiciones de reacción o para aplicaciones que no requieren grandes cantidades de producto. la síntesis de microgel, tamaño de partícula y la determinación de la estructura mediante dispersión de luz dinámica y estática se detallan en el protocolo. Se muestra que la adición de comonómeros funcionales puede tener una gran influencia sobre la nucleación y la estructura de las partículas. rastreo de partículas Single de campo amplio microscopía de fluorescencia permite una investigación de la difusión de microgeles trazador marcado en una matriz concentrada de microgeles no etiquetados, un sistema que no fue investigado por la facilidadotros métodos tales como dispersión de luz dinámica.
Introducción
Los estímulos sensibles poli (N -isopropylacrylamide) (PNIPAM) microgeles 1,2 han atraído el interés continuo en las últimas dos décadas debido a su potencial en diversas aplicaciones inteligentes. Casos de uso demostradas incluyen estabilizadores de emulsión conmutables 3-8, microlentes 9, sustratos de cultivo celular para facilitar la recolección de células, 10,11 y portadores inteligentes para compuestos de bajo peso molecular y otros usos biomédicos 12. Desde un punto de vista de investigación fundamental estas partículas se han demostrado ser útiles para la investigación de temas tales como las interacciones coloidales 13-15 y las interacciones de polímero-disolvente 16-18.
El uso exitoso de microgeles de PNIPAM y sus derivados en cualquier aplicación dada normalmente requiere el conocimiento del tamaño de partícula medio y la anchura de la distribución del tamaño de partícula. Para la correcta interpretación de los resultados experimentales implica PNIPAM microgeles, la estructura de las partículas, que puede ser afectada por comonómeros funcionales, tiene que ser conocida. dispersión de luz dinámica y estática (DLS y SLS, respectivamente) son especialmente adecuado para la adquisición de esta información debido a que estos métodos son rápidos y relativamente fácil de usar; y sondean las propiedades de las partículas de forma no invasiva en su ambiente nativo (dispersión). DLS y SLS también recogen datos de gran número de partículas evitando el sesgo derivado de tamaños de muestra pequeños, típicos de métodos de microscopía. Por lo tanto, el primer objetivo de este trabajo es dar a conocer las buenas prácticas en relación con la dispersión de luz de los nuevos practicantes de la caracterización coloidal.
Típicamente, la polimerización por precipitación se lleva a cabo a escala de laboratorio y encontrando las condiciones de reacción adecuadas para propiedades de las partículas específicas puede ser laborioso y requiere muchas repeticiones de la síntesis. En contraste con la síntesis de lotes grandes, polimerización no agitada precipitación 19,20 es arAPID procedimiento en el que los lotes de diferente composición de reactivo puede ser polimerizado partículas simultáneamente rendimiento de estrecha distribución de tamaños. polimerización simultánea minimiza la variación experimental y salida grande significa que las condiciones de reacción adecuadas se pueden encontrar rápida ampliación de la escala de la reacción. Por lo tanto, nuestro segundo objetivo es demostrar la utilidad de la polimerización no se agita la precipitación en la creación de prototipos y en aplicaciones que no requieren una gran cantidad de producto.
Diferentes aspectos de la síntesis y caracterización se unen en el ejemplo de aplicación de la etiqueta fluorescente microgeles de PNIPAM en la investigación de la interacción coloidal. Aquí se utiliza el seguimiento de partícula de gran precisión para investigar la difusión de microgeles trazador marcado en dispersión de microgeles de matriz no marcados en un amplio intervalo de concentración de la matriz y resolver el efecto jaula en dispersión coloidal concentrada. microscopía de fluorescencia de campo amplio es muy adecuado for este propósito, ya que puede caracterizar el comportamiento específico de unas pocas moléculas de trazador entre un gran número de especies potencialmente diferentes de la matriz. Esto está en contraste con las técnicas tales como DLS, SLS y reología, que miden las propiedades medias conjunto de sistemas y por lo tanto no puede resolver el comportamiento de pequeño número de partículas de la sonda en un sistema grande. Además, en este ejemplo específico métodos de dispersión de luz convencionales no pueden ser utilizados también debido a la alta concentración de partículas, lo que conduce a una fuerte dispersión múltiple invalidar cualquier análisis estándar. El uso de tratamiento automatizado de datos y métodos estadísticos permiten el análisis del comportamiento del sistema en general también para el rastreo de partículas individuales, promediada sobre muestras de gran tamaño.
Access restricted. Please log in or start a trial to view this content.
Protocolo
1. Síntesis microgel
NOTA: -isopropylacrylamide N (NIPAM) se recristalizó en n-hexano. Otros reactivos se utilizaron tal como se recibieron.
- Síntesis de lotes convencional de poli (NIPAM) microgeles Matrix
- Disolver 1,8 g de NIPAM y 24 mg de N, N '-bisacrylamide (BIS) en 245 ml filtrados (0,2 micras de celulosa regenerada (RC) filtro de membrana) agua doblemente destilada en un 500 ml de tres bocas matraz de fondo redondo equipado con un condensador de reflujo, un agitador y un tabique de caucho.
- Insertar un termómetro y una aguja 120 mm para la entrada de nitrógeno a través del septum.
- Calentar la solución a 60 ° C, mientras se agita. Desoxigenar la solución de una purga con nitrógeno durante 40 min.
- Simultáneamente preparar una solución de iniciador de 155 mg persulfato de potasio (KPS) en 5 ml filtrados agua bidestilada y la burbuja de la solución con nitrógeno para eliminar el oxígeno.
- La transferencia de los completos 5 ml s KPSolución en una jeringa de nitrógeno-lavado equipada con una aguja de 120 mm.
- Elevar la aguja de nitrógeno por encima del nivel de la solución en el matraz de tres bocas y añadir la solución KPS rápidamente a través del tabique de caucho en el reactor.
- Deje que la polimerización transcurra durante 1 hora bajo flujo de nitrógeno y agitación lenta a 60 ° C.
- Use un embudo Buchner y filtro de papel para filtrar la solución de reacción caliente con el fin de desprenderse de grandes agregados. Deje que la dispersión se enfríe.
- Centrifugar y redispersar la dispersión tres veces durante 40 minutos a 257.000 xg y finalmente redispersar el sedimento en una cantidad viable mínima de agua bidestilada. Típicamente, esto es de 2-4 ml.
- Liofilizar la dispersión para el almacenamiento.
- No agitada Síntesis de microgeles (NIPAM) marcado con fluorescencia Poly
- Pesar 257,7 mg NIPAM, 3,5 mg BIS, y 1,5 mg metacriloxietil tiocarbamoılo rodamina B (colorante) en el recipiente de vidrio y añadir 10 ml de doble destile filtradaagua ed.
- Ultrasonicate la solución de tinte-monómero durante 15 min para disolver el colorante en agua.
- Preparar la misma solución sin el colorante en un recipiente de vidrio por separado.
- Preparar varias diluciones de la solución de monómero con el colorante usando la solución de monómero sin el colorante para obtener una serie de concentraciones con diversas concentraciones de colorante. En este trabajo, el uso de tinte en el rango de concentración de 0,02-0,1 mmol / L.
- Disolver 8,4 mg KPS en 10 ml de agua bidestilada se filtra con el fin de obtener la solución de iniciador.
- Transferir 0,5 ml de la serie de concentraciones y 0,5 ml de la solución de KPS a tubos de ensayo con 10 mm de diámetro para obtener las soluciones de reacción finales y sellarlos con septos de goma.
- Precalentar un baño de aceite en un recipiente de doble pared de vidrio conectado a un circulador de calefacción a 63 ° C.
- Deoxygenize las soluciones de reacción mediante purga con nitrógeno a través de 120 agujas mm para 20 min.
- Inserte los tubos en afloating plataforma y sumergir a la plataforma en el baño de aceite precalentado. Ajuste la temperatura a 60 ° C. Inicialmente mayor temperatura en el baño es necesario ya que las soluciones a temperatura ambiente se enfríe el baño. Para una alta tuning tamaño de partícula precisión el control de la temperatura durante la reacción inicial tiene que ser riguroso, típicamente ± 0,1 ° C.
- Deje que la reacción continúe durante un tiempo apropiado. Por lo general 1 hora es suficiente.
- La transferencia de los tubos de reacción rápidamente a un horno a 60 ° C y poner una gota de la dispersión caliente a 10 ml de agua bidestilada se filtra precalentado sobre el volumen PNIPAM temperatura de transición de fase (VPTT, 32 -34 ° C) 1, para la caracterización en el DLS estado colapsado.
- Dejar que el resto de las dispersiones se enfríe a temperatura ambiente y transferirlos en tubos de centrífuga.
- Centrifugar la solución tres veces durante 40 minutos a 257.000 xg y diluir los microgeles finalmente en 2 ml de agua bidestilada se filtra for uso como partículas trazadoras.
2. Dispersión de Luz Caracterización
- Determinación hidrodinámico Radio en estado colapsado por Dynamic Light Scattering
- Lávese las cubetas y cristalería con vapor de acetona.
- Heat 10 ml de agua destilada doble filtrada (por ejemplo, 200 nm o más pequeño filtro RC) más de PNIPAM VPTT.
- Transferir una gota de la dispersión caliente para el agua filtrada utilizando una aguja pre-calentado (0,9 x 40 mm) y la jeringa (1 ml).
- Templar el DLS goniómetro baño partido índice a 50 ° C y transferir la muestra al instrumento sin dejar que se enfríe.
- Encontrar el mayor ángulo de dispersión, donde la intensidad dispersada es suficiente para adquirir una correlogram mediante la realización de mediciones de prueba.
- Introducir la cubeta de muestra (tubo de vidrio de diámetro 10 mm con 1 ml de la dispersión de partículas). Mover el brazo detector de ángulo de dispersión pequeño (en este caso 30 °).
- Compruebe el perfil del haz for dispersión múltiple: sin resplandor alrededor de la viga principal, sin dispersión múltiple, etc. Compruebe que la gama de títulos es adecuado para la medición en el ángulo de dispersión más baja (aproximadamente entre 30 y 600 kHz; esquina superior derecha de la ventana del software.).
- Mover el brazo del goniómetro de ángulo de dispersión más alta (120 ° elegir aquí). Compruebe que la tasa de recuento es todavía lo suficientemente alta para la medición (entre 30 y 600 kHz). Si la intensidad es demasiado baja, mover el brazo para reducir el ángulo de dispersión.
- Compruebe visualmente el haz a través del cristal del baño tolueno en el ángulo de dispersión más bajo, si resplandor alrededor del haz incidente se observa una dispersión múltiple se lleva a cabo. En este caso, reducir la intensidad del láser o utilizar una dilución mayor.
- Adquirir 20 correlograms entre el mínimo y el ángulo de dispersión máximo (por ejemplo, 30 ° - 140 °) con el mínimo tiempo de adquisición de 60 seg. Aumentar el tiempo de adquisición para grandes ángulos de dispersión de intensidad débilsi necesario.
- Análisis de Datos 37
- Calcular la dispersión de las magnitudes vectoriales para el ángulo de dispersión de acuerdo con la
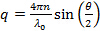 , Donde n es el índice de refracción de la dispersión,
, Donde n es el índice de refracción de la dispersión, 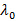 la longitud de onda del láser en vacío y
la longitud de onda del láser en vacío y 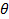 el ángulo de dispersión.
el ángulo de dispersión. - En el caso de que el software de medición proporciona la función de correlación de intensidad
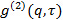 , Transformarla en función de correlación de campo eléctrico
, Transformarla en función de correlación de campo eléctrico 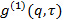 de acuerdo a
de acuerdo a  . Parámetro
. Parámetro 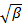 es un parámetro decisivo poco interesante en relación con el grado de coherencia espacial de la luz dispersada over el área del detector.
es un parámetro decisivo poco interesante en relación con el grado de coherencia espacial de la luz dispersada over el área del detector. - Realizar análisis acumulativo en correlograms, es decir, adaptarse polinomio de segundo orden al logaritmo de cada función de correlación de campo eléctrico
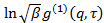 por mínimos cuadrados lineales.
por mínimos cuadrados lineales. 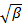 aparece como la intersección de la forma y su valor exacto no es importante en relación con el análisis de datos. Restringir el ajuste a un valor τ tiempo de retraso significativo, por ejemplo, de modo que la amplitud de correlación es 10 a 20% de la amplitud máxima. El coeficiente del término de primer orden es la velocidad de disminución media de la función de correlación,
aparece como la intersección de la forma y su valor exacto no es importante en relación con el análisis de datos. Restringir el ajuste a un valor τ tiempo de retraso significativo, por ejemplo, de modo que la amplitud de correlación es 10 a 20% de la amplitud máxima. El coeficiente del término de primer orden es la velocidad de disminución media de la función de correlación, 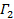 .
. - Encontrar el valor más probable para el coeficiente de difusión media
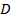 de las partículas por mínimos cuadrados lineales caber en
de las partículas por mínimos cuadrados lineales caber en  . Si
. Si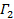 en contra
en contra 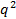 no parece lineal y pasar por el origen dentro del error, la distribución del tamaño de partícula es amplia y radio hidrodinámico será mal definido.
no parece lineal y pasar por el origen dentro del error, la distribución del tamaño de partícula es amplia y radio hidrodinámico será mal definido. - Calcular el radio hidrodinámico medio de la relación de Stokes-Einstein
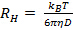 , donde
, donde 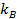 es el coeficiente de Boltzmann,
es el coeficiente de Boltzmann, 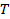 la temperatura absoluta y
la temperatura absoluta y 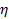 la viscosidad de la dispersión a
la viscosidad de la dispersión a 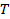 . Propagar la desviación estándar de
. Propagar la desviación estándar de 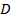 a
a 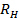 .
.
- Calcular la dispersión de las magnitudes vectoriales para el ángulo de dispersión de acuerdo con la
- Estructura de partículas Determinación por dispersión de luz estática
- Lávese las cubetas y cristalería con vapor de acetona. Utilice 20 mm de diámetro o más grandes cubetas para minimizar el efecto de lente cilíndrica.
- Filter (filtro RC 200 nm o menor) de aproximadamente 20 ml de agua doblemente destilada a un vial de vidrio y transferir una gota de dispersión purificado al vial. Lavar el filtro con 10 ml de agua antes de usarla para la preparación de muestras para eliminar las impurezas que quedan del proceso de fabricación.
- Compruebe muestra en contra de cualquier fuente de luz ambiente. Si se observa un color azul, la muestra es probable que sea demasiado concentrada. Diluir en consecuencia.
- Preparar la muestra de agua de fondo por el lavado de la cubeta varias veces con agua filtrada y luego llenar hasta el volumen apropiado de la muestra, dependiendo de la cubeta y la posición del láser en el instrumento. El láser debe pasar a través de la muestra sin ser refractada desde el menisco.
- Calibrar el instrument usando una muestra de tolueno.
- Medir la dispersión de agua (de fondo) en todo el rango angular disponible.
- Medir la intensidad de la dispersión de la muestra a lo largo del rango angular disponible preferentemente en varias longitudes de onda. El patrón de Dispersión Normalizada a la intensidad de dispersión hacia adelante se conoce como el factor de forma.
- Si la estructura de las partículas se conoce, utilice la expresión modelo apropiado para el cálculo de ajuste global de los conjuntos de datos medidos en diferentes longitudes de onda.
- Para uso desconocido estructura de partículas regularizado directa (como FitIt! 33) o una inversa indirecta más general transformada de Fourier 21,22 rutina conjuntamente con la deconvolución de la función de distribución de par distancia (sólo para partículas esféricas) 23,24 para la clasificación aproximada de partícula tipo.
- En caso de que la rutina de ajuste o inversión proporciona una estimación de la función de distribución radio de la partícula, calcular la polidispersidadíndice (desviación estándar de la distribución dividida por su media).
3. Seguimiento de partículas por microscopía de fluorescencia de campo amplio
NOTA: Tracer y de la matriz de partículas de 465 ± 7 nm y 405 nm ± 7 radios hidrodinámicos a 20 ° C, respectivamente, fueron utilizados para el rastreo de partículas.
- Preparación de la muestra
- Preparar dispersión matriz microgel concentrado por redispersión cantidad conocida de microgel no marcado se liofilizó para cantidad conocida de agua bidestilada. Añadir una pequeña cantidad de partículas de trazador marcado.
- Confirmar la concentración del marcador microgel apropiada en el microscopio. La concentración óptima es un compromiso entre adquisiciones simultáneas de número máximo de pistas, al tiempo que la concentración de marcador lo suficientemente bajo como para que la probabilidad de que las pistas de partículas de trazador se cruzan durante la adquisición es insignificante.
- Preparar dispersiones concentradas por evaporaciónde agua en un horno. Determinar la concentración de peso comparando el peso de la dispersión al peso original de la muestra antes de la evaporación.
- Adquisición y análisis de datos
- Utilizar una lente de objetivo apropiado de la ampliación deseada y la abertura para la excitación de los trazadores y la recogida de la fluorescencia de la muestra simultánea. En este trabajo, use un 100X / 1.3 NA aceite de inmersión, lente del objetivo.
- Coloque la cámara de humedad sobre una mesa xyz-piezo, que encaja en un microscopio comercial.
- Para evitar que la muestra de secado, colocar una hoja de cubierta plasma limpiado en la cámara de humedad y la pipeta 10 l de poli (NIPAM) dispersión de la concentración deseada en el deslizamiento.
- Dependiendo de la excitación y espectros de emisión del colorante fluorescente, utilizar un láser adecuado para la excitación y ajustar la potencia del láser apropiadamente. La intensidad debe ser suficientemente bajo para evitar photobleaching rápido de los tintes, pero alal mismo tiempo lo suficientemente fuerte para el posicionamiento exacto sola partícula (véase más adelante). En este trabajo, use un bombeado por diodos láser de estado sólido de 561 nm y mantener constante la potencia del láser a los 16 mW (ca. 0,5 kW cm-2 en la muestra) para todas las mediciones.
- Para obtener una iluminación homogénea de la muestra, utilice la configuración de iluminación crítica se describe aquí. Para ello, par el láser en una fibra multimodo (NA 0,22 ± 0,02, 0,6 mm de diámetro del núcleo), agitar la fibra utilizando un vórtice temporal con el fin de promediar motas láser, y se proyecta la fibra de extremo en el plano de la muestra.
- Calibrar la distancia z de la reflexión posterior de la hoja de la cubierta y se centran varios micrómetros en la muestra moviendo el objetivo ligeramente hacia arriba y fijar la posición z usando un z-compensador. Esto evita cualquier efecto de interfaz con el cubreobjetos.
- Ajuste los parámetros del detector, tales como tiempo de exposición, a la fuerza de la señal de fluorescencia. En este caso, utilizar una cámara EMCCDcon el tiempo de exposición de 0,1 segundos, el modo de electrones y la ganancia de 50 multiplicando.
- Adquirir varias películas con el número apropiado de tramas para obtener tiempo de retraso adecuado para calcular el desplazamiento cuadrático medio de los microgeles en diferentes regiones de la muestra. En este trabajo, utilice los números de fotograma de adquisición de 500 o 1.000 marcos.
- Analizar los datos mediante la colocación de las partículas en cada cuadro con el mecanismo de Gauss 25 y utilizar un algoritmo de seguimiento de partícula apropiado 26 para obtener el desplazamiento cuadrático medio. 27 Calcular los valores medios y desviación estándar promediando sobre todas las pistas de todas las películas. Calcular los coeficientes de difusión de largo tiempo de retraso por regresión lineal a partir de
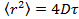 , dónde
, dónde 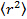 es el desplazamiento cuadrático medio, D el coeficiente de difusión media y la tau el tiempo de retraso.
es el desplazamiento cuadrático medio, D el coeficiente de difusión media y la tau el tiempo de retraso. - Estimate el parámetro γ anomalía de la ecuación de difusión anómala
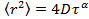 mediante la transformación de los datos en escala logarítmica, produciendo
mediante la transformación de los datos en escala logarítmica, produciendo 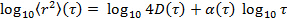 . El parámetro anomalía
. El parámetro anomalía 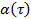 está dada por la derivada de la trama. El derivado puede ser estimado por las diferencias finitas de los puntos de datos, o el montaje de los puntos de datos por funciones polinómicas y diferenciar analíticamente. Determinar el grado suficiente de las funciones de ajuste polinómico por el trazado de los residuos de ajuste y norma residual para incrementar el fin polinomio.
está dada por la derivada de la trama. El derivado puede ser estimado por las diferencias finitas de los puntos de datos, o el montaje de los puntos de datos por funciones polinómicas y diferenciar analíticamente. Determinar el grado suficiente de las funciones de ajuste polinómico por el trazado de los residuos de ajuste y norma residual para incrementar el fin polinomio. - Repetir el mismo procedimiento con diferentes concentraciones de las matrices de microgel.
Access restricted. Please log in or start a trial to view this content.
Resultados
El número de partículas de microgel de PNIPAM en el lote, y por tanto el volumen de la partícula final, se determina temprano en la reacción durante la fase de nucleación 20 hidrófoba metacriloxietil colorante co-monómero tiocarbamoil rodamina B influye en la nucleación mediante la reducción de la densidad del número de partículas en el lote. La disminución de la concentración de partículas para dos con...
Access restricted. Please log in or start a trial to view this content.
Discusión
La adición de pequeñas cantidades de comonómero funcional puede tener un efecto significativo en el tamaño de partícula y la estructura de los microgeles de PNIPAM derivada. polimerización simultánea tubo de ensayo a pequeña escala es un buen método para dar cuenta de estos cambios, y ayuda a encontrar rápidamente las composiciones de reactivos adecuados para el tamaño de partícula objetivo de ampliación de la escala de la r...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
The authors have nothing to disclose.
Agradecimientos
The Deutsche Forschungsgemeinschaft (DFG) is acknowledged for financial support within the Sonderforschungsbereich SFB 985 "Functional Microgels and Microgel Systems".
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| Acetone | VWR Chemicals | KRAF13455 | |
| Bisacrylamid | AppliChem | A3636 | |
| n-Hexane | Merck | 104374 | |
| N-Isopropylacrylamide | Fisher Scientific | AC412785000 | recrystallized from n-hexane |
| Methacryloxyethyl thiocarbamoyl rhodamine B | Polysciences | 23591 | |
| Potassium peroxodisulfate | Merck | 105091 | |
| Silicone oil 47 V 350 | VWR Chemicals | 83851 | |
| Toluene | Sigma Aldrich | 244511 | |
| F12 Refrigerated/heating circulator | Julabo | 9116612 | |
| Microscope | Olympus | IX83 | |
| XY(Z) Piezo System | Physik Instrumente | P-545.3R7 | |
| 100X Oil immersion objective | Olympus | UPLSAPO | |
| QuadLine Beamsplitter | AHF Analysentechnik | F68-556T | |
| Cobolt Jive 150 laser | Cobolt | 0561-04-01-0150-300 | |
| Multimode Fiber | Thorlabs | UM22-600 | |
| iXON Ultra 897 EMCCD camera | Andor | DU-897U-CS0-BV | |
| Laser goniometer | SLS Systemtechnik | Mark III | |
| CF40 Cryo-compact circulator | Julabo | 9400340 | |
| Laser goniometer system | ALV GmbH | ALV / CGS-8F | |
| Multi-tau corretator | ALV GmbH | ALV-7004 | |
| Light scattering electronics | ALV GmbH | ALV / LSE 5004 | |
| Photon counting module | PerkinElmer | SPCM-CD2969 | 2 units in pseudo cross-correlation mode |
| 633 nm HeNe Laser | JDS Uniphase | 1145P | |
| F32 Refrigerated/heating circulator | Julabo | 9312632 |
Referencias
- Pelton, R. Temperature-sensitive aqueous microgels. Adv. Colloid Interfac. 85, 1-33 (2000).
- Pich, A., Richtering, W. Microgels by Precipitation Polymerization: Synthesis, Characterization and Functionalization. Adv. Polym. Sci. 234, 1-37 (2010).
- Richtering, W. Responsive Emulsions Stabilized by Stimuli-Sensitive Microgels: Emulsions with Special Non-Pickering Properties. Langmuir. 28 (50), 17218-17229 (2012).
- Wiese, S., Spiess, A. C., Richtering, W. Microgel-Stabilized Smart Emulsions for Biocatalysis. Angew. Chem. Int. Edit. 52 (2), 576-579 (2012).
- Schmitt, V., Ravaine, V. Surface compaction versus stretching in Pickering emulsions stabilised by microgels. Curr. Opin. Colloid In. 18 (6), 532-541 (2013).
- Wellert, S., Richter, M., Hellweg, T., von Klitzing,, R,, Hertle, Y. Responsive Microgels at Surfaces and Interfaces. Z. Phys. Chem. 229 (7-8), 1-26 (2015).
- Li, Z., Harbottle, D., Pensini, E., Ngai, T., Richtering, W., Xu, Z. Fundamental Study of Emulsions Stabilized by Soft and Rigid Particles. Langmuir. 31 (23), 6282-6288 (2015).
- Deshmukh, O. S., van den Ende, D., Stuart, M. C., Mugele, F., Duits, M. H. G. Hard and soft colloids at fluid interfaces: Adsorption, interactions, assembly & rheology. Adv. Colloid Interfac. 222, 215-227 (2015).
- Serpe, M. J., Kim, J., Lyon, L. A. Colloidal Hydrogel Microlenses. Adv. Mater. 16 (2), 184-187 (2004).
- Schmidt, S., Zeiser, M., Hellweg, T., Duschl, C., Fery, A., Möhwald, H. Adhesion and Mechanical Properties of PNIPAM Microgel Films and Their Potential Use as Switchable Cell Culture Substrates. Adv. Func. Mater. 20 (19), 3235-3243 (2010).
- Xia, Y., He, X., et al. Thermoresponsive Microgel Films for Harvesting Cells and Cell Sheets. Biomacromolecules. 14 (10), 3615-3625 (2013).
- Guan, Y., Zhang, Y. PNIPAM microgels for biomedical applications: from dispersed particles to 3D assemblies. Soft Matter. 7 (14), 6375(2011).
- Yunker, P. J., Chen, K., Gratale, M. D., Lohr, M. A., Still, T., Yodh, A. G. Physics in ordered and disordered colloidal matter composed of poly(N-isopropylacrylamide) microgel particles. Rep. Prog. Phys. 77 (5), 056601-056629 (2014).
- Lohr, M. A., Still, T., et al. Vibrational and structural signatures of the crossover between dense glassy and sparse gel-like attractive colloidal packings. Phys. Rev. E. 90 (6), 062305(2014).
- Dreyfus, R., Xu, Y., Still, T., Hough, L. A., Yodh, A. G., Torquato, S. Diagnosing hyperuniformity in two-dimensional, disordered, jammed packings of soft spheres. Phys. Rev. E. 91 (1), 012302-012312 (2015).
- Kojima, H., Tanaka, F. Reentrant volume phase transition of cross-linked poly(N-isopropylacrylamide) gels in mixed solvents of water/methanol. Soft Matter. 8 (10), 3010-3011 (2012).
- Hofmann, C. H., Plamper, F. A., Scherzinger, C., Hietala, S., Richtering, W. Cononsolvency Revisited: Solvent Entrapment by N-Isopropylacrylamide and N, N-Diethylacrylamide Microgels in Different Water/Methanol Mixtures. Macromolecules. 46 (2), 523-532 (2013).
- Bischofberger, I., Calzolari, D. C. E., Trappe, V. Co-nonsolvency of PNiPAM at the transition between solvation mechanisms. Soft Matter. 10 (41), 8288-8295 (2014).
- Virtanen, O. L. J., Richtering, W. Kinetics and particle size control in non-stirred precipitation polymerization of N-isopropylacrylamide. Colloid Polym. Sci. 292 (8), 1743-1756 (2014).
- Virtanen, O. L. J., Ala-Mutka, H. M., Richtering, W. Can the Reaction Mechanism of Radical Solution Polymerization Explain the Microgel Final Particle Volume in Precipitation Polymerization of N-Isopropylacrylamide? Macromol. Chem. Phys. 216 (13), 1431-1440 (2015).
- Glatter, O. A new method for the evaluation of small-angle scattering data. J. Appl. Crystallogr. 10 (5), 415-421 (1977).
- Svergun, D. I. Determination of the regularization parameter in indirect-transform methods using perceptual criteria. J. Appl. Crystallogr. 25 (4), 495-503 (1992).
- Glatter, O. Convolution Square Root of Band-Limited Symmetrical Functions and Its Application to Small-Angle Scattering Data. J. Appl. Crystallogr. 14, 101-108 (1981).
- Glatter, O., Hainisch, B. Improvements in Real-Space Deconvolution of Small-Angle Scattering Data. J. Appl. Crystallogr. 17, 435-441 (1984).
- Cheezum, M. K., Walker, W. F., Guilford, W. H. Quantitative Comparison of Algorithms for Tracking Single Fluorescent Particles. Biophys. J. 81 (4), 2378-2388 (2001).
- Wöll, D., Kölbl, C., Stempfle, B., Karrenbauer, A. A novel method for automatic single molecule tracking of blinking molecules at low intensities. Phys. Chem. Chem. Phys. 15 (17), 6196-6205 (2013).
- Saxton, M. J., Jacobson, K. Single-particle tracking: Applications to membrane dynamics. Annu. Rev. Bioph. Biom. 26, 373-399 (1997).
- Pusey, P. N., van Megen, W. Detection of small polydispersities by photon correlation spectroscopy. J. Chem. Phys. 80 (8), 3513(1984).
- Stieger, M., Pedersen, J. S., Richtering, W., Lindner, P. Small-angle neutron scattering study of structural changes in temperature sensitive microgel colloids. J. Chem. Phys. 120 (13), 6197-6206 (2004).
- Wu, X., Pelton, R. H., Hamielec, A. E., Woods, D. R., McPhee, W. The kinetics of poly(N-isopropylacrylamide) microgel latex formation. Colloid Polym. Sci. 272, 467-477 (1994).
- Weeks, E. R., Weitz, D. A. Subdiffusion and the cage effect studied near the colloidal glass transition. Chem. Phys. 284 (1-2), 361-367 (2002).
- Ernst, D., Köhler, J., Weiss, M. Probing the type of anomalous diffusion with single-particle tracking. Phys. Chem. Chem. Phys. 16 (17), 7686-7691 (2014).
- Virtanen, O. L. J. FitIt! (Version 1.1.4). , Available from: https://www.github.com/ovirtanen/fitit (2015).
- Provencher, S. W. A Constrained Regularization Method For Inverting Data Represented By A Linear Algebraic or Integral Equations. Comput. Phys. Commun. 27 (3), 213-227 (1982).
- Holtzer, L., Meckel, T., Schmidt, T. Nanometric three-dimensional tracking of individual quantum dots in cells. Appl. Phys. Lett. 90 (5), 053902-053904 (2007).
- Diezmann, A. V., Lee, M. Y., Lew, M. D., Moerner, W. E. Correcting field-dependent aberrations with nanoscale accuracy in three-dimensional single-molecule localization microscopy. Optica. 2 (11), 985-989 (2015).
- Neutrons, X-rays and Light: Scattering Methods Applied to Soft Condensed Matter. Lindner, P., Zemb, T. , North Holland Delta Series. Amsterdam. (2002).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados