Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Контролируемый синтез и флуоресценция отслеживание высокой однородности поли (
В этой статье
Резюме
Non-перемешивалась полимеризации осадков обеспечивает быстрое, воспроизводимое прототипирования подход к синтезу раздражителей-чувствительных поли (N -isopropylacrylamide) микрогелей узким распределением по размерам. В этом синтезе протокола, свет характеристика рассеяния и флуоресценции одного отслеживания частиц этих микрогелей в установке микроскопии широкого поля демонстрируются.
Аннотация
Стимулы чувствительные поли (N -isopropylacrylamide) (PNIPAM) микрогели имеют различные перспективные практического применения и использования в фундаментальных исследованиях. В этой работе мы используем одну частицу отслеживания флуоресцентно меченых PNIPAM микрогелей как витрина для размера настройки микрогелевого быстрым не перемешанной методикой полимеризации осадков. Этот подход хорошо подходит для создания прототипов новых композиций реакции и условий или для приложений, которые не требуют большого количества продукта. Синтез микрогель, размер частиц и определение структуры с помощью динамического и статического рассеяния света подробно описаны в протоколе. Показано, что добавление функциональных сомономеров могут иметь большое влияние на зарождение и структуры частиц. Одно отслеживание частиц по широким полем флуоресцентной микроскопии позволяет исследованию диффузии меченых трассирующих микрогелей в концентрированном матрице немеченого микрогелей, система легко не исследоваласьДругие методы, такие как динамического рассеяния света.
Введение
Стимулы чувствительные поли (N -isopropylacrylamide) (PNIPAM) микрогели 1,2 привлекли постоянный интерес в течение последних двух десятилетий из - за их потенциала в различных интеллектуальных приложений. Продемонстрированные случаи использования включают переключаемые стабилизаторов эмульсии 3-8, микролинз 9, культура клеток субстратов для легкого сбора клеток 10,11 и смарт - носителей для низкомолекулярных соединений и других биомедицинских использует 12. С фундаментальной точки зрения исследований эти частицы были доказаны , чтобы быть полезным для изучения предметов , таких как коллоидных взаимодействий 13-15 и полимер-растворитель взаимодействий 16-18.
Успешное использование PNIPAM микрогелей и их производных в любом приложении, как правило, требует знания о среднего размера частиц и ширины распределения частиц по размерам. Для правильной интерпретации результатов эксперимента с участием PNIPAM микрогели, структура частиц, которая может зависеть от функциональных сомономеров, должно быть известно. Динамическое и статическое рассеяние света (DLS и СЛС, соответственно) однозначно подходит для получения этой информации, потому что эти методы быстро и относительно просты в использовании; и они зондировать свойства частиц неинвазивным в их родной среде (дисперсии). DLS и СЛС также собирать данные из огромного числа частиц избежать смещения, возникающего из малых размеров выборки, характерных для методов микроскопии. Таким образом, первая цель этой работы является внедрение хорошей практики в отношении рассеяния света для специалистов-практиков новых к коллоидной характеристике.
Как правило, полимеризация осаждение проводят в лабораторном масштабе и поиск нужных условий реакции для специфических свойств частиц может быть трудоемким и требует много повторений синтеза. В отличие от большого пакетного синтеза, без осадков перемешивают полимеризации 19,20 является арПроцедура APID, в котором партий различных реагентной композиции могут быть полимеризованы одновременно прибыльные частицы узким распределением по размерам. Одновременная полимеризация минимизирует экспериментальное изменение и большой выход означает, что правильные условия реакции могут быть найдены быстро для масштабировании реакции. Следовательно, наша вторая цель состоит в том, чтобы продемонстрировать полезность полимеризации, не размешивают осаждения в прототипирования и в приложениях, которые не требуют большого количества продукта.
Различные аспекты синтеза и характеристики объединяются в примере применения флуоресцентных меченый PNIPAM микрогелей в коллоидной исследования взаимодействия. Здесь мы используем высокоточное отслеживание одной частицы, чтобы исследовать диффузию меченых трассирующих микрогелей в дисперсии немеченых матричных микрогелей в широком диапазоне концентраций матрицы и устранить эффект клетки в концентрированной коллоидной дисперсии. Широкое поле флуоресцентной микроскопии хорошо подходит FOR эта цель, как это может характеризовать специфическое поведение нескольких молекул трассеров среди большого количества потенциально различных видов матриц. Это в отличие от таких методов, как DLS, СЛС и реологии, измеряющих среднее по ансамблю свойств систем и, следовательно, не может разрешить поведение небольшого числа пробных частиц в большой системе. Кроме того, в этом конкретном примере, обычные методы рассеяния света не может быть использовано также в связи с высокой концентрацией частиц, что приводит к сильному многократного рассеяния любой стандартный утрачивает анализ. Использование автоматизированной обработки данных и статистических методов позволяют анализировать поведение системы в целом также для одного отслеживания частиц при усреднении по больших размеров выборки.
протокол
1. микрогель Синтез
Примечание: N -isopropylacrylamide (NIPAM) перекристаллизовывают из н-гексана. Другие реагенты использовали в полученном виде.
- Обычные Пакетное Синтез поли (NIPAM) Matrix микрогелями
- Растворить 1,8 г NIPAM и 24 мг N, N '-bisacrylamide (BIS) в 245 мл отфильтрованных (0,2 мкм из регенерированной целлюлозы (RC) мембранный фильтр) двойной дистиллированной воды в 500 мл трехгорлую круглодонную колбу , снабженную обратным холодильником, перемешивающим устройством и резиновой перегородкой.
- Вставьте термометр и 120 мм иглу для ввода азота через мембрану.
- Раствор нагревают до 60 ° С, при перемешивании. Обескислороживание раствор продувкой азотом в течение 40 мин.
- Одновременно готовят раствор инициатора 155 мг персульфата калия (КПС) в 5 мл отфильтрованных дважды дистиллированной водой и пузырь раствора с азотом для удаления кислорода.
- Передача полных 5 мл КПС секв способность по азотного промытые шприц, снабженный 120-мм иглой.
- Поднимите иглу азота выше уровня раствора в колбе трехгорлой и добавляют раствор KPS быстро через резиновую перегородку в реактор.
- Пусть полимеризацию проводят в течение 1 ч в токе азота и медленном перемешивании при 60 ° С.
- Используйте воронку и бумажный фильтр Бюхнера для фильтрации горячего реакционного раствора, чтобы отбрасывать большие агрегаты. Пусть дисперсия остыть.
- Центрифуга и редиспергируются Дисперсия три раза в течение 40 мин при 257000 х г и, наконец, повторно диспергируют осадка в минимальном количестве жизнеспособных бидистиллированной воды. Как правило, это составляет 2-4 мл.
- Лиофилизации дисперсии для хранения.
- Non-перемешивалась Синтез флуоресцентно меченных поли (NIPAM) микрогелей
- Взвешивание 257,7 мг NIPAM, 3,5 мг BIS и 1,5 мг methacryloxyethyl тиокарбамоильная родамина B (краситель) в стеклянный сосуд и добавляют 10 мл фильтрованной двойной Отфильтровываюред вода.
- Ultrasonicate краситель-мономер раствор в течение 15 мин, чтобы растворить краситель в воде.
- Приготовить такой же раствор без красителя в отдельный стеклянный сосуд.
- Приготовьте различные разведений раствора мономера с красителем с использованием мономерного раствора, без красителя для получения концентраций, при различных концентрациях красителя. В этой работе, используют краситель в диапазоне концентраций 0,02-0,1 ммоль / л.
- Растворить 8,4 мг КПС в 10 мл отфильтрованных бидистиллированной воды, чтобы получить раствор инициатора.
- Перенести 0,5 мл концентраций, и 0,5 мл раствора КПС в пробирки с диаметром 10 мм, чтобы получить конечные реакции решения, и запечатать их с резиновыми перегородками.
- Предварительный нагрев масляной бани в двойными стенками стеклянный сосуд, соединенный с нагревательным циркулятора до 63 ° C.
- Deoxygenize реакционных растворов продувкой азотом через иглы 120 мм в течение 20 мин.
- Вставьте трубки в афloating платформу и погрузите платформу в предварительно нагретую масляную баню. Установите температуру до 60 ° С. Изначально более высокая температура в бане необходимо, так как температура в помещении растворы охладить ванну. Для настройки высокой точности размеров частиц контроль температуры во время первоначальной реакции должна быть строгой, как правило, ± 0,1 ° C.
- Пусть реакция протекать в течение соответствующего времени. Как правило, 1 час достаточно.
- Перенести реакционные трубы быстро в печи при температуре 60 ° С и положить одну каплю горячей дисперсии в 10 мл отфильтрованных бидистиллированной воды , предварительно нагретой по объему PNIPAM температуры фазового перехода (VPTT, 32 -34 ° C) 1, для DLS характеристик в свернутое состояние.
- Пусть остальные дисперсии охладиться до комнатной температуры и перевести их в центрифужные пробирки.
- Центрифуга Раствор три раза в течение 40 мин при 257000 XG и разбавленных микрогелей, наконец, в 2 мл отфильтрованных дважды дистиллированной воды FOиспользование в качестве г трассирующих частиц.
2. Рассеяние света Характеристика
- Определение гидродинамического радиуса в свернутом состоянии путем динамического рассеяния света
- Вымойте кюветки и изделия из стекла с парами ацетона.
- Тепло 10 мл фильтрованной (например, 200 нм или меньше , RC фильтр) дважды дистиллированной воды над PNIPAM VPTT.
- Перенести каплю горячей дисперсии в отфильтрованной воде с использованием предварительно нагретой иглы (0,9 х 40 мм) и шприц (1 мл).
- Закалить DLS гониометра индекс соответствия ванны до 50 ° C и переноса образца в прибор, не давая ей остыть.
- Найдите наибольший угол рассеяния, где интенсивность рассеянного света достаточно, чтобы приобрести коррелограмме, выполняя контрольные измерения.
- Вставка образца кювету (10 мм стекла диаметром трубки 1 мл дисперсии частиц). Перемещение рычага детектора малого угла рассеяния (здесь 30 °).
- Проверьте профиль пучка Foг многократного рассеяния: нет свечения вокруг первичного пучка, отсутствие многократного рассеяния и т.д. Убедитесь , что диапазон счетчика предназначен для измерения на самом низком угле рассеяния (приблизительно от 30 до 600 кГц, в правом верхнем углу окна программы.) .
- Переместить гониометра руку до самого высокого угла рассеяния (выбрать 120 ° здесь). Убедитесь, что скорость счета по-прежнему достаточно высок для измерения (от 30 до 600 кГц). Если интенсивность слишком низкая, переместить руку, чтобы нижний угол рассеяния.
- Проверьте луч визуально через толуол ванны стекло на самом низком угле рассеяния, если свечение вокруг падающего пучка наблюдается многократное рассеяние происходит. В этом случае, уменьшить интенсивность лазерного излучения или использовать более высокое разбавление.
- Приобретать 20 коррелограмм между минимальным и максимальным углом рассеяния (например, 30 ° - 140 °) с минимальным временем приобретения 60 сек. Увеличьте время приобретения для слабой интенсивности больших углов рассеянияесли необходимо.
- Анализ данных 37
- Расчет рассеяния векторных величин для угла рассеяния согласно
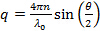 , Где п - показатель преломления дисперсии,
, Где п - показатель преломления дисперсии, 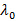 длина волны лазера в вакууме и
длина волны лазера в вакууме и 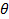 угол рассеяния.
угол рассеяния. - В случае, программное обеспечение измерения обеспечивает функцию корреляции интенсивности
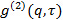 , Преобразование его корреляционной функции электрического поля
, Преобразование его корреляционной функции электрического поля 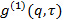 в соответствии с
в соответствии с  , параметр
, параметр 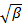 это неинтересный инструментальный параметр, связанный со степенью пространственной когерентности рассеянного света Овег площади детектора.
это неинтересный инструментальный параметр, связанный со степенью пространственной когерентности рассеянного света Овег площади детектора. - Выполните кумулянт анализ на кореллограмм, т.е. подходят полином второго порядка к логарифму каждой корреляционной функции электрического поля
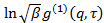 линейными методом наименьших квадратов.
линейными методом наименьших квадратов. 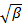 выступает как перехватывать фита и его точное значение не имеет значения по отношению к анализу данных. Ограничить впору содержательного значения т времени запаздывания, например, так , что амплитуда корреляции составляет 10 - 20% от максимальной амплитуды. Коэффициент члена первого порядка является средняя скорость затухания корреляционной функции,
выступает как перехватывать фита и его точное значение не имеет значения по отношению к анализу данных. Ограничить впору содержательного значения т времени запаздывания, например, так , что амплитуда корреляции составляет 10 - 20% от максимальной амплитуды. Коэффициент члена первого порядка является средняя скорость затухания корреляционной функции, 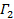 ,
, - Найти наиболее вероятное значение среднего коэффициента диффузии
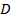 частиц линейными наименьших квадратов на
частиц линейными наименьших квадратов на  , Если
, Если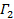 против
против 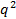 не появляется линейно и проходит через начало координат в пределах ошибки определения распределения частиц по размерам является широким и гидродинамический радиус будет плохо определена.
не появляется линейно и проходит через начало координат в пределах ошибки определения распределения частиц по размерам является широким и гидродинамический радиус будет плохо определена. - Вычислить среднее гидродинамический радиус из соотношения Стокса-Эйнштейна
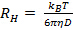 , где
, где 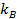 коэффициент Больцмана,
коэффициент Больцмана, 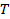 абсолютная температура и
абсолютная температура и 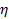 вязкость дисперсии в
вязкость дисперсии в 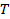 , Размножаются стандартное отклонение
, Размножаются стандартное отклонение 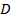 к
к 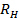 ,
,
- Расчет рассеяния векторных величин для угла рассеяния согласно
- Частица Определение структуры под воздействием статического рассеяния света
- Вымойте кюветки и изделия из стекла с парами ацетона. Используйте диаметр 20 мм и более кювет, чтобы минимизировать цилиндрический эффект линзы.
- Фильтр (200 нм RC-фильтра или меньше) примерно в 20 мл дистиллированной воды в стеклянную пробирку и переносят каплю очищенного дисперсии во флакон. Промыть фильтр 10 мл воды перед использованием для приготовления образца для удаления примесей, оставшихся из производственного процесса.
- Проверьте образец против любого окружающего источника света. Если наблюдается голубой оттенок, образец, вероятно, будет слишком сгущают. Развести соответственно.
- Подготовка фона пробы воды с помощью промывки в кювету несколько раз с фильтрованной водой, а затем заполнить до соответствующего объема образца, в зависимости от кювету и положение лазера в приборе. Лазер должен проходить через образец без преломляется от мениска.
- Откалибруйте INSTRUMлор, используя образец толуола.
- Мера воды рассеяние (фон) в течение всего доступного диапазона углов.
- Измерение интенсивности рассеяния от образца в течение всего доступного угловом диапазоне предпочтительно на нескольких длинах волн. Картинырассеяния нормирована на интенсивность рассеяния вперед известна как форм-фактор.
- Если структура частиц, как известно, используют соответствующее выражение модели для расчета глобальной посадки на наборах данных, измеренных на разных длинах волн.
- Для использования неизвестной структуры частиц регуляризированной прямой (например, FitIt! 33) или в более общем косвенном обратное преобразование Фурье 21,22 процедуру в сочетании с деконволюции парной функции распределения расстояния (только для сферических частиц) 23,24 для получения приблизительной классификации частиц тип.
- В случае фитинга или инверсии рутина дает оценку функции распределения частиц радиуса, вычислить полидисперсностиИндекс (стандартное отклонение распределения, деленной на ее среднее значение).
3. Отслеживание частиц с помощью широкоугольной флуоресцентной микроскопии
Примечание: Tracer и матричные частицы 465 ± 7 нм и 405 ± 7 нм гидродинамических радиусов при 20 ° С, соответственно, были использованы для отслеживания частиц.
- Базовые приготовления
- Готовят концентрированной дисперсии матрицы микрогеля путем повторного диспергирования известное количество немеченого лиофилизированного микрогель к известному количеству бидистиллированной воды. Добавьте небольшой объем меченых трассирующих частиц.
- Подтвердите соответствующую концентрацию изотопных индикаторов микрогеля в микроскоп. Оптимальная концентрация представляет собой компромисс между одновременным приобретением максимального количества треков, имея при этом концентрации индикаторного достаточно низко, так что вероятность того, что следы частиц трассирующими крест во время приобретения незначительна.
- Приготовьте концентрированных дисперсий путем выпариваниявода в печи. Определить концентрацию веса путем сравнения веса дисперсии к исходной массе образца перед выпариванием.
- Сбора и анализа данных
- Используйте соответствующий объектив желаемого увеличения и диафрагмы для возбуждения трейсеров и одновременного сбора флуоресценции от образца. В этой работе, использовать 100X / 1.3 NA иммерсионным объектива.
- Поместите камеру влаги на в хуг-пьезо таблицу, которая вписывается в коммерческий микроскоп.
- Для того, чтобы предотвратить образца от высыхания, поместите плазменную очищено покровного стекла в камеру влаги и пипеткой 10 мкл поли (NIPAM) дисперсии нужной концентрации на скольжении.
- В зависимости от возбуждения и излучения флуоресцентного красителя, используйте подходящий лазер для возбуждения и регулировки мощности лазера соответствующим образом. Интенсивность должна быть достаточно низкой, чтобы избежать быстрого фотообесцвечивание красителей, но прив то же время достаточно сильным для точного позиционирования одночастичной (смотри ниже). В этой работе, используют 561 нм с диодной накачкой твердотельный лазер и поддержания постоянной мощности лазера в 16 мВт (приблизительно 0,5 кВт см -2 в образце) для всех измерений.
- Для получения однородного образца освещения, используют критическую установку освещения, описанной здесь. Для этого, пара лазер в многомодовом волокне (NA 0,22 ± 0,02, 0,6 мм диаметр сердцевины), встряхните волокно, используя Вортекс для того, чтобы временно усредненной лазерные пятнышки, и проект конец волокна в плоскости образца.
- Калибровка расстояния г от заднего отражения покровного стекла и фокус несколько микрометров в образец, перемещая цель немного вверх и зафиксировать Z-позицию, используя Z-компенсатор. Это позволяет избежать каких-либо эффектов интерфейса с покровным.
- Настройка параметров детектора, таких как время экспозиции, чтобы сила сигнала флуоресценции. В этом случае используйте камеру EMCCDсо временем экспозиции 0,1 сек, электронный режим и коэффициент усиления 50 умножения.
- Приобретите несколько фильмов с соответствующим количеством кадров, чтобы получить достаточное количество времени задержки для вычисления среднего квадрата смещения микрогелей в различных областях образца. В этой работе, используют номера кадров приобретения 500 или 1000 кадров.
- Анализ данных путем размещения частиц в каждом кадре с помощью Gaussian фитинг 25 и использовать соответствующий алгоритм отслеживания частиц 26 , чтобы получить средний квадрат смещения. 27 Вычислить средние значения и стандартное отклонение путем усреднения по всем следам во всех фильмах. Вычислить длинные коэффициенты диффузии времени запаздывания с помощью линейной регрессии с
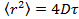 , где
, где 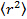 это средний квадрат смещения, D означает среднюю величину коэффициента диффузии и т временной лаг.
это средний квадрат смещения, D означает среднюю величину коэффициента диффузии и т временной лаг. - Стандартное восточное времяImate параметр аномалии у из аномального уравнения диффузии
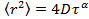 путем преобразования данных в логарифмическом масштабе, что дает
путем преобразования данных в логарифмическом масштабе, что дает 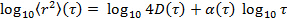 , Параметр аномалия
, Параметр аномалия 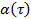 дается производной от сюжета. Производное может быть оценена с помощью конечных разностей точек данных, или подгонки точек данных с помощью полиномиальных функций и дифференцирования аналитически. Определить достаточную степень полиномиальных функций подгонки путем построения графика уложения остатков и остаточную норму для увеличения полиномиальное порядка.
дается производной от сюжета. Производное может быть оценена с помощью конечных разностей точек данных, или подгонки точек данных с помощью полиномиальных функций и дифференцирования аналитически. Определить достаточную степень полиномиальных функций подгонки путем построения графика уложения остатков и остаточную норму для увеличения полиномиальное порядка. - Повторите ту же процедуру для различных концентраций матриц микрогеля.
Результаты
Число частиц PNIPAM микрогеля в пакете, и , таким образом , чтобы конечный объем частиц, определяется в начале реакции в течение Гидрофобный methacryloxyethyl красителя со-мономер фаза зарождение 20 тиокарбамоильная родамин влияет на зарожде...
Обсуждение
Добавление небольших количеств функционального сомономера может оказывать значительное влияние на размер частиц и структуры PNIPAM полученных микрогелей. Полимеризация пробирка Одновременная мелкосерийное является хорошим методом для уч?...
Раскрытие информации
The authors have nothing to disclose.
Благодарности
The Deutsche Forschungsgemeinschaft (DFG) is acknowledged for financial support within the Sonderforschungsbereich SFB 985 "Functional Microgels and Microgel Systems".
Материалы
| Name | Company | Catalog Number | Comments |
| Acetone | VWR Chemicals | KRAF13455 | |
| Bisacrylamid | AppliChem | A3636 | |
| n-Hexane | Merck | 104374 | |
| N-Isopropylacrylamide | Fisher Scientific | AC412785000 | recrystallized from n-hexane |
| Methacryloxyethyl thiocarbamoyl rhodamine B | Polysciences | 23591 | |
| Potassium peroxodisulfate | Merck | 105091 | |
| Silicone oil 47 V 350 | VWR Chemicals | 83851 | |
| Toluene | Sigma Aldrich | 244511 | |
| F12 Refrigerated/heating circulator | Julabo | 9116612 | |
| Microscope | Olympus | IX83 | |
| XY(Z) Piezo System | Physik Instrumente | P-545.3R7 | |
| 100X Oil immersion objective | Olympus | UPLSAPO | |
| QuadLine Beamsplitter | AHF Analysentechnik | F68-556T | |
| Cobolt Jive 150 laser | Cobolt | 0561-04-01-0150-300 | |
| Multimode Fiber | Thorlabs | UM22-600 | |
| iXON Ultra 897 EMCCD camera | Andor | DU-897U-CS0-BV | |
| Laser goniometer | SLS Systemtechnik | Mark III | |
| CF40 Cryo-compact circulator | Julabo | 9400340 | |
| Laser goniometer system | ALV GmbH | ALV / CGS-8F | |
| Multi-tau corretator | ALV GmbH | ALV-7004 | |
| Light scattering electronics | ALV GmbH | ALV / LSE 5004 | |
| Photon counting module | PerkinElmer | SPCM-CD2969 | 2 units in pseudo cross-correlation mode |
| 633 nm HeNe Laser | JDS Uniphase | 1145P | |
| F32 Refrigerated/heating circulator | Julabo | 9312632 |
Ссылки
- Pelton, R. Temperature-sensitive aqueous microgels. Adv. Colloid Interfac. 85, 1-33 (2000).
- Pich, A., Richtering, W. Microgels by Precipitation Polymerization: Synthesis, Characterization and Functionalization. Adv. Polym. Sci. 234, 1-37 (2010).
- Richtering, W. Responsive Emulsions Stabilized by Stimuli-Sensitive Microgels: Emulsions with Special Non-Pickering Properties. Langmuir. 28 (50), 17218-17229 (2012).
- Wiese, S., Spiess, A. C., Richtering, W. Microgel-Stabilized Smart Emulsions for Biocatalysis. Angew. Chem. Int. Edit. 52 (2), 576-579 (2012).
- Schmitt, V., Ravaine, V. Surface compaction versus stretching in Pickering emulsions stabilised by microgels. Curr. Opin. Colloid In. 18 (6), 532-541 (2013).
- Wellert, S., Richter, M., Hellweg, T., von Klitzing, ., R, Y., Hertle, Responsive Microgels at Surfaces and Interfaces. Z. Phys. Chem. 229 (7-8), 1-26 (2015).
- Li, Z., Harbottle, D., Pensini, E., Ngai, T., Richtering, W., Xu, Z. Fundamental Study of Emulsions Stabilized by Soft and Rigid Particles. Langmuir. 31 (23), 6282-6288 (2015).
- Deshmukh, O. S., van den Ende, D., Stuart, M. C., Mugele, F., Duits, M. H. G. Hard and soft colloids at fluid interfaces: Adsorption, interactions, assembly & rheology. Adv. Colloid Interfac. 222, 215-227 (2015).
- Serpe, M. J., Kim, J., Lyon, L. A. Colloidal Hydrogel Microlenses. Adv. Mater. 16 (2), 184-187 (2004).
- Schmidt, S., Zeiser, M., Hellweg, T., Duschl, C., Fery, A., Möhwald, H. Adhesion and Mechanical Properties of PNIPAM Microgel Films and Their Potential Use as Switchable Cell Culture Substrates. Adv. Func. Mater. 20 (19), 3235-3243 (2010).
- Xia, Y., He, X., et al. Thermoresponsive Microgel Films for Harvesting Cells and Cell Sheets. Biomacromolecules. 14 (10), 3615-3625 (2013).
- Guan, Y., Zhang, Y. PNIPAM microgels for biomedical applications: from dispersed particles to 3D assemblies. Soft Matter. 7 (14), 6375 (2011).
- Yunker, P. J., Chen, K., Gratale, M. D., Lohr, M. A., Still, T., Yodh, A. G. Physics in ordered and disordered colloidal matter composed of poly(N-isopropylacrylamide) microgel particles. Rep. Prog. Phys. 77 (5), 056601-056629 (2014).
- Lohr, M. A., Still, T., et al. Vibrational and structural signatures of the crossover between dense glassy and sparse gel-like attractive colloidal packings. Phys. Rev. E. 90 (6), 062305 (2014).
- Dreyfus, R., Xu, Y., Still, T., Hough, L. A., Yodh, A. G., Torquato, S. Diagnosing hyperuniformity in two-dimensional, disordered, jammed packings of soft spheres. Phys. Rev. E. 91 (1), 012302-012312 (2015).
- Kojima, H., Tanaka, F. Reentrant volume phase transition of cross-linked poly(N-isopropylacrylamide) gels in mixed solvents of water/methanol. Soft Matter. 8 (10), 3010-3011 (2012).
- Hofmann, C. H., Plamper, F. A., Scherzinger, C., Hietala, S., Richtering, W. Cononsolvency Revisited: Solvent Entrapment by N-Isopropylacrylamide and N, N-Diethylacrylamide Microgels in Different Water/Methanol Mixtures. Macromolecules. 46 (2), 523-532 (2013).
- Bischofberger, I., Calzolari, D. C. E., Trappe, V. Co-nonsolvency of PNiPAM at the transition between solvation mechanisms. Soft Matter. 10 (41), 8288-8295 (2014).
- Virtanen, O. L. J., Richtering, W. Kinetics and particle size control in non-stirred precipitation polymerization of N-isopropylacrylamide. Colloid Polym. Sci. 292 (8), 1743-1756 (2014).
- Virtanen, O. L. J., Ala-Mutka, H. M., Richtering, W. Can the Reaction Mechanism of Radical Solution Polymerization Explain the Microgel Final Particle Volume in Precipitation Polymerization of N-Isopropylacrylamide?. Macromol. Chem. Phys. 216 (13), 1431-1440 (2015).
- Glatter, O. A new method for the evaluation of small-angle scattering data. J. Appl. Crystallogr. 10 (5), 415-421 (1977).
- Svergun, D. I. Determination of the regularization parameter in indirect-transform methods using perceptual criteria. J. Appl. Crystallogr. 25 (4), 495-503 (1992).
- Glatter, O. Convolution Square Root of Band-Limited Symmetrical Functions and Its Application to Small-Angle Scattering Data. J. Appl. Crystallogr. 14, 101-108 (1981).
- Glatter, O., Hainisch, B. Improvements in Real-Space Deconvolution of Small-Angle Scattering Data. J. Appl. Crystallogr. 17, 435-441 (1984).
- Cheezum, M. K., Walker, W. F., Guilford, W. H. Quantitative Comparison of Algorithms for Tracking Single Fluorescent Particles. Biophys. J. 81 (4), 2378-2388 (2001).
- Wöll, D., Kölbl, C., Stempfle, B., Karrenbauer, A. A novel method for automatic single molecule tracking of blinking molecules at low intensities. Phys. Chem. Chem. Phys. 15 (17), 6196-6205 (2013).
- Saxton, M. J., Jacobson, K. Single-particle tracking: Applications to membrane dynamics. Annu. Rev. Bioph. Biom. 26, 373-399 (1997).
- Pusey, P. N., van Megen, W. Detection of small polydispersities by photon correlation spectroscopy. J. Chem. Phys. 80 (8), 3513 (1984).
- Stieger, M., Pedersen, J. S., Richtering, W., Lindner, P. Small-angle neutron scattering study of structural changes in temperature sensitive microgel colloids. J. Chem. Phys. 120 (13), 6197-6206 (2004).
- Wu, X., Pelton, R. H., Hamielec, A. E., Woods, D. R., McPhee, W. The kinetics of poly(N-isopropylacrylamide) microgel latex formation. Colloid Polym. Sci. 272, 467-477 (1994).
- Weeks, E. R., Weitz, D. A. Subdiffusion and the cage effect studied near the colloidal glass transition. Chem. Phys. 284 (1-2), 361-367 (2002).
- Ernst, D., Köhler, J., Weiss, M. Probing the type of anomalous diffusion with single-particle tracking. Phys. Chem. Chem. Phys. 16 (17), 7686-7691 (2014).
- . FitIt! (Version 1.1.4) Available from: https://www.github.com/ovirtanen/fitit (2015)
- Provencher, S. W. A Constrained Regularization Method For Inverting Data Represented By A Linear Algebraic or Integral Equations. Comput. Phys. Commun. 27 (3), 213-227 (1982).
- Holtzer, L., Meckel, T., Schmidt, T. Nanometric three-dimensional tracking of individual quantum dots in cells. Appl. Phys. Lett. 90 (5), 053902-053904 (2007).
- Diezmann, A. V., Lee, M. Y., Lew, M. D., Moerner, W. E. Correcting field-dependent aberrations with nanoscale accuracy in three-dimensional single-molecule localization microscopy. Optica. 2 (11), 985-989 (2015).
- Lindner, P., Zemb, T. . Neutrons, X-rays and Light: Scattering Methods Applied to Soft Condensed Matter. , (2002).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены