Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Kontrollierte Synthese und Fluoreszenz-Tracking von Hoch Uniform Poly (
In diesem Artikel
Zusammenfassung
Nicht gerührt Fällungspolymerisation liefert eine schnelle, reproduzierbare Prototyping Ansatz zur Synthese von Stimuli empfindlichen Poly (N Isopropylacrylamid) Mikrogele mit enger Größenverteilung. In diesem Protokoll Synthese, Charakterisierung Lichtstreuung und Einzelpartikelfluoreszenz-Tracking dieser Mikrogele in einem Weitfeldmikroskopie Einrichtung demonstriert.
Zusammenfassung
Stimuli-sensitive Poly (N Isopropylacrylamid) (PNIPAM) Mikrogele haben verschiedene potenzielle praktische Anwendungen und nutzt in der Grundlagenforschung. In dieser Arbeit verwenden wir einzelne Partikel von fluoreszenzmarkierten PNIPAM-Mikrogele als Schaufenster für Tuning Mikrogel Größe durch eine schnelle nicht gerührten Fällungspolymerisation Verfahren zu verfolgen. Dieser Ansatz eignet sich für das Prototyping neuer Reaktionszusammensetzungen und Bedingungen oder für Anwendungen, die keine großen Mengen des Produkts benötigen. Microgel Synthese, Partikelgröße und Strukturbestimmung durch dynamische und statische Lichtstreuung sind im Protokoll aufgeführt. Es wird gezeigt, dass die Zugabe von funktionellen Comonomeren einen großen Einfluß auf die Kornkeimbildung und Struktur haben kann. Einzelpartikel Tracking von Weitfeldfluoreszenzmikroskopie ermöglicht eine Untersuchung der Diffusion von markiertem Tracer-Mikrogele in einer konzentrierten Matrix von nicht-markiertem Mikrogele, ein System nicht leicht untersucht durchandere Verfahren, wie beispielsweise dynamische Lichtstreuung.
Einleitung
Stimuli-sensitive Poly (N Isopropylacrylamid) (PNIPAM) Mikrogele 1,2 haben kontinuierliche Interesse in den vergangenen zwei Jahrzehnten angezogen aufgrund ihres Potenzials in den verschiedenen intelligenten Anwendungen. Nachgewiesene Anwendungsfälle sind schaltbare Emulsionsstabilisatoren 3-8, Mikrolinsen 9, Zellkultur - Substrate für die einfache Zellernte 10,11 und intelligente Träger für niedermolekulare Verbindungen und anderen biomedizinischen 12 verwendet. Aus einer Grundlagenforschung Sicht haben diese Teilchen erwiesen für die Untersuchung Themen wie kolloidale Wechselwirkungen 13-15 und Polymer-Lösungsmittel - Wechselwirkungen 16-18 nützlich.
Erfolgreiche Verwendung von PNIPAM-Mikrogele und ihre Derivate in einer gegebenen Anwendung benötigt typischerweise Wissen über die mittlere Partikelgröße und die Breite der Teilchengrößenverteilung. Für die korrekte Interpretation der experimentellen Ergebnisse Beteiligung PNIPAM MikroGele, die Kornstruktur, die durch funktionelle Comonomere beeinflußt werden kann, muß bekannt sein. Dynamische und statische Lichtstreuung (DLS und SLS sind) sind in einzigartiger Weise geeignet, diese Informationen für den Erwerb, weil diese Methoden sind schnell und relativ einfach zu bedienen; und sie untersuchen die Partikeleigenschaften nicht-invasiv in ihrer natürlichen Umgebung (Dispersion). auch DLS und SLS sammeln Daten aus großen Anzahl von Teilchen, die die Vorspannung die sich aus kleinen Probengrößen, die typisch für Mikroskopieverfahren zu vermeiden. Daher ist das erste Ziel dieser Arbeit für die Praxis gute Praxis in Bezug auf die Lichtstreuung zur Einführung neuer kolloidale Charakterisierung.
Typischerweise wird die Fällungspolymerisation in Labormaßstab durchgeführt und das Finden der richtigen Reaktionsbedingungen für bestimmte Partikeleigenschaften aufwendig und viele Wiederholungen der Synthese erforderlich sein kann. Im Gegensatz zu großen Batch - Synthese, nicht gerührte Fällungspolymerisation 19,20 ist arapid Verfahren, bei dem Chargen unterschiedlicher Reaktionszusammensetzung können gleichzeitig ertragreiche Teilchen mit enger Größenverteilung polymerisiert werden. Die gleichzeitige Polymerisation minimiert experimentelle Variation und große Leistung bedeutet, dass richtige Reaktionsbedingungen schnell gefunden werden kann, um die Reaktion für Upscaling. Daher ist unser zweites Ziel, den Nutzen von nicht gerührten Fällungspolymerisation in Prototyping und in Anwendungen zu zeigen, dass nicht eine große Menge an Produkt erfordern.
Verschiedene Aspekte der Synthese und Charakterisierung kommen zusammen in dem Beispiel der Anwendung der fluoreszenzmarkierten PNIPAM-Mikrogele in kolloidalen Wechselwirkung Forschung. Hier verwenden wir eine hochgenaue Einzelpartikelverfolgung, die Diffusion von markierten Tracers Mikrogele in Dispersion von nicht-markierten Matrix Mikrogele über einen weiten Konzentrationsbereich Matrix zu untersuchen und den Käfig-Effekt in konzentrierter kolloidalen Dispersion lösen. Weitfeld-Fluoreszenzmikroskopie ist gut geeignet, for diesen Zweck, da sie kann unter einer großen Anzahl von potentiell unterschiedlichen Matrixspezies das spezifische Verhalten von einigen Tracermoleküle zu charakterisieren. Dies steht im Gegensatz zu Techniken wie DLS, SLS und Rheologie, die die Gesamtdurchschnittseigenschaften von Systemen messen und daher nicht das Verhalten von kleinen Anzahl von Sonden Teilchen in einem großen System auflösen kann. Weiterhin kann in diesem speziellen Beispiel herkömmlichen Lichtstreuungsverfahren nicht auch aufgrund der hohen Partikelkonzentration verwendet werden, die starke Mehrfachstreuung führt jede Standardanalyse ungültig gemacht. Die Verwendung von automatischen Datenverarbeitung und statistischen Methoden ermöglichen die Analyse von Gesamtsystemverhalten auch für Einzelpartikelverfolgung, wenn über große Probengrößen gemittelt.
Protokoll
1. Microgel Synthese
HINWEIS: N Isopropylacrylamid (NIPAM) wurde aus n-Hexan umkristallisiert. Andere Reagenzien wurden wie erhalten verwendet.
- Herkömmlichen Batch Synthese von Poly (NIPAM) Matrix Mikrogele
- Man löst 1,8 g NIPAM und 24 mg N, N '-bisacrylamide (BIS) in 245 ml filtriert (0,2 & mgr; m regenerierter Cellulose (RC) Membranfilter) doppelt destilliertem Wasser in einem 500 ml Dreihalsrundkolben , der mit einem Rückflußkühler ausgestattet ist , einem Rührer und einem Gummiseptum.
- Legen Sie ein Thermometer und ein 120-mm-Nadel für den Stickstoffeintrag durch das Septum.
- Die Lösung wird auf 60 ° C unter Rühren. Desoxygenieren die Lösung von 40 min mit Stickstoff gespült.
- Gleichzeitig bereiten die Lösung eine Initiatorlösung von 155 mg Kaliumpersulfat (KPS) in 5 ml gefiltert doppelt destilliertem Wasser und Blase mit Stickstoff Sauerstoff zu entfernen.
- Übertragen Sie die komplette 5 ml KPS solution in einer Spritze Stickstoff-washed mit einem 120-mm-Nadel ausgestattet.
- Heben Sie die Stickstoff-Nadel über der Lösungsebene im Dreihalskolben und fügen Sie die KPS-Lösung schnell durch das Gummiseptum in den Reaktor.
- Ließ die Polymerisation für 1 Stunde unter einem Stickstoffstrom und langsamen Rühren bei 60 ° C stattfindet.
- Verwenden Sie einen Büchner-Trichter und Filterpapier die heiße Reaktionslösung zu filtern, um große Aggregate zu verwerfen. Lassen Sie die Dispersion abkühlen.
- Zentrifuge und Redispersion der Dispersion dreimal 40 min lang bei 257.000 xg und schließlich das Sediment in einem minimalen praktikable Menge an doppelt destilliertem Wasser redispergieren. Typischerweise ist dies 2-4 ml.
- Lyophilisieren der Dispersion zum Speichern.
- Nicht gerührt Synthese von fluoreszenzmarkierten Poly (NIPAM) Mikrogele
- Wiegen 257,7 mg NIPAM, 3,5 mg BIS und 1,5 mg Methacryloxyethylgruppe Thiocarbamoyl Rhodamin B (Farbstoff) in Glasgefäß und 10 ml gefiltertes Doppel destillierened Wasser.
- Ultrasonicate der Farbstoff-Monomer-Lösung 15 min um den Farbstoff in Wasser zu lösen.
- Bereiten Sie die gleiche Lösung ohne Farbstoff in einen separaten Glasgefäß.
- Bereiten verschiedener Verdünnungen der Monomerlösung mit dem Farbstoff der Monomerlösung ohne den Farbstoff unter Verwendung einer Konzentrationsreihe mit verschiedenen Farbstoffkonzentrationen zu erhalten. In dieser Arbeit verwenden Farbstoff in einem Konzentrationsbereich von 0,02 bis 0,1 mmol / L.
- Man löst 8,4 mg KPS in 10 ml filtriert doppelt destilliertem Wasser, um die Initiatorlösung zu erhalten.
- Übertragung von 0,5 ml der Konzentrationsreihe und 0,5 ml der KPS-Lösung Röhrchen mit 10 mm Durchmesser zu testen, um die endgültigen Reaktionslösungen zu erhalten, und abdichten sie mit Gummimembranen.
- Vorwärmen ein Ölbad in einem doppelwandigen Glasbehälter mit einem Heizungs Zirkulators verbunden bis 63 ° C.
- Deoxygenize die Reaktionslösungen durch 20 min mit Stickstoff durch 120 mm Nadeln gespült wurde.
- Legen Sie die Rohre in afloating Plattform und die Plattform in den vorgeheizten Ölbad getaucht werden. Die Temperatur auf 60 ° C. Anfänglich höhere Temperatur im Bad ist notwendig, da die Raumtemperatur-Lösungen das Bad abkühlen. Für hohe Präzision Teilchengrösse tuning hat die Temperatursteuerung während der anfänglichen Reaktion streng sein, typischerweise ± 0,1 ° C.
- Ließ die Reaktion für eine angemessene Zeit fortzufahren. Typischerweise 1 Stunde ist genug.
- Übertragen die Reaktionsrohre schnell in einen Ofen bei 60 ° C und stellte einen Tropfen der heißen Dispersion auf 10 ml gefiltertes doppelt destilliertem Wasser vorgewärmt über PNIPAM Volumenphasenübergangstemperatur (VPTT, 32 -34 ° C) 1 für DLS Charakterisierung in der zusammengeklappten Zustand.
- Lassen Sie den Rest der Dispersionen auf Raumtemperatur abkühlen und übertragen sie in Zentrifugenröhrchen.
- Zentrifugieren Sie die Lösung dreimal für 40 min bei 257.000 xg und verdünnen die Mikrogele schließlich in 2 ml filtriert doppelt destilliertem Wasser for die Verwendung als Tracer-Partikel.
2. Light Scattering Charakterisierung
- Hydrodynamischen Radius Bestimmung in zusammengeklappten Zustand durch Dynamic Light Scattering
- Waschen Sie Küvetten und mit Acetondampf Glas.
- Wärme 10 ml filtriert (zB 200 nm oder kleiner RC - Filter) doppelt destilliertem Wasser über PNIPAM VPTT.
- Übertragen einer Tropfen Heiß Dispersion auf das gefilterte Wasser, das eine vorgewärmte Nadel (0,9 x 40 mm) und die Spritze (1 ml).
- Mildern des DLS Goniometer Indexanpassung Bad auf 50 ° C und übertragen Sie die Probe auf das Gerät, ohne dass es abkühlen.
- Finden Sie die größte Streuwinkel, wo die Streuintensität ausreicht, um eine Korrelogramm zu erwerben, die von Testmessungen durchführen.
- Analysenküvette einsetzen (10 mm Durchmesser Glasrohr mit 1 ml der Partikeldispersion). Bewegen Sie den Detektor Arm zu kleinen Streuwinkel (hier 30 °).
- Schauen Sie sich die Strahlprofil for Mehrfachstreuung: kein Glühen um den Primärstrahl, keine Mehrfachstreuung usw. Überprüfen Sie, ob der Zählerbereich für die Messung bei der niedrigsten Streuwinkel geeignet ist (ca. zwischen 30 und 600 kHz; oberen rechten Ecke des Software - Fensters..)
- Bewegen Sie den Goniometerarm auf höchste Streuwinkel (120 ° wählen hier). Überprüfen Sie, ob die Zählrate noch hoch genug für die Messung ist (zwischen 30 und 600 kHz). Wenn die Intensität zu niedrig ist, bewegen Sie den Arm zu senken Winkelstreuung.
- Überprüfen Sie den Strahl visuell durch das Toluolbad Glas auf dem niedrigsten Streuwinkel, wenn Glühen um den einfallenden Strahl Mehrfachstreuung erfolgt beobachtet wird. In diesem Fall reduzieren die Laserintensität oder einer höheren Verdünnung verwenden.
- Erwerben 20 Korrelogramme zwischen dem minimalen und maximalen Streuungswinkel (zB 30 ° - 140 °) mit minimaler Erfassungszeit von 60 sec. Erhöhen Sie die Erfassungszeit für schwache Intensität große StreuwinkelFalls benötigt.
- Datenanalyse 37
- Berechnen Vektorgrößen für den Streuwinkelstreuung gemäß
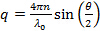 Ist , wobei n der Brechungsindex der Dispersion,
Ist , wobei n der Brechungsindex der Dispersion, 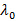 die Wellenlänge des Lasers im Vakuum und
die Wellenlänge des Lasers im Vakuum und 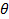 der Streuwinkel.
der Streuwinkel. - Im Fall stellt die Messtechnik-Software, die Intensität Korrelationsfunktion
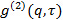 , Wandeln es in elektrische Feld Korrelationsfunktion
, Wandeln es in elektrische Feld Korrelationsfunktion 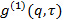 gemäß
gemäß  . Parameter
. Parameter 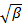 ist ein uninteressant instrumental Parameter auf den Grad der räumlichen Kohärenz des gestreuten Lichts Ove bezogenenr der Detektorfläche.
ist ein uninteressant instrumental Parameter auf den Grad der räumlichen Kohärenz des gestreuten Lichts Ove bezogenenr der Detektorfläche. - Führen Sie Kumulantenanalyse auf Korrelogramme, also passen Polynom zweiter Ordnung zum Logarithmus jedes elektrischen Feldkorrelationsfunktion
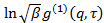 durch lineare kleinsten Quadrate.
durch lineare kleinsten Quadrate. 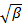 erscheint als der Achsenabschnitt der Passung und der genaue Wert wird in Bezug auf die Datenanalyse ohne Bedeutung. Beschränken die Passform zu einem sinnvollen Wert τ Verzögerungszeit, beispielsweise so , dass die Korrelationsamplitude von 10 bis 20% der maximalen Amplitude. Der Koeffizient der Term erster Ordnung ist die mittlere Abnahmerate der Korrelationsfunktion,
erscheint als der Achsenabschnitt der Passung und der genaue Wert wird in Bezug auf die Datenanalyse ohne Bedeutung. Beschränken die Passform zu einem sinnvollen Wert τ Verzögerungszeit, beispielsweise so , dass die Korrelationsamplitude von 10 bis 20% der maximalen Amplitude. Der Koeffizient der Term erster Ordnung ist die mittlere Abnahmerate der Korrelationsfunktion, 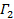 .
. - Finden Sie den wahrscheinlichsten Wert für die mittlere Diffusionskoeffizient
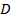 der Partikel durch linear kleinsten Quadrate auf
der Partikel durch linear kleinsten Quadrate auf  . Ob
. Ob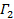 gegen
gegen 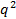 nicht linear erscheinen und den Ursprung innerhalb des Fehlers durchlaufen, ist die Partikelgrößenverteilung breit und hydrodynamischen Radius wird schlecht definiert werden.
nicht linear erscheinen und den Ursprung innerhalb des Fehlers durchlaufen, ist die Partikelgrößenverteilung breit und hydrodynamischen Radius wird schlecht definiert werden. - Berechnen Sie den mittleren hydrodynamischen Radius von der Stokes-Einstein-Beziehung
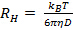 gegebenen
gegebenen 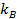 die Boltzmann-Koeffizient,
die Boltzmann-Koeffizient, 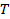 die absolute Temperatur und
die absolute Temperatur und 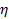 die Viskosität der Dispersion bei
die Viskosität der Dispersion bei 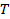 . Propagieren der Standardabweichung
. Propagieren der Standardabweichung 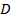 nach
nach 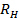 .
.
- Berechnen Vektorgrößen für den Streuwinkelstreuung gemäß
- Partikelstrukturbestimmung durch statische Lichtstreuung
- Waschen Sie Küvetten und mit Acetondampf Glas. Verwenden 20 mm Durchmesser oder größer Küvetten die zylindrische Linseneffekt zu minimieren.
- Filter (200 nm RC-Filter oder kleiner) in etwa 20 ml doppelt destilliertem Wasser auf einem Glasfläschchen und übertragen einen Tropfen gereinigt Dispersion in das Fläschchen. Das Filter wird mit 10 ml Wasser, bevor es für die Probenvorbereitung zur Entfernung von Verunreinigungen aus dem Herstellungsverfahren zurückbleibt.
- Überprüfen Probe gegen jede Umgebungslichtquelle. Wenn blauen Farbton beobachtet wird, wird die Probe wahrscheinlich zu konzentrieren. Verdünnte entsprechend.
- Bereiten Sie Hintergrund Wasserprobe durch die Küvette mehrmals mit gefiltertem Wasser gespült und dann füllen, um geeignete Probenvolumen in Abhängigkeit von der Küvette und der Laserposition im Gerät. Der Laser muss durch die Probe passieren, ohne von dem Meniskus gebrochen wird.
- Kalibrieren Sie den instrument unter Verwendung einer Toluol Probe.
- Messen Sie Wasser-Streuung (Hintergrund) in der gesamten verfügbaren Winkelbereich.
- Messen Sie die Streuintensität von der Probe während des gesamten verfügbaren Winkelbereich vorzugsweise bei mehreren Wellenlängen. Das Streumuster auf der vorderen Streuintensität normalisiert wird als Formfaktor bekannt.
- Wenn Partikelstruktur bekannt ist, verwenden Sie die entsprechende Modellausdruck globale Anpassung an den Datensätzen bei verschiedenen Wellenlängen gemessen zu berechnen.
- Für unbekannte Verwendung Partikelstruktur regularisiert direkt (wie FitIt! 33) oder eine allgemeinere indirekte inversen Fourier 21,22 Routine in Verbindung mit Entfaltungs des Paares Abstand Verteilungsfunktion (nur für kugelförmige Teilchen) 23,24 , um ungefähre Klassifizierung der Partikel verwandeln Art.
- Im Fall liefert die Armatur oder Inversionsroutine eine Schätzung der Partikelradius Verteilungsfunktion, die Berechnung der PolydispersitätIndex (Standardabweichung der Verteilung von seinem Mittelwert geteilt).
3. Partikelverfolgung durch Weitfeld-Fluoreszenzmikroskopie
HINWEIS: Tracer und Matrixteilchen von 465 ± 7 nm und 405 ± 7 nm hydrodynamischen Radien bei 20 ° C wurden jeweils für die Partikelverfolgung verwendet.
- Probenvorbereitung
- Bereiten Sie konzentrierte Matrix Mikrogeldispersion durch Redispergierung bekannte Menge an gefriergetrockneten unmarkierten Mikrogel bekannte Menge doppelt destilliertem Wasser. Fügen Sie ein kleines Volumen von markierten Tracerpartikel.
- Bestätigen Sie die entsprechende Tracer Mikrogel Konzentration im Mikroskop. Die optimale Konzentration ist ein Kompromiss zwischen gleichzeitigen Erwerb von maximal Anzahl von Spuren, während die niedrig genug Tracer-Konzentration aufweist, so dass die Wahrscheinlichkeit, dass die Tracerpartikel Spuren während der Erfassung überqueren vernachlässigbar ist.
- Bereiten Sie konzentrierten Dispersionen durch VerdampfenWasser in einem Ofen. Bestimmen Gewichtskonzentration durch das Gewicht der Dispersion auf das ursprüngliche Gewicht der Probe vor der Verdampfung zu vergleichen.
- Datenerfassung und Auswertung
- Verwenden Sie eine entsprechende Objektivlinse der gewünschten Vergrößerung und Blende zur Anregung der Tracer und gleichzeitige Fluoreszenz Sammlung aus der Probe. In dieser Arbeit verwenden, um eine 100X / 1.3 NA -Ölimmersionsobjektiv Linse.
- Legen Sie die Feuchtigkeitskammer auf einen xyz-Piezo-Tabelle, die in ein kommerzielles Mikroskop passt.
- Um die Probe vor dem Austrocknen zu verhindern, wird ein Plasma gereinigt Deckglas in die Feuchtigkeitskammer und Pipette 10 ul Poly (NIPAM) Dispersion der gewünschten Konzentration auf den Schlupf.
- In Abhängigkeit von der Anregungs- und Emissionsspektren des Fluoreszenzfarbstoffs, einen geeigneten Laser zur Anregung verwendet werden und die Laserleistung entsprechend einzustellen. Die Intensität sollte ausreichend niedrig sein, schnelle Photobleaching der Farbstoffe zu vermeiden, aber beidie gleichzeitig stark genug für eine genaue Einzelpartikelpositionierung (siehe unten). In dieser Arbeit verwenden , um eine 561 nm diodengepumpten Festkörperlaser und halten Sie die Laserleistung konstant bei 16 mW (ca. 0,5 kW cm -2 bei der Probe) bei allen Messungen.
- Zur Erzielung homogene Probenbeleuchtung, verwenden Sie die kritische Beleuchtung Setup hier beschrieben. Dazu koppeln die Laser in eine Multimode-Faser (NA 0,22 ± 0,02, 0,6 mm Kerndurchmesser), schütteln Sie die Faser mit einem Vortexer um zeitlich Durchschnitt aus Laserspeckles verwenden und projizieren die Faser in der Probenebene zu beenden.
- Kalibrieren Sie die z Abstand von der Rückreflexion des Deckglases und mehreren Mikrometern in die Probe fokussieren, indem das Ziel leicht nach oben bewegen und fixieren Sie die z-Position einen z-Kompensator verwendet wird. Dies vermeidet Grenzflächeneffekte mit dem Deckglas.
- Stellen Sie die Detektorparameter wie Belichtungszeit, zu der Stärke des Fluoreszenzsignals. In diesem Fall verwenden Sie eine EMCCD Kameramit Belichtungszeit von 0,1 sec, Elektronenvervielfachungsmodus und Verstärkung von 50.
- Erwerben mehrere Filme mit der entsprechenden Anzahl von Rahmen eine ausreichende Verzögerungszeit zu erhalten, um den mittleren quadratischen Verschiebung der Mikrogele in verschiedenen Bereichen der Probe zu berechnen. In dieser Arbeit, Erwerb Rahmenzahlen von 500 oder 1.000 Frames verwenden.
- Analysieren Sie die Daten , die durch die Positionierung der Partikel in jedem Rahmen mit Gauß - Angleich 25 und verwenden Sie ein geeignetes Partikel - Tracking - Algorithmus 26 , um die mittlere quadratische Verschiebung erhalten. 27 berechnen Werte Mittelwert und Standardabweichung durch Mittelung über alle Titel in allen Filmen. Berechnen Sie die lange Zeitverzögerung Diffusionskoeffizienten durch lineare Regression aus
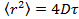 , woher
, woher 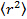 ist der mittlere quadratische Verschiebung der mittleren Diffusionskoeffizienten D und die Verzögerungszeit & tgr;.
ist der mittlere quadratische Verschiebung der mittleren Diffusionskoeffizienten D und die Verzögerungszeit & tgr;. - Europäische SommerzeitiMate die Anomalie Parameter γ aus der anomalen Diffusionsgleichung
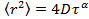 indem die Daten auf logarithmische Skala Transformation, wodurch man
indem die Daten auf logarithmische Skala Transformation, wodurch man 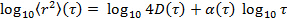 . Die Anomalie Parameter
. Die Anomalie Parameter 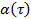 wird durch die Ableitung der Handlung gegeben. Das Derivat kann durch die Finite-Differenzen der Datenpunkte geschätzt werden, oder die Datenpunkte durch Polynomfunktionen Montage und Differenzierung analytisch. Bestimmen Sie den ausreichenden Grad der Polynomfit Funktionen durch die Anpassungs Residuen und Restnorm Plotten für Polynomordnung erhöhen.
wird durch die Ableitung der Handlung gegeben. Das Derivat kann durch die Finite-Differenzen der Datenpunkte geschätzt werden, oder die Datenpunkte durch Polynomfunktionen Montage und Differenzierung analytisch. Bestimmen Sie den ausreichenden Grad der Polynomfit Funktionen durch die Anpassungs Residuen und Restnorm Plotten für Polynomordnung erhöhen. - Wiederholen Sie den Vorgang für verschiedene Konzentrationen der Mikrogelteilchen Matrizen.
Ergebnisse
Die Anzahl der PNIPAM Mikrogelteilchen in der Charge und damit die endgültige Partikelvolumen, wird früh in der Reaktion während der Phase der Keimbildung 20 Thiocarbamoyl Rhodamin B beeinflußt die Keimbildung durch Reduzierung der Teilchendichte in der Charge Hydrophobic Comonomer Farbstoff methacryloxyethyl bestimmt. Die Abnahme der Partikelkonzentration für zwei unterschiedliche Anfangs NIPAM Konzentrationen ...
Diskussion
Zugabe von geringen Mengen von funktionellen Comonomer kann eine signifikante Wirkung auf die Partikelgröße und Struktur der PNIPAM abgeleitet Mikrogele. Gleichzeitige kleine Reagenzglas Polymerisation ist eine gute Methode, um solche Änderungen zu berücksichtigen, und hilft, schnell die richtigen Reaktantenzusammensetzungen für Zielpartikelgröße finden für Upscaling der Reaktion nach Bedarf. Die Masse der Teilchen etwa exponenti...
Offenlegungen
The authors have nothing to disclose.
Danksagungen
The Deutsche Forschungsgemeinschaft (DFG) is acknowledged for financial support within the Sonderforschungsbereich SFB 985 "Functional Microgels and Microgel Systems".
Materialien
| Name | Company | Catalog Number | Comments |
| Acetone | VWR Chemicals | KRAF13455 | |
| Bisacrylamid | AppliChem | A3636 | |
| n-Hexane | Merck | 104374 | |
| N-Isopropylacrylamide | Fisher Scientific | AC412785000 | recrystallized from n-hexane |
| Methacryloxyethyl thiocarbamoyl rhodamine B | Polysciences | 23591 | |
| Potassium peroxodisulfate | Merck | 105091 | |
| Silicone oil 47 V 350 | VWR Chemicals | 83851 | |
| Toluene | Sigma Aldrich | 244511 | |
| F12 Refrigerated/heating circulator | Julabo | 9116612 | |
| Microscope | Olympus | IX83 | |
| XY(Z) Piezo System | Physik Instrumente | P-545.3R7 | |
| 100X Oil immersion objective | Olympus | UPLSAPO | |
| QuadLine Beamsplitter | AHF Analysentechnik | F68-556T | |
| Cobolt Jive 150 laser | Cobolt | 0561-04-01-0150-300 | |
| Multimode Fiber | Thorlabs | UM22-600 | |
| iXON Ultra 897 EMCCD camera | Andor | DU-897U-CS0-BV | |
| Laser goniometer | SLS Systemtechnik | Mark III | |
| CF40 Cryo-compact circulator | Julabo | 9400340 | |
| Laser goniometer system | ALV GmbH | ALV / CGS-8F | |
| Multi-tau corretator | ALV GmbH | ALV-7004 | |
| Light scattering electronics | ALV GmbH | ALV / LSE 5004 | |
| Photon counting module | PerkinElmer | SPCM-CD2969 | 2 units in pseudo cross-correlation mode |
| 633 nm HeNe Laser | JDS Uniphase | 1145P | |
| F32 Refrigerated/heating circulator | Julabo | 9312632 |
Referenzen
- Pelton, R. Temperature-sensitive aqueous microgels. Adv. Colloid Interfac. 85, 1-33 (2000).
- Pich, A., Richtering, W. Microgels by Precipitation Polymerization: Synthesis, Characterization and Functionalization. Adv. Polym. Sci. 234, 1-37 (2010).
- Richtering, W. Responsive Emulsions Stabilized by Stimuli-Sensitive Microgels: Emulsions with Special Non-Pickering Properties. Langmuir. 28 (50), 17218-17229 (2012).
- Wiese, S., Spiess, A. C., Richtering, W. Microgel-Stabilized Smart Emulsions for Biocatalysis. Angew. Chem. Int. Edit. 52 (2), 576-579 (2012).
- Schmitt, V., Ravaine, V. Surface compaction versus stretching in Pickering emulsions stabilised by microgels. Curr. Opin. Colloid In. 18 (6), 532-541 (2013).
- Wellert, S., Richter, M., Hellweg, T., von Klitzing, ., R, Y., Hertle, Responsive Microgels at Surfaces and Interfaces. Z. Phys. Chem. 229 (7-8), 1-26 (2015).
- Li, Z., Harbottle, D., Pensini, E., Ngai, T., Richtering, W., Xu, Z. Fundamental Study of Emulsions Stabilized by Soft and Rigid Particles. Langmuir. 31 (23), 6282-6288 (2015).
- Deshmukh, O. S., van den Ende, D., Stuart, M. C., Mugele, F., Duits, M. H. G. Hard and soft colloids at fluid interfaces: Adsorption, interactions, assembly & rheology. Adv. Colloid Interfac. 222, 215-227 (2015).
- Serpe, M. J., Kim, J., Lyon, L. A. Colloidal Hydrogel Microlenses. Adv. Mater. 16 (2), 184-187 (2004).
- Schmidt, S., Zeiser, M., Hellweg, T., Duschl, C., Fery, A., Möhwald, H. Adhesion and Mechanical Properties of PNIPAM Microgel Films and Their Potential Use as Switchable Cell Culture Substrates. Adv. Func. Mater. 20 (19), 3235-3243 (2010).
- Xia, Y., He, X., et al. Thermoresponsive Microgel Films for Harvesting Cells and Cell Sheets. Biomacromolecules. 14 (10), 3615-3625 (2013).
- Guan, Y., Zhang, Y. PNIPAM microgels for biomedical applications: from dispersed particles to 3D assemblies. Soft Matter. 7 (14), 6375 (2011).
- Yunker, P. J., Chen, K., Gratale, M. D., Lohr, M. A., Still, T., Yodh, A. G. Physics in ordered and disordered colloidal matter composed of poly(N-isopropylacrylamide) microgel particles. Rep. Prog. Phys. 77 (5), 056601-056629 (2014).
- Lohr, M. A., Still, T., et al. Vibrational and structural signatures of the crossover between dense glassy and sparse gel-like attractive colloidal packings. Phys. Rev. E. 90 (6), 062305 (2014).
- Dreyfus, R., Xu, Y., Still, T., Hough, L. A., Yodh, A. G., Torquato, S. Diagnosing hyperuniformity in two-dimensional, disordered, jammed packings of soft spheres. Phys. Rev. E. 91 (1), 012302-012312 (2015).
- Kojima, H., Tanaka, F. Reentrant volume phase transition of cross-linked poly(N-isopropylacrylamide) gels in mixed solvents of water/methanol. Soft Matter. 8 (10), 3010-3011 (2012).
- Hofmann, C. H., Plamper, F. A., Scherzinger, C., Hietala, S., Richtering, W. Cononsolvency Revisited: Solvent Entrapment by N-Isopropylacrylamide and N, N-Diethylacrylamide Microgels in Different Water/Methanol Mixtures. Macromolecules. 46 (2), 523-532 (2013).
- Bischofberger, I., Calzolari, D. C. E., Trappe, V. Co-nonsolvency of PNiPAM at the transition between solvation mechanisms. Soft Matter. 10 (41), 8288-8295 (2014).
- Virtanen, O. L. J., Richtering, W. Kinetics and particle size control in non-stirred precipitation polymerization of N-isopropylacrylamide. Colloid Polym. Sci. 292 (8), 1743-1756 (2014).
- Virtanen, O. L. J., Ala-Mutka, H. M., Richtering, W. Can the Reaction Mechanism of Radical Solution Polymerization Explain the Microgel Final Particle Volume in Precipitation Polymerization of N-Isopropylacrylamide?. Macromol. Chem. Phys. 216 (13), 1431-1440 (2015).
- Glatter, O. A new method for the evaluation of small-angle scattering data. J. Appl. Crystallogr. 10 (5), 415-421 (1977).
- Svergun, D. I. Determination of the regularization parameter in indirect-transform methods using perceptual criteria. J. Appl. Crystallogr. 25 (4), 495-503 (1992).
- Glatter, O. Convolution Square Root of Band-Limited Symmetrical Functions and Its Application to Small-Angle Scattering Data. J. Appl. Crystallogr. 14, 101-108 (1981).
- Glatter, O., Hainisch, B. Improvements in Real-Space Deconvolution of Small-Angle Scattering Data. J. Appl. Crystallogr. 17, 435-441 (1984).
- Cheezum, M. K., Walker, W. F., Guilford, W. H. Quantitative Comparison of Algorithms for Tracking Single Fluorescent Particles. Biophys. J. 81 (4), 2378-2388 (2001).
- Wöll, D., Kölbl, C., Stempfle, B., Karrenbauer, A. A novel method for automatic single molecule tracking of blinking molecules at low intensities. Phys. Chem. Chem. Phys. 15 (17), 6196-6205 (2013).
- Saxton, M. J., Jacobson, K. Single-particle tracking: Applications to membrane dynamics. Annu. Rev. Bioph. Biom. 26, 373-399 (1997).
- Pusey, P. N., van Megen, W. Detection of small polydispersities by photon correlation spectroscopy. J. Chem. Phys. 80 (8), 3513 (1984).
- Stieger, M., Pedersen, J. S., Richtering, W., Lindner, P. Small-angle neutron scattering study of structural changes in temperature sensitive microgel colloids. J. Chem. Phys. 120 (13), 6197-6206 (2004).
- Wu, X., Pelton, R. H., Hamielec, A. E., Woods, D. R., McPhee, W. The kinetics of poly(N-isopropylacrylamide) microgel latex formation. Colloid Polym. Sci. 272, 467-477 (1994).
- Weeks, E. R., Weitz, D. A. Subdiffusion and the cage effect studied near the colloidal glass transition. Chem. Phys. 284 (1-2), 361-367 (2002).
- Ernst, D., Köhler, J., Weiss, M. Probing the type of anomalous diffusion with single-particle tracking. Phys. Chem. Chem. Phys. 16 (17), 7686-7691 (2014).
- . FitIt! (Version 1.1.4) Available from: https://www.github.com/ovirtanen/fitit (2015)
- Provencher, S. W. A Constrained Regularization Method For Inverting Data Represented By A Linear Algebraic or Integral Equations. Comput. Phys. Commun. 27 (3), 213-227 (1982).
- Holtzer, L., Meckel, T., Schmidt, T. Nanometric three-dimensional tracking of individual quantum dots in cells. Appl. Phys. Lett. 90 (5), 053902-053904 (2007).
- Diezmann, A. V., Lee, M. Y., Lew, M. D., Moerner, W. E. Correcting field-dependent aberrations with nanoscale accuracy in three-dimensional single-molecule localization microscopy. Optica. 2 (11), 985-989 (2015).
- Lindner, P., Zemb, T. . Neutrons, X-rays and Light: Scattering Methods Applied to Soft Condensed Matter. , (2002).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten