Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Synthèse contrôlée et le suivi Fluorescence de très uniforme Poly (
Dans cet article
Résumé
Polymérisation par précipitation non agité fournit une approche de prototypage rapide, reproductible à la synthèse de stimuli-sensibles poly (N -isopropylacrylamide) microgels de distribution de taille étroite. Dans cette synthèse de protocole, la caractérisation de la diffusion de la lumière et unique suivi de fluorescence des particules de ces microgels dans une configuration de microscopie à champ large sont démontrées.
Résumé
Stimuli sensible poly (N -isopropylacrylamide) (PNIPAM) microgels ont diverses applications pratiques prospectives et utilise dans la recherche fondamentale. Dans ce travail, nous utilisons seule particule suivi microgels de PNIPAM des marquées par fluorescence comme une vitrine pour la taille tuning microgel par un procédé de polymérisation de précipitation rapide non agité. Cette approche est bien adaptée pour le prototypage de nouvelles compositions de réaction et les conditions ou pour des applications qui ne nécessitent pas de grandes quantités de produit. synthèse de Microgel, la taille des particules et la détermination de la structure par diffusion de lumière dynamique et statique sont détaillés dans le protocole. Il est montré que l'addition de comonomères fonctionnels peuvent avoir une grande influence sur la nucléation des particules et la structure. suivi de particules unique par grand champ microscopie par fluorescence permet une enquête sur la diffusion de microgels traceurs marqués dans une matrice concentrée de microgels non marqués, un système pas facilement étudiée pard'autres méthodes telles que la diffusion de lumière dynamique.
Introduction
Stimuli sensible poly (N -isopropylacrylamide) (PNIPAM) microgels 1,2 ont suscité un intérêt continu au cours des deux dernières décennies , en raison de leur potentiel dans diverses applications intelligentes. Les cas d'utilisation comprennent des stabilisants commutables démontrées en émulsion 3-8, 9 microlentilles, des substrats de culture cellulaire pour faciliter la récolte des cellules 10,11 et les transporteurs à puce pour des composés à faible poids moléculaire et d' autres utilisations biomédicales 12. D'un point de la recherche fondamentale de vue ces particules se sont avérées être utiles pour enquêter sur des sujets tels que les interactions colloïdales 13-15 et les interactions polymère-solvant 16-18.
L'utilisation réussie des microgels de PNIPAM et de leurs dérivés dans une application donnée nécessite généralement la connaissance de la taille moyenne des particules et la largeur de la distribution des tailles des particules. Pour l'interprétation correcte des résultats expérimentaux impliquant PNIPAM microdes gels, de la structure des particules, qui peut être affectée par des comonomères fonctionnels, doit être connue. diffusion de la lumière dynamique et statique (DLS et SLS, respectivement) sont particulièrement adaptés pour l'acquisition de ces informations parce que ces méthodes sont rapides et relativement facile à utiliser; et ils sondent les propriétés des particules non effractive dans leur environnement natif (dispersion). DLS et SLS recueillent également des données de grand nombre de particules en évitant les biais résultant de petite taille des échantillons, typiques pour les méthodes de microscopie. Par conséquent, le premier objectif de ce travail est de présenter les bonnes pratiques en ce qui concerne la diffusion de la lumière pour les praticiens de nouvelles à la caractérisation colloïdale.
En règle générale, la polymérisation par précipitation est effectuée à l'échelle du laboratoire et de trouver les conditions de réaction bonnes pour les propriétés spécifiques de particules peuvent être laborieux et nécessitent de nombreuses répétitions de la synthèse. Contrairement à la synthèse à grande discontinu, la polymérisation non agitée précipitation est de 19,20 arProcédure de apid dans lequel les lots de composition de réactifs différents peuvent être simultanément polymérisée particules plastification de distribution de taille étroite. polymérisation simultanée minimise la variation expérimentale et signifie grande sortie que les conditions de réaction de droite peuvent être trouvés rapide pour upscaling la réaction. Par conséquent, notre deuxième objectif est de démontrer l'utilité de la polymérisation non agitée précipitation dans le prototypage et dans les applications qui ne nécessitent pas une grande quantité de produit.
Différents aspects de la synthèse et la caractérisation sont réunis dans l'exemple d'application marqués par fluorescence microgels de PNIPAM dans la recherche sur l'interaction colloïdale. Ici, nous utilisons un suivi unique de particules de haute précision pour étudier la diffusion des microgels traceurs marqués dans la dispersion de microgels de matrice non marqués sur une large plage de concentration de la matrice et de résoudre l'effet de cage en dispersion colloïdale concentrée. Grand champ microscopie à fluorescence est bien adapté for cet effet, comme on peut caractériser le comportement spécifique de quelques molécules de traceur parmi un grand nombre d'espèces potentiellement différentes de la matrice. Ceci est en contraste avec des techniques telles que DLS, SLS et la rhéologie, qui mesurent les propriétés moyennes d'ensemble des systèmes et donc ne peut pas résoudre le comportement du petit nombre de particules de sonde dans un grand système. En outre, dans cet exemple spécifique des méthodes de diffusion de lumière classiques ne peuvent pas être utilisés aussi en raison de la concentration de particules élevée, ce qui conduit à une forte diffusion multiple viciant toute analyse standard. Utilisation du traitement automatisé des données et des méthodes statistiques permettant l'analyse du comportement global du système aussi pour le suivi des particules individuelles, en moyenne sur les grandes tailles d'échantillon.
Access restricted. Please log in or start a trial to view this content.
Protocole
1. Microgel Synthèse
REMARQUE: N -isopropylacrylamide (NIPAM) , on a fait recristalliser à partir de n-hexane. D'autres réactifs ont été utilisés tels que reçus.
- Conventionnel Batch Synthèse de poly (NIPAM) microgels Matrix
- Dissoudre 1,8 g de NIPAM et 24 mg de N, N '-bisacrylamide (BRI) dans 245 ml filtré (0,2 um de cellulose régénérée (RC) filtre à membrane) d'eau bidistillée dans un 500 ml à trois cols à fond rond équipé d'un condenseur à reflux, un agitateur et d'un septum en caoutchouc.
- Insérer un thermomètre et d'une aiguille de 120 mm pour l'apport d'azote à travers le septum.
- Chauffer la solution à 60 ° C, tout en agitant. Désoxygéner la solution en purgeant avec de l'azote pendant 40 min.
- En même temps préparer une solution d'initiateur de 155 mg de persulfate de potassium (KPS) dans 5 ml eau filtrée double distillée et bulle la solution avec de l'azote pour éliminer l'oxygène.
- Transférez les complets 5 ml KPS solution dans une seringue d'azote lavé équipé d'une aiguille de 120 mm.
- Soulever l'aiguille d'azote au-dessus du niveau de la solution dans le ballon à trois cols et à ajouter la solution de KPS rapidement à travers la cloison en caoutchouc dans le réacteur.
- Laissez la polymérisation procéder pendant 1 h sous flux d'azote et sous agitation lente à 60 ° C.
- Utilisez un entonnoir et le papier filtre Buchner pour filtrer la solution de réaction à chaud pour éliminer les grands agrégats. Laissez la dispersion refroidir.
- Centrifugeuse et redisperser la dispersion trois fois pour 40 minutes à 257.000 xg et enfin redisperser le sédiment dans une quantité minimale viable de l'eau distillée deux fois. Typiquement, cela est de 2-4 ml.
- Lyophiliser la dispersion pour le stockage.
- Synthèse non agitée de poly (NIPAM) microgels marqué par fluorescence
- Peser 257,7 mg NIPAM, 3,5 mg BIS, et 1,5 mg méthacryloxyéthyle thiocarbamoyle rhodamine B (colorant) dans un récipient en verre et ajouter 10 ml d'une double distillation filtréeeau ed.
- Ultrasonicate la solution de colorant monomère pendant 15 minutes pour dissoudre le colorant dans l'eau.
- Préparer de la même solution sans colorant dans un récipient en verre séparé.
- Préparer différentes dilutions de la solution de monomère avec le colorant en utilisant la solution de monomère sans que le colorant pour obtenir une série de concentrations avec diverses concentrations de colorant. Dans ce travail, utilisez un colorant dans la plage de concentration de 0,02-0,1 mmol / L.
- Dissoudre 8,4 mg KPS dans 10 ml eau filtrée distillée deux fois afin d'obtenir la solution d'initiateur.
- Transférer 0,5 ml de la série de concentrations et de 0,5 ml de la solution de KPS tubes à essai de 10 mm de diamètre pour obtenir des solutions de réaction final et les sceller avec des septums en caoutchouc.
- Préchauffer un bain d'huile dans un récipient à double paroi de verre reliée à un circulateur de chauffage à 63 ° C.
- Deoxygenize les solutions de réaction en purgeant avec de l'azote à travers les aiguilles 120 mm pendant 20 minutes.
- Insérer les tubes dans afloating plate-forme et immerger la plate-forme dans le bain d'huile préchauffé. Réglez la température à 60 ° C. température initiale plus élevée dans le bain est nécessaire que les solutions à température ambiante refroidir le bain. Pour une grande précision la taille des particules de réglage de la régulation de la température au cours de la première réaction doit être rigoureuse, typiquement ± 0,1 ° C.
- Laissez la réaction se déroule pendant un temps approprié. Généralement 1 heure suffit.
- Transférer les tubes de réaction rapide à l'étuve à 60 ° C et à mettre une goutte de la dispersion à chaud 10 ml d' eau filtrée bidistillée préchauffé par rapport au volume PNIPAM température de transition de phase (VPTT, 32 -34 ° C) 1, pour DLS caractérisation du état affaissé.
- Que le reste des dispersions refroidir à la température ambiante et de les transférer dans des tubes de centrifugeuse.
- Centrifuger la solution trois fois pour 40 minutes à 257.000 xg et diluer les microgels enfin dans 2 ml eau filtrée distillée deux fol'utilisation de r en tant que particules de traceur.
2. Light Scattering Caractérisation
- Hydrodynamiques Radius Détermination dans l'État Collapsed par Dynamic Light Scattering
- Laver les cuvettes et verrerie avec la vapeur d'acétone.
- Chauffer 10 ml de filtration (par exemple, 200 nm ou un filtre plus petit RC) de l' eau distillée deux fois plus de PNIPAM VPTT.
- Transférer une goutte de dispersion chaude à l'eau filtrée à l'aide d'une aiguille préalablement chauffée (0,9 x 40 mm) et une seringue (1 ml).
- Tempérez le DLS goniomètre bain de match de l'indice à 50 ° C et transférer l'échantillon à l'instrument sans le laisser refroidir.
- Trouver le plus grand angle de diffusion où l'intensité diffusée est suffisante pour acquérir un corrélogramme en effectuant des mesures de test.
- Insérer cuvette d'échantillon (10 mm de tube en verre de diamètre avec 1 ml d'une dispersion de particules). Déplacez le bras du détecteur à petit angle de diffusion (ici 30 °).
- Vérifiez le profil de faisceau for diffusion multiple: aucune lueur autour du faisceau primaire, pas la diffusion multiple, etc. Vérifiez que la plage de comptage est adapté à la mesure à l'angle le plus faible de diffusion (environ entre 30 et 600 kHz; coin supérieur droit de la fenêtre du logiciel..)
- Déplacez le bras de goniomètre au plus grand angle de diffusion (choisir 120 ° ici). Assurez-vous que le taux de comptage est encore assez élevé pour la mesure (entre 30 et 600 kHz). Si l'intensité est trop faible, déplacer le bras pour abaisser l'angle de diffusion.
- Vérifiez le faisceau visuellement à travers le verre de bain de toluène à l'angle de diffusion le plus bas, si lueur autour du faisceau incident est observé la diffusion multiple a lieu. Dans ce cas, réduire l'intensité du laser ou d'utiliser une plus grande dilution.
- Acquérir 20 corrélogrammes entre le minimum et le maximum de l' angle de diffusion (par exemple 30 ° - 140 °) avec un temps d'acquisition minimum de 60 secondes. Augmenter le temps d'acquisition pour faible intensité de grands angles de diffusionsi nécessaire.
- Analyse des données 37
- Calculer la dispersion des grandeurs de vecteurs pour l'angle de diffusion selon la
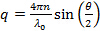 Où n est l'indice de réfraction de la dispersion,
Où n est l'indice de réfraction de la dispersion, 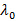 la longueur d'onde du laser dans le vide, et
la longueur d'onde du laser dans le vide, et 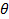 l'angle de diffusion.
l'angle de diffusion. - Dans le cas où le logiciel de mesure fournit la fonction de corrélation d'intensité
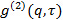 , Le transformer en fonction électrique de corrélation de champ
, Le transformer en fonction électrique de corrélation de champ 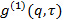 selon
selon  . Paramètre
. Paramètre 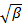 est un paramètre instrumental sans intérêt en rapport avec le degré de cohérence spatiale de la lumière diffusée over la zone de détection.
est un paramètre instrumental sans intérêt en rapport avec le degré de cohérence spatiale de la lumière diffusée over la zone de détection. - Effectuer une analyse des cumulants sur corrélogrammes, à savoir, adapter polynôme du second ordre au logarithme de chaque fonction de corrélation de champ électrique
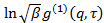 par moindres carrés linéaires.
par moindres carrés linéaires. 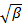 apparaît comme l'interception de l'ajustement et sa valeur exacte est sans importance en ce qui concerne l'analyse des données. Restreindre l'ajustement à une valeur de τ de temps de latence significatif, par exemple, de sorte que l'amplitude de corrélation est de 10 - 20% de l'amplitude maximale. Le coefficient du premier terme d'ordre est le taux décroissance moyenne de la fonction de corrélation,
apparaît comme l'interception de l'ajustement et sa valeur exacte est sans importance en ce qui concerne l'analyse des données. Restreindre l'ajustement à une valeur de τ de temps de latence significatif, par exemple, de sorte que l'amplitude de corrélation est de 10 - 20% de l'amplitude maximale. Le coefficient du premier terme d'ordre est le taux décroissance moyenne de la fonction de corrélation, 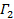 .
. - Trouvez la valeur la plus probable pour le coefficient de diffusion moyen
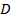 des particules par moindres carrés linéaires tenir sur
des particules par moindres carrés linéaires tenir sur  . Si
. Si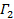 contre
contre 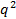 ne semble pas linéaire et passer par l'origine au sein de l'erreur, la distribution de taille des particules est large et rayon hydrodynamique sera mal défini.
ne semble pas linéaire et passer par l'origine au sein de l'erreur, la distribution de taille des particules est large et rayon hydrodynamique sera mal défini. - Calculer le rayon hydrodynamique moyen de la relation de Stokes-Einstein
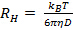 où
où 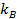 est le coefficient de Boltzmann,
est le coefficient de Boltzmann, 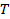 la température absolue et
la température absolue et 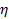 la viscosité de la dispersion à
la viscosité de la dispersion à 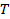 . Propager l'écart-type
. Propager l'écart-type 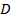 à
à 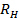 .
.
- Calculer la dispersion des grandeurs de vecteurs pour l'angle de diffusion selon la
- Particle Structure Détermination par Static Light Scattering
- Laver les cuvettes et verrerie avec la vapeur d'acétone. Utiliser 20 mm de diamètre ou plus grandes cuves pour minimiser l'effet de lentille cylindrique.
- Filtre (filtre RC 200 nm ou moins) à environ 20 ml d'eau bi-distillée dans un flacon en verre et transférer une goutte de dispersion purifiée dans le flacon. Laver le filtre avec 10 ml d'eau avant de l'utiliser pour la préparation des échantillons pour éliminer les impuretés restantes du processus de fabrication.
- Vérifiez échantillon contre toute source de lumière ambiante. Si la teinte bleue est observée, l'échantillon est susceptible d'être trop concentré. Diluer en conséquence.
- Préparer fond échantillon d'eau par rinçage de la cuvette plusieurs fois avec de l'eau filtrée, puis compléter au volume d'échantillon approprié, en fonction de la cuvette et la position du laser dans l'instrument. Le laser doit passer à travers l'échantillon sans être réfractée du ménisque.
- Calibrer le instrument à l'aide d'un échantillon de toluène.
- Mesurer la diffusion de l'eau (fond) dans toute la plage angulaire disponible.
- Mesurer l'intensité de diffusion de l'échantillon tout au long de la plage angulaire disponible de préférence à plusieurs longueurs d'onde. Le motif de diffusion normalisée à l'intensité de la diffusion vers l'avant est connu comme le facteur de forme.
- Si la structure des particules est connue, utiliser l'expression de modèle approprié pour calculer ajustement global sur les ensembles de données mesurées à différentes longueurs d'onde.
- De inconnue utilisation de la structure des particules régularisée directe ( par exemple, FitIt! 33) ou inverse indirecte plus générale transformée de Fourier 21,22 routine en conjonction avec une déconvolution de la fonction de distribution paire de distance (uniquement pour des particules sphériques) 23,24 pour une classification approximative des particules type.
- Dans le cas où la routine d'ajustement ou une inversion fournit une estimation de la fonction de distribution du rayon des particules, le calcul de la polydispersitéindice (écart-type de la distribution divisé par la moyenne).
3. Suivi de particules par Wide-field Fluorescence Microscopy
NOTE: Tracer et de la matrice des particules de 465 ± 7 nm et 405 ± 7 nm rayons hydrodynamiques à 20 ° C, respectivement, ont été utilisés pour le suivi des particules.
- La préparation des échantillons
- Préparer la dispersion matrice de microgel concentrée par redispersion quantité connue de microgel non marqué lyophilisé pour quantité connue d'eau distillée deux fois. Ajouter un petit volume de particules de traceur marqué.
- Confirmer la concentration de traceur microgel approprié dans le microscope. La concentration optimale est un compromis entre les acquisitions simultanées du nombre maximal de pistes, tout en ayant la concentration suffisamment faible traceur de telle sorte que la probabilité que les pistes traceur de particules se croisent lors de l'acquisition est négligeable.
- Préparer des dispersions concentrées par évaporationl'eau dans un four. Déterminer la concentration en poids en comparant le poids de la dispersion au poids initial de l'échantillon avant l'évaporation.
- Acquisition et analyse des données
- Utilisez un objectif approprié de l'agrandissement souhaité et l'ouverture pour l'excitation des traceurs et de collecte de fluorescence simultanée de l'échantillon. Dans ce travail, utiliser un NA immersion dans l'huile objectif 100X / 1.3.
- Placer la chambre de l'humidité sur une table piézo-xyz, qui se loge dans un microscope commercial.
- Pour empêcher l'échantillon de séchage, placez un plasma nettoyé lamelle dans la chambre de l'humidité et de la pipette 10 pl de poly (NIPAM) dispersion de la concentration souhaitée sur le bordereau.
- En fonction de l'excitation et des spectres d'émission du colorant fluorescent, en utilisant un laser d'excitation et adapté pour régler la puissance du laser de manière appropriée. L'intensité doit être suffisamment faible pour éviter photoblanchiment rapide des colorants, maisen même temps assez fort pour le positionnement unique de particules précise (voir ci-dessous). Dans ce travail, utiliser un 561 nm pompé par diode laser à l' état solide et maintenir constante la puissance du laser à 16 mW (environ 0,5 kW cm -2 à l'échantillon) pour toutes les mesures.
- Pour obtenir un éclairage échantillon homogène, utiliser la configuration d'éclairage critique décrit ici. Pour cela, coupler le laser dans une fibre multimode (NA 0,22 ± 0,02, diamètre de noyau de 0,6 mm), secouer la fibre en utilisant un vortex afin de temporellement moyenne sur mouchetures laser et projet de fin de la fibre dans le plan de l'échantillon.
- Calibrer le z distance de la réflexion arrière de la lamelle et concentrer plusieurs micromètres dans l'échantillon en déplaçant l'objectif légèrement et fixer la position z en utilisant un z-Compensateur. Ceci permet d'éviter les effets d'interface avec la lamelle.
- Ajuster les paramètres du détecteur, comme le temps d'exposition, à l'intensité du signal de fluorescence. Dans ce cas, utiliser une caméra EMCCDavec le temps d'exposition de 0,1 s, le mode électronique et le gain de 50 multiplier.
- Acquérir plusieurs films avec le nombre approprié de trames pour obtenir un temps de latence suffisant pour calculer le déplacement quadratique moyen des microgels dans les différentes régions de l'échantillon. Dans ce travail, utiliser des numéros de trame d'acquisition de 500 ou 1000 images.
- Analyser les données en positionnant les particules dans chaque trame en utilisant raccord gaussien 25 et utiliser un algorithme de suivi de particules approprié 26 pour obtenir le déplacement quadratique moyen. 27 Calculer les valeurs moyennes et écart - type par la moyenne sur toutes les pistes dans tous les films. Calculer les longs coefficients de diffusion de temps de latence par régression linéaire à partir
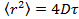 , où
, où 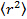 est le déplacement quadratique moyen, D le coefficient de diffusion moyenne et T pour le temps de latence.
est le déplacement quadratique moyen, D le coefficient de diffusion moyenne et T pour le temps de latence. - EstiMate le paramètre d'anomalie γ de l'équation de diffusion anormale
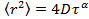 en transformant les données à échelle logarithmique, ce qui donne
en transformant les données à échelle logarithmique, ce qui donne 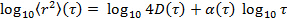 . Le paramètre d'anomalie
. Le paramètre d'anomalie 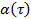 est donnée par la dérivée de la parcelle. Le dérivé peut être évaluée par les différences finies de points de données ou de mise en place des points de données par des fonctions polynomiales et différencier de manière analytique. Déterminer le degré suffisant des fonctions d'ajustement de polynômes en traçant les résidus d'ajustement et la norme résiduelle pour augmenter polynôme.
est donnée par la dérivée de la parcelle. Le dérivé peut être évaluée par les différences finies de points de données ou de mise en place des points de données par des fonctions polynomiales et différencier de manière analytique. Déterminer le degré suffisant des fonctions d'ajustement de polynômes en traçant les résidus d'ajustement et la norme résiduelle pour augmenter polynôme. - Répétez la même procédure pour les différentes concentrations des matrices de microgel.
Access restricted. Please log in or start a trial to view this content.
Résultats
Le nombre de particules de microgel PNIPAM dans le lot, et par conséquent le volume de la particule finale, on détermine au début de la réaction pendant la phase de germination 20 Hydrophobe co-monomère colorant méthacryloxyéthyl thiocarbamoyle rhodamine B influe sur la nucléation en réduisant la densité du nombre de particules dans le lot. La diminution de la concentration en particules pour deux concentra...
Access restricted. Please log in or start a trial to view this content.
Discussion
L'addition de petites quantités de co-monomère fonctionnel peut avoir un effet significatif sur la taille des particules et la structure des dérivés PNIPAM microgels. Simultanée à petite échelle polymérisation en tube à essai est une bonne méthode pour tenir compte de ces changements, et aide à trouver rapidement les compositions réactives à droite pour la taille de particule cible pour upscaling la réaction selon les b...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
The authors have nothing to disclose.
Remerciements
The Deutsche Forschungsgemeinschaft (DFG) is acknowledged for financial support within the Sonderforschungsbereich SFB 985 "Functional Microgels and Microgel Systems".
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| Acetone | VWR Chemicals | KRAF13455 | |
| Bisacrylamid | AppliChem | A3636 | |
| n-Hexane | Merck | 104374 | |
| N-Isopropylacrylamide | Fisher Scientific | AC412785000 | recrystallized from n-hexane |
| Methacryloxyethyl thiocarbamoyl rhodamine B | Polysciences | 23591 | |
| Potassium peroxodisulfate | Merck | 105091 | |
| Silicone oil 47 V 350 | VWR Chemicals | 83851 | |
| Toluene | Sigma Aldrich | 244511 | |
| F12 Refrigerated/heating circulator | Julabo | 9116612 | |
| Microscope | Olympus | IX83 | |
| XY(Z) Piezo System | Physik Instrumente | P-545.3R7 | |
| 100X Oil immersion objective | Olympus | UPLSAPO | |
| QuadLine Beamsplitter | AHF Analysentechnik | F68-556T | |
| Cobolt Jive 150 laser | Cobolt | 0561-04-01-0150-300 | |
| Multimode Fiber | Thorlabs | UM22-600 | |
| iXON Ultra 897 EMCCD camera | Andor | DU-897U-CS0-BV | |
| Laser goniometer | SLS Systemtechnik | Mark III | |
| CF40 Cryo-compact circulator | Julabo | 9400340 | |
| Laser goniometer system | ALV GmbH | ALV / CGS-8F | |
| Multi-tau corretator | ALV GmbH | ALV-7004 | |
| Light scattering electronics | ALV GmbH | ALV / LSE 5004 | |
| Photon counting module | PerkinElmer | SPCM-CD2969 | 2 units in pseudo cross-correlation mode |
| 633 nm HeNe Laser | JDS Uniphase | 1145P | |
| F32 Refrigerated/heating circulator | Julabo | 9312632 |
Références
- Pelton, R. Temperature-sensitive aqueous microgels. Adv. Colloid Interfac. 85, 1-33 (2000).
- Pich, A., Richtering, W. Microgels by Precipitation Polymerization: Synthesis, Characterization and Functionalization. Adv. Polym. Sci. 234, 1-37 (2010).
- Richtering, W. Responsive Emulsions Stabilized by Stimuli-Sensitive Microgels: Emulsions with Special Non-Pickering Properties. Langmuir. 28 (50), 17218-17229 (2012).
- Wiese, S., Spiess, A. C., Richtering, W. Microgel-Stabilized Smart Emulsions for Biocatalysis. Angew. Chem. Int. Edit. 52 (2), 576-579 (2012).
- Schmitt, V., Ravaine, V. Surface compaction versus stretching in Pickering emulsions stabilised by microgels. Curr. Opin. Colloid In. 18 (6), 532-541 (2013).
- Wellert, S., Richter, M., Hellweg, T., von Klitzing,, R,, Hertle, Y. Responsive Microgels at Surfaces and Interfaces. Z. Phys. Chem. 229 (7-8), 1-26 (2015).
- Li, Z., Harbottle, D., Pensini, E., Ngai, T., Richtering, W., Xu, Z. Fundamental Study of Emulsions Stabilized by Soft and Rigid Particles. Langmuir. 31 (23), 6282-6288 (2015).
- Deshmukh, O. S., van den Ende, D., Stuart, M. C., Mugele, F., Duits, M. H. G. Hard and soft colloids at fluid interfaces: Adsorption, interactions, assembly & rheology. Adv. Colloid Interfac. 222, 215-227 (2015).
- Serpe, M. J., Kim, J., Lyon, L. A. Colloidal Hydrogel Microlenses. Adv. Mater. 16 (2), 184-187 (2004).
- Schmidt, S., Zeiser, M., Hellweg, T., Duschl, C., Fery, A., Möhwald, H. Adhesion and Mechanical Properties of PNIPAM Microgel Films and Their Potential Use as Switchable Cell Culture Substrates. Adv. Func. Mater. 20 (19), 3235-3243 (2010).
- Xia, Y., He, X., et al. Thermoresponsive Microgel Films for Harvesting Cells and Cell Sheets. Biomacromolecules. 14 (10), 3615-3625 (2013).
- Guan, Y., Zhang, Y. PNIPAM microgels for biomedical applications: from dispersed particles to 3D assemblies. Soft Matter. 7 (14), 6375(2011).
- Yunker, P. J., Chen, K., Gratale, M. D., Lohr, M. A., Still, T., Yodh, A. G. Physics in ordered and disordered colloidal matter composed of poly(N-isopropylacrylamide) microgel particles. Rep. Prog. Phys. 77 (5), 056601-056629 (2014).
- Lohr, M. A., Still, T., et al. Vibrational and structural signatures of the crossover between dense glassy and sparse gel-like attractive colloidal packings. Phys. Rev. E. 90 (6), 062305(2014).
- Dreyfus, R., Xu, Y., Still, T., Hough, L. A., Yodh, A. G., Torquato, S. Diagnosing hyperuniformity in two-dimensional, disordered, jammed packings of soft spheres. Phys. Rev. E. 91 (1), 012302-012312 (2015).
- Kojima, H., Tanaka, F. Reentrant volume phase transition of cross-linked poly(N-isopropylacrylamide) gels in mixed solvents of water/methanol. Soft Matter. 8 (10), 3010-3011 (2012).
- Hofmann, C. H., Plamper, F. A., Scherzinger, C., Hietala, S., Richtering, W. Cononsolvency Revisited: Solvent Entrapment by N-Isopropylacrylamide and N, N-Diethylacrylamide Microgels in Different Water/Methanol Mixtures. Macromolecules. 46 (2), 523-532 (2013).
- Bischofberger, I., Calzolari, D. C. E., Trappe, V. Co-nonsolvency of PNiPAM at the transition between solvation mechanisms. Soft Matter. 10 (41), 8288-8295 (2014).
- Virtanen, O. L. J., Richtering, W. Kinetics and particle size control in non-stirred precipitation polymerization of N-isopropylacrylamide. Colloid Polym. Sci. 292 (8), 1743-1756 (2014).
- Virtanen, O. L. J., Ala-Mutka, H. M., Richtering, W. Can the Reaction Mechanism of Radical Solution Polymerization Explain the Microgel Final Particle Volume in Precipitation Polymerization of N-Isopropylacrylamide? Macromol. Chem. Phys. 216 (13), 1431-1440 (2015).
- Glatter, O. A new method for the evaluation of small-angle scattering data. J. Appl. Crystallogr. 10 (5), 415-421 (1977).
- Svergun, D. I. Determination of the regularization parameter in indirect-transform methods using perceptual criteria. J. Appl. Crystallogr. 25 (4), 495-503 (1992).
- Glatter, O. Convolution Square Root of Band-Limited Symmetrical Functions and Its Application to Small-Angle Scattering Data. J. Appl. Crystallogr. 14, 101-108 (1981).
- Glatter, O., Hainisch, B. Improvements in Real-Space Deconvolution of Small-Angle Scattering Data. J. Appl. Crystallogr. 17, 435-441 (1984).
- Cheezum, M. K., Walker, W. F., Guilford, W. H. Quantitative Comparison of Algorithms for Tracking Single Fluorescent Particles. Biophys. J. 81 (4), 2378-2388 (2001).
- Wöll, D., Kölbl, C., Stempfle, B., Karrenbauer, A. A novel method for automatic single molecule tracking of blinking molecules at low intensities. Phys. Chem. Chem. Phys. 15 (17), 6196-6205 (2013).
- Saxton, M. J., Jacobson, K. Single-particle tracking: Applications to membrane dynamics. Annu. Rev. Bioph. Biom. 26, 373-399 (1997).
- Pusey, P. N., van Megen, W. Detection of small polydispersities by photon correlation spectroscopy. J. Chem. Phys. 80 (8), 3513(1984).
- Stieger, M., Pedersen, J. S., Richtering, W., Lindner, P. Small-angle neutron scattering study of structural changes in temperature sensitive microgel colloids. J. Chem. Phys. 120 (13), 6197-6206 (2004).
- Wu, X., Pelton, R. H., Hamielec, A. E., Woods, D. R., McPhee, W. The kinetics of poly(N-isopropylacrylamide) microgel latex formation. Colloid Polym. Sci. 272, 467-477 (1994).
- Weeks, E. R., Weitz, D. A. Subdiffusion and the cage effect studied near the colloidal glass transition. Chem. Phys. 284 (1-2), 361-367 (2002).
- Ernst, D., Köhler, J., Weiss, M. Probing the type of anomalous diffusion with single-particle tracking. Phys. Chem. Chem. Phys. 16 (17), 7686-7691 (2014).
- Virtanen, O. L. J. FitIt! (Version 1.1.4). , Available from: https://www.github.com/ovirtanen/fitit (2015).
- Provencher, S. W. A Constrained Regularization Method For Inverting Data Represented By A Linear Algebraic or Integral Equations. Comput. Phys. Commun. 27 (3), 213-227 (1982).
- Holtzer, L., Meckel, T., Schmidt, T. Nanometric three-dimensional tracking of individual quantum dots in cells. Appl. Phys. Lett. 90 (5), 053902-053904 (2007).
- Diezmann, A. V., Lee, M. Y., Lew, M. D., Moerner, W. E. Correcting field-dependent aberrations with nanoscale accuracy in three-dimensional single-molecule localization microscopy. Optica. 2 (11), 985-989 (2015).
- Neutrons, X-rays and Light: Scattering Methods Applied to Soft Condensed Matter. Lindner, P., Zemb, T. , North Holland Delta Series. Amsterdam. (2002).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon