JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
제어 합성 및 매우 균일 한 폴리 형광 추적 (
요약
비 교반 침전 중합 자극 성 폴리 (N- 이소 프로필 아크릴 아미드의) 좁은 크기 분포의 마이크로 겔의 합성에 대한 빠르고 재현성있는 조형 방법을 제공한다. 이 프로토콜 합성에서, 광 산란 특성과 넓은 필드 현미경 설정에서 이러한 마이크로 겔의 단일 입자의 형광 추적 증명된다.
초록
자극에 민감한 폴리 (N의 이소 프로필 아크릴 아미드가) (PNIPAM) 미크로 겔은 다양한 미래의 실용적인 응용 프로그램을 가지고 기초 연구에 사용합니다. 이 작품에서 우리는 빠른 비 교반 침전 중합 절차에 의해 조정 마이크로 겔의 크기 쇼케이스 등의 형광 표지 PNIPAM 미크로 겔을 추적하는 하나의 입자를 사용합니다. 이 방법은 새로운 반응 조성물 및 조건을 프로토 타입이나 제품의 많은 양을 필요로하지 않는 애플리케이션에 적합하다. 동적 및 정적 광산란에 의해 마이크로 겔의 합성, 입자 크기 및 구조 결정 프로토콜에 자세히 설명되어 있습니다. 이 기능 공 단량체의 첨가는 입자의 핵 생성과 구조에 큰 영향을 미칠 수 있음을 나타낸다. 넓은 필드 형광 현미경에 의한 단일 입자 추적 비 표지 미크로 겔의 집중 매트릭스에 표시 추적 마이크로 겔의 확산의 조사를 허용, 시스템이 쉽게 의해 조사되지동적 광 산란과 같은 다른 방법에 관한 것이다.
서문
자극에 민감한 폴리 (N의 이소 프로필 아크릴 아미드) (PNIPAM) 미크로 겔 1,2 인해 다양한 스마트 응용 프로그램에서 자신의 잠재력을 지난 20 년 동안 지속적으로 관심을 받고있다. 입증 된 사용 사례 전환 유화 안정제 3-8, 마이크로 렌즈 (9), 쉽게 휴대 수확 10, 11에 대한 세포 배양 기판 및 저 분자량 화합물의 스마트 사업자 및 다른 생물 의학 12을 사용합니다 포함한다. 보기의 기초 연구의 관점에서 이들 입자는 콜로이드 작용 13-15 중합체 - 용매 상호 작용 16-18으로 피사체를 조사에 유용한 것으로 입증되었다.
임의의 주어진 응용에서 PNIPAM 미크로 겔 및 그 유도체의 성공적인 사용은 일반적으로 입도 분포의 평균 입자 직경 및 폭에 대한 지식을 필요로한다. PNIPAM 마이크로 관련된 실험 결과의 올바른 해석겔은 기능적 공 단량체에 의해 영향을받을 수있는 입자 구조가 공지되어야한다. 동적 및 정적 광산란 (DLS 각각 SLS는) 이러한 방법은 빠르고 상대적으로 사용하기 쉽기 때문에,이 정보를 취득 독특하게 적합하다; 그리고 그들은 그 나라의 환경 (분산)에 비 침습적 입자 특성을 조사. DLS와 SLS는 현미경 방법에 대한 전형적인 작은 샘플 크기에서 발생하는 편견을 피하는 입자의 수많은 데이터를 수집합니다. 따라서,이 작품의 첫 번째 목표는 콜로이드 특성에 새로운 실무자에 대한 광산란에 대한 좋은 습관을 소개하는 것입니다.
일반적으로, 침전 중합은 실험실 규모에서 수행 특정 입자의 특성이 힘든하고 합성의 많은 반복을 필요로 할 수 있습니다에 대한 올바른 반응 조건을 찾아 내고있다. 대규모 일괄 합성 대조적으로, 비 - 교반 침전 중합 19,20 AR은APID 절차는 상이한 반응 조성물의 배치는 좁은 크기 분포를 동시에 항복 입자를 중합 할 수있다. 동시 중합 실험적 변이를 최소화하고 큰 출력이 바로 반응 조건은 반응을 업 스케일링 빠른 발견 될 수 있다는 것을 의미한다. 따라서, 두 번째 목적은 프로토 타입의 제품의 대량을 요구하지 않는 애플리케이션에 비 교반 침전 중합 반응의 유용성을 입증하는 것이다.
합성 및 특성의 다른 측면은 콜로이드의 상호 작용 연구에 형광 표지 된 PNIPAM 미크로 겔의 응용 프로그램의 예와 함께. 여기에서 우리는 다양한 기질 농도 범위 레이블이없는 매트릭스 마이크로 겔의 분산에 표시된 추적 마이크로 겔의 확산을 조사하고 농축 된 콜로이드 분산 케이지 효과를 해결하기 위해 매우 정확한 단일 입자 추적을 사용합니다. 와이드 필드 형광 현미경 잘 fo를 적합연구 그것으로이 목적은 잠재적으로 다른 매트릭스 종의 큰 숫자 사이에 몇 추적 분자의 특정 동작을 특성화 할 수 있습니다. 이것은 많은 시스템에서 프로브 입자의 적은 수의 동작을 확인할 수 있으므로 시스템의 앙상블 평균 특성을 측정 및 DLS, SLS 및 유변학 같은 기법과는 대조적이다. 또한, 이러한 특정 실시 예에서, 종래의 광산란 방식으로 인해 표준 분석을 무효화 강한 다중 산란에 이르게 높은 입자 농도로도 이용 될 수 없다. 자동화 된 데이터 처리 및 통계 방법의 사용은 큰 샘플 크기에 대해 평균 단일 입자 추적을위한 전반적인 시스템 동작의 분석을 가능하게한다.
프로토콜
1. 마이크로 젤 합성
주 : N의 이소 프로필 아크릴 아미드 (NIPAM)을 n- 헥산으로부터 재결정 하였다. 수신과 같은 다른 시약을 사용 하였다.
- 폴리 (NIPAM) 매트릭스 마이크로 겔의 기존 배치 합성
- 여과하고 245 ㎖에 1.8 g의 NIPAM 24 mg을 N, N '-bisacrylamide (BIS)를 녹이고 (0.2 ㎛의 재생 셀룰로오스 (RC)의 멤브레인 필터) 환류 냉각기가 장착 된 500㎖의 3 구 둥근 바닥 플라스크에 증류수, 교반기, 고무 격막.
- 온도계 및 격막을 통해 질소 입력 용 120mm 바늘을 삽입한다.
- 교반하면서, 60 ° C에 대한 해결책을 가열한다. 40 분 동안 질소로 퍼지하여 탈산 소화 용액.
- 동시에 산소를 제거 이중 증류수 버블을 상기 용액 중에 질소를 여과 5ml에 155 mg의 황산 칼륨 (KPS)의 개시제 용액을 제조 하였다.
- 전체 5 ML의 KPS s의 전송120 밀리 바늘을 구비 한 질소 세척 주사기 olution.
- 세 목 플라스크 내의 액면 위에 질소 바늘을 올리고 반응기에 고무 격막을 통해 빠르게 KPS 용액을 추가한다.
- 중합은 60 ℃에서 질소 기류 천천히 교반하면서 1 시간 동안 진행하자.
- 큰 응집체를 폐기하기 위해 뜨거운 반응 용액을 필터링 흐너 깔대기 및 필터 종이를 사용한다. 분산가 식을 때까지하자.
- 원심 257,000 XG에 분산액을 40 분 동안 세 차례 재 분산 최종적 증류수 최소 가능한 양의 침전물을 재 분산하고. 일반적으로이 2-4 ml 인 것을.
- 기억 분산액을 동결 건조.
- 형광 표지 된 폴리 (NIPAM) 미크로 겔의 비 교반 합성
- 유리 용기에 257.7 mg을 NIPAM, 3.5 mg의 BIS, 1.5 mg을 메타 크릴 티오 카르 로다 민 B (염료)를 달아 여과 이중의 distill 10 ㎖를 추가에드 물.
- 초음파 처리를 15 분 동안 염료 단량체 용액을 물에 염료를 용해.
- 별도의 유리 용기에 염료없이 동일한 솔루션을 준비합니다.
- 다양한 염료 농도 농도 시리즈를 얻기 위해 염료없이 단량체 수용액을 사용하여 염료 단량체 용액의 각종 희석 물을 준비한다. 본 연구에서는 0.02-0.1 밀리몰 / L의 농도 범위에서 염료를 사용합니다.
- 개시제 용액을 얻기 위해 증류수를 필터링 10 ml의 8.4 mg을 KPS를 녹여.
- 최종 반응 액을 얻었다 고무 격막으로 밀봉을 10mm 직경 튜브를 테스트 KPS 용액 0.5 농도 시리즈의 용액 0.5 mL로 옮긴다.
- 63 ° C로 가열 순환기 접속 이중벽 유리 용기에 오일 욕 예열.
- 20 분 동안 120mm 바늘을 통해 질소 정화하여 반응 액을 Deoxygenize.
- AF에 튜브를 삽입플랫폼을 loating하고 예열 된 오일 배스로 플랫폼을 담그지. 60 ° C까지 온도를 설정합니다. 실온 솔루션은 욕조로 냉각 욕 초기에 더 높은 온도가 필요하다. 정밀 입도 조정에 대한 초기 반응시의 온도 제어는 일반적으로 0.1 ° C, ± 엄격한다.
- 상기 반응은 적절한 시간 동안 진행하자. 일반적으로 1 시간은 충분하다.
- 60 ° C의 오븐에 빠르게 반응 튜브로 이동하고에서 DLS 특성화, PNIPAM 체적 상전이 온도 (VPTT 32 -34 °의 C) 하나 이상 예열 증류수를 여과하고 10 ㎖로 열 분산 한 방울을 넣어 축소 된 상태입니다.
- 분산액의 나머지 실온으로 식힌 원심 분리 튜브로 옮긴다.
- 257,000 XG에서 용액을 40 분 동안 세 번 원심 분리기를 두 번 증류수 기용 필터 2 ㎖에 마지막으로 미크로 겔을 희석추적 입자로 r에 사용.
2. 광 산란 특성
- 동적 광산란으로 접힌 상태에서 유체 역학적 반경 결정
- 큐벳을 세척하고 아세톤 증기로 유리 제품.
- 열 PNIPAM VPTT상에서 여과 (예를 들어, 200 nm 이하 RC 필터) 증류수 10 ㎖.
- 예열 된 바늘 (0.9 × 40 ㎜) 및 주사기 (1ml)에 사용하는 여과수에 고온 분산액의 저하를 옮긴다.
- 50 ° C에 DLS의 고니 오 미터 인덱스 경기 목욕 성질하고 냉각 말도없이 악기의 샘플을 전송합니다.
- 산란 강도의 테스트 측정들을 수행하여 correlogram를 획득하기에 충분한 최대 산란 각도를 찾는다.
- 샘플 큐벳 (입자 분산액 1 ㎖와 10mm 직경 유리 튜브)를 삽입한다. 작은 산란 각도 (여기에 30 °)에 검출기 팔을 이동합니다.
- FO 빔 프로파일을 확인R 다중 산란 : 등 차 빔, 아니 다중 산란, 주위에 빛이 카운트 범위가 가장 낮은 산란 각도 측정에 적합 함을 확인 (약 30, 600 kHz의 사이에, 소프트웨어 창의 오른쪽 상단 모서리를..)
- 가장 높은 산란 각도로 고니 오 미터 암을 이동 (120 ° 여기를 선택). 카운트 속도가 (30, 600 kHz의 사이에) 아직 측정을위한 충분 있는지 확인합니다. 강도가 너무 낮 으면, 산란 각 낮출 아암을 이동.
- 입사 빔의 주위에 빛을 다중 산란 관찰되는 경우 일어나는 가장 낮은 산란 각도에서 톨루엔 욕 유리를 통해 시각적으로 빔을 확인한다. 이 경우, 레이저 강도를 감소 시키거나 더 높은 희석을 사용한다.
- 60 초의 최소 획득 시간 - (예를 들어 140 °, 30 °) 최소 및 최대 산란 각도는 20 상관 도표 획득. 약한 강도의 큰 산란 각도의 획득 시간을 증가필요하다면.
- 데이터 분석 (37)
- 에 따라 산란 각도 벡터의 크기를 산란 계산
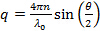 n은 분산액의 굴절률이고,
n은 분산액의 굴절률이고, 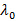 진공에서 레이저의 파장
진공에서 레이저의 파장 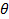 산란 각도.
산란 각도. - 경우에 측정 소프트웨어는 강도 상관 함수를 제공한다
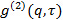 전계 상관 함수로 변환
전계 상관 함수로 변환 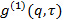 에 따라
에 따라  . 매개 변수
. 매개 변수 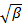 산란 된 빛을 비켜의 공간 간섭의 정도와 관련된 재미 쓸모있는 매개 변수입니다검출기 영역 r에.
산란 된 빛을 비켜의 공간 간섭의 정도와 관련된 재미 쓸모있는 매개 변수입니다검출기 영역 r에. - 즉, 상관 도표에 cumulant 분석을 수행하여 각 전계 상관 함수의 대수로 2 차 다항식에 맞게
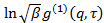 선형 최소 제곱으로.
선형 최소 제곱으로. 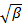 착용감의 차단으로 표시하고 그 정확한 값은 데이터 분석에 대하여 중요하다. 최대 진폭의 20 % - 상관 진폭이 10가되도록, 예를 들어 의미있는 지연 시간 τ 값에 맞추기를 제한한다. 1 차 항의 계수, 상관 함수의 평균 감소율 인
착용감의 차단으로 표시하고 그 정확한 값은 데이터 분석에 대하여 중요하다. 최대 진폭의 20 % - 상관 진폭이 10가되도록, 예를 들어 의미있는 지연 시간 τ 값에 맞추기를 제한한다. 1 차 항의 계수, 상관 함수의 평균 감소율 인 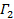 .
. - 평균 확산 계수에 대한 가능성이 가장 높은 값을 찾기
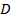 선형 최소 제곱에 의한 입자에 맞게
선형 최소 제곱에 의한 입자에 맞게  . 만약
. 만약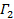 에 대하여
에 대하여 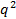 선형 나타나는 에러 내에서 원점을 통과하지 않고, 입자 크기 분포는 광범위하고 유체 역학적 반경이 제대로 정의 될 것이다.
선형 나타나는 에러 내에서 원점을 통과하지 않고, 입자 크기 분포는 광범위하고 유체 역학적 반경이 제대로 정의 될 것이다. - 스톡스 - 아인슈타인 관계로부터 평균 유체 역학적 반경을 계산
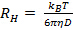 여기서
여기서 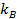 볼츠만 계수이며
볼츠만 계수이며 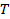 절대 온도
절대 온도 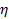 분산액의 점도
분산액의 점도 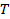 . 표준 편차를 전파
. 표준 편차를 전파 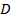 에
에 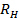 .
.
- 에 따라 산란 각도 벡터의 크기를 산란 계산
- 정적 광산란에 의한 입자 구조 결정
- 큐벳을 세척하고 아세톤 증기로 유리 제품. 원통형 렌즈 효과를 최소화 직경 20mm 이상인 큐벳을 사용한다.
- 필터 (200 나노 RC 필터 이하) 유리 바이알에 증류수 약 20 ㎖의 바이알에 정제 된 분산액의 저하를 옮긴다. 제조 공정에서 남은 불순물을 제거하기 위해 샘플 제조에 사용하기 전에 물 10ml로 필터를 세척 하였다.
- 모든 주변 광 소스에 대해 샘플을 확인합니다. 파란색 색상이 관찰되면, 시료는 지나치게 집중되기 쉽다. 이에 따라 희석.
- 큐벳을 여과 물에 여러 번 세척하여 배경 물 샘플을 준비하고 큐벳 및 장비의 레이저 위치에 따라 적절한 샘플 량까지 입력합니다. 레이저는 메 니스 커스에서 굴절되지 않고 샘플을 통과해야합니다.
- 기구도 교정엔트 톨루엔 샘플을 사용.
- 사용 가능한 각도 범위에 걸쳐 물 산란 (배경)을 측정한다.
- 바람직하게는 여러 파장에서 가능한 각도 범위에 걸쳐 시료에서 산란 강도를 측정한다. 순방향 산란 강도로 정규화 산란 패턴은 형태 인자로 알려져있다.
- 입자 구조가 공지되어있는 경우, 서로 다른 파장에서 측정 한 데이터 집합에 맞는 전체를 계산하는 적절한 모델 식을 사용한다.
- (예 FitIt! 33)에 직접 정규화 미지의 입자 구조를 이용하거나 일반적인 간접 역 푸리에 입자의 대략적인 분류 (단 구형 입자에 대한) 한 쌍의 거리 분포 함수의 컨벌루션 (23, 24)과 함께 21,22 루틴 변환 유형.
- 경우에 피팅 또는 반전 루틴 분산도를 계산, 입자 반경 분포 함수의 추정치를 제공한다지수 (그것의 평균으로 나눈 분포의 표준 편차).
넓은 필드 형광 현미경 3. 입자 추적
참고 : 20 ° C에서 465 ± 7 405 ± nm 내지 7 nm의 수력 학적 반경의 트레이서 매트릭스 입자들은 각각의 입자 추적 하였다.
- 샘플 준비
- 이중 증류수 알려진 양 동결 건조 된 레이블이없는 마이크로 겔의 알려진 양을 재 분산하여 농축 된 매트릭스 마이크로 젤 분산을 준비합니다. 라벨 추적 입자의 작은 볼륨을 추가합니다.
- 현미경에서 적절한 추적 마이크로 겔 농도를 확인합니다. 트레이서 입자 트랙 취득 중에 교차 확률을 무시할 수 있도록 충분히 낮은 추적자의 농도를 갖는 반면, 최적의 농도는, 트랙의 최대 수의 동시 획득 절충이다.
- 증발에 의해 농축 분산을 준비오븐에 물. 증착하기 전에 샘플의 원래 중량을 분산액의 중량과 비교하여 중량 농도를 결정한다.
- 데이터 수집 및 분석
- 원하는 배율의 적절한 대물 렌즈를 사용하여 샘플에서 추적자의 여기 및 동시 형광 수집을 위해 조리개. 이 작품에서, 100X / 1.3 NA 오일 침지 대물 렌즈를 사용합니다.
- 상업 현미경에 맞는 XYZ-압전 테이블에 수분 챔버를 놓습니다.
- 건조에서 샘플을 방지하기 위해, 슬립에 원하는 농도의 수분 챔버 및 폴리 (NIPAM)의 피펫 10 μl의 분산에 플라즈마 세정 커버 슬립을 배치합니다.
- 형광 염료의 여기 및 발광 스펙트럼에 따라, 여기에 적합한 레이저를 사용하여 적절한 레이저 파워를 조정한다. 강도는 염료의 빠른 광표백을 방지하기에 충분히 낮게,하지만에 있어야정확한 단일 입자의 위치에 대해 충분히 강한 같은 시간 (아래 참조). 본 연구에서는, 561 nm의 다이오드 펌핑 고체 레이저를 사용하고 모든 측정에서 16 mW의 (약 0.5 킬로와트 cm -2 시료에서)을 레이저 파워를 일정하게 유지한다.
- 균일 한 샘플 조명을 얻으려면 여기에 설명 된 중요한 조명 설정을 사용합니다. 이를 위해 부부는 다중 모드 광섬유에 레이저 (NA 0.22 ± 0.02, 0.6 mm 코어 직경), 위해 밖으로 시간적으로 평균 레이저 얼룩을 vortexer를를 사용하여 섬유를 흔들 및 섬유 샘플 비행기에 종료 전망이다.
- 커버 슬립의 후면 반사로부터의 거리 Z를 보정하고 살짝 대물 이동하여 샘플에 수 ㎛ 초점 및 Z-보상기를 사용하여 Z 축 위치를 고정한다. 이 coverslip에있는 모든 인터페이스 효과를 방지 할 수 있습니다.
- 형광 신호의 세기로, 예컨대 노광 시간으로 검출 파라미터를 조정한다. 이 경우, EMCCD 카메라를 사용0.1 초의 노출 시간, 전자는 모드 (50)의 이득을 승산.
- 샘플의 상이한 영역에서 마이크로 겔의 평균 제곱 변위를 계산하기 위해 적절한 지연 시간을 얻기 위해 프레임의 적절한 수의 여러 동영상을 획득. 본 연구에서는 500 또는 1,000 프레임의 취득 프레임 번호를 사용합니다.
- 가우시안 피팅 (25)을 이용하여 각각의 프레임에서의 입자의 위치에 의해 데이터를 분석하고, 평균 제곱 변위를 얻기 위해 적당한 입자 추적 알고리즘 (26)을 사용한다. (27) 계산은 모든 영화의 모든 트랙에 걸쳐 평균 한 값과 표준 편차를 의미한다. 의 선형 회귀에 의해 긴 지연 시간의 확산 계수를 계산
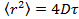 여기서
여기서 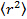 평균 제곱 변위 D의 평균 확산 계수이고, 지연 시간 τ.
평균 제곱 변위 D의 평균 확산 계수이고, 지연 시간 τ. - 예상변칙 확산 방정식에서 이상 매개 변수 γ를으로 iMate
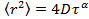 대수 스케일의 데이터를 변환하여 수득
대수 스케일의 데이터를 변환하여 수득 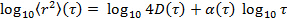 . 비정상 매개 변수
. 비정상 매개 변수 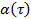 플롯의 파생 상품으로 주어진다. 유도체는 다항 함수에 의해 데이터 포인트 피팅 분석적 미분 데이터 포인트의 유한 차에 의해 추정하거나 할 수있다. 다항식 차수를 증가 맞는 잔차 잔류 규범 플로팅하여 다항식 피팅 함수의 충분한 정도를 결정한다.
플롯의 파생 상품으로 주어진다. 유도체는 다항 함수에 의해 데이터 포인트 피팅 분석적 미분 데이터 포인트의 유한 차에 의해 추정하거나 할 수있다. 다항식 차수를 증가 맞는 잔차 잔류 규범 플로팅하여 다항식 피팅 함수의 충분한 정도를 결정한다. - 미크로 겔 매트릭스의 상이한 농도에 대해 동일한 절차를 반복한다.
결과
일괄 처리 PNIPAM 미크로 겔 입자의 수, 따라서 최종 입자 부피, 티오 카르 바 모일 로다 민 B는 배치 내의 입자 수 농도를 감소시킴으로써 핵 영향 핵화 단계 20 소수성 공 단량체 염료 메타 크릴 초기의 반응으로 결정된다. 개의 상이한 초기 NIPAM 농도에 대한 입자 농도의 감소는도 1에 도시 된 증가 염료 농도...
토론
기능 공 단량체의 소량 첨가는 PNIPAM 유래 마이크로 겔의 입자 크기 및 구조에 상당한 영향을 미칠 수있다. 동시 소규모 시험관 중합 이러한 변화를 설명하는 좋은 방법이다 빠르게 필요한 반응을 업 스케일링 할 대상 입자 직경에 적합한 반응물 조성물를 찾는 것을 돕는다. 입자의 질량은 대략 같은 KPS 같은 열 개시제를 분해 중합 온?...
공개
The authors have nothing to disclose.
감사의 말
The Deutsche Forschungsgemeinschaft (DFG) is acknowledged for financial support within the Sonderforschungsbereich SFB 985 "Functional Microgels and Microgel Systems".
자료
| Name | Company | Catalog Number | Comments |
| Acetone | VWR Chemicals | KRAF13455 | |
| Bisacrylamid | AppliChem | A3636 | |
| n-Hexane | Merck | 104374 | |
| N-Isopropylacrylamide | Fisher Scientific | AC412785000 | recrystallized from n-hexane |
| Methacryloxyethyl thiocarbamoyl rhodamine B | Polysciences | 23591 | |
| Potassium peroxodisulfate | Merck | 105091 | |
| Silicone oil 47 V 350 | VWR Chemicals | 83851 | |
| Toluene | Sigma Aldrich | 244511 | |
| F12 Refrigerated/heating circulator | Julabo | 9116612 | |
| Microscope | Olympus | IX83 | |
| XY(Z) Piezo System | Physik Instrumente | P-545.3R7 | |
| 100X Oil immersion objective | Olympus | UPLSAPO | |
| QuadLine Beamsplitter | AHF Analysentechnik | F68-556T | |
| Cobolt Jive 150 laser | Cobolt | 0561-04-01-0150-300 | |
| Multimode Fiber | Thorlabs | UM22-600 | |
| iXON Ultra 897 EMCCD camera | Andor | DU-897U-CS0-BV | |
| Laser goniometer | SLS Systemtechnik | Mark III | |
| CF40 Cryo-compact circulator | Julabo | 9400340 | |
| Laser goniometer system | ALV GmbH | ALV / CGS-8F | |
| Multi-tau corretator | ALV GmbH | ALV-7004 | |
| Light scattering electronics | ALV GmbH | ALV / LSE 5004 | |
| Photon counting module | PerkinElmer | SPCM-CD2969 | 2 units in pseudo cross-correlation mode |
| 633 nm HeNe Laser | JDS Uniphase | 1145P | |
| F32 Refrigerated/heating circulator | Julabo | 9312632 |
참고문헌
- Pelton, R. Temperature-sensitive aqueous microgels. Adv. Colloid Interfac. 85, 1-33 (2000).
- Pich, A., Richtering, W. Microgels by Precipitation Polymerization: Synthesis, Characterization and Functionalization. Adv. Polym. Sci. 234, 1-37 (2010).
- Richtering, W. Responsive Emulsions Stabilized by Stimuli-Sensitive Microgels: Emulsions with Special Non-Pickering Properties. Langmuir. 28 (50), 17218-17229 (2012).
- Wiese, S., Spiess, A. C., Richtering, W. Microgel-Stabilized Smart Emulsions for Biocatalysis. Angew. Chem. Int. Edit. 52 (2), 576-579 (2012).
- Schmitt, V., Ravaine, V. Surface compaction versus stretching in Pickering emulsions stabilised by microgels. Curr. Opin. Colloid In. 18 (6), 532-541 (2013).
- Wellert, S., Richter, M., Hellweg, T., von Klitzing, ., R, Y., Hertle, Responsive Microgels at Surfaces and Interfaces. Z. Phys. Chem. 229 (7-8), 1-26 (2015).
- Li, Z., Harbottle, D., Pensini, E., Ngai, T., Richtering, W., Xu, Z. Fundamental Study of Emulsions Stabilized by Soft and Rigid Particles. Langmuir. 31 (23), 6282-6288 (2015).
- Deshmukh, O. S., van den Ende, D., Stuart, M. C., Mugele, F., Duits, M. H. G. Hard and soft colloids at fluid interfaces: Adsorption, interactions, assembly & rheology. Adv. Colloid Interfac. 222, 215-227 (2015).
- Serpe, M. J., Kim, J., Lyon, L. A. Colloidal Hydrogel Microlenses. Adv. Mater. 16 (2), 184-187 (2004).
- Schmidt, S., Zeiser, M., Hellweg, T., Duschl, C., Fery, A., Möhwald, H. Adhesion and Mechanical Properties of PNIPAM Microgel Films and Their Potential Use as Switchable Cell Culture Substrates. Adv. Func. Mater. 20 (19), 3235-3243 (2010).
- Xia, Y., He, X., et al. Thermoresponsive Microgel Films for Harvesting Cells and Cell Sheets. Biomacromolecules. 14 (10), 3615-3625 (2013).
- Guan, Y., Zhang, Y. PNIPAM microgels for biomedical applications: from dispersed particles to 3D assemblies. Soft Matter. 7 (14), 6375 (2011).
- Yunker, P. J., Chen, K., Gratale, M. D., Lohr, M. A., Still, T., Yodh, A. G. Physics in ordered and disordered colloidal matter composed of poly(N-isopropylacrylamide) microgel particles. Rep. Prog. Phys. 77 (5), 056601-056629 (2014).
- Lohr, M. A., Still, T., et al. Vibrational and structural signatures of the crossover between dense glassy and sparse gel-like attractive colloidal packings. Phys. Rev. E. 90 (6), 062305 (2014).
- Dreyfus, R., Xu, Y., Still, T., Hough, L. A., Yodh, A. G., Torquato, S. Diagnosing hyperuniformity in two-dimensional, disordered, jammed packings of soft spheres. Phys. Rev. E. 91 (1), 012302-012312 (2015).
- Kojima, H., Tanaka, F. Reentrant volume phase transition of cross-linked poly(N-isopropylacrylamide) gels in mixed solvents of water/methanol. Soft Matter. 8 (10), 3010-3011 (2012).
- Hofmann, C. H., Plamper, F. A., Scherzinger, C., Hietala, S., Richtering, W. Cononsolvency Revisited: Solvent Entrapment by N-Isopropylacrylamide and N, N-Diethylacrylamide Microgels in Different Water/Methanol Mixtures. Macromolecules. 46 (2), 523-532 (2013).
- Bischofberger, I., Calzolari, D. C. E., Trappe, V. Co-nonsolvency of PNiPAM at the transition between solvation mechanisms. Soft Matter. 10 (41), 8288-8295 (2014).
- Virtanen, O. L. J., Richtering, W. Kinetics and particle size control in non-stirred precipitation polymerization of N-isopropylacrylamide. Colloid Polym. Sci. 292 (8), 1743-1756 (2014).
- Virtanen, O. L. J., Ala-Mutka, H. M., Richtering, W. Can the Reaction Mechanism of Radical Solution Polymerization Explain the Microgel Final Particle Volume in Precipitation Polymerization of N-Isopropylacrylamide?. Macromol. Chem. Phys. 216 (13), 1431-1440 (2015).
- Glatter, O. A new method for the evaluation of small-angle scattering data. J. Appl. Crystallogr. 10 (5), 415-421 (1977).
- Svergun, D. I. Determination of the regularization parameter in indirect-transform methods using perceptual criteria. J. Appl. Crystallogr. 25 (4), 495-503 (1992).
- Glatter, O. Convolution Square Root of Band-Limited Symmetrical Functions and Its Application to Small-Angle Scattering Data. J. Appl. Crystallogr. 14, 101-108 (1981).
- Glatter, O., Hainisch, B. Improvements in Real-Space Deconvolution of Small-Angle Scattering Data. J. Appl. Crystallogr. 17, 435-441 (1984).
- Cheezum, M. K., Walker, W. F., Guilford, W. H. Quantitative Comparison of Algorithms for Tracking Single Fluorescent Particles. Biophys. J. 81 (4), 2378-2388 (2001).
- Wöll, D., Kölbl, C., Stempfle, B., Karrenbauer, A. A novel method for automatic single molecule tracking of blinking molecules at low intensities. Phys. Chem. Chem. Phys. 15 (17), 6196-6205 (2013).
- Saxton, M. J., Jacobson, K. Single-particle tracking: Applications to membrane dynamics. Annu. Rev. Bioph. Biom. 26, 373-399 (1997).
- Pusey, P. N., van Megen, W. Detection of small polydispersities by photon correlation spectroscopy. J. Chem. Phys. 80 (8), 3513 (1984).
- Stieger, M., Pedersen, J. S., Richtering, W., Lindner, P. Small-angle neutron scattering study of structural changes in temperature sensitive microgel colloids. J. Chem. Phys. 120 (13), 6197-6206 (2004).
- Wu, X., Pelton, R. H., Hamielec, A. E., Woods, D. R., McPhee, W. The kinetics of poly(N-isopropylacrylamide) microgel latex formation. Colloid Polym. Sci. 272, 467-477 (1994).
- Weeks, E. R., Weitz, D. A. Subdiffusion and the cage effect studied near the colloidal glass transition. Chem. Phys. 284 (1-2), 361-367 (2002).
- Ernst, D., Köhler, J., Weiss, M. Probing the type of anomalous diffusion with single-particle tracking. Phys. Chem. Chem. Phys. 16 (17), 7686-7691 (2014).
- . FitIt! (Version 1.1.4) Available from: https://www.github.com/ovirtanen/fitit (2015)
- Provencher, S. W. A Constrained Regularization Method For Inverting Data Represented By A Linear Algebraic or Integral Equations. Comput. Phys. Commun. 27 (3), 213-227 (1982).
- Holtzer, L., Meckel, T., Schmidt, T. Nanometric three-dimensional tracking of individual quantum dots in cells. Appl. Phys. Lett. 90 (5), 053902-053904 (2007).
- Diezmann, A. V., Lee, M. Y., Lew, M. D., Moerner, W. E. Correcting field-dependent aberrations with nanoscale accuracy in three-dimensional single-molecule localization microscopy. Optica. 2 (11), 985-989 (2015).
- Lindner, P., Zemb, T. . Neutrons, X-rays and Light: Scattering Methods Applied to Soft Condensed Matter. , (2002).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유