È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Sintesi controllata e fluorescenza di monitoraggio altamente uniforme Poli (
In questo articolo
Riepilogo
Non agitata polimerizzazione precipitazione fornisce un rapido, riproducibile approccio prototipazione alla sintesi di stimoli-sensibili poli (N -isopropylacrylamide) microgel di distribuzione dimensionale ristretta. In questa sintesi protocollo, luce caratterizzazione dispersione e unico rilevamento di fluorescenza delle particelle di questi microgel in una configurazione di microscopia a largo campo sono dimostrati.
Abstract
Gli stimoli sensibili poli (N -isopropylacrylamide) (PNIPAM) microgel ha diverse applicazioni pratiche prospettici e utilizza nella ricerca fondamentale. In questo lavoro, usiamo singola particella monitoraggio microgel PNIPAM di fluorescente come una vetrina per dimensioni sintonizzazione Microgel da un procedimento di precipitazione di polimerizzazione rapida non si mosse. Questo approccio è adatto per prototipazione nuove composizioni di reazione e condizioni o per applicazioni che non richiedono grandi quantità di prodotto. sintesi Microgel, la dimensione delle particelle e la determinazione struttura per dispersione della luce dinamica e statica sono dettagliati nel protocollo. È dimostrato che l'aggiunta di comonomeri funzionali può avere una grande influenza sulla nucleazione delle particelle e la struttura. inseguimento singola particella grande campo microscopia a fluorescenza consente un'indagine della diffusione di microgel traccianti marcati in una matrice concentrata di microgel non etichettati, un sistema non facilmente indagine daaltri metodi come dynamic light scattering.
Introduzione
Gli stimoli sensibili poli (N -isopropylacrylamide) (PNIPAM) microgel 1,2 hanno attirato l'interesse continuo nel corso degli ultimi due decenni a causa del loro potenziale in varie applicazioni intelligenti. Casi d'uso dimostrate includono stabilizzatori commutabili emulsione 3-8, microlenti 9, substrati di coltura cellulare per facilitare la raccolta di cellule 10,11, e trasportatori intelligenti per i composti a basso peso molecolare e altri usi biomedici 12. Da un punto di vista fondamentale di ricerca queste particelle hanno dimostrato di essere utile per indagare temi come le interazioni colloidali 13-15 e le interazioni polimero-solvente 16-18.
uso di successo di microgel PNIPAM e loro derivati in qualsiasi applicazione in genere richiede la conoscenza della dimensione media delle particelle e la larghezza della distribuzione granulometrica. Per una corretta interpretazione dei risultati sperimentali che coinvolgono PNIPAM microgel, la struttura delle particelle, che può essere influenzata da comonomeri funzionali, deve essere conosciuta. Dinamico e statico Light Scattering (DLS e SLS, rispettivamente) sono particolarmente adatto per l'acquisizione di queste informazioni perché questi metodi sono veloci e relativamente facile da usare; e sondare le proprietà delle particelle in modo non invasivo nel loro ambiente nativo (dispersione). DLS e SLS raccolgono anche i dati provenienti da gran numero di particelle evitando la distorsione derivante da campioni di piccole dimensioni, tipiche per i metodi di microscopia. Pertanto, il primo obiettivo di questo lavoro è quello di introdurre buone pratiche in materia di dispersione della luce per gli operatori nuovi alla caratterizzazione colloidale.
Tipicamente, precipitazione polimerizzazione viene effettuata in scala di laboratorio e cercando le giuste condizioni di reazione per le proprietà delle particelle specifici possono essere laborioso e richiede molte ripetizioni della sintesi. In contrasto con la sintesi in grande serie, precipitazione polimerizzazione non agitata 19,20 è arProcedura APID in cui gruppi di diversa composizione reagente può essere polimerizzato particelle contemporaneamente rendimento di distribuzione delle dimensioni stretta. polimerizzazione simultanea riduce al minimo la variazione sperimentale e grande uscita significa che le condizioni di reazione di destra può essere trovato veloce per l'upscaling la reazione. Quindi, il secondo scopo è quello di dimostrare l'utilità di polimerizzazione non agitata precipitazione nella prototipazione e in applicazioni che non richiedono una grande quantità di prodotto.
Diversi aspetti della sintesi e caratterizzazione si incontrano nel esempio di applicazione fluorescenti etichettati microgel PNIPAM nella ricerca interazione colloidale. Qui usiamo altamente accurato monitoraggio singola particella di indagare la diffusione di microgel traccianti marcati in dispersione di microgel matrice senza etichetta in un ampio intervallo di concentrazione della matrice e risolvere l'effetto gabbia in dispersione colloidale concentrata. Wide-field microscopia a fluorescenza è adatto FOr tale scopo, come si può caratterizzare il comportamento specifico di alcune molecole traccianti tra un gran numero di diverse specie potenzialmente matrice. Questo è in contrasto con tecniche come DLS, SLS e reologia, che misurano le proprietà medie insieme di sistemi e quindi non può risolvere comportamento del piccolo numero di particelle sonda in un grande sistema. Inoltre, in questo esempio specifico metodi di diffusione della luce convenzionali non possono essere utilizzati anche per concentrazione elevata di particelle, che porta ad una forte scattering multiplo invalidazione analisi standard. L'utilizzo di trattamento automatizzato di dati e metodi statistici consentire l'analisi del comportamento del sistema globale anche per il monitoraggio singola particella, quando in media su campioni di grandi dimensioni.
Protocollo
1. Sintesi Microgel
NOTA: N -isopropylacrylamide (NIPAM) è stato ricristallizzato da n-esano. Altri reagenti sono stati utilizzati come ricevuti.
- Convenzionale Batch sintesi di poli (NIPAM) microgel Matrix
- Sciogliere 1.8 g NIPAM e 24 mg N, N '-bisacrylamide (BIS) in 245 ml filtrati (0,2 micron cellulosa rigenerata (RC) filtro a membrana) acqua bidistillata in 500 ml a tre colli pallone a fondo tondo dotato di un condensatore a riflusso, un agitatore e di un setto di gomma.
- Inserire un termometro e un ago 120 mm per l'ingresso di azoto attraverso il setto.
- Riscaldare la soluzione a 60 ° C, sotto agitazione. Deoxygenate la soluzione da spurgo con azoto per 40 min.
- Contemporaneamente preparare una soluzione di iniziatore di 155 persolfato di potassio mg (KPS) in 5 ml di filtrati acqua bidistillata e bolla la soluzione con azoto per eliminare l'ossigeno.
- Trasferire i completi 5 ml KPS solution in siringa azoto lavato con ago 120 mm.
- Sollevare l'ago azoto sopra il livello della soluzione nel pallone a tre colli e aggiungere la soluzione KPS rapidamente attraverso il setto di gomma nel reattore.
- Sia la polimerizzazione procede per 1 ora sotto flusso di azoto e lenta agitazione a 60 ° C.
- Utilizzare un imbuto e filtro di carta Buchner filtrare la soluzione di reazione calda per scartare grandi aggregati. Lasciate che la dispersione raffreddare.
- Centrifuga e redisperse la dispersione tre volte per 40 min a 257.000 xg ed infine redisperse il sedimento in una quantità minima vitale di acqua bidistillata. In genere questo è di 2-4 ml.
- Lyophilize la dispersione per la memorizzazione.
- Sintesi non si mosse di poli (NIPAM) microgel fluorescente
- Pesare 257,7 mg NIPAM, 3,5 mg BIS, e 1,5 mg methacryloxyethyl thiocarbamoyl rodamina B (dye) nel recipiente di vetro e aggiungere 10 ml di filtrato doppio distillareacqua ed.
- Ultrasonicate soluzione colorante-monomero per 15 minuti per sciogliere il colorante in acqua.
- Preparare la stessa soluzione senza il colorante in un recipiente di vetro separata.
- Preparare varie diluizioni della soluzione monomero con il colorante utilizzando la soluzione di monomero senza colorante per ottenere una serie di concentrazione con varie concentrazioni di colorante. In questo lavoro, utilizzare colorante nella gamma di concentrazione di 0,02-0,1 mmol / L.
- Sciogliere 8.4 mg KPS in 10 ml filtrati acqua bidistillata per ottenere la soluzione di iniziatore.
- Trasferire 0,5 ml della serie concentrazione e 0,5 ml della soluzione KPS per testare tubi con diametro di 10 mm per ottenere le soluzioni di reazione finale e sigillare con setti di gomma.
- Preriscaldare un bagno d'olio in un recipiente a doppia parete in vetro collegata ad un circolatore riscaldamento a 63 ° C.
- Deoxygenize le soluzioni di reazione spurgando con azoto attraverso aghi 120 mm per 20 min.
- Inserire i tubi in AFloating piattaforma ed immergere la piattaforma in bagno d'olio già caldo. Impostare la temperatura a 60 ° C. Inizialmente la temperatura più alta nel bagno è necessario in quanto le soluzioni a temperatura ambiente raffreddare il bagno. Per l'alta sintonia precisione di formato delle particelle del controllo della temperatura durante la reazione iniziale deve essere rigorosi, tipicamente ± 0,1 ° C.
- Lasciate che la reazione procede per un tempo adeguato. Tipicamente 1 ora è sufficiente.
- Trasferire le provette di reazione rapida in stufa a 60 ° C e mettere una goccia della dispersione calda a 10 ml filtrata acqua bidistillata preriscaldata sopra la temperatura di volume PNIPAM transizione di fase (VPTT, 32 -34 ° C) 1, per la caratterizzazione DLS nel stato compresso.
- Lasciare il resto delle dispersioni raffreddare a temperatura ambiente e trasferirli in provette da centrifuga.
- Centrifugare la soluzione tre volte per 40 min a 257.000 xg e diluire le microgel finalmente in 2 ml di filtrati acqua bidistillata FOr uso come particelle traccianti.
2. Light Scattering Caratterizzazione
- Idrodinamica Raggio Determinazione in stato compresso da Dynamic Light Scattering
- Lavare le provette e cristalleria con il vapore di acetone.
- Calore 10 ml di filtrato (ad esempio, 200 nm o più piccolo filtro RC) acqua bidistillata oltre PNIPAM VPTT.
- Trasferire una goccia di dispersioni di calore per l'acqua filtrata con un ago preriscaldato (0,9 x 40 mm) e la siringa (1 ml).
- Temperare il DLS goniometro indice delle corrispondenze bagno a 50 ° C e trasferire il campione allo strumento senza farla raffreddare.
- Trova il grande angolo di diffusione in cui l'intensità diffusa è sufficiente per acquisire un correlogramma eseguendo misurazioni di prova.
- Inserire cuvetta campione (10 mm tubo di vetro del diametro di 1 ml di dispersione di particelle). Spostare il braccio rivelatore di angolo di diffusione di piccole dimensioni (qui 30 °).
- Controllare il profilo del fascio FOR scattering multiplo: nessun bagliore attorno al fascio primario, non scattering multiplo, ecc Controllare che il campo di conteggio è adatto per la misurazione con l'angolo di scattering più basso (circa tra i 30 ei 600 kHz; in alto a destra della finestra del software..)
- Spostare il braccio del goniometro al più alto angolo di diffusione (scegliere 120 ° qui). Verificare che il tasso di conteggio è ancora abbastanza alta per la misura (tra 30 e 600 kHz). Se l'intensità è troppo bassa, muovere il braccio per abbassare dispersione angolare.
- Controllare il fascio visivamente attraverso il vetro vasca toluene a l'angolo di scattering basso, se bagliore attorno al fascio incidente si osserva scattering multiplo avviene. In questo caso, ridurre l'intensità del laser o utilizzare una diluizione più elevata.
- Acquisire 20 correlogrammi tra l'angolo di scattering minima e massima (ad esempio, 30 ° - 140 °) con tempo minimo di acquisizione 60 sec. Aumentare il tempo di acquisizione per intensità debole grandi angoli di scatteringse necessario.
- Analisi dei dati 37
- Calcola la dispersione grandezze vettoriali per l'angolo di scattering in base alle
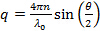 , Dove n è l'indice di rifrazione della dispersione,
, Dove n è l'indice di rifrazione della dispersione, 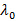 la lunghezza d'onda del laser a vuoto e
la lunghezza d'onda del laser a vuoto e 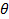 l'angolo di scattering.
l'angolo di scattering. - Nel caso il software di misura fornisce la funzione di correlazione intensità
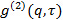 , Trasformarlo in funzione di correlazione campo elettrico
, Trasformarlo in funzione di correlazione campo elettrico 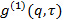 secondo
secondo  . Parametro
. Parametro 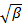 è un interessante parametro strumentale correlato al grado di coerenza spaziale del ove luce diffusar zona rivelatore.
è un interessante parametro strumentale correlato al grado di coerenza spaziale del ove luce diffusar zona rivelatore. - Effettuare analisi cumulant su correlogrammi, vale a dire, in forma polinomio di secondo grado al logaritmo di ogni funzione di correlazione campo elettrico
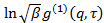 da minimi quadrati lineari.
da minimi quadrati lineari. 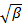 appare come l'intercetta della forma e il suo valore esatto è irrilevante per quanto riguarda l'analisi dei dati. Limitare la misura per un valore di τ ritardo significativo, ad esempio, in modo che l'ampiezza di correlazione è del 10 - 20% dell'ampiezza massima. Il coefficiente del primo termine di ordine è il tasso di decadimento media della funzione di correlazione,
appare come l'intercetta della forma e il suo valore esatto è irrilevante per quanto riguarda l'analisi dei dati. Limitare la misura per un valore di τ ritardo significativo, ad esempio, in modo che l'ampiezza di correlazione è del 10 - 20% dell'ampiezza massima. Il coefficiente del primo termine di ordine è il tasso di decadimento media della funzione di correlazione, 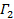 .
. - Trova il valore più probabile per il coefficiente di diffusione media
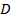 delle particelle di minimi quadrati lineari stare su
delle particelle di minimi quadrati lineari stare su  . Se
. Se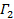 contro
contro 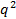 non appare lineare e passare attraverso l'origine entro l'errore, la distribuzione granulometrica è ampio e idrodinamica raggio sarà poco definito.
non appare lineare e passare attraverso l'origine entro l'errore, la distribuzione granulometrica è ampio e idrodinamica raggio sarà poco definito. - Calcolare il raggio idrodinamico dal rapporto Stokes-Einstein
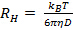 , dove
, dove 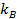 è il coefficiente di Boltzmann,
è il coefficiente di Boltzmann, 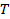 la temperatura assoluta e
la temperatura assoluta e 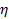 la viscosità della dispersione a
la viscosità della dispersione a 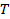 . Propagare la deviazione standard di
. Propagare la deviazione standard di 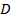 a
a 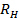 .
.
- Calcola la dispersione grandezze vettoriali per l'angolo di scattering in base alle
- Particle Struttura Determinazione di Static Light Scattering
- Lavare le provette e cristalleria con il vapore di acetone. Utilizzare diametro 20 mm o cuvette più grandi per minimizzare l'effetto lente cilindrica.
- Filter (filtro RC 200 nm o più piccola) di circa 20 ml di acqua bidistillata a un flacone di vetro e trasferire una goccia della dispersione purificata al flaconcino. Lavare il filtro con 10 ml di acqua prima di utilizzarla per la preparazione del campione per rimuovere le impurità residue dal processo di fabbricazione.
- Controllo a campione nei confronti di qualsiasi fonte di luce ambientale. Se si osserva la tonalità blu, il campione rischia di essere troppo concentrato. Diluire conseguenza.
- Predisporre il campione sfondo svuotando la cuvetta più volte con acqua filtrata e poi portare a volume del campione appropriata, a seconda della cuvetta e la posizione del laser nello strumento. Il laser deve passare attraverso il campione senza essere rifratta dal menisco.
- Calibrare il instrument utilizzando un campione toluene.
- Misurare la dispersione di acqua (sfondo) su tutta la gamma angolare disponibile.
- Misurare l'intensità di scattering dal campione in tutto il campo angolare disponibile preferibilmente a più lunghezze d'onda. Il modello di dispersione normalizzato all'intensità forward scattering è noto come il fattore di forma.
- Se la struttura delle particelle è noto, l'espressione modello appropriato per calcolare in forma globale sui set di dati misurati a diverse lunghezze d'onda.
- In struttura particellare Sconosciuto regolarizzata diretta (ad esempio FitIt! 33) o inversa indiretta più generale Fourier trasformare 21,22 di routine unitamente deconvoluzione della funzione di distribuzione a coppie distanza (solo per particelle sferiche) 23,24 per la classificazione approssimativa di particelle Digitare.
- Nel caso la routine raccordo o inversione fornisce una stima della funzione di distribuzione delle particelle di raggio, calcolare la polidispersitàindex (deviazione standard della distribuzione diviso per la sua media).
3. Particle monitoraggio da Wide-field microscopia a fluorescenza
NOTA: Tracer e matrice particelle di 465 ± 7 nm e 405 nm ± 7 raggi idrodinamica a 20 ° C, rispettivamente, sono stati utilizzati per il monitoraggio delle particelle.
- Preparazione del campione
- Preparare concentrato dispersione matrice Microgel da redispersing quantità nota di liofilizzato Microgel senza etichetta alla quantità nota di acqua bidistillata. Aggiungere una piccola quantità di particelle traccianti marcati.
- Confermare la concentrazione del tracciante Microgel adeguato al microscopio. La concentrazione ottimale è un compromesso tra le acquisizioni simultanee del numero massimo di tracce, pur avendo la concentrazione di tracciante abbastanza basso in modo che la probabilità che le piste tracciante particelle attraversano durante l'acquisizione è trascurabile.
- Preparare dispersioni concentrate per evaporazionel'acqua in un forno. Determinare la concentrazione di peso confrontando il peso della dispersione al peso originale del campione prima dell'evaporazione.
- Acquisizione dati e analisi
- Utilizzare una lente obiettivo appropriata del ingrandimento desiderato e l'apertura per l'eccitazione dei rivelatori e la raccolta di fluorescenza simultanea dal campione. In questo lavoro, utilizzare un 100X / 1.3 NA immersione in olio lente dell'obiettivo.
- Posizionare la camera di umidità su un tavolo XYZ-piezo, che si inserisce in un microscopio commerciale.
- Per evitare che il campione si secchi, posizionare un plasma pulito vetrino nella camera di umidità e pipetta 10 ml di poli (NIPAM) dispersione della concentrazione desiderata sul slittamento.
- A seconda della eccitazione ed emissione spettri del colorante fluorescente, utilizzare un laser adatto per l'eccitazione e regolare la potenza del laser in modo appropriato. L'intensità deve essere sufficientemente bassa da evitare photobleaching rapida dei coloranti, maallo stesso tempo abbastanza forte per un accurato posizionamento singola particella (vedi sotto). In questo lavoro, utilizzare un 561 nm diodo pompato laser a stato solido e mantenere costante la potenza del laser a 16 mW (ca. 0,5 kW cm -2 al campione) per tutte le misurazioni.
- Per ottenere un'illuminazione campione omogeneo, utilizzare l'impostazione di illuminazione critica qui descritto. Per questo, due il laser in una fibra multimodale (NA 0.22 ± 0.02, 0.6 mm di diametro core), agitare la fibra utilizzando un vortex in modo da temporalmente media fuori macchioline laser, e proiettare terminare la fibra nel piano di campionamento.
- Calibrare la distanza z dalla riflessione retro del vetrino e mettere a fuoco diversi micrometri nel campione spostando l'obiettivo leggermente verso l'alto e fissare la posizione z utilizzando una z-compensatore. Questo consente di evitare eventuali effetti di interfaccia con il vetrino.
- Regolare i parametri del rivelatore, come il tempo di esposizione, la forza del segnale di fluorescenza. In questo caso, utilizzare una fotocamera EMCCDcon il tempo di esposizione di 0,1 sec, elettrone modalità e guadagno di 50 moltiplicarsi.
- Acquisire diversi film con il numero appropriato di fotogrammi per ottenere un adeguato lasso di tempo per calcolare lo spostamento quadratico medio dei microgel in diverse regioni del campione. In questo lavoro, utilizzare numeri di telaio di acquisizione di 500 o 1.000 fotogrammi.
- Analizzare i dati posizionando le particelle in ogni fotogramma usando raccordo gaussiana 25 e utilizzare un algoritmo di monitoraggio adeguato delle particelle 26 per ottenere lo spostamento quadratico medio. 27 Calcolare dire i valori e la deviazione standard dalla media su tutte le piste in tutti i film. Calcolare i coefficienti di diffusione lungo intervallo di tempo mediante regressione lineare da
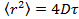 , dove
, dove 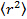 è lo spostamento quadratico medio, D il coefficiente di diffusione media e T si il tempo di ritardo.
è lo spostamento quadratico medio, D il coefficiente di diffusione media e T si il tempo di ritardo. - EstiMate il parametro anomalia γ dall'equazione diffusione anomala
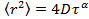 trasformando i dati in scala logaritmica, cedendo
trasformando i dati in scala logaritmica, cedendo 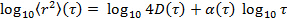 . Il parametro di anomalia
. Il parametro di anomalia 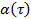 è dato dalla derivata della trama. Il derivato può essere stimato dalle differenze finite dei punti di dati, o il montaggio dei punti dati da funzioni polinomiali e differenziando analiticamente. Determinare il grado sufficiente di funzioni polinomiale tracciando i residui in forma e norma residuale per aumentare ordine polinomiale.
è dato dalla derivata della trama. Il derivato può essere stimato dalle differenze finite dei punti di dati, o il montaggio dei punti dati da funzioni polinomiali e differenziando analiticamente. Determinare il grado sufficiente di funzioni polinomiale tracciando i residui in forma e norma residuale per aumentare ordine polinomiale. - Ripetere la stessa procedura per diverse concentrazioni delle matrici Microgel.
Risultati
Il numero di particelle Microgel PNIPAM nel batch, e quindi il volume delle particelle finale, è determinata presto nella reazione durante la fase di nucleazione 20 idrofobo co-monomero dye methacryloxyethyl thiocarbamoyl rodamina B influenza la nucleazione riducendo particella densità numerica nel batch. La diminuzione della concentrazione di particelle per due diverse concentrazioni NIPAM iniziali può essere vis...
Discussione
L'aggiunta di piccole quantità di comonomero funzionale può avere un effetto significativo sulla dimensione delle particelle e la struttura dei PNIPAM derivato microgel. Simultanea su piccola scala provetta di polimerizzazione è un buon metodo per tenere conto di tali cambiamenti, e aiuta a trovare rapidamente le composizioni reagenti giusti per dimensioni di destinazione delle particelle per l'upscaling la reazione, se necess...
Divulgazioni
The authors have nothing to disclose.
Riconoscimenti
The Deutsche Forschungsgemeinschaft (DFG) is acknowledged for financial support within the Sonderforschungsbereich SFB 985 "Functional Microgels and Microgel Systems".
Materiali
| Name | Company | Catalog Number | Comments |
| Acetone | VWR Chemicals | KRAF13455 | |
| Bisacrylamid | AppliChem | A3636 | |
| n-Hexane | Merck | 104374 | |
| N-Isopropylacrylamide | Fisher Scientific | AC412785000 | recrystallized from n-hexane |
| Methacryloxyethyl thiocarbamoyl rhodamine B | Polysciences | 23591 | |
| Potassium peroxodisulfate | Merck | 105091 | |
| Silicone oil 47 V 350 | VWR Chemicals | 83851 | |
| Toluene | Sigma Aldrich | 244511 | |
| F12 Refrigerated/heating circulator | Julabo | 9116612 | |
| Microscope | Olympus | IX83 | |
| XY(Z) Piezo System | Physik Instrumente | P-545.3R7 | |
| 100X Oil immersion objective | Olympus | UPLSAPO | |
| QuadLine Beamsplitter | AHF Analysentechnik | F68-556T | |
| Cobolt Jive 150 laser | Cobolt | 0561-04-01-0150-300 | |
| Multimode Fiber | Thorlabs | UM22-600 | |
| iXON Ultra 897 EMCCD camera | Andor | DU-897U-CS0-BV | |
| Laser goniometer | SLS Systemtechnik | Mark III | |
| CF40 Cryo-compact circulator | Julabo | 9400340 | |
| Laser goniometer system | ALV GmbH | ALV / CGS-8F | |
| Multi-tau corretator | ALV GmbH | ALV-7004 | |
| Light scattering electronics | ALV GmbH | ALV / LSE 5004 | |
| Photon counting module | PerkinElmer | SPCM-CD2969 | 2 units in pseudo cross-correlation mode |
| 633 nm HeNe Laser | JDS Uniphase | 1145P | |
| F32 Refrigerated/heating circulator | Julabo | 9312632 |
Riferimenti
- Pelton, R. Temperature-sensitive aqueous microgels. Adv. Colloid Interfac. 85, 1-33 (2000).
- Pich, A., Richtering, W. Microgels by Precipitation Polymerization: Synthesis, Characterization and Functionalization. Adv. Polym. Sci. 234, 1-37 (2010).
- Richtering, W. Responsive Emulsions Stabilized by Stimuli-Sensitive Microgels: Emulsions with Special Non-Pickering Properties. Langmuir. 28 (50), 17218-17229 (2012).
- Wiese, S., Spiess, A. C., Richtering, W. Microgel-Stabilized Smart Emulsions for Biocatalysis. Angew. Chem. Int. Edit. 52 (2), 576-579 (2012).
- Schmitt, V., Ravaine, V. Surface compaction versus stretching in Pickering emulsions stabilised by microgels. Curr. Opin. Colloid In. 18 (6), 532-541 (2013).
- Wellert, S., Richter, M., Hellweg, T., von Klitzing, ., R, Y., Hertle, Responsive Microgels at Surfaces and Interfaces. Z. Phys. Chem. 229 (7-8), 1-26 (2015).
- Li, Z., Harbottle, D., Pensini, E., Ngai, T., Richtering, W., Xu, Z. Fundamental Study of Emulsions Stabilized by Soft and Rigid Particles. Langmuir. 31 (23), 6282-6288 (2015).
- Deshmukh, O. S., van den Ende, D., Stuart, M. C., Mugele, F., Duits, M. H. G. Hard and soft colloids at fluid interfaces: Adsorption, interactions, assembly & rheology. Adv. Colloid Interfac. 222, 215-227 (2015).
- Serpe, M. J., Kim, J., Lyon, L. A. Colloidal Hydrogel Microlenses. Adv. Mater. 16 (2), 184-187 (2004).
- Schmidt, S., Zeiser, M., Hellweg, T., Duschl, C., Fery, A., Möhwald, H. Adhesion and Mechanical Properties of PNIPAM Microgel Films and Their Potential Use as Switchable Cell Culture Substrates. Adv. Func. Mater. 20 (19), 3235-3243 (2010).
- Xia, Y., He, X., et al. Thermoresponsive Microgel Films for Harvesting Cells and Cell Sheets. Biomacromolecules. 14 (10), 3615-3625 (2013).
- Guan, Y., Zhang, Y. PNIPAM microgels for biomedical applications: from dispersed particles to 3D assemblies. Soft Matter. 7 (14), 6375 (2011).
- Yunker, P. J., Chen, K., Gratale, M. D., Lohr, M. A., Still, T., Yodh, A. G. Physics in ordered and disordered colloidal matter composed of poly(N-isopropylacrylamide) microgel particles. Rep. Prog. Phys. 77 (5), 056601-056629 (2014).
- Lohr, M. A., Still, T., et al. Vibrational and structural signatures of the crossover between dense glassy and sparse gel-like attractive colloidal packings. Phys. Rev. E. 90 (6), 062305 (2014).
- Dreyfus, R., Xu, Y., Still, T., Hough, L. A., Yodh, A. G., Torquato, S. Diagnosing hyperuniformity in two-dimensional, disordered, jammed packings of soft spheres. Phys. Rev. E. 91 (1), 012302-012312 (2015).
- Kojima, H., Tanaka, F. Reentrant volume phase transition of cross-linked poly(N-isopropylacrylamide) gels in mixed solvents of water/methanol. Soft Matter. 8 (10), 3010-3011 (2012).
- Hofmann, C. H., Plamper, F. A., Scherzinger, C., Hietala, S., Richtering, W. Cononsolvency Revisited: Solvent Entrapment by N-Isopropylacrylamide and N, N-Diethylacrylamide Microgels in Different Water/Methanol Mixtures. Macromolecules. 46 (2), 523-532 (2013).
- Bischofberger, I., Calzolari, D. C. E., Trappe, V. Co-nonsolvency of PNiPAM at the transition between solvation mechanisms. Soft Matter. 10 (41), 8288-8295 (2014).
- Virtanen, O. L. J., Richtering, W. Kinetics and particle size control in non-stirred precipitation polymerization of N-isopropylacrylamide. Colloid Polym. Sci. 292 (8), 1743-1756 (2014).
- Virtanen, O. L. J., Ala-Mutka, H. M., Richtering, W. Can the Reaction Mechanism of Radical Solution Polymerization Explain the Microgel Final Particle Volume in Precipitation Polymerization of N-Isopropylacrylamide?. Macromol. Chem. Phys. 216 (13), 1431-1440 (2015).
- Glatter, O. A new method for the evaluation of small-angle scattering data. J. Appl. Crystallogr. 10 (5), 415-421 (1977).
- Svergun, D. I. Determination of the regularization parameter in indirect-transform methods using perceptual criteria. J. Appl. Crystallogr. 25 (4), 495-503 (1992).
- Glatter, O. Convolution Square Root of Band-Limited Symmetrical Functions and Its Application to Small-Angle Scattering Data. J. Appl. Crystallogr. 14, 101-108 (1981).
- Glatter, O., Hainisch, B. Improvements in Real-Space Deconvolution of Small-Angle Scattering Data. J. Appl. Crystallogr. 17, 435-441 (1984).
- Cheezum, M. K., Walker, W. F., Guilford, W. H. Quantitative Comparison of Algorithms for Tracking Single Fluorescent Particles. Biophys. J. 81 (4), 2378-2388 (2001).
- Wöll, D., Kölbl, C., Stempfle, B., Karrenbauer, A. A novel method for automatic single molecule tracking of blinking molecules at low intensities. Phys. Chem. Chem. Phys. 15 (17), 6196-6205 (2013).
- Saxton, M. J., Jacobson, K. Single-particle tracking: Applications to membrane dynamics. Annu. Rev. Bioph. Biom. 26, 373-399 (1997).
- Pusey, P. N., van Megen, W. Detection of small polydispersities by photon correlation spectroscopy. J. Chem. Phys. 80 (8), 3513 (1984).
- Stieger, M., Pedersen, J. S., Richtering, W., Lindner, P. Small-angle neutron scattering study of structural changes in temperature sensitive microgel colloids. J. Chem. Phys. 120 (13), 6197-6206 (2004).
- Wu, X., Pelton, R. H., Hamielec, A. E., Woods, D. R., McPhee, W. The kinetics of poly(N-isopropylacrylamide) microgel latex formation. Colloid Polym. Sci. 272, 467-477 (1994).
- Weeks, E. R., Weitz, D. A. Subdiffusion and the cage effect studied near the colloidal glass transition. Chem. Phys. 284 (1-2), 361-367 (2002).
- Ernst, D., Köhler, J., Weiss, M. Probing the type of anomalous diffusion with single-particle tracking. Phys. Chem. Chem. Phys. 16 (17), 7686-7691 (2014).
- . FitIt! (Version 1.1.4) Available from: https://www.github.com/ovirtanen/fitit (2015)
- Provencher, S. W. A Constrained Regularization Method For Inverting Data Represented By A Linear Algebraic or Integral Equations. Comput. Phys. Commun. 27 (3), 213-227 (1982).
- Holtzer, L., Meckel, T., Schmidt, T. Nanometric three-dimensional tracking of individual quantum dots in cells. Appl. Phys. Lett. 90 (5), 053902-053904 (2007).
- Diezmann, A. V., Lee, M. Y., Lew, M. D., Moerner, W. E. Correcting field-dependent aberrations with nanoscale accuracy in three-dimensional single-molecule localization microscopy. Optica. 2 (11), 985-989 (2015).
- Lindner, P., Zemb, T. . Neutrons, X-rays and Light: Scattering Methods Applied to Soft Condensed Matter. , (2002).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon