Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Un protocolo simple y eficaz para la inserción catalítico de polimerización norbornenos funcionales
En este artículo
Resumen
We describe the catalytic insertion polymerization of 5-norbornene-2-carboxylic acid and 5-vinyl-2-norbornene to form functional polymers with a very high glass transition temperature.
Resumen
Norborneno puede ser polimerizado por una variedad de mecanismos, incluyendo la polimerización de inserción mediante el cual el doble enlace se polimeriza y la naturaleza bicíclico del monómero se conserva. El polímero, polinorborneno resultante, tiene una temperatura muy alta de transición vítrea, Tg, y propiedades ópticas y eléctricas interesantes. Sin embargo, la polimerización de norbornenos funcionales por este mecanismo es complicado por el hecho de que el monómero de norborneno endo sustituido tiene, en general, una reactividad muy baja. Además, la separación del monómero endo sustituido a partir del monómero exo es una tarea tediosa. A continuación, presentamos un protocolo sencillo para la polimerización de norbornenos sustituidos (endo: exo ca. 80:20) que lleva un ácido carboxílico o un doble enlace colgante. El proceso no requiere que pueden separar los dos isómeros, y procede con cargas de catalizador bajas (0,01-0,02% en moles). Los pend cojinete de polímerodobles enlaces de hormigas pueden ser transformados adicionalmente con un alto rendimiento, para proporcionar un cojinete de polímero de grupos epoxi colgantes. Estos procedimientos simples se pueden aplicar para preparar polynorbornenes con una variedad de grupos funcionales, tales como ésteres, alcoholes, imidas, dobles enlaces, ácidos carboxílicos, bromo-alquilos, aldehídos y anhídridos.
Introducción
Norborneno, NBE, el aducto de Diels-Alder de etileno y ciclopentadieno (obtenido por "cracking" de diciclopentadieno (DCPD)), se polimeriza fácilmente usando polimerización por radicales libres, 1 polimerización catiónica, metátesis polimerización por apertura de anillo de 2 3 y la inserción catalítica polimerización. 4, 5, 6, 7 A diferencia de los otros mecanismos, la polimerización de inserción catalítico conduce a la formación de una temperatura muy alta de transición vítrea (Tg) del polímero mediante el cual se conserva la columna vertebral bicíclico de NBE. Una variedad de catalizadores tales como catalizadores de metaloceno y catalizadores de metales de transición finales se puede utilizar para promover la polimerización de NBE. 4, 5, 6, 7 Sin embargo, debido a su baja solubilidad y debido a las dificultades asociadas con el procesamiento de un polímero muy alta Tg, el homopolímero PNBE ha, que nosotros sepamos, nunca se encontró ningún uso.
Polynorbornenes funcionales (PNBEs) han sido objeto de un escrutinio considerable durante los últimos 20 años, ya que combinan la alta Tg impartida por la unidad de repetición rígida bicíclico, así como propiedades deseables dotadas por sus funcionalidades. 8, 9, 10 monómeros NBE se obtienen de materias primas bastante simple y de bajo costo, utilizando una reacción de Diels-Alder de un solo paso entre el ciclopentadieno y un dienófilo funcionalizado. Sin embargo, la reacción de Diels-Alder conduce a dos estereoisómeros, endo y exo, que tienen muy diferentes reactividades. 11, 12 De hecho, el equipo de música endoisómero es menos reactivo que forma exo y desactiva el catalizador. 11, 12 Por lo tanto, en el pasado, la preparación de polynorbornenes funcionales requiere generalmente la separación de los estereoisómeros endo y exo, y se utilizó sólo el estereoisómero exo. Dicho procedimiento de separación era mucho tiempo, y dio lugar a la acumulación de estereoisómeros endo sin reaccionar como residuos indeseables.
Recientemente hemos demostrado que la polimerización de NBEs funcionalizados que contienen ambos estereoisómeros es, de hecho, factible. 13 por lo que hemos sido capaces de preparar una variedad de PNBEs sustituidos, que contienen grupos funcionales tales como ésteres, anhídridos, aldehídos, alcoholes, imidas y dobles enlaces. Debido a su alto T g y funcionalidad, estos polímeros muestran propiedades deseables. Se describe aquí dos métodos para preparar polímeros funcionales. El primero conduce ala síntesis de la poli polímero soluble en agua (ácido 5-norborneno-2-carboxílico), PNBE (CO 2 H), utilizando un catalizador de Pd catiónico (Figura 1). 13, 14 El mismo método de polimerización puede usarse para preparar PNBEs funcionales con varias funcionalidades colgantes, tales como ésteres, alcoholes, imidas, bromo-alquilos, aldehídos y anhídridos. En nuestras manos, este catalizador Pd catiónico no se puede utilizar para NBEs que contienen dobles enlaces colgantes tales como 5-vinil-2-norborneno. En este caso, una inserción parcial del doble enlace colgante durante la polimerización conduce a la formación de un material reticulado. Por lo tanto, se presenta aquí un segundo método dedicado a la formación de poli (5-vinil-2-norborneno), PNBE (vinilo), usando Pd 2 (dba) 3: AgSbF 6: PPh 3 como un catalizador en situ. 14 Los grupos vinilo colgantes del polímero epoxidado son luego más allá, al llevar a THe formación de PNBE (epoxi) (Figura 1). Tanto PNBE (CO 2 H) y PNBE (epoxi) se han encontrado para conducir a la formación de resinas termoendurecibles con una Tg tan alta como 350 ° C. 14 Por lo tanto, el simple método descrito aquí permite a uno preparar eficientemente polímeros con una alta Tg y que tiene una variedad de grupos funcionales, que se pueden utilizar para numerosas aplicaciones.
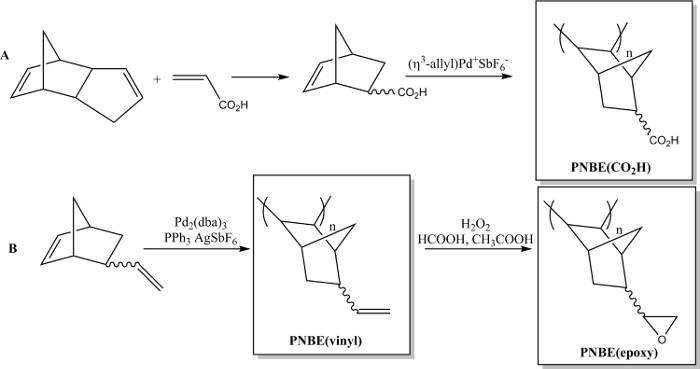
Figura 1: PNBEs funcionales preparados por Pd catalizada polimerización. (A) Preparación de PNBE (CO 2 H), (B) la preparación de PNBE (vinilo) y PNBE (epoxi). El enlace de trazos indica una mezcla de isómeros endo y exo. Haga clic aquí para ver una versión más grande de esta figura.
Access restricted. Please log in or start a trial to view this content.
Protocolo
1. Preparación de poli (ácido 5-norborneno-2-carboxílico), PNBE (CO 2 H)
- Preparación de la NBE monómero (CO 2 H)
- Pesar ácido acrílico (AA) (327 g, 4,5 mol, 2 eq.) E hidroquinona (4,9 g, 4,5 x 10 -2 moles, 0,02 eq.) Y añadirlos a un matraz de 2 l de fondo redondo equipado con un condensador y una barra de agitación magnética. Se calienta el matraz a 150 ° C utilizando un baño de aceite de silicona.
- Una vez que se resuelva el reflujo, añadir DCPD (300 g, 2,3 mol, 1 eq.) En una sola porción, y luego aumentar la temperatura a 170 ° C.
- Dejar la reacción a esta temperatura durante 16 h. Observe el cambio de color de claro a amarillo-marrón.
- Tomar una muestra de la extracción con una pipeta Pasteur, y analizarla por 1 H RMN (usando CDCl3 como disolvente) 15. Observar la aparición de NBE (señales de doble enlace entre 6,0 y 6,5 ppm, la figura 2 arriba). dieciséis
- La purificación del NBE (CO 2 H)
- Reemplazar el condensador con una configuración de destilación simple (una meseta) conectado a un condensador en el que se hace circular agua fría.
- Ponga la configuración de la reacción bajo un vacío ajustado a aprox. 1 mmHg. Calentar la mezcla a 100 ° C, y recoger un líquido claro (ca. 40 ml) que puede ser desechado.
- Sustituir el matraz de recogida con un matraz de fondo redondo de 500 mL. Calentar el baño de aceite a 155 ° C, y observar la destilación gota a gota de NBE (CO 2 H) (317 g, 2,3 mol. Rendimiento = 98%). La destilación se hace cargo de 7 h.
- Analizar el líquido incoloro mediante 1H RMN para evaluar la pureza, así como endo: exo proporciones (Figura 2, abajo). 15 Las endo: exo de relación de cambios con el tiempo utilizado para la destilación, así como con el tiempo de calentamiento se utiliza para la preparación de la NBE crudo (CO 2 H). Típicamente, endo:exo proporciones entre 50:50 y 80:20 se obtienen (60:40 en este caso).
- La polimerización de NBE (CO 2 H)
- Colocar 300 g (2,3 mol, 5,000 eq.) De NBE (CO 2 H) en un matraz de fondo redondo de 500 ml equipado con una barra de agitación magnética. Desgasificar el líquido mediante el burbujeo de nitrógeno durante 30 min.
- Pesar alilpaladio (II) dímero de cloruro, [PdCl (C 3 H 5)] 2 (76 mg, 4,2 x 10 -1 mmol, 1 eq. De Pd) y añadirlo a la solución. Añadir AgSbF antimoniato de plata 6 (180 mg, 5,2 x 10 -1 mmol, 1,2 eq.).
- Bajo agitación, se disuelve la sal de Pd por calentamiento a 70 ° C, y mantener la temperatura a 70 ° C bajo un flujo de nitrógeno ligero. Después de 7 a 8 h, la agitación se detiene debido a un aumento de la viscosidad.
- Se detiene la reacción después de 36 h.
- Se enfría el matraz de fondo redondo con nitrógeno líquido. Con una espátula, romper el polímero en trozos pequeños.
- En un vaso de precipitados de 2 L equipado con una barra de agitación magnética, añadir 750 ml de acetato de etilo. Añadir los trozos de polímero de acetato de etilo con agitación vigorosa. Continuar la agitación durante 2 h.
- Filtrar la solución a través de un diámetro embudo Buchner de 15 cm equipado con un filtro de papel (grado 413, 15 cm de diámetro).
- Lavar el polímero con acetato de etilo tres veces (500 ml cada lavado). Se seca el polímero (123 g, 9,4 x 10 -1 mol, rendimiento = 41%) en una estufa de vacío ajustada a 50 ° C durante 12 h.
2. Preparación de PNBE (vinilo)
- La polimerización de NBE (vinilo)
- Degas tolueno (ca. 200 ml) y NBE (vinilo) (ca. 200 ml) por burbujeo con N2 durante 30 min y colocarlos en una caja de guantes.
- Dentro de la caja de guantes, tolueno carga (100 g) en un matraz de fondo redondo de 250 mL.
- Añadir Pd 2 (dba) 3 (76 mg, 1,6 x 10 -1 mmol, 1 eq. De Pd), AgSbF 6 (68 mg, 2,0 x 10 -1 mmol, 1,2 eq.) y trifenilfosfina, PPh 3 (43 mg, 1,6 x 10 -1 mmol, 1 eq.) sucesivamente a la solución de tolueno.
- Se calienta la mezcla a 70 ° C hasta que se produce la disolución completa. Se produce dentro de 10 min.
- Añadir 100 g (8,0 x 10 -1 mol, 5,000 eq.) De NBE (vinilo) a esta solución de color púrpura.
- Se agita a 70 ° C durante 72 h.
- Retirar la solución de la guantera, y pasar la solución viscosa negro a una botella de vidrio de 1 l que contenía una barra de agitación magnética.
- Añadir tolueno (200 ml) y se agita.
- Agregue el polvo de sílice (gel de sílice 40-63 micras, 10 g). Se agita a temperatura ambiente durante 16 h.
- Detener la agitación y dejar que el polvo se conforme con al menos 2 h para que las partículas de sílice a sedimentar.
- Filtrar la solución a través de un diámetro embudo Buchner de 15 cm equipado con un filtro de papel (grado 413, 15 cm de diámetro). Evitar verter partículas de sílice sedimentados en el embudo de Buchner.
- Enjuague el par de sílicetículos con tolueno (50 ml) y se filtra a través del embudo Buchner.
- Añadir metanol (1,2 L) a un vaso de precipitados de 4 l equipado con una barra de agitación magnética.
- Añadir toda la solución de tolueno que contiene el polímero a la metanol gradualmente con agitación vigorosa, y continuar agitando durante 30 min.
- Se filtra el polímero durante un diámetro embudo Buchner de 15 cm equipado con un filtro de papel (grado 413, 15 cm de diámetro). Se lava el polímero con tres alícuotas de metanol (400 ml cada una). Cambiar el papel de filtro entre cada lavado.
- Evaluar la pureza de polímero por 1 H RMN en CDCl 3, con el fin de ver si el monómero residual está presente (señales de doble enlace entre 6,0 y 6,3 ppm). 15, 16 Si este es el caso, seguir lavando con metanol.
- Se seca el polímero (75 g, 6,3 x 10 -1 mol, rendimiento = 78%) a vacío a temperatura ambiente durante la noche.
3.Preparación de PNBE (epoxi)
- La epoxidación del PNBE (vinilo)
- Añadir 150 g de diclorometano en un matraz de fondo redondo de 500 ml equipado con un agitador magnético y un condensador.
- Añadir PNBE (vinílico) (15 g, 1,3 x 10 -1 mol, 1 eq.) Con agitación hasta disolución completa.
- Colocar el matraz en un baño de hielo y dejar que se enfríe durante 15 minutos.
- En un recipiente separado, mezclar ácido fórmico (30 g, 6,5 x 10 -1 mol, 5 eq.) Y ácido acético (5 g, 8,3 x 10 -2 mol, 0,6 eq.). Añadir los ácidos combinados a la solución polimérica.
- Deje que se enfríe durante 15 minutos.
- Añadir solución de peróxido de hidrógeno acuoso (30%) (75 g, 6,5 x 10 -1 mol, 5 eq.) A la solución polimérica.
- Se agita durante 18 h. El baño de hielo no tiene que ser eliminado, ya que la temperatura aumentará gradualmente a la temperatura ambiente.
- Tomar una pequeña muestra, precipitar el polímero con acetona, y analizarla mediante 1H NMR en CD Cl 3. 15 Si la señal para el doble enlace (δ = 4,5-6,0 ppm) está suficientemente disminuyó (Figura 3), pase a la siguiente etapa. Típicamente, la relación de la integral de los dobles enlaces a los otros protones es de menos de 1:20 (1:83 en la Figura 3). De lo contrario, continúe la reacción.
- Añadir acetona (750 ml) a un vaso de precipitados de 4 l equipado con una barra de agitación magnética.
- Añadir la solución de polímero a la acetona gradualmente bajo agitación vigorosa durante 15 min.
- Se filtra el polímero durante un diámetro embudo Buchner de 15 cm equipado con un filtro de papel (grado 413, 15 cm de diámetro).
- Lavar el polímero cuatro veces con acetona (200 ml cada vez).
- Cambiar el papel de filtro entre cada lavado.
- Se seca el polímero (7,5 g) a vacío a temperatura ambiente durante la noche.
g "/>
Figura 2: 1H NMR de crudo (parte superior) y purificado (parte inferior) NBE (CO 2 H). El producto purificado se obtiene por destilación simple. Tenga en cuenta los picos que se utilizan para evaluar la endo: exo relación. Haga clic aquí para ver una versión más grande de esta figura.
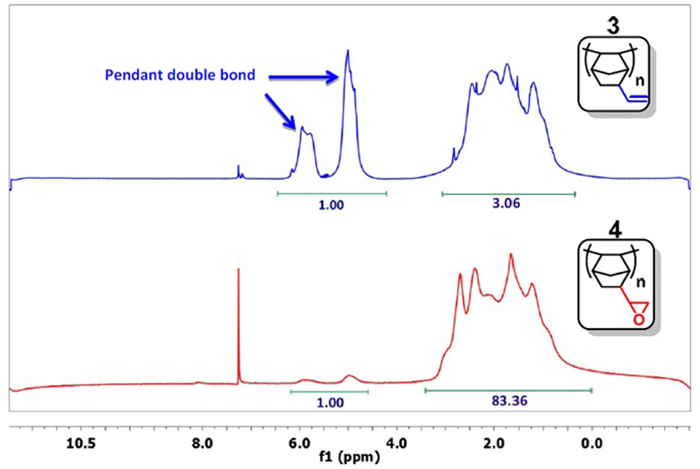
Figura 3: 1H NMR de PNBE (vinilo) (azul) y PNBE (epoxi) (rojo). Tenga en cuenta la relación de 1: 3 entre las integrales del grupo vinilo (δ = 4,5 a 6,0 ppm) y los otros protones en el espectro PNBE (vinilo). Después de la reacción con H 2 O 2, la relación disminuye a 1:83, lo que confirma que epoxidación de grupo vinilo se ha producido.nk "> Haga clic aquí para ver una versión más grande de esta figura.
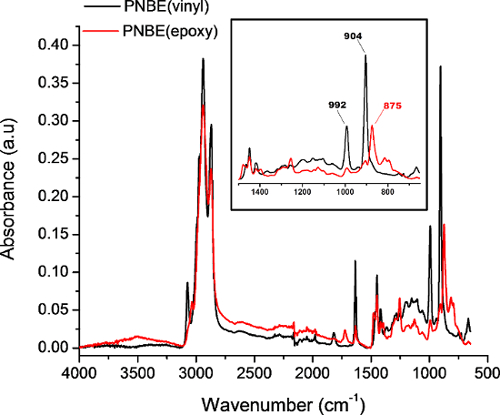
Figura 4: espectros FTIR de PNBE (vinilo) (negro) y PNBE (epoxi) adquirida en el modo de reflectancia total atenuada. Inserto muestra un zoom de las bandas características de PNBE (vinilo) y PNBE (epoxi). Los 902 cm-1 y 992 cm -1 bandas corresponden a la C = CH fuera del plano de flexión, mientras que el 875 cm -1 banda corresponde a la deformación del anillo epóxido. Haga clic aquí para ver una versión más grande de esta figura.
Access restricted. Please log in or start a trial to view this content.
Resultados
Los monómeros NBE se preparan por simple reacción de Diels-Alder de DCPD y un dienófilo adecuado, por ejemplo ácido acrílico (AA). Normalmente, DCPD está agrietada para dar ciclopentadieno (CPD) antes de la reacción. 17 CPD recién abierto entonces se dedica a la reacción de Diels-Alder. Sin embargo, en este protocolo, ambos pasos de craqueo y de Diels-Alder se realizan de forma concomitante, en una reacción en un solo recipiente. Por lo tanto, tan pronto...
Access restricted. Please log in or start a trial to view this content.
Discusión
El método propuesto aquí es simple y fácilmente susceptible de aumento de escala. Todos los productos químicos podrían ser utilizados como se recibieron sin purificación. Tenga en cuenta que la realización de la reacción a una escala más baja (por ejemplo, balanzas ≤1 g) por lo general tienen rendimientos más bajos debido a una pérdida inevitable de material durante la manipulación y la colección.
Los catalizadores se forman in situ en la reacción de compues...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
The authors acknowledge funding from Fonds de Recherche du Québec - Nature et Technologies, from Conseil Recherches en Sciences Naturelles et Génie (program INNOV) and PrimaQuébec.
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| acrylic acid | Sigma-Aldrich | 147230 | |
| hydroquinone | Sigma-Aldrich | H9003 | |
| dicyclopendadiene | Sigma-Aldrich | 454338 | |
| palladium allyl dichloride dimer | Sigma-Aldrich | 222380 | |
| silver hexfluoro antimonate | Sigma-Aldrich | 227730 | |
| liquid nitrogen | Local Facility | NA | |
| ethyl acetate | Fischer Scientific | E14520 | |
| 5-vinyl-2-norbornene | Sigma-Aldrich | 148679 | |
| toluene | Fischer Scientific | T290-4 | |
| palladium dba | Sigma-Aldrich | 227994 | |
| triphenyl phosphine | Sigma-Aldrich | 93090 | |
| silica gel 40-63 microns | Silicycle | Siliaflash | |
| methanol | Fischer Scientific | BPA412-20 | |
| dichloromethane | EMD Millipore | DX08311 | |
| formic acid | Sigma-Aldrich | F0507 | |
| acetic acid | Sigma-Aldrich | 320099 | |
| hydrogen peroxide solution | Sigma-Aldrich | 216763 | |
| acetone | Fischer Scientific | A18-200 |
Referencias
- Gaylord, N. G., Mandal, B. M., Martan, M. Peroxide-induced polymerization of norbornene. J. Polym. Science, Polym. Lett. Ed. 14 (9), 555-559 (1976).
- Janiak, C., Lassahn, P. G. The vinyl homopolymerization of norbornene. Macromol. Rapid Comm. 22 (7), 479-493 (2001).
- Bielawski, C. W., Grubbs, R. H. Living ring-opening metathesis polymerization. Prog. Polym. Sci. 32 (1), 1-29 (2007).
- Blank, F., Janiak, C. Metal catalysts for the vinyl/addition polymerization of norbornene. Coord. Chem. Rev. 253 (7-8), 827-861 (2009).
- Kaminsky, W., Boggioni, L., Tritto, I. Cycloolefin polymerization. Polymer Science: A Comprehensive Reference, 10 Volume Set. 3, 843-873 (2012).
- Boggioni, L., Tritto, I. State of the art of cyclic olefin polymers. MRS Bull. 38 (3), 245-251 (2013).
- Goodall, B. Cycloaliphatic polymers via late transition metal catalysis. Late Transition Metal Polymerization Catalysis. Rieger, B., Baugh, L., Kacker, S., Striegler, S. , Wiley-VCH Verlag GmbH. 101-154 (2003).
- Zhou, W., He, X., Chen, Y., Chen, M., Shi, L., Wu, Q. Vinyl-addition copolymerization of norbornene and polar norbornene derivatives using novel bis(β-ketoamino)Ni(II)/B(C6F5)3/AlEt3 catalytic systems. J. Appl. Polym. Sci. 120 (4), 2008-2016 (2011).
- Müller, K., Jung, Y., Yoon, D. Y., Agarwal, S., Greiner, A. Vinyl-type polymerization of alkylester-substituted norbornenes without endo/exo separation. Macromol. Chem. Phys. 211 (14), 1595-1601 (2010).
- Boffa, L. S., Novak, B. M. Copolymerization of polar monomers with olefins using transition-metal complexes. Chem. Rev. 100 (4), 1479-1494 (2000).
- Funk, J. K., Andes, C. E., Sen, A. Addition Polymerization of Functionalized Norbornenes: The Effect of Size Stereochemistry, and Coordinating Ability of the Substituent. Organometallics. 23 (8), 1680-1683 (2004).
- Hennis, A. D., Polley, J. D., et al. Novel, efficient, palladium-based system for the polymerization of norbornene derivatives: Scope and mechanism. Organometallics. 20 (13), 2802-2812 (2001).
- Commarieu, B., Claverie, J. P. Bypassing the lack of reactivity of endo-substituted norbornenes with the catalytic rectification-insertion mechanism. Chem. Sci. 6 (4), 2172-2182 (2015).
- Commarieu, B., Potier, J., et al. Ultrahigh Tg epoxy thermosets based on insertion polynorbornenes. Macromoecules. 49 (3), 920-925 (2016).
- Pirrung, M. C. The Synthetic Organic Chemist's Companion. , John Wiley & Sons, Inc. (2007).
- Kanao, M., Otake, A., Tsuchiya, K., Ogino, K. Stereo-selective synthesis of 5-norbornene-2-exo-carboxylic acid-Rapid isomerization and kinetically selective hydrolysis. Int. J. Org. Chem. 2 (1), 26-30 (2012).
- Huertas, D., Florscher, M., Dragojlovic, V. Solvent-free Diels-Alder reactions of in situ generated cyclopentadiene. Green Chem. 11 (1), 91-95 (2009).
- Pierre, F., Commarieu, B., Tavares, A. C., Claverie, J. High Tg sulfonated insertion polynorbornene ionomers prepared by catalytic insertion polymerization. Polymer. 86, 91-97 (2016).
- Woo, H. G., Li, H. Advanced functional materials, Chapter 1.6.8,30. 1, Zheijiang University Press. Hangzhou. (2011).
- Kim, D. -G., Bell, A., Register, R. a Living vinyl addition polymerization of substituted norbornenes by a t-Bu3P-Ligated Methylpalladium Complex. ACS Macro Letters. 4 (3), 327-330 (2015).
- Seung, H., S, A., Baek, K., Sang, S. Low Dielectric Materials for Microelectronics. Dielectric Material. Intech, S. ilagui,M. .A. .,ed., , 59-76 (2012).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados