È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Un protocollo semplice ed efficiente per l'inserimento catalitica polimerizzazione di norborneni funzionali
In questo articolo
Riepilogo
We describe the catalytic insertion polymerization of 5-norbornene-2-carboxylic acid and 5-vinyl-2-norbornene to form functional polymers with a very high glass transition temperature.
Abstract
Norbornene può essere polimerizzato da una varietà di meccanismi, tra cui la polimerizzazione di inserimento in cui il doppio legame è polimerizzato e la natura biciclico del monomero viene conservata. Il polimero risultante, polinorbornene, ha una temperatura molto elevata di transizione vetrosa, Tg, e interessanti proprietà ottiche ed elettriche. Tuttavia, la polimerizzazione di norborneni funzionali da questo meccanismo è complicato dal fatto che la endo sostituito norbornene monomero ha, in generale, una bassa reattività. Inoltre, la separazione della endo sostituito monomero dal monomero exo è un compito noioso. Qui, presentiamo un protocollo semplice per la polimerizzazione di norborneni sostituiti (endo: eso ca. 80:20) portante sia un acido carbossilico o un doppio legame pendente. Il processo non richiede che entrambi gli isomeri separati, e procede con carichi di catalizzatore basse (da 0,01 a 0,02 moli%). I pend polimerici cuscinettodoppi legami formica possono essere ulteriormente trasformati in alto rendimento, per permettersi un cuscinetto polimero gruppi ciondolo epossidici. Queste procedure semplici possono essere applicati per preparare polynorbornenes con una varietà di gruppi funzionali, come esteri, alcoli, immidi, doppi legami, acidi carbossilici, bromo-alchili, aldeidi e anidridi.
Introduzione
Norbornene, NBE, l'addotto di Diels-Alder di etilene e ciclopentadiene (ottenuto per "cracking" di diciclopentadiene (DCPD)), è facilmente polimerizzato utilizzando la polimerizzazione a radicali liberi, 1 polimerizzazione cationica, 2 ad apertura di anello polimerizzazione via metatesi 3 e inserimento catalitico polimerizzazione. 4, 5, 6, 7 differenza degli altri meccanismi, la polimerizzazione catalitica inserimento porta alla formazione di una temperatura molto elevata di transizione vetrosa (Tg) del polimero in cui è conservata l'ossatura biciclico di NBE. Una varietà di catalizzatori come catalizzatori metallocenici e catalizzatori metallici ritardo di transizione può essere usato per promuovere la polimerizzazione di NBE. 4, 5, 6, 7 Tuttavia, a causa della sua scarsa solubilità e per le difficoltà associate alla lavorazione di altissima T g di polimero, l'omopolimero PNBE è, a nostra conoscenza, non trovato alcun uso.
Polynorbornenes funzionali (PNBEs) sono stati oggetto di notevole controllo per gli ultimi 20 anni, perché uniscono la T g alta impartita da parte dell'unità di ripetizione rigida biciclico così come le proprietà desiderabili dotati dal loro funzionalità. 8, 9, 10 monomeri NBE sono ottenuti da materie prime piuttosto semplici e poco costose, utilizzando un solo passaggio Reazione di Diels-Alder tra ciclopentadiene e un dienofilo funzionalizzato. Tuttavia, la reazione di Diels-Alder porta a due stereoisomeri, endo ed eso, che hanno molto diversa reattività. 11, 12 infatti, lo stereo endoisomero è meno reattivo forma exo e disattiva il catalizzatore. 11, 12 Così, in passato, la preparazione di polynorbornenes funzionali solitamente richiesto la separazione dei endo ed eso stereoisomeri, e solo il stereoisomero exo è stato utilizzato. Tale procedura separazione era tempo, e ha portato all'accumulo di stereoisomeri endo reagiti come rifiuti indesiderabili.
Recentemente abbiamo dimostrato che la polimerizzazione di NBEs funzionalizzati contenenti sia stereoisomeri è infatti fattibile. 13 Abbiamo così potuto preparare una varietà di PNBEs sostituiti, contenenti gruppi funzionali quali esteri, anidridi, aldeidi, immidi, alcoli e doppi legami. A causa della loro Tg e funzionalità elevata, questi polimeri presentano proprietà desiderabili. Descriviamo qui due metodi per preparare polimeri funzionali. La prima comportala sintesi dell'acqua poli polimero solubile (acido 5-norbornene-2-carbossilico), PNBE (CO 2 H), utilizzando un catalizzatore Pd cationico (Figura 1). 13, 14 Lo stesso metodo di polimerizzazione può essere utilizzato per preparare PNBEs funzionali con diverse funzionalità sospensione, come esteri, alcoli, immidi, bromo-alchili, aldeidi e anidridi. Nelle nostre mani, questo catalizzatore Pd cationico non può essere utilizzato per NBEs contenenti doppi legami pendente come 5-vinil-2-norbornene. In questo caso, un inserimento parziale del doppio legame pendente durante la polimerizzazione porta alla formazione di un materiale reticolato. Pertanto, presentiamo qui un secondo metodo dedicato alla formazione di poli (5-vinil-2-norbornene), PNBE (vinile), utilizzando Pd 2 (dba) 3: AgSbF 6: PPh 3 come nel catalizzatore situ. 14 I gruppi vinilici pendente del polimero sono poi ulteriormente epossidati, per portare a the formazione di PNBE (epossidica) (Figura 1). Entrambi PNBE (CO 2 H) e PNBE (epossidica) sono stati trovati per portare alla formazione di resine termoindurenti con una Tg alto come 350 ° C. 14 Così, il semplice metodo qui descritto permette di preparare in modo efficiente polimeri con Tg molto elevata e con una varietà di gruppi funzionali, che possono essere utilizzati per numerose applicazioni.
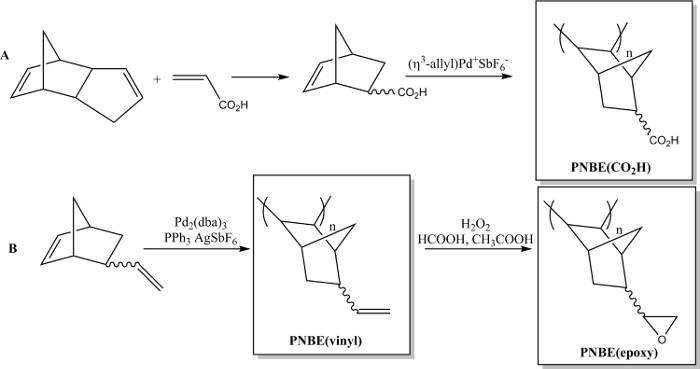
Figura 1: PNBEs funzionali preparati da Pd catalizzata polimerizzazione. (A) preparazione di PNBE (CO 2 H), (B) Preparazione di PNBE (vinile) e PNBE (epossidica). Il legame tratteggiata indica una miscela di endo ed eso isomeri. Clicca qui per vedere una versione più grande di questa fifigura.
Access restricted. Please log in or start a trial to view this content.
Protocollo
1. Preparazione di poli (acido 5-norbornene-2-carbossilico), PNBE (CO 2 H)
- Preparazione della NBE monomero (CO 2 H)
- Pesare acido acrilico (AA) (327 g, 4,5 mol, 2 eq.) E idrochinone (4,9 g, 4,5 x 10 -2 mol, 0,02 eq.) E aggiungerli a un pallone da 2 L a fondo tondo dotato di un condensatore e un ancoretta magnetica. Riscaldare il pallone a 150 ° C utilizzando un bagno di olio siliconico.
- Una volta reflusso costante, aggiungere DCPD (300 g, 2,3 moli, 1 eq.) In un'unica porzione, e quindi aumentare la temperatura a 170 ° C.
- Lasciare la reazione a questa temperatura per 16 ore. Osservare il cambiamento di colore da chiaro a giallo-marrone.
- Prelevare un campione mediante estrazione con una pipetta Pasteur e analizzarlo da 1 H NMR (usando CDCl 3 come solvente) 15. Osservare l'apparizione della NBE (segnali doppio legame tra 6,0 e 6,5 ppm, figura 2 in alto). 16
- Purificazione di NBE (CO 2 H)
- Sostituire il condensatore con una semplice configurazione di distillazione (un plateau) collegato ad un condensatore in cui viene fatta circolare acqua fredda.
- Mettere il setup reazione sotto vuoto impostato su circa. 1 mmHg. Riscaldare la miscela a 100 ° C, e raccogliere un liquido trasparente (ca. 40 mL) che può essere scartata.
- Sostituire il pallone di raccolta con un pallone a fondo rotondo da 500 ml. Riscaldare il bagno d'olio a 155 ° C, e osservare la distillazione goccia a goccia di NBE (CO 2 H) (317 g, 2,3 mol. Resa = 98%). La distillazione prende il sopravvento 7 h.
- Analizzare il liquido incolore da 1 H NMR per valutare la purezza così come endo: exo proporzioni (Figura 2, in basso). 15 Le endo: rapporto cambia exo con il tempo utilizzato per la distillazione e con il tempo di riscaldamento utilizzato per la preparazione del greggio NBE (CO 2 H). In genere, endo:exo rapporti tra 50:50 e 80:20 sono ottenuti (60:40 in questo caso).
- La polimerizzazione della NBE (CO 2 H)
- Mettere 300 g (2,3 mol, 5.000 eq.) Di NBE (CO 2 H) in un pallone a fondo rotondo da 500 ml dotato di ancoretta magnetica. Degassare il liquido facendo gorgogliare azoto per 30 min.
- Pesare allylpalladium (II) dimero cloruro, [PdCl (C 3 H 5)] 2 (76 mg, 4,2 x 10 -1 mmol, 1 eq. Di Pd) e aggiungerlo alla soluzione. Aggiungere argento antimoniato AgSbF 6 (180 mg, 5,2 x 10 -1 mmol, 1,2 eq.).
- Sotto agitazione, sciogliere il sale Pd mediante riscaldamento a 70 ° C e mantenere la temperatura a 70 ° C sotto leggero flusso di azoto. Dopo 7 a 8 h, l'agitazione si ferma a causa di un aumento della viscosità.
- Arrestare la reazione dopo 36 h.
- Raffreddare il pallone a fondo tondo con azoto liquido. Con una spatola, rompere il polimero in piccoli pezzi.
- In un becher equi 2 Lpped con ancoretta magnetica, aggiungere 750 ml di acetato di etile. Aggiungere i blocchi polimerici per l'acetato di etile sotto vigorosa agitazione. Continuare a mescolare per 2 h.
- Filtrare la soluzione più di 15 cm di diametro imbuto Buchner dotato di un filtro di carta (grado 413, 15 cm di diametro).
- Lavare il polimero con acetato di etile per tre volte (500 ml ogni lavaggio). Essiccare il polimero (123 g, 9,4 x 10 -1 mol, resa = 41%) in un vuoto a 50 ° C per 12 h.
2. Preparazione di PNBE (vinile)
- Polimerizzazione di NBE (vinile)
- Degas toluene (circa 200 ml) e NBE (vinile) (circa 200 ml) facendo gorgogliare N 2 per 30 minuti e metterli in un vano portaoggetti.
- All'interno del vano portaoggetti, carico toluene (100 g) in un pallone a fondo rotondo da 250 ml.
- Aggiungere Pd 2 (DBA) 3 (76 mg, 1,6 x 10 -1 mmol, 1 eq. Di Pd), AgSbF 6 (68 mg, 2,0 x 10 m -1mol, 1,2 eq.) e trifenilfosfina, PPh 3 (43 mg, 1,6 x 10 -1 mmol, 1 eq.) successivamente alla soluzione toluenica.
- Riscaldare la miscela a 70 ° C fino alla completa dissoluzione. Essa si verifica entro 10 minuti.
- Aggiungere 100 g (8,0 x 10 -1 mol, 5.000 eq.) Di NBE (vinile) a questa soluzione viola.
- Mescolare a 70 ° C per 72 h.
- Togliere la soluzione dal cassetto portaoggetti, e trasferire la soluzione nero vischioso, di una bottiglia di vetro da 1 L contenente una ancoretta magnetica.
- Aggiungere toluene (200 ml) e mescolare.
- Aggiungere la polvere di silice (gel di silice 40-63 micron, 10 g). Mescolare a temperatura ambiente per 16 h.
- Smettere di mescolare e lasciare che la polvere stabilirsi per almeno 2 ore in modo che le particelle di silice per sedimentate.
- Filtrare la soluzione più di 15 cm di diametro imbuto Buchner dotato di un filtro di carta (grado 413, 15 cm di diametro). Evitare di versare particelle di silice sedimentate nell'imbuto Buchner.
- Risciacquare par di siliceticelle con toluene (50 mL) e filtrare attraverso l'imbuto Buchner.
- Aggiungere metanolo (1.2 L) per un 4 L bicchiere dotato di ancoretta magnetica.
- Aggiungere tutta la soluzione toluenica contenente il polimero al metanolo gradualmente sotto vigorosa agitazione, e continuare a mescolare per 30 min.
- Filtrare il polimero più di 15 cm di diametro imbuto Buchner dotato di un filtro di carta (grado 413, 15 cm di diametro). Lavare il polimero con tre aliquote di metanolo (400 ml ciascuna). Cambiare la carta da filtro tra ogni lavaggio.
- Valutare la purezza del polimero da 1 H NMR in CDCl 3, per vedere se il monomero residuo è presente (segnali doppio legame tra 6,0 e 6,3 ppm). 15, 16 Se questo è il caso, continuare lavaggio con metanolo.
- Essiccare il polimero (75 g, 6,3 x 10 -1 mol, resa = 78%) sotto vuoto a temperatura ambiente per una notte.
3.Preparazione di PNBE (epossidica)
- Epossidazione di PNBE (vinile)
- Aggiungere 150 g di diclorometano in un pallone a fondo rotondo da 500 ml munito di agitatore magnetico e condensatore.
- Aggiungere PNBE (vinile) (15 g, 1,3 x 10 -1 mol, 1 eq.) Agitando fino a completa dissoluzione.
- Porre il pallone in un bagno di ghiaccio e lasciate raffreddare per 15 minuti.
- In un contenitore separato, mescolare acido formico (30 g, 6,5 x 10 -1 mol, 5 eq.) E acido acetico (5 g, 8,3 x 10 -2 mol, 0,6 eq.). Aggiungere gli acidi combinati alla soluzione polimerica.
- Lasciate raffreddare per 15 minuti.
- Aggiungere la soluzione di perossido di idrogeno acquoso (30%) (75 g, 6,5 x 10 -1 mol, 5 eq.) Alla soluzione di polimero.
- Mescolare per 18 h. Il bagno di ghiaccio non deve essere rimosso, come la temperatura aumenta gradualmente fino a temperatura ambiente.
- Prendete un piccolo campione, precipitare il polimero con acetone, e analizzarlo da 1 H NMR in CD Cl 3. 15 Se il segnale per il doppio legame (δ = 4.5-6.0 ppm) è sufficientemente ridotta (figura 3), passaggio alla fase successiva. Tipicamente, il rapporto tra l'integrale dei doppi legami agli altri protoni è inferiore a 1:20 (1:83 in figura 3). In caso contrario, continuare la reazione.
- Aggiungere acetone (750 ml) per un 4 L bicchiere dotato di ancoretta magnetica.
- Aggiungere la soluzione polimerica al acetone gradualmente sotto vigorosa agitazione per 15 min.
- Filtrare il polimero più di 15 cm di diametro imbuto Buchner dotato di un filtro di carta (grado 413, 15 cm di diametro).
- Lavare il polimero quattro volte con acetone (200 ml ogni volta).
- Cambiare la carta da filtro tra ogni lavaggio.
- Essiccare il polimero (7,5 g) sotto vuoto a temperatura ambiente per una notte.
g "/>
Figura 2: 1 H NMR del greggio (in alto) e purificato (in basso) NBE (CO 2 H). Il prodotto purificato viene ottenuto per semplice distillazione. Notare i picchi che vengono utilizzati per valutare l'endo: exo rapporto. Clicca qui per vedere una versione più grande di questa figura.
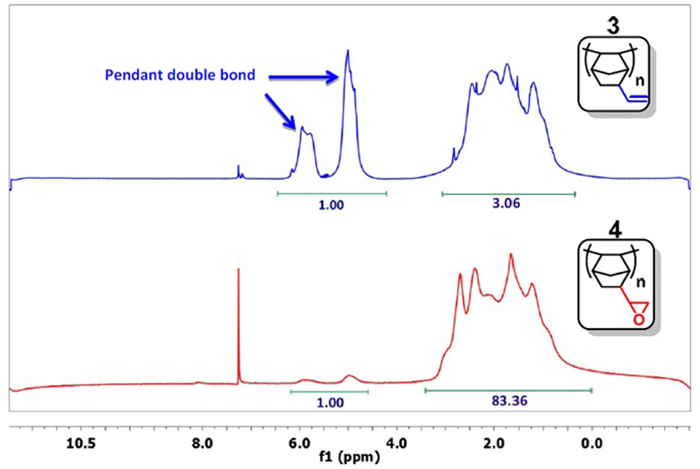
Figura 3: 1 H NMR del PNBE (vinile) (blu) e PNBE (epossidica) (rosso). Si noti il rapporto 1: 3 tra gli integrali del gruppo vinilico (δ = 4.5-6.0 ppm) e le altre protoni (vinile) Spettro PNBE. Dopo la reazione con H 2 O 2, il rapporto scende a 1:83, confermando così che epossidazione del gruppo vinilico è verificato.nk "> Clicca qui per vedere una versione più grande di questa figura.
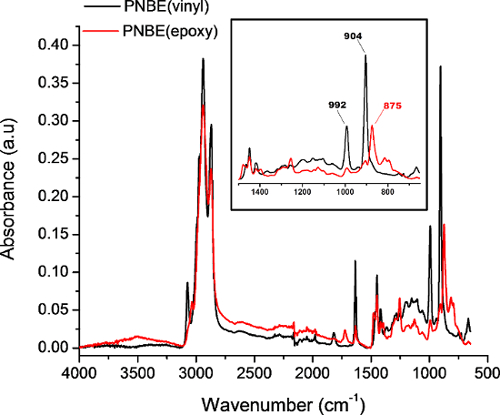
Figura 4: FTIR spettri di PNBE (vinile) (nero) e PNBE (epossidica) acquisita in modalità riflettanza totale attenuata. Inserire mostra uno zoom delle bande caratteristiche di PNBE (vinile) e PNBE (resina epossidica). Le 902 cm -1 e 992 cm -1 bande corrispondono al C = CH fuori del piano di piegatura, mentre il 875 cm -1 banda corrisponde alla deformazione anello epossidico. Clicca qui per vedere una versione più grande di questa figura.
Access restricted. Please log in or start a trial to view this content.
Risultati
I monomeri NBE vengono preparati per semplice reazione di Diels-Alder di DCPD e un dienofilo adatto, per l'acido acrilico esempio (AA). Normalmente, DCPD è rotto per produrre ciclopentadiene (CPD) prima della reazione. 17 CPD appena incrinato è poi impegnato nella reazione di Diels-Alder. Tuttavia, in questo protocollo, entrambe le fasi di cracking e di Diels-Alder vengono eseguite contemporaneamente, in una reazione one-pot. Così, non appena si forma CPD, ...
Access restricted. Please log in or start a trial to view this content.
Discussione
Il metodo proposto è semplice, e facilmente suscettibili di scale-up. Tutte le sostanze chimiche potrebbero essere utilizzati come ricevuti senza alcuna purificazione. Si noti che l'esecuzione della reazione ad una scala inferiore (ad esempio scale ≤1 g) di solito produce rese inferiori a causa di una perdita inevitabile di materiale durante la movimentazione e la raccolta.
I catalizzatori vengono formati in situ sulla reazione di composti commerciali Pd con agenti c...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
The authors acknowledge funding from Fonds de Recherche du Québec - Nature et Technologies, from Conseil Recherches en Sciences Naturelles et Génie (program INNOV) and PrimaQuébec.
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| acrylic acid | Sigma-Aldrich | 147230 | |
| hydroquinone | Sigma-Aldrich | H9003 | |
| dicyclopendadiene | Sigma-Aldrich | 454338 | |
| palladium allyl dichloride dimer | Sigma-Aldrich | 222380 | |
| silver hexfluoro antimonate | Sigma-Aldrich | 227730 | |
| liquid nitrogen | Local Facility | NA | |
| ethyl acetate | Fischer Scientific | E14520 | |
| 5-vinyl-2-norbornene | Sigma-Aldrich | 148679 | |
| toluene | Fischer Scientific | T290-4 | |
| palladium dba | Sigma-Aldrich | 227994 | |
| triphenyl phosphine | Sigma-Aldrich | 93090 | |
| silica gel 40-63 microns | Silicycle | Siliaflash | |
| methanol | Fischer Scientific | BPA412-20 | |
| dichloromethane | EMD Millipore | DX08311 | |
| formic acid | Sigma-Aldrich | F0507 | |
| acetic acid | Sigma-Aldrich | 320099 | |
| hydrogen peroxide solution | Sigma-Aldrich | 216763 | |
| acetone | Fischer Scientific | A18-200 |
Riferimenti
- Gaylord, N. G., Mandal, B. M., Martan, M. Peroxide-induced polymerization of norbornene. J. Polym. Science, Polym. Lett. Ed. 14 (9), 555-559 (1976).
- Janiak, C., Lassahn, P. G. The vinyl homopolymerization of norbornene. Macromol. Rapid Comm. 22 (7), 479-493 (2001).
- Bielawski, C. W., Grubbs, R. H. Living ring-opening metathesis polymerization. Prog. Polym. Sci. 32 (1), 1-29 (2007).
- Blank, F., Janiak, C. Metal catalysts for the vinyl/addition polymerization of norbornene. Coord. Chem. Rev. 253 (7-8), 827-861 (2009).
- Kaminsky, W., Boggioni, L., Tritto, I. Cycloolefin polymerization. Polymer Science: A Comprehensive Reference, 10 Volume Set. 3, 843-873 (2012).
- Boggioni, L., Tritto, I. State of the art of cyclic olefin polymers. MRS Bull. 38 (3), 245-251 (2013).
- Goodall, B. Cycloaliphatic polymers via late transition metal catalysis. Late Transition Metal Polymerization Catalysis. Rieger, B., Baugh, L., Kacker, S., Striegler, S. , Wiley-VCH Verlag GmbH. 101-154 (2003).
- Zhou, W., He, X., Chen, Y., Chen, M., Shi, L., Wu, Q. Vinyl-addition copolymerization of norbornene and polar norbornene derivatives using novel bis(β-ketoamino)Ni(II)/B(C6F5)3/AlEt3 catalytic systems. J. Appl. Polym. Sci. 120 (4), 2008-2016 (2011).
- Müller, K., Jung, Y., Yoon, D. Y., Agarwal, S., Greiner, A. Vinyl-type polymerization of alkylester-substituted norbornenes without endo/exo separation. Macromol. Chem. Phys. 211 (14), 1595-1601 (2010).
- Boffa, L. S., Novak, B. M. Copolymerization of polar monomers with olefins using transition-metal complexes. Chem. Rev. 100 (4), 1479-1494 (2000).
- Funk, J. K., Andes, C. E., Sen, A. Addition Polymerization of Functionalized Norbornenes: The Effect of Size Stereochemistry, and Coordinating Ability of the Substituent. Organometallics. 23 (8), 1680-1683 (2004).
- Hennis, A. D., Polley, J. D., et al. Novel, efficient, palladium-based system for the polymerization of norbornene derivatives: Scope and mechanism. Organometallics. 20 (13), 2802-2812 (2001).
- Commarieu, B., Claverie, J. P. Bypassing the lack of reactivity of endo-substituted norbornenes with the catalytic rectification-insertion mechanism. Chem. Sci. 6 (4), 2172-2182 (2015).
- Commarieu, B., Potier, J., et al. Ultrahigh Tg epoxy thermosets based on insertion polynorbornenes. Macromoecules. 49 (3), 920-925 (2016).
- Pirrung, M. C. The Synthetic Organic Chemist's Companion. , John Wiley & Sons, Inc. (2007).
- Kanao, M., Otake, A., Tsuchiya, K., Ogino, K. Stereo-selective synthesis of 5-norbornene-2-exo-carboxylic acid-Rapid isomerization and kinetically selective hydrolysis. Int. J. Org. Chem. 2 (1), 26-30 (2012).
- Huertas, D., Florscher, M., Dragojlovic, V. Solvent-free Diels-Alder reactions of in situ generated cyclopentadiene. Green Chem. 11 (1), 91-95 (2009).
- Pierre, F., Commarieu, B., Tavares, A. C., Claverie, J. High Tg sulfonated insertion polynorbornene ionomers prepared by catalytic insertion polymerization. Polymer. 86, 91-97 (2016).
- Woo, H. G., Li, H. Advanced functional materials, Chapter 1.6.8,30. 1, Zheijiang University Press. Hangzhou. (2011).
- Kim, D. -G., Bell, A., Register, R. a Living vinyl addition polymerization of substituted norbornenes by a t-Bu3P-Ligated Methylpalladium Complex. ACS Macro Letters. 4 (3), 327-330 (2015).
- Seung, H., S, A., Baek, K., Sang, S. Low Dielectric Materials for Microelectronics. Dielectric Material. Intech, S. ilagui,M. .A. .,ed., , 59-76 (2012).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon