É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Um protocolo simples e eficiente para a polimerização por inserção catalítica de norbornenos funcionais
Neste Artigo
Resumo
We describe the catalytic insertion polymerization of 5-norbornene-2-carboxylic acid and 5-vinyl-2-norbornene to form functional polymers with a very high glass transition temperature.
Resumo
Norborneno pode ser polimerizado por uma variedade de mecanismos, incluindo a polimerização de inserção através do qual a ligação dupla é polimerizada e a natureza do monómero bicíclico é conservada. A resultante polímero, polinorborneno, tem uma temperatura muito elevada de transição vítrea, Tg, e propriedades ópticas e elétricas interessantes. No entanto, a polimerização de norbornenos funcionais por este mecanismo é complicado pelo facto de o monómero de norborneno endo substituído tem, em geral, uma reactividade muito baixa. Além disso, a separação da endo substituído monómero a partir do monómero exo é uma tarefa tediosa. Aqui, apresentamos um protocolo simples para a polimerização de norbornenos substituídos (endo: exo ca. 80:20) tendo um ácido carboxílico ou uma ligação dupla pendant. O processo não requer que ambos os isómeros ser separada, e prossegue com baixas cargas de catalisador (0,01 a 0,02 mol%). Os pend polímero tendoligações duplas formigas podem ser ainda transformado com um rendimento elevado, para se obter um rolamento de polímero epoxi grupos pendentes. Estes procedimentos simples pode ser aplicado para preparar polynorbornenes com uma variedade de grupos funcionais, tais como ésteres, álcoois, imidas, ligações duplas, ácidos carboxílicos, bromo-alquilos, aldeídos e anidridos.
Introdução
Norborneno, NBE, o aducto de Diels-Alder de etileno e ciclopentadieno (obtido por "cracking" de diciclopentadieno (DCPD)), é facilmente polimerizada utilizando quer polimerização de radicais livres, uma catiónico de polimerização, 2 de abertura de anel de metátese de polimerização 3 e inserção catalítica polimerização. 4, 5, 6, 7 Ao contrário dos outros mecanismos, a polimerização de inserção catalítico leva à formação de uma temperatura muito alta de transição vítrea (Tg) do polímero em que a espinha dorsal bicíclico de NBE é conservada. Uma variedade de catalisadores tais como catalisadores de metaloceno e catalisadores de metais de transição tardia pode ser usado para promover a polimerização de NBE. 4, 5, 6, 7 No entanto, devido à sua baixa solubilidade e devido a dificuldades associadas com o processamento de um polímero muito alto T g, o homopolímero PNBE tem, a nosso conhecimento, nunca encontrou qualquer uso.
Polynorbornenes funcionais (PNBEs) têm sido o objecto de controlo considerável durante os últimos 20 anos, porque eles combinam a alta Tg transmitida pela unidade de repetição rígida bicíclico, bem como as propriedades desejáveis dotados pelo funcionalidades. 8, 9, 10 monômeros NBE são obtidos a partir de matérias-primas bastante simples e de baixo custo, utilizando um único passo de reacção Diels-Alder entre ciclopentadieno e um dienófilo funcionalizado. No entanto, a reacção de Diels-Alder leva a dois estereoisómeros, endo e exo, que têm muito diferentes reactividades. 11, 12 Na verdade, o aparelho de som endoisômero é menos reativo que forma exo e desactiva o catalisador. 11, 12 Deste modo, no passado, a preparação de polynorbornenes funcionais geralmente necessária a separação dos estereoisómeros endo e exo, e utilizou-se apenas ao estereoisómero exo. Tal procedimento de separação era demorado, e conduziu à acumulação de estereoiseros endo que não reagiram como resíduos indesejáveis.
Recentemente mostrámos que a polimerização de SENV funcionalizados contendo ambos os estereoisómeros é de facto viável. 13 Temos, assim, sido capazes de preparar uma variedade de PNBEs substituídos, contendo grupos funcionais tais como ésteres, anidridos, aldeídos, álcoois e imidas, ligações duplas. Devido à sua elevada Tg e funcionalidade, estes polímeros apresentam propriedades desejáveis. Descrevemos aqui dois métodos para preparar polímeros funcionais. O primeiro leva àa síntese do polímero solúvel em água poli (ácido 5-norborneno-2-carboxílico), PNBE (CO 2 H), utilizando um catalisador de Pd catiónico (Figura 1). 13, 14 se o mesmo método de polimerização pode ser usado para preparar PNBEs funcionais com diversas funcionalidades pendentes, tais como ésteres, álcoois, imidas, bromo-alquilos, aldeídos e anidridos. Nas nossas mãos, este catalisador de Pd não catiónico pode ser usado para SENV contendo pingente ligações duplas tais como o 5-vinil-2-norborneno. Neste caso, uma inserção parcial da ligação dupla pingente durante a polimerização conduz à formação de um material reticulado. Por conseguinte, apresenta-se aqui um segundo método dedicada à formação de poli (5-vinil-2-norborneno), PNBE (vinilo), utilizando-se Pd 2 (dba) 3: 6 AgSbF: PPh3 como um catalisador em si tu. 14 Os grupos vinilo pendentes do polímero são, então, ainda mais epoxidado, para levar a the formação de PNBE (epoxy) (Figura 1). Ambos PNBE (CO 2 H) e PNBE (epóxi) foram encontrados para levar à formação de resinas termoendurecíveis com uma Tg tão elevada como 350 ° C. 14 Assim, o método simples descrito aqui permite uma eficiente para preparar polímeros com uma elevada Tg, e tendo uma variedade de grupos funcionais, que podem ser utilizados para inúmeras aplicações.
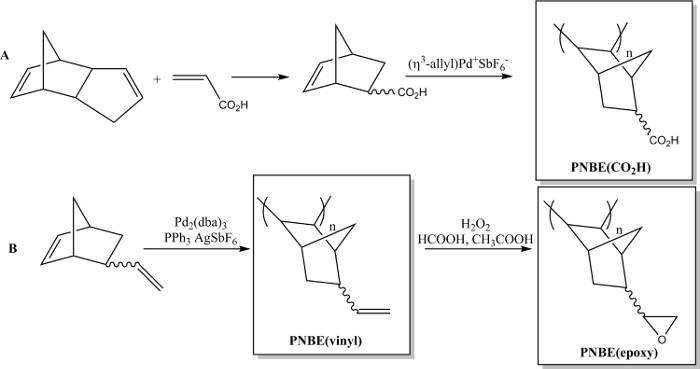
Figura 1: PNBEs funcionais preparados por polimerização catalisada por Pd. (A) Preparação de PNBE (CO 2 H), (B) preparação de PNBE (vinilo) e PNBE (epoxi). A ligação a tracejado indica uma mistura de isómeros endo e exo. Por favor clique aqui para ver uma versão maior desta figura.
Access restricted. Please log in or start a trial to view this content.
Protocolo
1. Preparação de Poli (ácido 5-norborneno-2-carboxílico), PNBE (CO 2 H)
- Preparação do monómero NBE (CO 2 H)
- Pesar o ácido acrílico (AA) (327 g, 4,5 mol, 2 eq.) E hidroquinona (4,9 g, 4,5 x 10 -2 mole, 0,02 eq.) E adiciona-los a um balão de 2 L de fundo redondo equipado com um condensador e uma barra de agitação magnética. Aquecer o balão a 150 ° C utilizando um banho de óleo de silicone.
- Uma vez que o refluxo seja resolvido, adicionar DCPD (300 g, 2,3 mol, 1 eq.) Numa única porção, e depois aumentar a temperatura para 170 ° C.
- Deixar a reacção a esta temperatura durante 16 h. Observe a mudança de cor de claro a castanho-amarelado.
- Retirar uma amostra de extracção com uma pipeta de Pasteur, e analisá-las por 1 H RMN (CDCl 3 usando como solvente) 15. Observe a aparição de NBE (sinais dupla ligação entre 6,0 e 6,5 ppm, a Figura 2 em cima). 16
- Purificação de NBE (CO 2 H)
- Substituir o condensador com uma instalação de destilação simples (um plateau), ligado a um condensador de água fria no qual é circulado.
- Coloque a configuração de reacção sob vácuo ajustado para aprox. 1 mmHg. Aquecer a mistura a 100 ° C, e recolher um líquido claro (cerca de 40 mL) que pode ser descartado.
- Substitua o frasco de coleta com um balão de fundo redondo de 500 mL. Aquece-se a banho de óleo a 155 ° C, e de observar a destilação gota a gota de NBE (CO 2 H) (317 g, 2,3 mol. Rendimento = 98%). A destilação assume 7 h.
- Analisar o líquido incolor por 1H RMN para avaliar a pureza, bem como endo: exo proporções (Figura 2, parte inferior). 15 As endo: exo relação muda com o tempo utilizado para a destilação, bem como com o tempo de aquecimento utilizado para a preparação do NBE bruto (CO 2 H). Tipicamente, endo:exo proporções entre 50:50 e 80:20 são obtidos (60:40, neste caso).
- Polimerização de NBE (CO 2 H)
- Colocar 300 g (2,3 mol, 5,000 eq.) De NBE (CO 2 H) num frasco de fundo redondo de 500 mL equipado com uma barra de agitação magnética. Desgasificar o líquido por borbulhamento de azoto durante 30 min.
- Pesar alilpaládio (II) dimero de cloreto, [PdCl (C 3 H 5)] 2 (76 mg, 4,2 x 10 -1 mmol, 1 eq. De Pd) e adicioná-lo para a solução. Adicionar antimonato de prata AgSbF 6 (180 mg, 5,2 x 10 -1 mmol, 1,2 eq.).
- Sob agitação, dissolve-se o sal de Pd por aquecimento a 70 ° C, e manter a temperatura a 70 ° C sob um ligeiro fluxo de azoto. Depois de 7 a 8 h, a agitação pára devido a um aumento da viscosidade.
- Parar a reacção após 36 h.
- Arrefecer o balão de fundo redondo com nitrogênio líquido. Com uma espátula, quebrar o polímero em pedaços pequenos.
- Numa proveta de 2 litros equiPPED com uma barra de agitação magnética, adicionar 750 ml de acetato de etilo. Adicionar os pedaços de polímero para o acetato de etilo sob agitação vigorosa. Continuar a agitação durante 2 h.
- Filtrar a solução através de 15 cm de diâmetro funil de Buchner equipado com um filtro de papel (grau 413, a 15 cm de diâmetro).
- Lavar o polímero com acetato de etilo três vezes (500 ml cada lavagem). Seca-se o polímero (123 g, 9,4 x 10 -1 mol, rendimento = 41%) num forno de vácuo regulado a 50 ° C durante 12 h.
2. Preparação de PNBE (vinil)
- Polimerização de NBE (vinil)
- Desgaseifica tolueno (ca. 200 mL) e NBE (vinil) (ca. 200 mL) borbulhando com N 2 durante 30 min e colocá-los numa caixa de luvas.
- Dentro da caixa de luva, tolueno carga (100 g) num balão de fundo redondo de 250 mL.
- Adicionar Pd 2 (dba) 3 (76 mg, 1,6 x 10 -1 mmol, 1 eq. De Pd), AgSbF 6 (68 mg, 2,0 x 10 -1 mmol, 1,2 eq.) e trifenilfosfina, PPh3 (43 mg, 1,6 x 10 -1 mmol, 1 eq.) sucessivamente à solução de tolueno.
- Aquecer a mistura a 70 ° C até ocorrer dissolução completa. Ela ocorre dentro de 10 min.
- Adicionam-se 100 g (8,0 x 10 -1 mol, 5,000 eq.) De NBE (vinil) a esta solução de cor púrpura.
- Agita-se a 70 ° C durante 72 h.
- Remover a solução a partir da caixa de luvas, e transferir a solução preto viscoso para um frasco de vidro de 1 L contendo uma barra de agitação magnética.
- Adicionar tolueno (200 mL) e agitar.
- Adicionar pó de sílica (gel de sílica 40-63 um, 10 g). Agita-se à temperatura ambiente durante 16 h.
- Parar de se agitar e deixar que o pó assentar durante pelo menos 2 h a fim de que as partículas de sílica para sedimentate.
- Filtrar a solução através de 15 cm de diâmetro funil de Buchner equipado com um filtro de papel (grau 413, a 15 cm de diâmetro). Evitar derramar partículas de sílica sedimentadas no funil de Buchner.
- Lavar a sílica partigos com tolueno (50 mL) e filtrar através de funil de Buchner.
- Adicionar metanol (1,2 L) para uma proveta de 4 L equipado com uma barra de agitação magnética.
- Adicionar toda a solução de tolueno contendo o polímero para o metanol, gradualmente, sob agitação vigorosa, e continuar a agitar durante 30 min.
- Filtra-se o polímero de mais de 15 cm de diâmetro funil de Buchner equipado com um filtro de papel (grau 413, a 15 cm de diâmetro). Lavar o polímero com três aliquotas de metanol (400 mL cada). Mudar o papel de filtro entre cada lavagem.
- Avaliar a pureza de polímeros por RMN de 1H em CDCl3, a fim de ver se o monómero residual é presentes sinais (ligação dupla entre 6,0 e 6,3 ppm). 15, 16, se este for o caso, continuar a lavagem com metanol.
- Seca-se o polímero (75 g, 6,3 x 10 -1 mol, rendimento = 78%) sob vácuo à temperatura ambiente durante a noite.
3.Preparação do PNBE (epoxy)
- Epoxidação do PNBE (vinil)
- Adicionar 150 g de diclorometano num balão de fundo redondo de 500 mL equipado com um agitador magnético e um condensador.
- Adicionar PNBE (vinil) (15 g, 1,3 x 10 -1 mol, 1 eq.), Com agitação, até à dissolução completa.
- Colocar o balão num banho de gelo e deixe-o esfriar por 15 min.
- Num recipiente separado, misturam ácido fórmico (30 g, 6,5 x 10 -1 mol, 5 eq.) E ácido acético (5 g, 8,3 x 10 -2 mole, 0,6 eq.). Adicionar os ácidos combinados com a solução de polímero.
- Deixe-o esfriar por 15 min.
- Adicionar solução aquosa de peróxido de hidrogénio (30%) (75 g, 6,5 x 10 -1 mol, 5 eq.) À solução de polímero.
- Agita-se durante 18 h. O banho de gelo não necessita de ser removido, como a temperatura vai aumentar gradualmente até à temperatura ambiente.
- Dê uma pequena amostra, precipitar o polímero com acetona, e analisá-lo por 1 H RMN em CD Cl 3. 15 Se o sinal para a ligao dupla (δ = 4,5-6,0 ppm) é suficientemente diminuída (Figura 3), passar para a etapa seguinte. Tipicamente, a proporção do integral das ligações duplas para os outros protões é inferior a 01:20 (1:83 na Figura 3). Caso contrário, continue a reação.
- Adicionar acetona (750 ml) para uma proveta de 4 L equipado com uma barra de agitação magnética.
- Adicionar a solução de polímero para a acetona, gradualmente, sob agitação vigorosa durante 15 min.
- Filtra-se o polímero de mais de 15 cm de diâmetro funil de Buchner equipado com um filtro de papel (grau 413, a 15 cm de diâmetro).
- Lavar os polímeros quatro vezes com acetona (200 mL de cada vez).
- Mudar o papel de filtro entre cada lavagem.
- Seca-se a polímero (7,5 g) sob vácuo à temperatura ambiente durante a noite.
g "/>
Figura 2: 1 H RMN Os espectros de (topo) e purificada (em baixo) NBE (CO 2 H). O produto purificado é obtido por destilação simples. Nota os picos que são usados para avaliar a endo: exo proporção. Por favor clique aqui para ver uma versão maior desta figura.
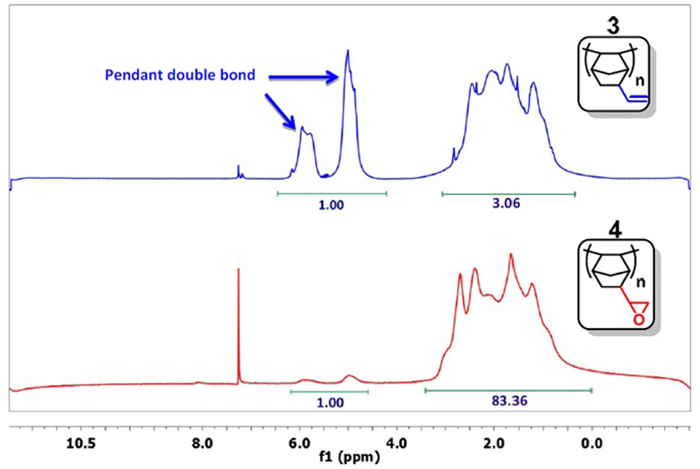
Figura 3: 1 H RMN Os espectros de PNBE (vinil) (azul) e PNBE (epoxy) (vermelho). Note-se a relação de 1: 3 entre os integrais do grupo vinilo (δ = 4,5-6,0 ppm) e os outros protões no PNBE (vinil) espectro. Após a reacção com H 2 O 2, a proporção diminui a 1:83, confirmando assim que a epoxidação do grupo vinilo ocorreu.nk "> Por favor, clique aqui para ver uma versão maior desta figura.
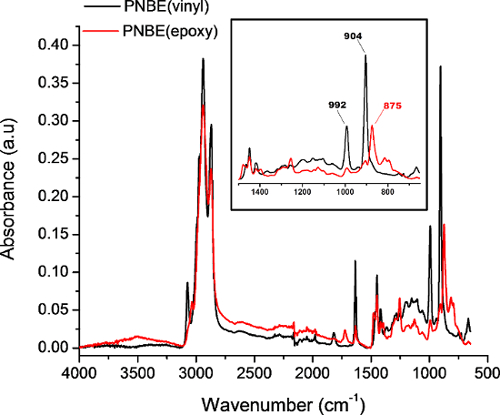
Figura 4: FTIR espectros do PNBE (vinil) (preto) e PNBE (epoxy) obtido em modo de reflectância total atenuada. Inserir mostra um zoom das bandas características de PNBE (vinil) e PNBE (epóxi). Os 902 cm -1 e 992 cm -1 bandas correspondem a C = CH para fora do plano de dobragem, ao passo que a 875 cm -1 banda corresponde à deformação do anel epóxido. Por favor clique aqui para ver uma versão maior desta figura.
Access restricted. Please log in or start a trial to view this content.
Resultados
Os monómeros NBE são preparados por simples reacção de Diels-Alder de DCPD e um dienófilo adequado, por exemplo ácido acrílico (AA). Normalmente, DCPD está rachado para produzir ciclopentadieno (CPD) antes da reação. 17 CPD recentemente rachado é então envolvido na reação de Diels-Alder. No entanto, neste protocolo, ambas de craqueamento e de Diels-Alder passos são realizados concomitantemente, numa reacção num só reactor. Assim, logo que o CPD ?...
Access restricted. Please log in or start a trial to view this content.
Discussão
O método proposto aqui é simples, e prontamente passível de scale-up. Todos os produtos químicos podem ser utilizados tal como recebidos sem purificação. Note-se que realizando a reacção a uma escala menor (por exemplo escalas ≤1 g) geralmente produz rendimentos mais baixos devido a uma perda inevitável de material durante o manuseamento e a recolha.
Os catalisadores são formados in situ mediante a reacção de compostos de Pd comerciais com agentes de cationiza...
Access restricted. Please log in or start a trial to view this content.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
The authors acknowledge funding from Fonds de Recherche du Québec - Nature et Technologies, from Conseil Recherches en Sciences Naturelles et Génie (program INNOV) and PrimaQuébec.
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| acrylic acid | Sigma-Aldrich | 147230 | |
| hydroquinone | Sigma-Aldrich | H9003 | |
| dicyclopendadiene | Sigma-Aldrich | 454338 | |
| palladium allyl dichloride dimer | Sigma-Aldrich | 222380 | |
| silver hexfluoro antimonate | Sigma-Aldrich | 227730 | |
| liquid nitrogen | Local Facility | NA | |
| ethyl acetate | Fischer Scientific | E14520 | |
| 5-vinyl-2-norbornene | Sigma-Aldrich | 148679 | |
| toluene | Fischer Scientific | T290-4 | |
| palladium dba | Sigma-Aldrich | 227994 | |
| triphenyl phosphine | Sigma-Aldrich | 93090 | |
| silica gel 40-63 microns | Silicycle | Siliaflash | |
| methanol | Fischer Scientific | BPA412-20 | |
| dichloromethane | EMD Millipore | DX08311 | |
| formic acid | Sigma-Aldrich | F0507 | |
| acetic acid | Sigma-Aldrich | 320099 | |
| hydrogen peroxide solution | Sigma-Aldrich | 216763 | |
| acetone | Fischer Scientific | A18-200 |
Referências
- Gaylord, N. G., Mandal, B. M., Martan, M. Peroxide-induced polymerization of norbornene. J. Polym. Science, Polym. Lett. Ed. 14 (9), 555-559 (1976).
- Janiak, C., Lassahn, P. G. The vinyl homopolymerization of norbornene. Macromol. Rapid Comm. 22 (7), 479-493 (2001).
- Bielawski, C. W., Grubbs, R. H. Living ring-opening metathesis polymerization. Prog. Polym. Sci. 32 (1), 1-29 (2007).
- Blank, F., Janiak, C. Metal catalysts for the vinyl/addition polymerization of norbornene. Coord. Chem. Rev. 253 (7-8), 827-861 (2009).
- Kaminsky, W., Boggioni, L., Tritto, I. Cycloolefin polymerization. Polymer Science: A Comprehensive Reference, 10 Volume Set. 3, 843-873 (2012).
- Boggioni, L., Tritto, I. State of the art of cyclic olefin polymers. MRS Bull. 38 (3), 245-251 (2013).
- Goodall, B. Cycloaliphatic polymers via late transition metal catalysis. Late Transition Metal Polymerization Catalysis. Rieger, B., Baugh, L., Kacker, S., Striegler, S. , Wiley-VCH Verlag GmbH. 101-154 (2003).
- Zhou, W., He, X., Chen, Y., Chen, M., Shi, L., Wu, Q. Vinyl-addition copolymerization of norbornene and polar norbornene derivatives using novel bis(β-ketoamino)Ni(II)/B(C6F5)3/AlEt3 catalytic systems. J. Appl. Polym. Sci. 120 (4), 2008-2016 (2011).
- Müller, K., Jung, Y., Yoon, D. Y., Agarwal, S., Greiner, A. Vinyl-type polymerization of alkylester-substituted norbornenes without endo/exo separation. Macromol. Chem. Phys. 211 (14), 1595-1601 (2010).
- Boffa, L. S., Novak, B. M. Copolymerization of polar monomers with olefins using transition-metal complexes. Chem. Rev. 100 (4), 1479-1494 (2000).
- Funk, J. K., Andes, C. E., Sen, A. Addition Polymerization of Functionalized Norbornenes: The Effect of Size Stereochemistry, and Coordinating Ability of the Substituent. Organometallics. 23 (8), 1680-1683 (2004).
- Hennis, A. D., Polley, J. D., et al. Novel, efficient, palladium-based system for the polymerization of norbornene derivatives: Scope and mechanism. Organometallics. 20 (13), 2802-2812 (2001).
- Commarieu, B., Claverie, J. P. Bypassing the lack of reactivity of endo-substituted norbornenes with the catalytic rectification-insertion mechanism. Chem. Sci. 6 (4), 2172-2182 (2015).
- Commarieu, B., Potier, J., et al. Ultrahigh Tg epoxy thermosets based on insertion polynorbornenes. Macromoecules. 49 (3), 920-925 (2016).
- Pirrung, M. C. The Synthetic Organic Chemist's Companion. , John Wiley & Sons, Inc. (2007).
- Kanao, M., Otake, A., Tsuchiya, K., Ogino, K. Stereo-selective synthesis of 5-norbornene-2-exo-carboxylic acid-Rapid isomerization and kinetically selective hydrolysis. Int. J. Org. Chem. 2 (1), 26-30 (2012).
- Huertas, D., Florscher, M., Dragojlovic, V. Solvent-free Diels-Alder reactions of in situ generated cyclopentadiene. Green Chem. 11 (1), 91-95 (2009).
- Pierre, F., Commarieu, B., Tavares, A. C., Claverie, J. High Tg sulfonated insertion polynorbornene ionomers prepared by catalytic insertion polymerization. Polymer. 86, 91-97 (2016).
- Woo, H. G., Li, H. Advanced functional materials, Chapter 1.6.8,30. 1, Zheijiang University Press. Hangzhou. (2011).
- Kim, D. -G., Bell, A., Register, R. a Living vinyl addition polymerization of substituted norbornenes by a t-Bu3P-Ligated Methylpalladium Complex. ACS Macro Letters. 4 (3), 327-330 (2015).
- Seung, H., S, A., Baek, K., Sang, S. Low Dielectric Materials for Microelectronics. Dielectric Material. Intech, S. ilagui,M. .A. .,ed., , 59-76 (2012).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados