Method Article
Polidimetilsiloxano-policarbonato celular dispositivos de microfluidos para Estudios de Inmigración en virtud perpendicular Química y gradientes de oxígeno
En este artículo
Resumen
The control of chemical and oxygen gradients is essential for cell cultures. This paper reports a polydimethylsiloxane-polycarbonate (PDMS-PC) microfluidic device capable of reliably generating combinations of chemical and oxygen gradients for cell migration studies, which can be practically utilized in biological labs without sophisticated instrumentation.
Resumen
Este artículo informa de un dispositivo de microfluidos hecho de polidimetilsiloxano (PDMS) con un policarbonato incorporado (PC) de película delgada para estudiar la migración celular en combinaciones de gradientes químicos y oxígeno. Ambos gradientes químicos y de oxígeno pueden afectar en gran medida la migración celular in vivo; Sin embargo, debido a limitaciones técnicas, muy poca investigación se ha realizado para investigar sus efectos in vitro. El dispositivo desarrollado en esta investigación se aprovecha de una serie de canales en forma de serpentina para generar los gradientes químicos deseados y explota un procedimiento de reacción química espacialmente confinados para la generación de gradiente de oxígeno. Las direcciones de los gradientes químicos y de oxígeno son perpendiculares entre sí para permitir la interpretación directa resultado la migración. Con el fin de generar eficientemente los gradientes de oxígeno con consumo de productos químicos mínima, la película delgada PC embebido se utiliza como una barrera de difusión de gas. El dispositivo de microfluidos desarrolladopuede ser accionado por bombas de jeringa y se colocaron en un incubador de células convencional durante los experimentos de migración celular para permitir la simplificación de instalación y condiciones de cultivo celular optimizados. En los experimentos de células, se utilizó el dispositivo para estudiar las migraciones de las células alveolares humanos adenocarcinomic basales epiteliales, A549, bajo combinaciones de quimioquinas (factor derivado de células del estroma, SDF-1α) y los gradientes de oxígeno. Los resultados experimentales muestran que el dispositivo puede generar de forma estable de quimioquinas y oxígeno gradientes perpendiculares y es compatible con las células. Los resultados del estudio indican que la migración gradientes de oxígeno pueden desempeñar un papel esencial en la orientación de la migración celular, y el comportamiento celular bajo combinaciones de gradientes no se pueden predecir a partir de los cuales son menores gradientes individuales. El dispositivo proporciona una herramienta poderosa y práctica para los investigadores para estudiar las interacciones entre los gradientes químicos y oxígeno en el cultivo de células, lo que puede promover mejores estudios de migración celular en más in vivo -como microenviam-.
Introducción
La distribución espacial de factores solubles y la tensión de oxígeno puede regular un número de funciones celulares importantes in vivo 1, 2, 3, 4. Con el fin de investigar mejor su efecto sobre las células, es muy deseada una plataforma de cultivo celular vitro en capaz de generar de forma estable gradientes químicos y oxígeno. Varios factores solubles desempeñan un papel clave en las actividades biológicas y afectan el comportamiento celular. Recientemente, debido al avance de las técnicas de microfluidos, un número de dispositivos de microfluidos capaz de generar de forma estable gradientes químicos se han desarrollado para estudiar la migración celular 5. Además, varios estudios también han revelado la necesidad de la tensión de oxígeno para los cultivos celulares in vitro 6, 7, 8. Sin embargo,el control de la tensión de oxígeno para el cultivo celular se basa principalmente en la adición química directa para la eliminación de oxígeno o de células incubadoras con cilindros de gas a presión. Además química directa altera el medio de cultivo celular y afecta a las respuestas celulares. incubadoras de control de oxígeno requieren un diseño especial incubadora, control de flujo de gas precisa, y un gran volumen de gas nitrógeno con el fin de lograr condiciones de hipoxia. Por otra parte, no es factible para el control de la distribución espacial de oxígeno usando esta configuración, que retarda el estudio el comportamiento celular bajo diferentes tensiones de oxígeno y gradientes. Para superar estas limitaciones, un número de dispositivos microfluídicos se han desarrollado para generar gradientes de oxígeno para aplicaciones de cultivo celular 9. Sin embargo, la mayoría de ellos son operadas con gases a presión, que pueden causar problemas de evaporación y generación de burbujas. Por lo tanto, a menudo requieren instrumentación sofisticada y pueden no ser confiables para Studie de cultivo celular a largo plazos.
Para superar los retos y seguir estudiando las interacciones entre los gradientes químicos y oxígeno para la migración celular, hemos desarrollado un dispositivo de cultivo de células de microfluidos hecho de polidimetilsiloxano (PDMS) con un policarbonato incrustado (PC) de película delgada 10. El dispositivo se compone de dos capas de canales de microfluidos separadas por una membrana de PDMS. La capa superior es una capa de PDMS-PC para la generación de gradiente de oxígeno; la capa inferior está hecha de PDMS para la generación de gradiente químico y cultivo celular. El dispositivo puede generar simultáneamente gradientes químicos y oxígeno perpendiculares sin el uso de cilindros de gas y sistemas de control de flujo sofisticados. En el dispositivo, PDMS proporciona gran transparencia óptica, permeabilidad a los gases, y la compatibilidad biológica para el cultivo celular y de formación de imágenes. La película PC embebido sirve como una barrera de difusión de gas para el control de la tensión de oxígeno eficiente. En el canal de microfluidos, se utilizó una serie de canal en forma de serpentinas para generar gradientes químicos. El diseño ha sido ampliamente explotados para generar gradientes químicos en dispositivos de microfluidos para diversas aplicaciones debido a su fiabilidad y la configuración experimental fácil. Además, los perfiles de gradiente químico se pueden diseñar mediante la variación de las geometrías de canal de antemano con simulación numérica. Para la generación de oxígeno gradiente, tomamos ventaja del método de reacción química en el espacio confinado que fue desarrollado previamente en nuestro laboratorio 10, 11, 12. El oxígeno puede ser rescatados de las áreas designadas sin purga de nitrógeno. Para uso práctico en los laboratorios biológicos, toda la configuración experimental es compatible con las incubadoras de cultivo celular convencionales. Mediante la integración de estos métodos, se puede generar simultáneamente gradientes químicos y oxígeno estables sin cilindros de gas a granel y la instrumentación sofisticada con el fin de estudiar la migración celular.
Protocolo
1. La fabricación del dispositivo de microfluidos
NOTA: Todo el dispositivo de microfluidos se fabrica mediante el proceso de moldeo de litografía blanda réplica de 13.
- Fabrication de moldes para la capas PDMS en la dispositivo de microfluidos
- Diseñar los patrones de los canales de microfluidos utilizando comercialmente disponible ilustración o el software de dibujo. Enviar el archivo a una empresa de alta resolución de la transparencia fotomáscara imprimir 14.
- Obleas de silicio limpio con acetona (≥99.5%), alcohol isopropílico (IPA; ≥99.9%), y grabado de óxido tamponado (BOE; 6: 1 NH4 F.HF). Enjuague con agua desionizada (DI) y deshidratar la oblea con una pistola de nitrógeno.
- capa de la vuelta aproximada 20 g de resina fotosensible tono negativo, SU-8 2050, sobre las obleas a 500 rpm durante 15 seg y luego 2.000 rpm durante 30 seg.
NOTA: La condición de recubrimiento por rotación debe ceder SU-8 2050 fotoresistir capas con un espesor de aproximadamente 75 micras en las obleas después de la litografía óptica. - hornear suave las obleas sobre una placa de cocción de 65 ° C durante 3 minutos y luego a 95 ° C durante 9 minutos. Después de la cocción suave, exponer las obleas utilizando un alineador de máscara con las máscaras de transparencia diseñados bajo luz UV; la energía total de exposición debe ser de aproximadamente 300 mJ / cm 2. bake post-exposición (PEB) las obleas a 65 ° C durante 2 min y luego a 95 ° C durante 7 min.
- Después de la PEB, sumergir las obleas en SU-8 desarrollador con fuerte agitación o en un baño de ultrasonidos (37 kHz y 180 W de potencia ultrasónica eficaz) para 7 min. Enjuague la oblea con acetona e IPA para eliminar el residuo de SU-8.
- Coloque la oblea y 100 l de silano (1H, 1H, 2H, 2H-perfluorooctyltrichlorosilane) en un diámetro del plato 6 cm Petri en un desecador conectado con una bomba de vacío de diafragma de oblea superficie silanización con el fin de evitar la unión no deseada. Encienda la bomba durante 15 minutos, apagarloY sellar el desecador con un vacío durante 30 minutos.
- Tomar las obleas silanizados fuera del desecador y pegarlas a 15 cm de diámetro platos de Petri para el siguiente proceso de litografía blanda:
- Fabricación y montaje de capas PDMS
- Preparación de la pre-polímero PDMS
- Mezcla de monómeros PDMS (base) y el agente de curado en una relación de 10: 1 (v / v). Desgasificar la mezcla en la configuración desecador durante 60 min.
- La fabricación de la capa superior de PC embebido
- Transferencia de 2 g de los PDMS pre-polímero sobre el molde con los patrones de canal fluídico de la capa superior para hacer una fina capa de PDMS. Colocar el molde en la configuración desecador para desgasificar el PDMS durante 60 minutos.
- Coloque la noche a la mañana molde en un horno a 60 ° de PDMS curado. Asegúrese de que el molde está en un plano horizontal.
- Enfriar el molde a temperatura ambiente. Verter un 13 g más de PDMS pre-polímero sobre el molde y desgasificar el PDMS en THconfiguración e desecador durante 60 minutos.
- Lentamente incrustar una película de PC de espesor 1 mm en la capa de PDMS fresco como una barrera de difusión de gas; expulsar cualquier burbuja de si es necesario.
- Poner el molde durante la noche en el horno a 60 ° C, y asegúrese de que está en un plano horizontal.
- Enfriar el PDMS curado a temperatura ambiente. Cortar el dispositivo con un bisturí para una superficie aproximada de 5,5 x 5 cm 2, que puede cubrir todos los patrones de canal, y se desprenda la losa PDMS del molde.
- Hacer agujeros para entradas y salidas utilizando un punzón de biopsia de 2 mm de diámetro. Almacenar la capa de PDMS-PC superior fabricada lejos del polvo ambiental para el montaje posterior.
- La fabricación de la capa de PDMS inferior
- Verter 11 g de la pre-polímero PDMS sobre el molde para la capa inferior. Colocar el molde en el desecador para desgasificar el PDMS durante 60 minutos. Mantenga la noche a la mañana molde en un horno de 60 ° C para curar los PDMS. Asegúrese de que se ha quedado en un plano horizontal.
- Enfriar THe PDMS a temperatura ambiente. Cortar el dispositivo a una superficie aproximada de 5,5 x 5 cm 2, que puede cubrir todos los patrones de canal, y despegarlo del molde. Almacenar la capa de PDMS inferior fabricada lejos del polvo ambiental para el montaje posterior.
- La fabricación de la membrana de PDMS
- capa de la vuelta aproximada 4 g de PDMS pre-polímero sobre una oblea en blanco silanizada a 100 rpm durante 90 seg y luego 3.000 rpm durante 4 s. Hornear la oblea spin-revestido en un horno a 60 ° C durante la noche.
- Montaje del dispositivo
- Coloque la capa superior de PDMS-PC fabricado y la oblea con la membrana de PDMS mediante revestimiento por centrifugación en una máquina de tratamiento de superficie de plasma 2 O con las superficies de unión hacia arriba. El tratamiento de las superficies de PDMS con 90 W de plasma de O2 durante 40 segundos.
- Unir la capa superior sobre la membrana de PDMS justo después del tratamiento superficial de plasma de O2. Coloque un peso (aproximadamente 600 g) en la parte superior de las capas unidas y ponerlos en una60 ° C durante la noche horno para promover la unión.
- Enfriar las capas unidas a temperatura ambiente y cortar la membrana unida a la capa superior con un bisturí a un área de aproximadamente 5,5 x 5 cm 2, que puede cubrir todos los patrones de canal. Despegar la estructura unida de la oblea de silicio y perforar agujeros en las entradas y la salida del canal de gradiente químico usando un punzón de biopsia de 2 mm de diámetro.
- Coloque la capa superior de la membrana unidos y la capa inferior PDMS fabricadas en la máquina de tratamiento de superficies 2 plasma O, con las superficies de unión hacia arriba, para activar las superficies de PDMS utilizando el plasma a 90 W durante 40 segundos.
- Una las capas superior e inferior juntos para unir inmediatamente después del tratamiento de superficie. Coloque un peso (aproximadamente 600 g) en la parte superior de todo el dispositivo de servidumbre y lo puso en un horno a 60 ° C durante la noche.
- Tome todo el dispositivo fabricado fuera del horno y enfriar a temperatura ambiente.
- Preparación de la pre-polímero PDMS
2. Ensayo de migración de células de microfluidos
NOTA: En este documento, usamos una línea celular de uso común, adenocarcinomic alveolar de células epiteliales basales humano (A549), y una quimiocina, factor de células del estroma derivadas (SDF-1α), como ejemplos. Para los investigadores que trabajan en otras células y quimiocinas, por favor, ajuste los procesos experimentales en consecuencia.
- Día 0: Preparación de las células
- Cultura el stock de las células A549 en medio de crecimiento completo que contiene DMEM F12 sustituto de L-glutamina, 10% (v / v) de suero bovino fetal (FBS) y 1% (v / v) de solución Antimicrob-antimicótico. Sub-cultivo mediante disociación con 0,25% de tripsina-EDTA.
- Preparar suspensiones de células para los experimentos mediante la centrifugación de células disociadas a 140 xg durante 3 min a temperatura ambiente. Para los experimentos de dispositivos de microfluidos, contar las células usando un hemocitómetro y la semilla al menos 1 x 10 6 células en un matraz T75 con 10 ml de completamedio de crecimiento.
NOTA: Todos los procesos de cultivo de células se llevan a cabo en un incubador con un 37 ° C y 5% de CO2.
- Día 1: Preparación de dispositivos
- Coloque el dispositivo en la máquina de plasma O 2 y tratarlo con plasma de O2 a 90 W durante 40 segundos para hacer que el canal de microfluidos superficies hidrófilas.
- Inmediatamente después del tratamiento de superficie, instalar dos 14 agujas romas G insertando directamente las agujas en los agujeros de diámetro 2 mm perforados en la capa de PDMS en las entradas de los canales de gradiente químico. Asegúrese de que las agujas no bloquean los canales de microfluidos. Dibuje 0,8 ml de ddH2O utilizando una jeringa de 1 ml con una aguja de 14 G romo. Se inyecta la ddH2O en el canal de gradiente químico de la toma hasta que el agua fluye hacia fuera de ambas agujas en las entradas.
- Preparar 1 ml de la solución de fibronectina 50 mg / ml por dilución de fibronectina de valores con Dulbecco & #39; s tamponada con fosfato salino (DPBS).
- Infundir la solución de fibronectina de la salida del canal de gradiente químico utilizando una jeringa de 1 ml con una aguja de 14 G romo hasta que la solución fluye hacia fuera de ambas agujas en las entradas.
- Incubar toda la noche a la mañana dispositivo en una incubadora de cultivo celular convencional.
- Día 2: la siembra de células y de imágenes de microscopía
- la siembra de células
- Aspirar el medio de las células que se cultivaron desde días 0 y lavar las células con 5 ml de DPBS 2 veces. Aspirar el DPBS, añadir 2 ml de tripsina-EDTA, y se incuban las células en la incubadora durante 5 min para separar las células de la superficie del matraz.
- Esperar hasta que las células se separan y se suspenden en la solución y añadir 8 ml de medio libre de suero (DMEM F12 + 1% (v / v) Antimicrob-antimicótico solución) al matraz. Transferir todo el líquido en un tubo cónico de 15 ml y centrifugar al 140 xg durante 5 min a temperatura ambiente.
- Aspirar el sobrenadante después de la centrifugación y añadir una cantidad apropiada del medio libre de suero para hacer que la densidad celular final de 1 x 10 6 células / ml. Sacar el dispositivo de microfluidos preparado el día 1. Contar las células utilizando un hemocitómetro u otro instrumento automático de recuento celular.
- Inyectar medio libre de suero a partir de la salida del canal de gradiente químico utilizando una jeringa de 1 ml con una aguja de 14 G romo hasta que el medio fluye hacia fuera de ambas agujas en las entradas. Inyectar 200 l de la suspensión de células a partir de la salida del canal de gradiente químico.
- Observar la cámara de cultivo celular en el dispositivo bajo un microscopio para confirmar que las células se han introducido en el canal de microfluidos. Coloque el dispositivo en un recipiente húmedo (por ejemplo, una caja de plástico con ddH2O en el interior) y mantenerlo en una incubadora de cultivo celular durante 5 horas para promover la adhesión de las células sobre la superficie del dispositivo.
- Preparación de reagpadres para la generación de gradiente químico
- Preparar el producto químico (SDF-1α) a la concentración deseada (100 ng / ml) en medio libre de suero. Dibuje el medio libre de suero con y sin el producto químico en dos separadas 3 ml jeringas conectadas a la tubería de alta pureza. Configurar las jeringas en una bomba de jeringa con un caudal de 1 l / min para un uso posterior.
- Preparación de los reactivos para la generación de gradiente de oxígeno
- Hacer 15 ml de solución de NaOH 1 M y 15 ml de 200 mg / ml de pirogalol solución. Dibuje el NaOH y soluciones de pirogalol en dos separadas 15 ml jeringas conectadas a alta pureza tubo de PTFE y el tubo de alta pureza, respectivamente. Configurar las jeringas en una bomba de jeringa con un caudal de 5 l / min para un uso posterior.
- configuración del dispositivo de microfluidos
- Después de la incubación de 5 horas, se llevará a cabo todo el dispositivo y colocarlo en un plato de 15 cm de diámetro Petri. Fijar el dispositivo en la placa de Petri utilizando masilla adhesiva. la transferencia de laplaca de Petri con un microscopio de imágenes de células vivas en una incubadora.
- Conectar el tubo de las jeringas para la generación gradiente químico a las entradas del canal de gradiente químico. Conectar la salida a un tubo que conduce a un depósito de residuos. Encienda la bomba de jeringa con las jeringas para la generación de gradiente químico.
- Conectar el tubo de alta pureza a partir de las jeringas que contienen NaOH y pirogalol a las entradas del canal de gradiente de oxígeno. Conecte el tubo a la salida para recoger los residuos. Encienda la bomba de jeringa con las jeringas para la generación de oxígeno gradiente.
- Añadir aproximadamente 15 ml de ddH 2 O a la placa de Petri para mantener el dispositivo hidratada. Configurar el microscopio imágenes de células vivas para la captura de imágenes en tiempo-caducado, y tomar una imagen cada 15 minutos.
- la siembra de células
- Día 3: recopilación y análisis de datos
- La transferencia de los archivos de imágenes capturadas a un ordenador. Analizar las imágenes usando una imagen de código abiertosoftware de estudio de carácter, ImageJ, con un plugin de código abierto para el seguimiento manual (https://imagej.nih.gov/ij/plugins/track/track.html) y una herramienta de software libre quimiotaxis (http://ibidi.com/xtproducts / es / Software-y-imagen-Análisis / Manual-imagen-Análisis / quimiotaxis-y-Migration-Tool) 15, 16.
3. Caracterización de los gradientes
NOTA: Los gradientes químicos y oxígeno pueden caracterizarse antes o después de los experimentos de células.
- Simulación numérica del gradiente químico
- Estimar la naturaleza de flujo laminar de microfluidos utilizando la dinámica de fluidos computacional de simulación (CFD).
- Caracterización experimental del gradiente de oxígeno
- Preparar un colorante fluorescente sensible al oxígeno, tris (2,2'-bipiridilo) rutenio (III) cloruro hexahidrato, solución en agua a una concentración de 5mg / ml.
- Dibuje la solución colorante sensible al oxígeno en dos jeringas de 3 ml separados conectados a la tubería de alta pureza. Configurar las jeringas en una bomba de jeringa con un caudal de 1 l / min (idéntica a las velocidades de flujo utilizadas para la generación gradiente químico).
- Conectar el tubo de las jeringas a las entradas del canal de gradiente químico. Conectar la salida a un tubo que conduce a un depósito de residuos. Encienda la bomba de jeringa con las jeringas para la generación de gradiente químico.
- Medir la intensidad de fluorescencia usando un microscopio de fluorescencia invertida con la luz de excitación que pasa a través de un filtro óptico nm 470 ± 20. Recoge la luz de emisión a través de un filtro de emisión de paso largo de 515 nm utilizando una cámara CCD fría.
- Conectar el tubo de alta pureza a partir de las jeringas que contienen NaOH y pirogalol a las entradas del canal de gradiente de oxígeno. Conecte el tubo a la salida para recoger los residuos. Encienda la bomba de jeringa con las jeringas de oxígenogeneración del gradiente.
- Recoger las imágenes de fluorescencia del colorante sensible al oxígeno que fluye en la cámara de cultivo celular.
- Detener el flujo de generación de gradiente de oxígeno y desconecte todos los tubos en el canal de generación de oxígeno. Conectar los tubos de alta pureza a partir de los cilindros de gas a la salida del canal de gradiente de oxígeno.
- Recoger las imágenes de fluorescencia del colorante sensible al oxígeno que fluye en la cámara de cultivo celular cuando fluye aire, nitrógeno puro y oxígeno puro en el tubo conectado al canal de gradiente de oxígeno.
- Estimar los gradientes de oxígeno mediante el análisis de las imágenes de fluorescencia usando la ecuación de Stern-Volmer según las referencias 10 y 11.
Resultados
Fabricado PDMS-PC híbrido dispositivo de cultivo de células de microfluidos. Higo. La figura 1 muestra una foto y una ilustración del dispositivo de microfluidos. La capa inferior contiene cuatro niveles de canales en forma de serpentina para generar soluciones de reactivos introducidos a partir de dos entradas separadas con seis relaciones de mezcla diferentes. Teóricamente, las seis relaciones de mezcla diferentes son 1: 0, 4: 1, 3: 2, 2: 3, 1: 4, y 0: 1 (izquierda: derecha) entre las dos soluciones introducidas desde las entradas. Los gradientes químicos construidos por las seis soluciones de relación de mezcla diferentes se pueden generar en la cámara de cultivo de células, que se encuentra aguas abajo. Las capas superior e inferior están separados por una membrana de PDMS. En la capa superior, los reactivos para la reacción química de eliminación de oxígeno se introducen en el canal de microfluidos a partir de dos entradas separadas. Los reactivos se mezclan entre sí para la reacción inmediatamente antes de fluir en la parte superior de la cámara de cultivo celular paracaptar el oxígeno de la parte inferior del canal, sin contacto químico directo. La película PC incorporado, con un coeficiente de difusión de gas más pequeño en comparación con PDMS, actúa como una barrera de difusión que hace de captación de oxígeno más eficiente. El oxígeno se difunde gradualmente de nuevo a la cámara de cultivo celular a través de los PDMS en la zona de aguas abajo para formar un gradiente de oxígeno a lo largo de la dirección del flujo. Puesto que la reacción química de eliminación de oxígeno se limita espacialmente, sólo las tensiones de oxígeno locales se ven afectados. Como resultado, el dispositivo se puede utilizar en una incubadora celular convencional sin alterar su tensión mundial oxígeno. En los experimentos de migración, las células se sembraron dentro de la cámara de cultivo celular para la observación. El medio de crecimiento y reactivos químicos se introducen en el dispositivo mediante bombas de jeringa con velocidades de flujo controladas con precisión.
Caracterización de gradientes químicos y oxígeno generado en el interior del dispositivo. Debido a tFlujo Laminar que la naturaleza de la microfluídica, los comportamientos de flujo pueden predecirse utilizando la dinámica de fluidos computacional de simulación (CFD). En este trabajo, se construyó un modelo 3D y se realizó la simulación utilizando un software de modelado multifísica disponible en el mercado. Higo. 2 (a) muestra una comparación entre los perfiles de concentración de fluoresceína caracterizado experimentalmente a través de la anchura de la cámara de cultivo celular basado en mediciones de la intensidad de fluorescencia y los resultados de simulación numérica. La concordancia entre los resultados de simulación y experimentales sugieren que el modelo CFD también puede estimar los gradientes químicos generados en el interior del dispositivo. Higo. 2 (b) representa el gradiente simulada SDF-1α generado en la cámara de cultivo celular. Higo. 3 muestra el gradiente de oxígeno de caracterización resultados por hacer fluir el colorante de fluorescencia sensible al oxígeno dentro de la cámara de cultivo celular antes de los experimentos celulares. El resultado indica que una Gradi oxígenoent, que varía de aproximadamente 1 a 16%, se puede establecer utilizando el protocolo anteriormente mencionado.
Resultados de la migración celular. Como una demostración, hemos realizado estudios de migración celular A549 de 4 combinaciones de quimioquinas (SDF-1a) y gradientes de oxígeno: (1) no quimioquinas y no hay gradientes de oxígeno como un control, (2) con un gradiente de quimioquinas y sin un gradiente de oxígeno, (3) con un gradiente de oxígeno y sin un gradiente de quimioquinas, y (4) tanto con quimiocina y los gradientes de oxígeno. Higo. La figura 4 muestra la foto de todo el montaje experimental. Los experimentos fueron realizados en una incubadora de cultivo celular convencional con la configuración completa (incluyendo los dispositivos de microfluidos, bombas de jeringa y microscopios imágenes de células vivas) colocados en su interior. Los resultados de migración de células se muestran en la Fig. 5. Higo. 5 (a) muestra las imágenes recogidas durante los experimentos utilizando la imagen de células vivas anaLyzer, y la fig. 5 (b) y (c) Las representaciones de las trayectorias de migración celular y los cambios medios en virtud de las cuatro combinaciones analizadas por el software ImageJ con los plugins. Los resultados muestran que la distancia media de migración celular en el control se aproxima a cero, lo que sugiere movimiento al azar de las células en el experimento. Por el contrario, sólo con el gradiente de quimioquinas, el movimiento promedio de las células es hacia la izquierda, donde la concentración de SDF-1α es mayor. Los resultados sugieren el comportamiento quimiotaxis SDF-1α de las células A549, que ha sido descrito previamente. En el experimento con sólo gradientes de oxígeno, el movimiento promedio de las células es hacia arriba, donde la tensión de oxígeno es menor. Más interesante, en el experimento con quimioquinas y oxígeno gradientes perpendiculares, el movimiento promedio de las células es hacia arriba y sin ningún movimiento obvio en la dirección horizontal (dirección de quimioquinas gradiente).
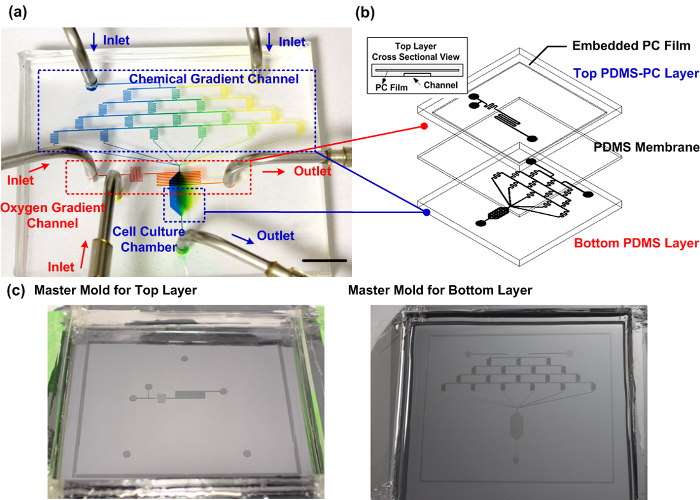
Figura 1: Fabricado PDMS-PC dispositivo de cultivo de células de microfluidos. (A) La foto experimental del dispositivo fabricado capaz de generar de forma fiable gradientes químicos y oxígeno perpendiculares para los estudios de migración celular. El canal de gradiente químico está lleno de azul y amarillo colorantes de alimentos para demostrar la generación de gradiente dentro de la cámara de cultivo celular. El canal de gradiente de oxígeno está lleno de colorante alimentario rojo. La barra de escala es de 1 cm. (B) El esquema del dispositivo de microfluidos. La capa superior se fabrica utilizando PDMS con una capa de PC incorporado como una barrera de difusión de gas para el control de gradiente de oxígeno eficiente dentro de la cámara de cultivo celular. (C) Los moldes maestros para la fabricación de las capas superior e inferior. Por favor, haga clic aquí paraver una versión más grande de esta figura.
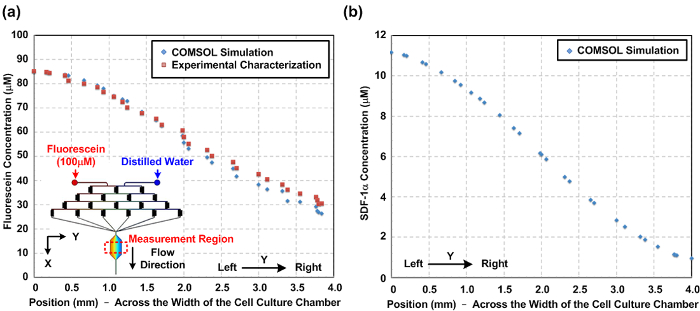
Figura 2: gradiente químico en el interior del dispositivo de cultivo de células de microfluidos. (A) Numéricamente simulado y experimentalmente caracterizado gradiente de concentración de fluoresceína en el interior de la cámara de cultivo celular a través de la anchura de la cámara de cultivo celular (dirección Y). La similitud entre los gradientes simulados y medidos experimentalmente indica que la simulación también puede predecir el gradiente químico. La figura recuadro muestra el modelo en tres dimensiones (3D) construido para la simulación. (B) resultado de la simulación numérica de la gradiente de quimioquinas SDF-1α través de la anchura de la cámara de cultivo de células para estudios de migración celular. Haga clic aquí para ver unaversión más grande de esta figura.
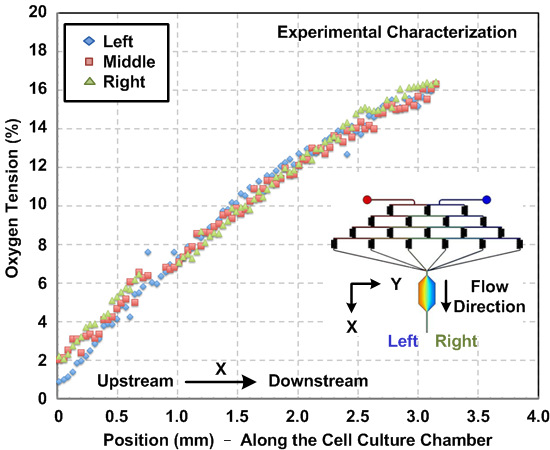
Figura 3: gradiente de oxígeno en el interior del dispositivo de cultivo de células de microfluidos. Medido experimentalmente gradientes de oxígeno dentro de la cámara de cultivo celular a lo largo de la dirección del flujo. Los gradientes se calcula utilizando el colorante fluorescente sensible al oxígeno y análisis de imágenes. Los gradientes, de izquierda a derecha de la cámara, se caracterizan, y los resultados muestran perfiles de gradiente coherentes en toda la anchura de la cámara.

Figura 4: Fotos de la configuración experimental. Toda la instalación, incluyendo los dispositivos de microfluidos, bombas de jeringa, y un microscopio de imágenes de células vivas, se coloca dentro de una incubadora de cultivo celular convencional para optimizadocondiciones de cultivo celular durante los experimentos. Haga clic aquí para ver una versión más grande de esta figura.
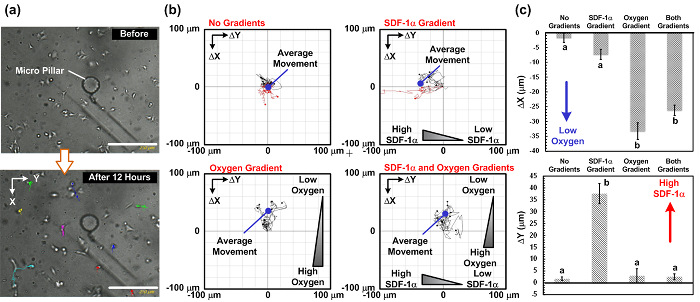
Figura 5: La migración celular en virtud de los resultados del estudio SDF-1 alfa y oxígeno gradientes perpendiculares. (A) Imágenes capturado antes y después del estudio de la migración de células de 12 h. Las rutas de migración de células pueden ser analizados desde las imágenes en tiempo-caducado capturados utilizando el microscopio de imágenes de células vivas. (B) Las rutas de migración celular y el movimiento de emigración promedio analizada desde las imágenes capturadas de 4 diferentes combinaciones de gradiente: sin gradiente, sólo el gradiente de quimioquinas, sólo el gradiente de oxígeno, y los dos gradientes de quimioquinas y oxígeno. Las imágenes fueron capturadas cada 15 minutos. La barra de escala es de 250 micras. (C) Las representaciones de las distancias promedio de migración celular en el (gradiente de oxígeno) perpendicular y horizontal (gradiente de quimioquinas) instrucciones de menos de cuatro combinaciones diferentes de degradado. Los datos se expresan como la media ± SD, obtenido a partir de tres conjuntos experimentales independientes, y 10 se analizaron las células en cada experimento. Las significativamente diferentes (prueba t de Student para datos independientes, p <0,01) los resultados estadísticos son designados por letras diferentes (A y B). Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Los pasos más críticos para fabricar el PDMS dispositivo de microfluidos con una película delgada PC embebido son: (1) la expulsión de todas las burbujas al insertar la película de PC en el PDMS pre-polímero, mientras que la fabricación de la capa superior de PDMS-PC y (2), asegurándose todos los PDMS procesos de curado se llevan a cabo en un plano horizontal bien nivelado. Para los experimentos de migración celular, los pasos más críticos son: (1) la eliminación de las burbujas dentro del dispositivo de microfluidos, tubos y bombas de jeringa durante los experimentos; (2) asegurar que el dispositivo de microfluidos se coloca en un plano horizontal bien nivelado durante imágenes de células vivas para la observación de la migración celular; y (3) mantener el dispositivo hidratada mediante la adición de ddH 2 O a la placa de Petri durante los experimentos y asegurarse de que el agua no se seca.
Con el fin de fabricar con éxito el dispositivo de microfluidos PDMS-híbrido PC sin delaminación, es fundamental para eliminar todas las burbujas durante la fi PCinserción lm. La película de PC se puede insertar lentamente de un ángulo (aproximadamente 15 a 30 grados de distancia de los PDMS superficie pre-polímero) para evitar la generación de burbujas durante la inserción de la película de PC en los PDMS pre-polímero. Si es necesario, la totalidad de PDMS pre-polímero con la película de PC embebido se puede colocar en el desecador conectado a la bomba de vacío durante 10 min para expulsar las burbujas atrapadas. Si la película de PC flota hacia arriba después de que el proceso de vacío, una punta de pipeta puede ser utilizado para presionar la película de PC hacia abajo sobre la capa de PDMS curado. Repetir los procesos de vacío y de prensa si es necesario.
Para los experimentos de células, la falta de burbujas de aire es crítico para el cultivo de células de microfluidos. Asegúrese de que no hay burbujas de aire se introducen en la configuración completa de microfluidos (incluyendo bombas de jeringa, los tubos y el dispositivo de microfluidos) al realizar las conexiones. Si las burbujas de aire se crean dentro de la configuración de microfluidos debido a la disminución de la solubilidad del gas en virtud de la temperatura elevada de la experimentos dentro de la incubadora, todos los componentes experimentales (incluyendo las jeringas y los tubos) y reactivos (incluyendo el medio de crecimiento, pirogalol, y NaOH) se pueden colocar en la incubadora de antemano (al menos 20 min antes de su uso) para minimizar la variación de temperatura . Las bombas de jeringa a menudo generan calor del funcionamiento de los motores dentro de las bombas. Por lo general es aceptable para operar las bombas de jeringa dentro de incubadoras; Sin embargo, comprobar la temperatura de la incubadora durante los experimentos. Si la temperatura se eleva durante los experimentos, los procedimientos de enfriamiento adicionales necesitan ser llevado a cabo. Varios métodos de enfriamiento factibles se pueden emplear, como la colocación de una caja de hielo en la incubadora, lo que reduce el número de bombas de jeringa colocado dentro de la incubadora, o el uso de una incubadora con un sistema de refrigeración fuerza.
El dispositivo de cultivo de células de microfluidos PDMS-PC desarrollado en este trabajo es capaz de generar de forma fiable gradientes químicos y oxígeno perpendiculares FOestudios de migración celular r. La limitación del dispositivo desarrollado es que los perfiles de gradiente de oxígeno generadas dependen del equilibrio entre el flujo de oxígeno, impulsado por barrido de reacción química, y la difusión de oxígeno de la atmósfera ambiente, a través del dispositivo, y en el medio. Como resultado, los perfiles de gradiente de oxígeno no pueden ser arbitrariamente controlados dentro del dispositivo. En comparación con las plataformas de cultivo de células de microfluidos existentes, el dispositivo desarrollado en este trabajo es el primero capaz de realizar estudios de cultivo celular bajo combinaciones de gradientes químicos y oxígeno. El dispositivo completo puede ser fabricado mediante el proceso de moldeo por litografía réplica suave convencional, sin la alineación tediosa e instrumentación cara. Los gradientes se pueden simular numéricamente como experimentalmente caracterizan por ofrecer condiciones más fisiológicas microambiente similar para los estudios de células in vitro. Mediante el uso de un método de reacción química espacialmente confinados con una película de PC como un di gasbarrera ffusion, el gradiente de oxígeno se puede generar sin el uso de cilindros de gas a presión y unidades sofisticados de control de flujo de gas. Además, la instalación requiere sólo pequeñas cantidades de productos químicos (menos de 10 ml por día) para mantener los gradientes de oxígeno. Dado que el control de la tensión de oxígeno se limita localmente alrededor del canal microfluídico, y no perturba la concentración de oxígeno en el ambiente, toda la configuración se puede colocar dentro de una incubadora de cultivo celular convencional sin adicional de temperatura, humedad y CO 2 de control de la instrumentación. Como resultado, el dispositivo desarrollado tiene gran potencial para ser utilizado en la práctica en laboratorios biológicos.
Debido a limitaciones técnicas, comportamientos celulares menores tensiones de oxígeno rara vez han sido estudiados en la literatura existente. Con la ayuda del dispositivo de desarrollado en el presente documento, el cultivo de células bajo gradientes de oxígeno se puede realizar de una manera fácil de que promueve enormemente estudios de células bajo gradientes de oxígeno. Furthermore, un principio de funcionamiento similar se puede aplicar para generar otros gradientes gaseosos fisiológicamente relevantes, tales como dióxido de carbono y óxido nítrico, para el cultivo in vitro de células en los estudios 17. Estas capacidades demuestran que el PDMS-PC dispositivo de microfluidos muestra un gran potencial para diversas aplicaciones de cultivo de células, incluidas las pruebas de drogas y la proliferación celular y ensayos de migración, para avanzar en los estudios de cultivo celular in vitro.
Divulgaciones
Los autores declaran que no tienen intereses financieros en competencia.
Agradecimientos
This paper is based on work supported by the National Health Research Institutes (NHRI) in Taiwan under the Innovative Research Grant (IRG) (EX105-10523EI), the Taiwan Ministry of Science and Technology (MOST 103-2221-E-001-001-MY2, 104-2221-E-001-015-MY3, 105-2221-E-001-002-MY2), the Academia Sinica Thematic Project (AS-105-TP-A06), and the Research Program in Nanoscience and Nanotechnology. The authors would like to thank Ms. Rachel A. Lucas for proofreading the manuscript.
Materiales
| Name | Company | Catalog Number | Comments |
| 1 ml Syringe | Becton-Dickinson, Franklin Lakes, NJ | 302104 | |
| 1.5 ml Microcentrifuge Tube | Smartgene | 6011-000 | |
| 10 ml Syringe | Becton-Dickinson, Franklin Lakes, NJ | 302151 | |
| 15 ml Centrifuge Tube | ThermoFisher Scientific,Waltham, MA | Falcon 352096 | |
| 150 mm Petri dish | Dogger Science | DP-43151 | |
| 1H,1H,2H,2H-Perfluorooctyltrichlorosilane | Alfa Aesar, Ward Hill, MA | 78560-45-9 | |
| 3 ml Syringe | Becton-Dickinson, Franklin Lakes, NJ | 302118 | |
| 4'' Silicon Dummy Wafer | Wollemi Technical, Taoyuan, Taiwan | ||
| Acetone | ECHO Chemical, Miaoli, Taiwan | AH3102-000000-72EC | |
| AG Double Expose Mask Aligner | M&R Nano Technology, Taoyuan, Taiwan | AG500-4D-D-V-S-H | |
| Antibiotic-Antimyotic solution | ThermoFisher Scientific,Waltham, MA | GIBCO 15240-062 | |
| Biopsy punch | Miltex, Plainsboro, NJ | 33-31 | |
| Blunt needle | JensenGlobal, Santa Barbara, CA | Gauge 14 | |
| Bright-Line Hemocytometer | Sigma-Aldrich, St. Louis, MO | Z359629 | for cell counting |
| Buffered Oxide Etch | ECHO Chemical, Miaoli, Taiwan | PH3101-000000-72EC | |
| Cell Culture Incubator | Caron, Marietta, OH | 6016-1 | |
| COMSOL Multiphysics | COMSOL, Burlington, MA | Ver. 4.3b | for numerical simulation of chemical gradients in the device |
| D-PBS | ThermoFisher Scientific,Waltham, MA | GIBCO 14190-144 | |
| Desicattor | A-VAC Industries, Anaheim, CA | 35.10001.01 | |
| DMEM/F12+GlutaMax-1 | ThermoFisher Scientific,Waltham, MA | GIBCO 10565-018 | |
| Fetal Bovine Serum | ThermoFisher Scientific,Waltham, MA | GIBCO 10082 | |
| Fibronectin from Human Plasma | Sigma-Aldrich, St. Louis, MO | F2006 | |
| Inverted Fluorescence Microscope | Leica Microsystems, Wetzlar, Germany | DMIL LED | |
| Isopropyl Alcohol (IPA) | ECHO Chemical, Miaoli, Taiwan | CMOS112-00000-72EC | |
| JuLi Smart Fluorescence Cell Imager | NanoEnTek, Seoul, Korea | DBJ01B | |
| Mechanical Convention Oven | ThermoFisher Scientific,Waltham, MA | Lindberg Blue M MO1450C | |
| NaOH | Showa Chemical Industry, Tokyo, Japan | 1943-0150 | |
| Plasma tretment system | Nordson MARCH, Concord CA | PX-250 | for oxygen plasma surface treatment |
| Polycarbonate (PC) film | Quantum Beam Technologies, Tainan Taiwan | ||
| Polydimehtylsiloxane (PDMS) | Dow Corning, Midland, MI | SYLGARD 184 | |
| Pyrogallol | Alfa Aesar, Ward Hill, MA | A13405 | |
| Removable Adhesive Putty | 3M | 860 | |
| Sorvall Legend Mach 1.6R Tabletop Centrifuge | ThermoFisher Scientific,Waltham, MA | ||
| Spin Coater | ELS Technology, Hsinchu, Taiwan | ELS 306MA | |
| SU-8 2050 | MicroChem, Westborough, MA | SU-8 2050 | |
| SU-8 Developer | MicroChem, Westborough, MA | Y020100 | |
| Surgical blade | Feather, Osaka, Japan | 5005093 | for PDMS cutting |
| Syringe Pump | Chemyx, Houston, TX | Fusion 400 | |
| T75 Cell Culture Flask | ThermoFisher Scientific,Waltham, MA | Nunc 156367 | |
| Trypan Blue Solution, 0.4% | ThermoFisher Scientific,Waltham, MA | 15250061 | |
| Trypsin-EDTA | ThermoFisher Scientific,Waltham, MA | GIBCO 25200 | |
| Tygon PTFE Tubing | Saint-Gobain Performance Plastics, Akron, OH | ||
| Tygon Tubing | Saint-Gobain Performance Plastics, Akron, OH | 621 |
Referencias
- Phillips, J. E., Burns, K. L., Le Doux, J. M., Guldberg, R. E., García, A. J. Engineering graded tissue interfaces. Proc. Natl. Acad. Sci. USA. 105 (34), 12170-12175 (2008).
- Wang, F. The signaling mechanisms underlying polarity and chemotaxis. Cold Spring Harb. Perspect Biol. 1 (4), 1-16 (2009).
- Oh, S. H., Ward, C. L., Atala, A., Yoo, J. J., Harrison, B. S. Oxygen generating scaffolds for enhancing engineering tissue survival. Biomaterials. 30 (5), 757-762 (2009).
- Decaris, M. L., Lee, C. I., Yoder, M. C., Tarantal, A. F., Leach, J. K. Influence of the oxygen microenvironment on the proangiogenic potential of human endothelial colony forming cells. Angiogenesis. 12, 303-311 (2009).
- Chung, B. G., et al. Human neural stem cell growth and differentiation in a gradient-generating microfluidic device. Lab Chip. 5 (4), 401-406 (2005).
- Harris, A. L. Hypoxia - a key regulatory factor in tumor growth. Nat. Rev. Cancer. 2 (1), 38-47 (2002).
- Allen, J. W., Bhatia, S. N. Formation of steady-state oxygen gradients in vitro: application to liver zonation. Biotechnol. Bioeng. 82 (3), 253-262 (2003).
- McCord, A. M., Jamal, M., Shankavaram, U. T., Lang, F. F., Camphausen, K., Tofilon, P. J. Physiologic oxygen concentration enhances the stem-like properties of CD133+ human glioblastoma cells in vitro. Mol. Cancer Res. 7 (4), 489-497 (2009).
- Lo, J. F., Sinkala, E., Eddington, D. T. Oxygen gradients for open well cellular cultures via microfluidic substrates. Lab Chip. 10 (18), 2394-2401 (2010).
- Chang, C. W., et al. A polydimethylsiloxane-polycarbonate hybrid microfluidic device capable of generating perpendicular chemical and oxygen gradients for cell culture studies. Lab Chip. 14 (19), 3762-3772 (2014).
- Chen, Y. A., et al. Generation of oxygen gradients in microfluidic devices for cell culture using spatially confined chemical reactions. Lab Chip. 11 (21), 3626-3633 (2011).
- Peng, C. C., Liao, W. H., Chen, Y. H., Wu, C. Y., Tung, Y. C. A microfluidic cell culture array with various oxygen tensions. Lab Chip. 13 (16), 3239-3245 (2013).
- Xia, Y., Whitesides, G. M. Soft Lithography. Ann. Rev. Mate. Sci. 28, 153-184 (1998).
- Friend, J., Yeo, L. Fabrication of microfluidic devices using polydimethylsiloxane. Biomicrofluidics. 4 (2), 026502 (2010).
- Cordelières, F. P. . Manual Tracking. , (2005).
- Asano, Y., Horn, E. . Instructions Chemotaxis and Migration Tool 2.0. , (2013).
- Chen, Y. H., Peng, C. C., Cheng, Y. J., Wu, J. G., Tung, Y. C. Generation of nitric oxide gradients in microfluidic devices for cell culture using spatially controlled chemical reactions. Biomicrofluidics. 7 (6), 064104 (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados