Method Article
셀 마이그레이션 연구에서 수직 화학 산소 그라디언트에 대한 폴리 디메틸 실록산 - 폴리 카보네이트 미세 유체 장치
요약
The control of chemical and oxygen gradients is essential for cell cultures. This paper reports a polydimethylsiloxane-polycarbonate (PDMS-PC) microfluidic device capable of reliably generating combinations of chemical and oxygen gradients for cell migration studies, which can be practically utilized in biological labs without sophisticated instrumentation.
초록
이 문서는 포함 된 폴리 카보네이트 (PC) 화학적 산소 그라디언트의 조합에 따라 세포 이동을 연구하는 박막 폴리 디메틸 실록산 (PDMS)로 제조 된 미세 유체 소자를보고합니다. 모두 화학적 산소 그라디언트 크게 생체 내에서 세포의 이동에 영향을 미칠 수있다; 그러나, 기술적 제한으로 인해 거의 연구 시험 관내에서의 효과를 조사하기 위해 수행되었다. 본 연구에서 개발 된 장치는 원하는 화학적 구배를 생성하는 구불 구불 한 형상의 채널이 일련의 활용 및 산소 구배 발생을위한 공간적 한정 화학 반응 법을 이용한다. 화학적 산소 그라디언트의 방향은 간단 마이그레이션 결과 해석을 가능하게하는 서로 수직이다. 효율적 최소한 화학 소비 산소 구배를 생성하기 위하여, 내장 된 PC 박막 기체 확산 장벽으로서 이용된다. 개발 된 미세 유체 장치주사기 펌프에 의해 작동 및 설정 단순화 및 최적화 세포 배양 조건을 허용하는 세포 이동 실험 동안 종래의 세포 배양기에 배치 될 수있다. 세포 실험에서, 우리는 (간질 세포 유래 인자, SDF-1α)와 산소 구배 케모카인의 조합에 따라, adenocarcinomic 인간의 폐포 기저 상피 세포, A549의 마이그레이션을 연구하기 위해 장치를 사용했다. 실험 결과는 장치가 안정적으로 수직 케모카인 및 산소 구배를 생성 세포와 호환 할 수 있음을 보여준다. 마이그레이션 연구 결과는 산소 그라데이션 그라데이션의 조합이 하나의 그라디언트 미만에서 예측할 수 없습니다 아래 세포 이동을 유도에 중요한 역할 및 셀룰러 동작을 재생할 수 있음을 나타냅니다. 이 장치는 더 생체 -like microenvi 더 나은 세포 이동 연구를 홍보 할 수있는 세포 배양에 화학적 산소 그라디언트 사이의 상호 작용을 연구하는 연구자를위한 강력하고 실용적인 도구를 제공합니다경으로.
서문
가용성 인자 및 산소 장력의 공간적 분포는 생체 1, 2, 3, 4에 중요한 세포 기능의 수를 조절할 수있다. 보다 세포에 미치는 영향을 조사하기 위하여, 안정 화학적 산소 구배를 생성 할 수있는 시험 관내 세포 배양 플랫폼은 매우 바람직하다. 다양한 수용성 요소는 생물학적 활성에 중요한 역할을하고 세포의 행동에 영향을 미친다. 최근에 의한 미세 유체 기술의 발전에 안정적으로 생성하는 화학 증감 가능한 미세 유동 장치의 수는 세포 이동 5를 연구 개발되고있다. 또한, 여러 연구는 또한 시험 관내 세포 배양 6, 7, 8 산소 장력의 필요성을 밝혀냈다. 하나,세포 배양을위한 산소 장력의 제어는 주로 가압 가스 실린더와 산소 소거 또는 셀 창업 보육 센터에 대한 직접적인 화학 물질 첨가에 의존한다. 직접 화학 물질 첨가는 세포 배양 배지를 바꾸고 세포 반응에 영향을 미친다. 산소 제어 인큐베이터 인큐베이터 특수 설계, 정확한 가스 유량 제어, 저산소증 조건을 달성하기 위해 질소 가스의 큰 부피를 필요로한다. 또한, 다양한 산소 및 장력 구배 하에서 셀룰러 동작 연구를 지연시킨다,이 설정을 사용하여 산소의 공간 분포를 제어하기 불가능하다. 이러한 한계를 극복하기 위해 마이크로 유체 소자의 수는 세포 배양 애플리케이션 9 산소 구배를 생성하기 위하여 개발되었다. 그러나, 이들 대부분은 증발 및 버블 발생의 문제가 발생할 수 가압 된 가스를 사용하여 작동된다. 따라서, 그들은 종종 정교한 장비를 필요로하고 장기 세포 배양 STUDIE에 대한 신뢰할 수 없습니다에스.
과제를 극복하고, 상기 세포 이동에 대한 화학적 산소 구배 사이의 상호 작용을 연구하기 위해, 우리는 내장 된 폴리 카보네이트 (PC), 박막 (10), 폴리 디메틸 실록산 (PDMS)로 이루어지는 미세 세포 배양 장치를 개발했다. 장치는 PDMS 막에 의해 분리 된 두 개의 미세 채널 층으로 구성된다. 상부층은 산소 구배 발생을위한 PDMS-PC 층이고; 바닥층은 화학적 구배 생성 및 세포 배양 PDMS로 만들어진다. 장치는 동시에 가스 실린더 정교한 유동 제어 시스템을 사용하지 않고 수직 화학적 산소 구배를 생성 할 수있다. 장치에서 PDMS 큰 광학 투명성, 가스 투과성 및 세포 배양 및 이미징을위한 생물학적 호환성을 제공합니다. 내장 된 PC 필름은 효율적인 산소 장력 제어하는 가스 확산 배리어로서 기능한다. 미세 유체 채널에서는 채널 구불 구불 한 형상의 연속 사용의 화학 그라디언트를 생성합니다. 디자인은 크게 때문에 그것의 신뢰성과 쉽게 실험 장치에 다양한 애플리케이션을위한 마이크로 유체 장치에서 화학 그라디언트를 생성하는 데 이용되고있다. 또한, 화학적 구배 프로파일은 수치 시뮬레이션으로 미리 채널 형상을 변화시킴으로써 설계 할 수있다. 산소 구배의 생성을 위해, 우리는 이전 연구실 10, 11, 12에서 개발 된 공간적으로 한정된 화학 반응 법을 이용했다. 산소는 질소 퍼징없이 지정된 영역에서 청소할 수있다. 생물 실험실에서 실제 사용을 위해, 전체 실험 장치는 기존의 세포 배양 인큐베이터와 호환됩니다. 이러한 방법을 통합함으로써, 우리는 동시에 세포의 이동을 연구하기 위해 대량 가스 실린더와 정교한 장비없이 안정적인 화학적 산소 그라디언트를 생성 할 수 있습니다.
프로토콜
미세 유체 장치 1. 제작
주 : 전체 미세 유동 장치는, 소프트 리소그래피 복제 성형 공정 (13)을 이용하여 제조된다.
- 미세 유동 장치에 PDMS 층 금형의 제작
- 미세 유체 채널 패턴 시판 그림을 사용하거나 소프트웨어를 그리기를 디자인합니다. (14) 인쇄 고해상도 투명 마스크하는 회사에 파일을 제출한다.
- 아세톤 (≥99.5 %), 이소 프로필 알코올 클린 실리콘 웨이퍼 (IPA; ≥99.9 %) 및 완충 산화물 에칭 (BOE 6 : 1 NH 4 F.HF). 탈 이온수 (DI) 물로 헹군 후 질소 총을 가진 웨이퍼를 탈수.
- 네거티브 톤 포토 레지스트의 스핀 코트 대략 20g, SU-8 2050, 15 초 동안 500 rpm에서 웨이퍼 상에 다음 2,000 rpm으로 30 초 동안.
주 : 스핀 코팅 조건은 SU-8 2050 사진을 수득한다광학 리소그래피 이후에 약 75 ㎛의 웨이퍼의 두께의 레지스트 층. - 소프트 베이킹 65 ° C의 열판에 웨이퍼 3 분 후 9 분 동안 95 ° C에서. 소프트 베이크 후, UV 빛 아래 디자인 된 투명 마스크와 마스크 얼 라이너를 사용하여 웨이퍼를 노출; 총 노출 에너지는 약 300 엠제이 / cm 2이어야한다. 노광 후 베이크 (PEB) 65 ℃에서 웨이퍼를 2 분 후 7 분 동안 95 ° C에서.
- PEB 후, 강한 교반 또는 초음파 목욕 7 분 (37 kHz와 180 W 효과적인 초음파 파워)에서 SU-8 개발자의 웨이퍼를 담가. 잔류 SU-8을 제거하기 위해 아세톤과 IPA와 웨이퍼를 씻어.
- 웨이퍼 실란 100 ㎕를 배치 (1H, 1H, 2H, 2H-perfluorooctyltrichlorosilane) 바람직하지 못한 결합을 방지하기 위해, 웨이퍼 표면에 실란 화하는 격막 진공 펌프에 연결된 건조기에서 6cm 직경 페트리 접시로. 15 분 동안 펌프를 켜고 끌및 30 분 동안, 진공 데시 케이 터로 밀봉.
- 데시 케이 밖으로 실란 화 웨이퍼를 타고 다음 소프트 리소그래피 공정에 대한 15cm 직경 페트리 접시로 테이프 :
- 제조 및 PDMS 층 어셈블리
- PDMS의 예비 중합체의 제조
- 10에서 PDMS 단량체 (염기)와 경화제를 혼합 : 1의 비율 (V / V). 60 분 동안 데시 케이 터 설정의 혼합물을 탈기.
- PC에 내장 상부층의 제작
- 상층 유체 채널 패턴을 가진 몰드 상에 PDMS 프리폴리머의 전송 2g는 PDMS의 얇은 층을 만드는. 60 분 동안 탈기에 PDMS를 데시 케이 터 설정에서 금형을 놓습니다.
- PDMS 경화에 대한 60 ° C 오븐에서 금형 하룻밤을 놓습니다. 금형은 수평면에 있는지 확인합니다.
- 실온으로 냉각 금형. 금형에 PDMS 사전 폴리머의 추가 13g을 붓고 일에 PDMS를 드가60 분 동안 전자 데시 케이 터 설정.
- 천천히 가스 확산 장벽 신선한 PDMS 층으로 1mm 두께의 PC 필름을 포함; 필요한 경우 모든 거품을 추방.
- 60 ° C 오븐에서 금형 하룻밤을 넣어, 그것은 수평면에 있는지 확인하십시오.
- 실온 경화 PDMS 식혀. 모든 채널 패턴을 커버 할 수있는 약 5.5 X 5cm (2)의 면적에 메스 장치를 절단하고 주형에서 PDMS 슬래브 벗겨.
- 2 mm의 직경 생검 펀치를 이용하여 입구와 출구를위한 구멍을 펀치. 멀리 나중에 조립 주변 먼지에서 제작 된 최고 PDMS-PC 계층을 저장합니다.
- 바닥 PDMS 층의 제조
- 하부층 용 몰드 위에 PDMS의 예비 중합체 11g을 붓는다. 60 분 동안 탈기에 PDMS를 데시 케이 터에서 금형을 놓습니다. PDMS의 치료를 위해 60 ° C의 오븐에서 주형 밤새 유지. 이 수평면에 누워되어 있는지 확인합니다.
- 일을 냉각실온 전자 PDMS. 모든 채널의 패턴을 포함하고, 금형의 해제를 벗겨 수 약 5.5 X 5cm (2)의 영역에 장치를 잘라. 멀리 나중에 조립 주변 먼지에서 제작 된 바닥 PDMS 층을 저장합니다.
- PDMS 막의 제조
- 스핀 코트 대략 4 90 초 동안 100 rpm에서 실란 화 된 빈 웨이퍼 위에 PDMS 사전 폴리머의 g 후 4 초 동안 3,000 rpm으로. 오븐에서 밤새 60 ° C에서 스핀 코팅 웨이퍼를 굽는다.
- 장치의 조립
- 제작 된 PDMS-PC의 상단 층과 접합면이 위를 향을 가진 O 2 플라즈마 표면 처리 기계에 스핀 코팅 PDMS 막과 웨이퍼를 놓습니다. 40 초 동안 O 2 플라즈마 (W) (90)와 PDMS 표면을 처리합니다.
- 바로 O 2 플라즈마 표면 처리 후, PDMS 막 위에 상층 접합. 접합 층의 상단에 무게 (약 600 g)을 배치하고에 넣어결합을 촉진하기 위해 60 ° C 오븐에서 밤새.
- 상온 접합 층을 냉각시키고 모든 채널 패턴을 커버 할 수있는 약 5.5 X 5cm (2)의 영역에 메스 최상층에 접착 막을 잘라. 실리콘 웨이퍼의 접합 구조를 박리 및 2mm 직경의 생검 펀치를 사용하여 화학적 구배 채널의 입구 및 출구에서의 펀치 구멍.
- 40 초 동안 90 W에 플라즈마를 이용하여 PDMS 표면을 활성화하기 위해, 접합면이 위를 향하게 O 2 플라즈마 표면 처리 장치에있어서, 멤브레인 - 결합 된 상부층 및 제조 PDMS 바닥층을 놓는다.
- 표면 처리 후 즉시 접착을 위해 함께 상단과 하단 레이어를 연결합니다. 전체 결합 장치의 상단에 무게 (약 600 g)을 넣고 오븐에서 밤새 60 ° C에 넣어.
- 오븐에서 전체 제조 장치를 가지고 실온까지 냉각.
- PDMS의 예비 중합체의 제조
2. 미세 유체 세포 마이그레이션 분석
참고 :이 논문에서는 예로서 일반적으로 사용되는 세포주, adenocarcinomic 인간의 폐포 기저 상피 세포 (A549) 및 케모카인, 간질 세포 유래 인자 (SDF-1α)를 사용합니다. 다른 세포와 케모카인 작업 연구자를 들어, 그에 따라 실험 과정을 조정하십시오.
- 날 0 : 셀 준비
- 배양 된 DMEM F12 L- 글루타민 대신 10 % (v / v)의 소 태아 혈청 (FBS), 1 % (v / v)의 antimicrob - 항진균제 용액을 포함하는 완전 성장 배지에 A549 세포의 재고. 0.25 % 트립신 EDTA와 분리하여 하위 문화.
- 실온에서 3 분 동안 140 XG에 해리 세포를 원심 분리하여 실험에 대한 세포 현탁액을 준비합니다. 미세 유체 장치의 실험, 혈구를 사용하여 세포를 세어 전체 10 ㎖와 T75 플라스크에서 적어도 1 × 106 세포를 시드성장 배지.
주 : 모든 세포 배양 과정은 37 ℃ 및 5 % CO 2 인큐베이터 분위기에서 수행된다.
- 1 일 : 장치 준비
- O 2 플라즈마 기계에 장치를 배치하고 미세 유체 채널이 친수성 표면 렌더링하는 데 40 초 90 W에서 O 2 플라즈마로 처리합니다.
- 즉시 표면 처리 한 후, 직접 화학적 구배 채널 입구에 PDMS 층에 천공 2 mm 직경의 구멍에 바늘을 삽입하여 14 개의 G 무딘 바늘을 설치한다. 바늘이 미세 유체 채널을 차단하지 않도록해야합니다. 무딘 14 G 바늘로 1 ML의 주사기를 사용하여 DDH 2 O의 0.8 ml의립니다. 물 입구에서 두 바늘로부터 흘러 나올 때까지 출구에서 화학적 구배 채널에 DDH 2 O를 주입한다.
- 둘 베코 & #과 피브로넥틴의 주식을 희석하여 50 μg의 / ㎖ 피브로넥틴 액 1ml를 준비39;의 인산염 완충 식염수 (DPBS).
- 용액이 입구에서 두 바늘로부터 흘러 나올 때까지 평활 14 G 바늘 1 mL를 주사기를 사용하여 화학적 구배 채널의 출구에서 피브로넥틴 용액을 주입.
- 기존의 세포 배양 인큐베이터에서 전체 장치의 하룻밤을 품어.
- 주 2 : 세포 파종 및 현미경 영상
- 셀 시드
- 0 일 이후 배양 세포에서 매체를 기음과 DPBS 5 ml의 2 배와 세포를 씻는다. 상기 DPBS 대기음 트립신 EDTA 2 mL를 넣고 플라스크 표면으로부터 세포를 분리하기 위해 5 분 동안 배양기에서 세포를 배양한다.
- 플라스크에 세포를 분리하고, 용액에 현탁 될 때까지 기다린 후 무 혈청 배지의 8 ml의 추가 (DMEM의 F12 + 1 % (v / v)의 antimicrob - 항진균제 용액). 15 ml의 원추형 튜브로 액체를 모두 전송하고, 실온 하에서 5 분 동안 140 XG 그것을 원심.
- 원심 분리 후 상등액을 흡인하고, 최종 세포 밀도 1 × 106 세포 / mL로 무 혈청 배지를 적당량 추가한다. 혈구 또는 다른 자동 세포 계수 장비를 사용하여 세포를 계산 날 1 일에 제조 된 미세 유체 장치를 꺼냅니다.
- 매체가 입구에서 두 바늘로부터 흘러 나올 때까지 평활 14 G 바늘 1 mL를 주사기를 사용하여 화학적 구배 채널의 출구에서 무 혈청 배지를 주입한다. 화학적 구배 채널의 출구에서 세포 현탁액 200 μl를 주입한다.
- 세포를 미세 유체 채널에 도입 된 것을 확인하기 위해 현미경 장치에서의 세포 배양 챔버를 관찰한다. 습한 용기 (예 DDH 2 O 내부와 플라스틱 상자)에 기기를 배치되고 장치 표면에 세포의 접착을 촉진하기 위해 5 시간 동안 세포 배양 용 인큐베이터에 보관.
- reag의 준비화학 그라디언트 생성 엔트
- 무 혈청 배지에서 원하는 농도 (100 NG / ㎖)에서 화학적 (SDF-1α)을 준비한다. 와 고순도 튜브에 연결된 두 개의 분리 된 3 ㎖ 주사기로 화학없이 무 혈청 배지를 그린다. 나중에 사용하기 위해 1 μL / 분의 유량 주사기 펌프의 주사기를 설정한다.
- 산소 구배 발생을위한 시약의 제조
- 1 M NaOH 용액 15 mL 및 200 ㎎ / ㎖ 피로 갈롤 용액 15 ml를 확인합니다. 각각 고순도 PTFE 배관 및 고순도 튜브에 연결된 두 개의 별개의 15 mL의 주사기에 피로 갈롤의 NaOH 용액을 그린다. 나중에 사용하기 위해 5 μL / 분의 유량 주사기 펌프의 주사기를 설정한다.
- 미세 유체 장치 설치
- 5 시간 배양 한 후, 전체 장치를 꺼내와 15cm 직경 페트리 접시에 놓습니다. 접착제 퍼티를 사용하여 배양 접시에서 장치를 고정한다. 전송할인큐베이터에서 라이브 세포 이미징 현미경에 페트리 접시.
- 화학적 구배 채널의 유입구로 화학적 구배 생성 용 주사기에서 튜브를 연결한다. 폐기물 저장소에 이르는 튜브에 콘센트를 연결합니다. 화학 그라데이션 생성을위한 주사기와 주사기 펌프를 켭니다.
- 산소 구배 채널의 입구로의 NaOH 및 피로 갈롤를 함유하는 주사기로부터 고순도 튜브를 연결한다. 폐기물을 수집하기 위해 콘센트에 튜브를 연결합니다. 산소 구배 생성을위한 주사기와 주사기 펌프를 켭니다.
- 촉촉 장치를 유지하기 위해 페트리 접시에 DDH 2 O의 15 ML을 추가합니다. 시간이 경과 이미지 캡처를위한 라이브 세포 이미징 현미경을 설정하고, 이미지마다 15 분을.
- 셀 시드
- 주 3 : 데이터 수집 및 분석
- 컴퓨터에 캡쳐 된 이미지 파일을 전송. 오픈 소스 이미지를 사용하여 이미지를 분석alysis 소프트웨어, ImageJ에, 수동 추적을위한 오픈 소스 플러그인 (https://imagej.nih.gov/ij/plugins/track/track.html) 무료 화성 도구 소프트웨어 (와 http://ibidi.com/xtproducts / EN / 소프트웨어 - 및 - 이미지 - 분석 / 수동 - 이미지 - 분석 / 화성 및 마이그레이션-도구) 15, 16.
그래디언트 3. 특성
주 : 화학적 산소 구배 전 또는 세포 실험 후에 특성화 될 수있다.
- 화학적 구배의 수치 시뮬레이션
- 전산 유체 역학 (CFD) 시뮬레이션을 사용하여 마이크로 유체의 층류 자연 추정된다.
- 산소 구배 실험 특성화
- (5)의 농도는 산소에 민감한 형광 염료, 트리스 (2,2'- 비 피리 딜) 루테늄 (III) 클로라이드 수화물 물 용액을 제조mg을 / ㎖.
- 고순도 튜브에 연결된 두 개의 분리 된 3 ㎖ 주사기로 산소에 민감한 염료 용액을 그립니다. (화학 그라디언트 생성에 사용되는 흐름 속도와 동일) 1 μL / 분의 유량 주사기 펌프의 주사기를 설정한다.
- 화학 그라데이션 채널의 입구에 주사기에서 튜브를 연결합니다. 폐기물 저장소에 이르는 튜브에 콘센트를 연결합니다. 화학 그라데이션 생성을위한 주사기와 주사기 펌프를 켭니다.
- 470 ± 20 nm의 광학 필터를 통과 한 여기 광으로 반전 형광 현미경을 이용하여 형광 강도를 측정한다. 차가운 CCD 카메라를 사용하여 515 nm의 롱 패스 필터로 방출 발광 광을 수집한다.
- 산소 구배 채널의 입구로의 NaOH 및 피로 갈롤를 함유하는 주사기로부터 고순도 튜브를 연결한다. 폐기물을 수집하기 위해 콘센트에 튜브를 연결합니다. 산소의 주사기와 주사기 펌프를 켜고그라데이션 세대.
- 세포 배양 챔버에 유입되는 산소에 민감한 염료의 형광 이미지를 수집한다.
- 산소 그라데이션 세대의 흐름을 중지하고 산소 생성 채널에 대한 모든 튜브를 분리합니다. 산소 구배 채널의 출구 가스 실린더로부터 고순도 튜브를 연결한다.
- 산소 구배 채널에 연결된 호스로 공기, 순수 질소, 및 순수한 산소를 흐르게 할 때의 세포 배양 챔버에 유입되는 산소에 민감한 염료의 형광 이미지를 수집한다.
- 참고 문헌 10, 11에 따른 스턴 Volmer 방정식을 사용하여 형광 이미지를 분석하여 산소 구배를 추정한다.
결과
제조 PDMS-PC 하이브리드 미세 세포 배양 장치. 무화과. 하나는 사진과 미세 유체 장치의 그림을 보여줍니다. 바닥 층은 여섯 가지 혼합 비율이 두 개의 분리 된 입구에서 도입 시약의 솔루션을 생성하기 위해 구불 구불 한 모양의 채널 4 단계가 포함되어 있습니다. (왼쪽 : 오른쪽) 1 : 입구로부터 도입 두 용액 사이의 0, 4 : 1, 3 : 2, 2 : 3, 1 : 4, 0 이론적 여섯 가지의 혼합 비율은 1이다. 여섯 가지의 혼합 비율 솔루션으로 구성된 화학 그라디언트 하류에 위치하고, 세포 배양 챔버에서 생성 될 수있다. 상단과 하단 층은 PDMS 막에 의해 분리된다. 상단 층에 산소 소거 화학 반응을위한 시약은 두 개의 입구들로부터 미세 유체 채널에 도입된다. 시약은 즉시로 세포 배양 챔버의 상부에 유입되기 전에 반응 서로 혼합직접 화학 접촉없이 바닥 채널에서 산소를, 소기. PDMS에 비해 작은 기체 확산 계수 임베디드 PC 막은, 산소 소거 더 효율적 확산 장벽으로서 작용한다. 산소 서서히 유동 방향을 따라 산소 구배를 형성하기 위해 다운 스트림 영역에 PDMS를 통해 다시 세포 배양 챔버로 확산된다. 산소 소거 화학 반응을 공간적으로 한정되기 때문에, 로컬 산소 장력은 영향을 받는다. 결과적으로, 장치는 글로벌 산소 장력을 변화시키지 않고, 종래의 세포 배양기에서 이용 될 수있다. 이주 실험에서, 세포를 관찰하기위한 세포 배양 챔버 내부 시딩. 성장 배지, 화학 시약은 정확하게 제어 유량 주사기 펌프를 이용하여 장치에 도입된다.
화학적 산소 그라디언트의 특성은 장치 내부에서 발생. 때문에 t에그는 흐름 행동은 전산 유체 역학 (CFD) 시뮬레이션을 사용하여 예측 될 수있다, 마이크로 유체의 자연 흐름을 층류. 본 연구에서는 3 차원 모델을 구성하고, 시판중인 다중 물리 모델링 소프트웨어를 이용하여 시뮬레이션을 수행 하였다. 무화과. (2) (a) 형광 강도를 측정하고, 수치 시뮬레이션 결과에 기초하여, 세포 배양 챔버의 폭을 따라 실험적있어서 형광 농도 프로파일의 비교를 나타낸다. 실험 및 시뮬레이션 결과 사이의 계약은 CFD 모델이 아니라 장치 내부에서 발생하는 화학 그라디언트를 추정 할 수 있음을 시사한다. 무화과. (b) (2)는 세포 배양 챔버에서 발생 된 시뮬레이션 된 SDF-1α 구배를 나타내는. 무화과. 도 3은 세포 실험 전에 세포 배양 챔버 내부의 산소에 민감한 형광 염료를 흘려 산소 그라데이션 특성 결과를 나타낸다. 그 결과 산소 GRADI 것을 나타낸다약 1 내지 16 % 범위 ENT는 상기 프로토콜을 이용하여 확립 될 수있다.
세포 이동의 결과. 데모, 우리는 4 케모카인의 조합 (SDF-1α)와 산소 구배에서 A549 세포 이동의 연구를 수행 : (1) 더 케모카인 및 제어 등의 더 산소 그라디언트, (2) 케모카인 그라디언트와 산소 그라데이션없이, (3) 산소 구배 및 케모카인 그라데이션없이, (4) 케모카인 및 산소 구배 모두. 무화과. 4는 전체 실험 장치의 사진을 보여줍니다. 실험은 모두 그 안에 배치 (마이크로 유체 장치, 시린지 펌프 및 생균 촬상 현미경 포함) 전체에 설치와 종래의 세포 배양 인큐베이터에서 수행 하였다. 세포 이동의 결과를도에 나타내었다. 5. 무화과. 도 5 (a)는 생균 촬상 아나 이용한 실험에서 수집 된 영상을 보여준다lyzer 및도. 도 5의 (b)와 (c)는 플러그와 ImageJ에 소프트웨어에 의해 분석 네 조합 하에서 세포 이동 궤적 평균 움직임을 나타내는. 결과는 제어 평균 세포 이동 거리가 실험에서 세포의 임의의 이동을 시사하는 제로에 접근을 보여준다. 대조적으로, 단지 케모카인 그라데이션 세포의 평균 운동은 SDF-1α 농도가 높은 왼쪽 방향이다. 이 결과는 이전에보고 된 A549 세포의 SDF-1α 화성 동작을 제안한다. 산소 장력이 낮은 곳에서만 산소 그라디언트 실험에서, 세포의 평균 운동 위쪽이다. 더 흥미로운 것은 수직 케모카인 및 산소 그라디언트 실험에서, 세포의 평균 운동 위쪽 및 수평 방향의 움직임이 없는지 (케모카인 그라디언트 방향)하지 않고있다.
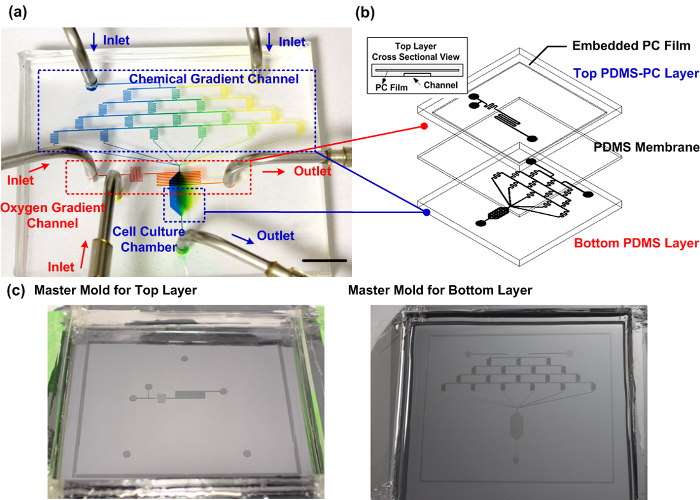
그림 1 : 조립식 PDMS-PC 미세 세포 배양 장치. (a) 세포 확실 이전 연구 직교 화학적 산소 구배를 생성 할 수있는 제조 장치의 실험 사진. 화학적 구배 채널은 세포 배양 챔버 내부 구배 발생을 입증하는 청색과 황색 식품 염료로 충전된다. 산소 구배 채널 적색 식품 염료로 충전된다. 스케일 바는 1cm입니다. (b) 미세 유체 장치의 개략도. 최상층은 세포 배양 챔버 내부 효율적인 산소 기울기 제어를위한 기체 확산 장벽 임베디드 PC 층 PDMS를 사용하여 제조된다. (c) 상부 및 하부 층의 제조를위한 마스터 몰드. 여기를 클릭하십시오이 그림의 더 큰 버전을 볼 수 있습니다.
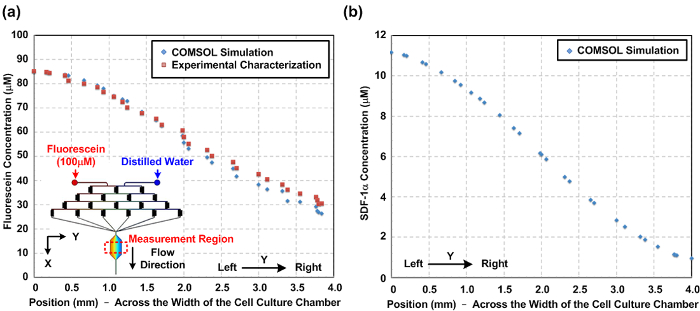
그림 2 : 미세 세포 배양 장치 내부의 화학 그라데이션. (a) 수치 시뮬레이션 및 실험적 세포 배양 챔버 (Y 방향)의 폭을 가로 질러 세포 배양 챔버 내부 형광 농도 구배를 특징으로한다. 시뮬레이션 및 실험적으로 측정 기울기 사이의 유사성은 시뮬레이션이 아니라 화학 구배를 예측할 수 있음을 나타냅니다. 도형 삽입 시뮬레이션을 위해 구성되는 3 차원 (3D) 모델을 도시한다. 세포 이동 시험을위한 세포 배양 챔버의 폭에 걸쳐 SDF-1α 케모카인 구배 (b) 수치 시뮬레이션 결과. 을 보려면 여기를 클릭하십시오이 그림의 더 큰 버전.
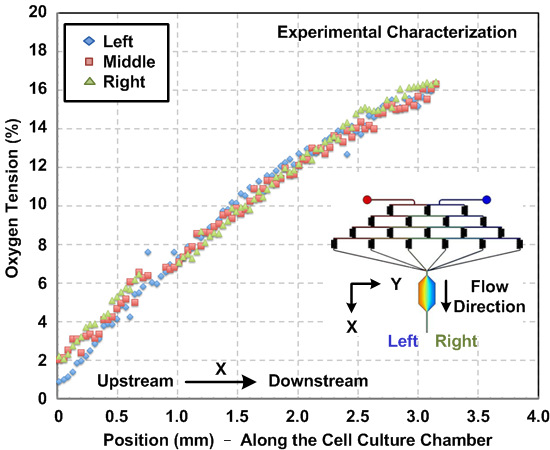
그림 3 : 미세 세포 배양 장치 내부의 산소 그라데이션. 실험적으로 유동 방향을 따라 세포 배양 챔버 내에 산소 구배를 측정 하였다. 기울기는 산소에 민감한 형광 염료 및 이미지 분석을 이용하여 추정 하였다. 기울기는 상기 챔버의 왼쪽에서 오른쪽으로, 특징, 결과는 챔버의 폭 일관성 구배 프로파일을 나타낸다.

그림 4 : 실험 장치의 사진. 최적화를위한 미세 유체 장치, 시린지 펌프, 및 생균 촬상 현미경 포함한 전체 셋업은 종래의 세포 배양 인큐베이터 내에 배치되고실험시 세포 배양 조건. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
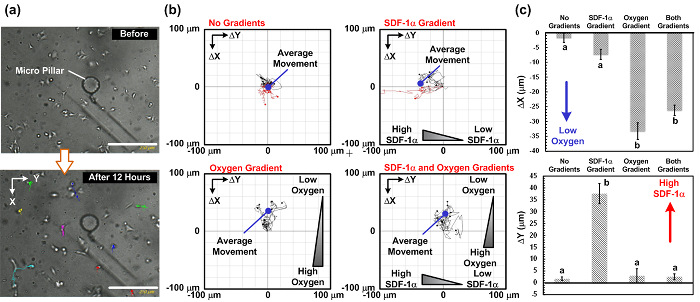
그림 5 : 수직 SDF-1α와 산소 그라디언트에서 셀 마이그레이션 연구 결과. (a)는 이미지 전에 12 시간 세포 이동의 연구 후 촬영. 세포 이동 경로는 생균 촬상 현미경을 이용하여 촬영 된 시간이 경과 된 이미지에서 분석 될 수있다. (b)의 4 가지 그라데이션 조합에서 촬영 된 이미지에서 세포 이동 경로 및 분석 평균 이동 운동 : 아니 그라디언트 만 케모카인 그라디언트 만 산소 그라데이션, 두 케모카인과 산소 그라디언트. 이미지는 매 15 분을 붙 잡았다. 스케일 바는 250 μm의입니다. 수직 (산소 구배) 평균 세포 이동의 거리 (c) 플롯과 수평 (케모카인 구배) 네 개의 다른 경사 아래 방향의 조합. 데이터는 세 개의 독립적 실험 세트에서 얻은 평균 ± SD로 표시되고, 셀 (10)은 각 실험에서 분석 하였다. 통계적 유의 한 차이 (짝 스튜던트 t 검정, p <0.01)의 결과는 다른 문자 (a 및 b)에 의해 지정된다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
임베디드 PC 박막으로 PDMS를 미세 유체 소자를 제조하기위한 가장 중요한 단계는 다음과 같다 : PDMS-PC 최상부 층의 제조 (2) 확인하는 동안 PDMS로 예비 중합체를 PC 필름을 삽입 할 때 (1) 모든 거품 추방 프로세스를 경화 모든 PDMS는 잘 수평 수평면에서 수행됩니다. 세포 이동의 실험을 위해, 가장 중요한 단계는 : (1) 미세 유동 장치 내의 기포를 제거 실험 동안 튜브, 주사기 펌프; (2) 미세 유동 장치는 세포 이동의 관찰 생균 촬상 중에 잘 - 계층화 수평면 상에 배치되는 것을 보장; (3) 실험 동안 페트리 접시에 O DDH이 부가 물은 밖으로 건조되어 있지 않은지 확인하여 수분 유지 장치.
성공적으로 박리없이 PDMS-PC 하이브리드 미세 유체 소자를 제작하기 위해서는, PC 좋 동안 모든 기포를 제거하는 것이 중요필름 삽입. PC의 막을 천천히 PDMS 프리폴리머로 PC 필름의 삽입시 거품 발생을 방지하기 위해 (약 15 ~ 30도 정도 떨어진 PDMS 프리폴리머면)에서 비스듬히 삽입 될 수있다. 필요한 경우, 임베디드 PC 막을 전체 PDMS 예비 중합체 갇힌 기포를 배출하기 위해 10 분간 진공 펌프에 연결된 건조기에 배치 될 수있다. PC의 막을 진공 공정 후에 수레 경우 피펫 팁은 경화 된 PDMS 층 상 PC 필름을 눌러하는데 사용될 수있다. 필요한 경우 진공를 눌러 프로세스를 반복합니다.
세포 실험에 기포의 부족은 미세 세포 배양 중요하다. 공기 방울이 연결하기 (주사기 펌프, 튜브 및 미세 유체 장치를 포함) 전체 미세 유체 설정에 도입되어 있지 않은지 확인합니다. 기포 기인의 expe의 승온 하에서 기체의 용해도를 감소시키기 위해 마이크로 유체 설치 이내 경우배양기 내부 riments는 (피로 갈롤, 성장 배지를 포함하고, 수산화 나트륨) 및 시약 (주사기와 튜브를 포함한) 모든 실험 요소는 온도 변동을 최소화하기 위해 (적어도 20 분에는 사전에) 미리 인큐베이터에 배치 될 수있다 . 주사기들은 펌프 내부의 모터의 동작에서 발열 펌프. 인큐베이터 안에 주사기 펌프를 작동 일반적으로 허용; 그러나, 실험하는 동안 인큐베이터 온도를 확인 할. 온도는 실험시 이르게되면 추가적인 냉각 과정이 수행 될 필요가있다. 여러 가능한 냉각 방법은 예컨대, 인큐베이터에 얼음 상자를 배치 인큐베이터 내에 배치 주사기 펌프의 수를 줄이거 나 강제 냉각 장치를 인큐베이터를 사용으로 사용될 수있다.
본 연구에서 개발 된 PDMS-PC 미세 세포 배양 장치를 확실 FO 수직 화학적 산소 구배를 발생시킬R 세포 이동 연구. 현상 장치의 한계가 발생 산소 구배 프로파일은 장치를 통해 주위 환경으로부터 화학 반응 소기 구동 산소 유량, 산소 확산 사이의 균형에 의존하고, 상기 매체에 있다는 것이다. 그 결과, 산소 구배 프로파일은 임의적으로 장치 내부를 제어 할 수 없다. 기존 미세 세포 배양 플랫폼에 비해, 본 연구에서 개발 된 장치는 화학적 산소 구배의 조합에 따라 세포 배양 실험을 수행 할 수있는 첫 번째이다. 전체 장치는 지루한 정렬 및 고가의 장비없이, 종래 소프트 리소그래피 복제 성형 공정을 이용하여 제조 될 수있다. 기울기는 수치 시뮬레이션 및 실험적 시험 관내 세포 연구 이상의 생체 미세 형상의 조건을 제공하는 것을 특징으로 할 수있다. 가스 디으로서 PC 필름 공간적으로 한정된 화학 반응 법을 이용하여ffusion 장벽 산소 구배 가압 가스 실린더 정교한 가스 유량 제어 장치를 사용하지 않고 생성 될 수있다. 또한, 설치 화학 소량 (하루 미만 10 ㎖) 산소 구배를 유지하기 위해 필요하다. 산소 장력 제어는 마이크로 유체 관 주위에 국부적으로 한정되고, 대기 산소 농도를 방해하지 않기 때문에, 전체 설정 추가적인 온도, 습도없이 종래의 세포 배양 인큐베이터 내에 배치하고, CO 2 제어 계측 할 수있다. 그 결과, 발전 장치는 실질적 생물 실험실에서 사용하는 잠재력을 갖는다.
기술적 한계로, 산소 긴장에서 휴대 행동은 거의 기존 문헌 연구되지 않았다. 본 연구에서 개발 된 장치의 도움으로, 산소 구배 하에서 세포 배양을 크게 산소 구배 하에서 세포 연구를 촉진하는 용이 한 방식으로 수행 될 수있다. 작고에hermore 유사한 동작 원리가 시험 관내 세포 배양 물 (17)을 연구를 들면 이산화탄소 및 질소 산화물과 같은 생리 학적으로 중요한 다른 기체 그라디언트를 생성하기 위해 적용될 수있다. 이러한 기능은 PDMS-PC 미세 유체 장치는 체외 세포 배양 연구에 진출, 약물 검사 및 세포 증식 및 마이그레이션 분석 등 다양한 세포 배양 응용 프로그램을위한 큰 잠재력을 보여주고 있음을 보여줍니다.
공개
저자는 더 경쟁 재정적 이해 관계가 없음을 선언합니다.
감사의 말
This paper is based on work supported by the National Health Research Institutes (NHRI) in Taiwan under the Innovative Research Grant (IRG) (EX105-10523EI), the Taiwan Ministry of Science and Technology (MOST 103-2221-E-001-001-MY2, 104-2221-E-001-015-MY3, 105-2221-E-001-002-MY2), the Academia Sinica Thematic Project (AS-105-TP-A06), and the Research Program in Nanoscience and Nanotechnology. The authors would like to thank Ms. Rachel A. Lucas for proofreading the manuscript.
자료
| Name | Company | Catalog Number | Comments |
| 1 ml Syringe | Becton-Dickinson, Franklin Lakes, NJ | 302104 | |
| 1.5 ml Microcentrifuge Tube | Smartgene | 6011-000 | |
| 10 ml Syringe | Becton-Dickinson, Franklin Lakes, NJ | 302151 | |
| 15 ml Centrifuge Tube | ThermoFisher Scientific,Waltham, MA | Falcon 352096 | |
| 150 mm Petri dish | Dogger Science | DP-43151 | |
| 1H,1H,2H,2H-Perfluorooctyltrichlorosilane | Alfa Aesar, Ward Hill, MA | 78560-45-9 | |
| 3 ml Syringe | Becton-Dickinson, Franklin Lakes, NJ | 302118 | |
| 4'' Silicon Dummy Wafer | Wollemi Technical, Taoyuan, Taiwan | ||
| Acetone | ECHO Chemical, Miaoli, Taiwan | AH3102-000000-72EC | |
| AG Double Expose Mask Aligner | M&R Nano Technology, Taoyuan, Taiwan | AG500-4D-D-V-S-H | |
| Antibiotic-Antimyotic solution | ThermoFisher Scientific,Waltham, MA | GIBCO 15240-062 | |
| Biopsy punch | Miltex, Plainsboro, NJ | 33-31 | |
| Blunt needle | JensenGlobal, Santa Barbara, CA | Gauge 14 | |
| Bright-Line Hemocytometer | Sigma-Aldrich, St. Louis, MO | Z359629 | for cell counting |
| Buffered Oxide Etch | ECHO Chemical, Miaoli, Taiwan | PH3101-000000-72EC | |
| Cell Culture Incubator | Caron, Marietta, OH | 6016-1 | |
| COMSOL Multiphysics | COMSOL, Burlington, MA | Ver. 4.3b | for numerical simulation of chemical gradients in the device |
| D-PBS | ThermoFisher Scientific,Waltham, MA | GIBCO 14190-144 | |
| Desicattor | A-VAC Industries, Anaheim, CA | 35.10001.01 | |
| DMEM/F12+GlutaMax-1 | ThermoFisher Scientific,Waltham, MA | GIBCO 10565-018 | |
| Fetal Bovine Serum | ThermoFisher Scientific,Waltham, MA | GIBCO 10082 | |
| Fibronectin from Human Plasma | Sigma-Aldrich, St. Louis, MO | F2006 | |
| Inverted Fluorescence Microscope | Leica Microsystems, Wetzlar, Germany | DMIL LED | |
| Isopropyl Alcohol (IPA) | ECHO Chemical, Miaoli, Taiwan | CMOS112-00000-72EC | |
| JuLi Smart Fluorescence Cell Imager | NanoEnTek, Seoul, Korea | DBJ01B | |
| Mechanical Convention Oven | ThermoFisher Scientific,Waltham, MA | Lindberg Blue M MO1450C | |
| NaOH | Showa Chemical Industry, Tokyo, Japan | 1943-0150 | |
| Plasma tretment system | Nordson MARCH, Concord CA | PX-250 | for oxygen plasma surface treatment |
| Polycarbonate (PC) film | Quantum Beam Technologies, Tainan Taiwan | ||
| Polydimehtylsiloxane (PDMS) | Dow Corning, Midland, MI | SYLGARD 184 | |
| Pyrogallol | Alfa Aesar, Ward Hill, MA | A13405 | |
| Removable Adhesive Putty | 3M | 860 | |
| Sorvall Legend Mach 1.6R Tabletop Centrifuge | ThermoFisher Scientific,Waltham, MA | ||
| Spin Coater | ELS Technology, Hsinchu, Taiwan | ELS 306MA | |
| SU-8 2050 | MicroChem, Westborough, MA | SU-8 2050 | |
| SU-8 Developer | MicroChem, Westborough, MA | Y020100 | |
| Surgical blade | Feather, Osaka, Japan | 5005093 | for PDMS cutting |
| Syringe Pump | Chemyx, Houston, TX | Fusion 400 | |
| T75 Cell Culture Flask | ThermoFisher Scientific,Waltham, MA | Nunc 156367 | |
| Trypan Blue Solution, 0.4% | ThermoFisher Scientific,Waltham, MA | 15250061 | |
| Trypsin-EDTA | ThermoFisher Scientific,Waltham, MA | GIBCO 25200 | |
| Tygon PTFE Tubing | Saint-Gobain Performance Plastics, Akron, OH | ||
| Tygon Tubing | Saint-Gobain Performance Plastics, Akron, OH | 621 |
참고문헌
- Phillips, J. E., Burns, K. L., Le Doux, J. M., Guldberg, R. E., García, A. J. Engineering graded tissue interfaces. Proc. Natl. Acad. Sci. USA. 105 (34), 12170-12175 (2008).
- Wang, F. The signaling mechanisms underlying polarity and chemotaxis. Cold Spring Harb. Perspect Biol. 1 (4), 1-16 (2009).
- Oh, S. H., Ward, C. L., Atala, A., Yoo, J. J., Harrison, B. S. Oxygen generating scaffolds for enhancing engineering tissue survival. Biomaterials. 30 (5), 757-762 (2009).
- Decaris, M. L., Lee, C. I., Yoder, M. C., Tarantal, A. F., Leach, J. K. Influence of the oxygen microenvironment on the proangiogenic potential of human endothelial colony forming cells. Angiogenesis. 12, 303-311 (2009).
- Chung, B. G., et al. Human neural stem cell growth and differentiation in a gradient-generating microfluidic device. Lab Chip. 5 (4), 401-406 (2005).
- Harris, A. L. Hypoxia - a key regulatory factor in tumor growth. Nat. Rev. Cancer. 2 (1), 38-47 (2002).
- Allen, J. W., Bhatia, S. N. Formation of steady-state oxygen gradients in vitro: application to liver zonation. Biotechnol. Bioeng. 82 (3), 253-262 (2003).
- McCord, A. M., Jamal, M., Shankavaram, U. T., Lang, F. F., Camphausen, K., Tofilon, P. J. Physiologic oxygen concentration enhances the stem-like properties of CD133+ human glioblastoma cells in vitro. Mol. Cancer Res. 7 (4), 489-497 (2009).
- Lo, J. F., Sinkala, E., Eddington, D. T. Oxygen gradients for open well cellular cultures via microfluidic substrates. Lab Chip. 10 (18), 2394-2401 (2010).
- Chang, C. W., et al. A polydimethylsiloxane-polycarbonate hybrid microfluidic device capable of generating perpendicular chemical and oxygen gradients for cell culture studies. Lab Chip. 14 (19), 3762-3772 (2014).
- Chen, Y. A., et al. Generation of oxygen gradients in microfluidic devices for cell culture using spatially confined chemical reactions. Lab Chip. 11 (21), 3626-3633 (2011).
- Peng, C. C., Liao, W. H., Chen, Y. H., Wu, C. Y., Tung, Y. C. A microfluidic cell culture array with various oxygen tensions. Lab Chip. 13 (16), 3239-3245 (2013).
- Xia, Y., Whitesides, G. M. Soft Lithography. Ann. Rev. Mate. Sci. 28, 153-184 (1998).
- Friend, J., Yeo, L. Fabrication of microfluidic devices using polydimethylsiloxane. Biomicrofluidics. 4 (2), 026502 (2010).
- Cordelières, F. P. . Manual Tracking. , (2005).
- Asano, Y., Horn, E. . Instructions Chemotaxis and Migration Tool 2.0. , (2013).
- Chen, Y. H., Peng, C. C., Cheng, Y. J., Wu, J. G., Tung, Y. C. Generation of nitric oxide gradients in microfluidic devices for cell culture using spatially controlled chemical reactions. Biomicrofluidics. 7 (6), 064104 (2013).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유